INTRODUCCIÓN
El estatus epiléptico (EE) se considera una urgencia neurológica y la forma más severa de crisis que pueda presentarse en un paciente por la elevada morbilidad y mortalidad que produce 1. En 1981 el EE fue incluido por la Liga Internacional contra la Epilepsia (ILAE) definiéndolo como cualquier convulsión que se presenta de manera repetida o con suficiente duración en el tiempo y en la cual no existe una recuperación de la conciencia entre episodios 2. Esta definición se consideró imprecisa poco después de su publicación. Posteriormente se consideró que la duración de 30 minutos era un marco trascendental a tener en cuenta dentro de la definición operativa del EE, pero se ha visto que el tiempo crítico de tratamiento debe ser antes de que se completen los 30 minutos, ya que pasado este periodo los cambios fisiopatológicos pueden empezar a ser irreversibles 3.
Recientemente la ILAE ha propuesto una nueva definición para el EE como una condición resultante de la falla en los mecanismos responsables de la terminación o inicio de las convulsiones (después del punto t1) que lo conduce a episodios anormalmente prolongados. Para su definición es un condicionante la existencia de consecuencia a largo plazo (después de point t2 tiempo), las cuales incluyen muerte y daño neuronal, además de alteraciónes de las redes neuro-nales dependientes del tipo y duración de las convulsiones 4. Esta definición considera que el punto t1 se ubica luego de 10 minutos y el punto t2 luego de 60, sin embargo, sobre este último periodo de tiempo no existe evidencia sólida.
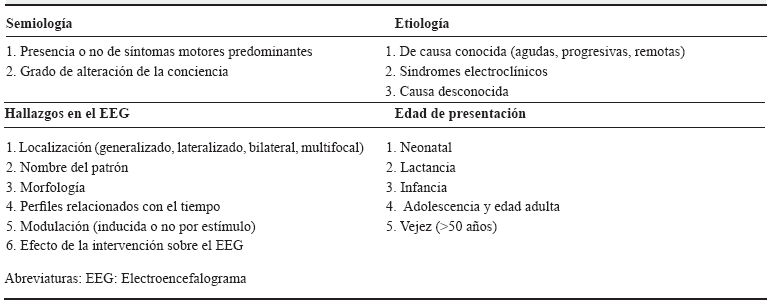
El EE se clasificaba de acuerdo a la edad de presentación, etiología, tipo de la crisis y localización de la lesión. La ILAE ha sugerido que se empleen cuatro ejes en la clasificación del EE: semiología, etiología, hallazgos electroencefalográficos y edad de presentación (tabla 1) 4.
En años recientes se han producido avances importantes en la comprensión del EE. La realización de estudios epidemiológicos en todo el mundo, el desarrollo de modelos animales, estudios en neurofisiología y el reporte de la experiencia clínica han permitido la evolución de los conceptos en este tema 5. El objetivo de esta revisión es presentar los avances en el entendimiento de la epidemiología, etiología, fisiopatología, manifestaciones clínicas y manejo del estatus epiléptico.
Aspectos epidemiológicos
El EE ha mostrado una mayor incidencia durante la primera década de la vida (14,3/100.000 personas-año) y después de los 60 años (28,4/100.000 personas-año), reduciéndose hasta menos de la mitad en otras edades (5-8/ personas-año) 6 y su frecuencia suele ser ligeramente más elevada en hombres (relación 1,3:1) 7. Se ha descrito una mayor frecuencia del EE en países en vías de desarrollo probablemente por mayor probabilidad de causas infecciosas 8.
La mortalidad secundaria al EE es variable de acuerdo al grupo etario y su causa. En niños, a pesar de presentarse una mayor incidencia que en los adultos, la mortalidad es inferior (1,6 %) que en adultos mayores (50 %) (HR 15,46 IC95 % 12,8,18,66), en otros grupos etarios la mortalidad se encuentra en alrededor del 26 % 9. La proporción de mortalidad muestra también variaciones de acuerdo a su causa, en una revisión sistemática se encontró que la mayor mortalidad se presenta cuando la causa del EE es la hipoxia severa (60-80 %), accidente cerebrovascular (20-40 %), trauma (11-25 %), infección del sistema nervioso central (30 %) y abuso de drogas (20 %) 10.
Se han descrito varios factores de riesgo para el desarrollo del EE. Uno de los factores de riesgo reconocidos y más importantes para desarrollar el EE es la interrupción brusca de los medicamentos antiepilépticos (OR 2,5) y un tratamiento irregular (OR 2,9) 11. En un estudio prospectivo se evaluó la adherencia de los pacientes encontrando que alrededor del 40 % de ellos no se adhieren adecuadamente al tratamiento y el principal factor asociado a la baja adherencia es un pobre control de las convulsiones (35 % de los pacientes) 12. La etiología también incrementa el riesgo de desarrollar el EE, el accidente cerebrovascular, trauma, descompensación hepática y cardiovascular aguda y la Hipo e Hipernatremia han sido relacionados con su aparición 13.
El EE produce también elevados costos de atención de los pacientes. En los Estados Unidos se ha estimado que la atención por año del EE supone costos de alrededor de 4 billones de dólares 14. El curso clínico del EE, y si éste es refractario o no, generan una importante carga económica para los sistemas de salud y produce secuelas en el paciente que también incrementan la carga de la enfermedad 15.
ETIOLOGÍA
La etiología del EE es diversa y varía de acuerdo a la edad. Las causas más comunes y fácilmente reconocibles del EE son: enfermedad cerebrovascular, trauma craneoencefá-lico, infecciones y niveles subterapéuticos de los medicamentos antiepilépticos. Dentro de las causas menos frecuentes se encuentran los errores innatos del metabolismo y la encefalitis 16. Los gatillos más comunes de este evento son: deprivación del sueño, abandono de los medicamentos, tratamiento inadecuado y consumo de alcohol 17.
En el paciente adulto sin historia previa de epilepsia el EE puede aparecer como consecuencia de una enfermedad cerebrovascular, intoxicación exógena (alcohol, anfetaminas, insecticidas organofosforados), intoxicación por medicamentos (antidepresivos, teofilina, antidiabéticos orales, litio, neurolépticos), síndrome de abstinencia por alcohol, infecciones del sistema nervioso central, trauma craneoencefálico, eclampsia y tumor primario o metastásico del sistema nervioso central 18-20.
En niños es importante la identificación de infecciones sistémicas las cuales pueden causar hasta el 50 % de los casos de EE, trastornos metabólicos (anoxia, hipoglucemia, hipocalcemia), traumatismo craneoencefálico, infecciones del sistema nervioso central o una lesión crónica cerebral (malformaciones, lesión neurocutánea) 21-23. En los pacientes con epilepsia la causa más común es el abandono del tratamiento 24.
Tabla 2 Características clínicas del EE
| Tipo de EE | Manifestaciones clínicas | Manifestaciones en EEG |
|---|---|---|
| Convulsivo: | ||
| 1. Focal simple | Sin alteración del nivel de conciencia, afecta párpados, dedos o manos | Descargas irritativas focales |
| 2. Mioclónico | Mioclonías multifocales, generalizadas, irregulares | Sacudidas de corta duración, breves, espontáneos, sin ritmo |
| 3. Tónico | Contracciones musculares tónicas en extremidades y tronco acompañadas de trastornos vegetativos | Puntas a 10-25 Hz, alta a moderada amplitud |
| 4. Clónico | Frecuente en niños. Contracciones musculares clónicas arrítmicas y asimétricas | Descargas generalizadas con punta-onda lentas de frecuencia media no altas |
| 6. Tónico clónico | Alteración de la conciencia, inicia con manifestaciones focales, posteriormente aparecen manifestaciones tónicas y clónicas | Descargas difusas |
| No convulsivo: | ||
| 1. Focal simple | Sin afectación de la conciencia: síntomas focales diversos (de órganos de los sentidos, disestésicos, psíquicos, vegetativos, conductuales, afasia | Actividad normal o punta-onda focal |
| 1. Focal complejo (discognitivo) | Afectación de la conciencia con trastornos conductuales y automatismos focal difusa | Actividad normal o punta-onda |
| 2. Focal sutil | Estado de coma tras el EE con movimientos sutiles en cara, dedos de manos o pies, nistagmo, movimiento ocular tónico | Punta onda lateralizada |
| 3. No convulsivo generalizado | Disminución del nivel de conciencia, cambios conductuales, alucinaciones, parpadeo rítmico, mioclonías sutiles | Punta-onda a 2-3 Hz |
| 4. Estado de ausencia típico | Corta duración, comienzo y fin bruscos | Normal en la actividad interictal |
| 5. Estado de ausencia atípico | Mayor alteración de la conciencia, alguna actividad motora anormal, comienzo y fin delimitados | Lentificación de fondo en la actividad interictal |
| 6. Estado de ausencia de novo | Amnesia y estupor | Punta-onda a 0,5-4 Hz |
| 7. Estatus epiléptico durante el sueño | Niños y adolescentes. Crisis durante el sueño y deterioro cognitivo progresivo | Unilateral, de punta-onda a 1,5-3,5 Hz de forma muy persistente durante el sueño |
| Basado en referencias 45-50. | ||
FISIOPATOLOGÍA
El EE es un proceso dinámico que implica una serie de alteraciones eléctricas del metabolismo, barrera hematoence-fálica y funcionamiento neuronal que se presentan de forma sistemática y pueden finalizar en la muerte neuronal 25. El EE es el resultado de un disbalance entre la excesiva excitación neuronal y de defectos en los sistemas de inhibición de la actividad neuronal. En la actualidad se considera que muchos de los procesos fisiopatológicos están relacionados con los procesos de fosforilación de proteínas y activación de canales en las neuronas, los medicamentos antiepilépticos disponibles realizan su actividad a este nivel o bien sobre el transporte de vesículas intracelulares o la actividad de los receptores inhibidores 26. Investigaciones recientes han permitido establecer que la alteración de los mecanismos mitocondriales de control del estrés oxidativo, deficiencia de cofactores y vitaminas así como los mecanismos de control del flujo de calcio conducen al desarrollo del EE, esto más es evidente en niños con enfermedades mitocondriales de origen genético 27.
La lesión neurológica es en parte consecuencia de una serie de complicaciones sistémicas que el EE produce, bien sea de manera directa o bien, como consecuencia del manejo farmacológico y el cuidado en la unidad de cuidados intensivos. A corto plazo se desarrollan acidosis respiratoria, hipoxia, descarga noradrenérgica, arritmias cardiacas, necrosis cardiaca, fracturas de huesos largos, fracturas por compresión y rabdomiolisis que puede o no estar acompañada de falla renal 28,29. Como consecuencia de la estancia en la unidad de cuidados intensivos y la farmacoterapia suelen presentarse depresión respiratoria, alteraciones de la conducción eléctrica del corazón, coagulopatía, íleo paralítico e incremento del riesgo de infección que hacen más complejo el proceso patológico en el cuerpo de personas con EE 30.
La lesión neurológica es también el resultado de la descarga eléctrica repetida que se produce como consecuencia de la alteración de balance entre los neurotransmisores excitatorios (glutamato, aspartate, acetilcolina) y los neuro-transmisores inhibitorios (GABA) 31. A nivel bioquímico se produce un incremento del calcio intracelular que desencadena una cascada de reacciones que producen la ruptura de la membrana celular, inhibición de la síntesis proteica y la necrosis celular 32. La lesión neurológica inicial es similar a la originada por la isquemia; en una fase tardía se desarrolla gliosis y atrofia 33, convirtiéndose la lesión neurológica en epileptógena. Determinadas áreas cerebrales como el hipocampo, los núcleos de la base, el cerebelo y las capas medias del córtex son las más afectadas en el EE 34. Se desconoce con exactitud cuánto tiempo se requiere para que una crisis epiléptica prolongada sea lesiva; en estas zonas más vulnerables se estima que deben pasar entre 20-60 minutos 35. En el EE de ausencia en el cual se presume un predominio inhibitorio, no cursa con lesiones anatómicas detectables al menos al examen macroscópico 36.
En una primera fase y como respuesta a la descarga de aminas aumenta la presión arterial sistémica y el gasto cardíaco, el flujo sanguíneo cerebral de tal modo que se surtan apropiadamente las necesidades metabólicas cerebrales. Sin embargo es este proceso el que facilita el desarrollo de alteraciones cardiacas y alteraciones estructurales en su función 37.
A nivel pulmonar la estimulación neurovegetativa favorece la broncoconstricción, el aumento de las secreciones bronquiales y como consecuencia la obstrucción de la vía aérea. A los cambios ventilatorios se suma una posible broncoaspiración favorecida por la inducción del vómito y la apnea que causa una contracción diafragmática sostenida. Como resultado final aparecen la hipoxemia y una acidosis respiratoria 38.
La contracción muscular sostenida puede conducir a la rabdomiolisis, mioglobinemia, mioglobinuria que conducen a una insuficiencia renal por necrosis tubular aguda; este proceso puede también ser causado por los medicamentos antiepilépticos utilizados en el manejo del EE 39. Además este proceso puede desencadenar hipercaliemia, que favorece la aparición de arritmias. Como resultado del agotamiento muscular se genera CO2, ácido láctico y acidosis metabólica 40.
Otras alteraciones que se presentan como consecuencia de la disfunción hipotalámica y de una contracción muscular sostenida es la relacionada con la presencia de la hipertermia severa, de incluso 40 °C. Por lo que se debe tener en cuenta que hipertermia en asociación a otros hallazgos como son la leucocitosis y pleocitosis con proteinorraquia en el LCR, las cuales son favorecidas por la estimulación simpática, pueden llegar a inducir erróneamente etiología infecciosa en los casos de EE 41.
A nivel bioquímico la hiperglucemia inducida por la estimulación simpática favorecerá la liberación de insulina que causará hipoglucemia en aquellos pacientes con escasa reserva de glucógeno, en esos casos este evento puede conducir a un empeoramiento del EE y daño neuronal 42.
Finalmente como consecuencia de la vasodilatación periférica favorecida por la acidosis metabólica, la deshidra-tación causada por la hipertermia y la deplección de aminas, puede tener lugar un colapso circulatorio. En definitiva, el EE puede ocasionar un fallo multiorgánico, incluyendo insuficiencia hepática y una coagulación intravascular diseminada, estos fenómenos pueden incrementar el daño neurológico resultante 43.
Presentación clínica y diagnóstico
El EE puede presentarse en diferentes formas, convulsiva, no convulsiva y electroencefalográfica. Estos tipos de EE muestran la complejidad de esta entidad clínica y los retos que suponen su diagnóstico y manejo apropiado 44. La tabla 2 presenta las características del EE de acuerdo al tipo 45-50.
Dentro de los diagnósticos diferenciales que deben tenerse en cuenta el síncope. Las características del examen motor, duración del episodio sincopal (generalmente menor a 1 minuto), presencia de cuadro presincopal (desvanecimiento, astenia, aturdimiento, alteraciones auditivas, palidez cutánea, atonía y una recuperación rápida del estado de conciencia permiten el reconocimiento y esclarecimiento de este diagnóstico 51.
Se ha descrito la existencia de crisis no epilépticas de origen psicogénico que deben incluirse en el diagnóstico diferencial del EE. Como factores orientadores del diagnóstico se encontraron: edad joven, alto nivel educativo, alto cociente intelectual, alto estatus social y manifestación de la convulsión menos expresiva que en los casos habituales. Estos casos suelen producir la misma carga de la enfermedad que los EE refractarios 52. En niños, la hipoglucemia, hipocalemia, hipomagnesemia, un ambiente familiar propicio (por ejemplo exposición a videos similares a la convulsión), mutaciones de los receptores de glicina y enfermedades oftalmológicas, entre otras causas menos comunes, pueden dar lugares a cuadros similares que deben ser tenidos en cuenta por el clínico que evalúa el paciente 53.
Diagnóstico
Ante un paciente que presenta una crisis epiléptica se debe realizar una rápida exploración clínica en busca de lesión estructural cerebral, hipertensión intracraneal, enfermedad cardiovascular, sepsis, metabolopatía u otros factores predisponentes (medicación, deprivación alcohólica o retirada de sedación). Además del análisis bioquímico se hace necesario, en ocasiones, evaluar el consumo de drogas, en especial de cocaína. La resonancia magnética en fase aguda es especialmente importante en la búsqueda de focos epileptogénicos y permite una evaluación de posibles causas 54. La realización de la tomografía muestra tener también un perfil de sensibilidad y especificidad en la detección de causas de EE similar a la de la resonancia magnética 55, su uso ofrece ventajas en cuenta a disponibilidad en muchos centros de atención y costos.
El flujo de trabajo diagnóstico (paralelo al inicio del manejo farmacológico) requiere de la realización de una glucometría, monitoreo de los signos vitales, tomografía computarizada, pruebas de laboratorio y electroencefalograma continuo. Otros estudios como la punción lumbar, resonancia magnética y pruebas de toxicología pueden también ser útiles pero se solicitan de acuerdo al contexto clínico 56.
Los estudios diagnósticos como exámenes de sangre, neuroimágenes o el electroencefalograma no deben demorar el inicio del manejo del EE. Dentro de las pruebas de sangre empleadas en el abordaje diagnóstico del EE se encuentran la evaluación de los niveles de electrolitos, glucemia, pruebas de función hepática, pruebas de función renal y troponina en pacientes en quienes se sospecha alteraciones cardiacas. Otras pruebas de laboratorio podrían ser útiles de acuerdo al contexto clínico como por ejemplo ocurre, cuando se sospecha un error innato del metabolismo 57.
La identificación de encefalopatías que cursan con epilepsia es especialmente importante para fijar el pronóstico, si bien existen casos en los cuales es posible un manejo médico que mejore el curso natural de la enfermedad, en muchos otros, esto no es posible y se relaciona con un empeoramiento progresivo del cuadro clínico y se consideran en la actualidad intratables, en el futuro, la existencia de pruebas genéticas directas permitirá la identificación de casos de EE en riesgo de convertirse en refractorios y superrefractarios 58.
En la actualidad, el uso del electroencefalograma continuo en la unidad de cuidados intensivos se considera una necesidad ya que permite el diagnóstico y clasificación del EE, la detección presintomática de convulsiones, el monitoreo de la respuesta a la terapia anticonvulsivante y el seguimiento del estado neurológico, especialmente en pacientes con enfermedad cerebrovascular 59.
Factores pronósticos
La evaluación de factores pronósticos es igualmente importante que el diagnóstico en el pacientes con EE. El uso de escalas de severidad, particularmente el score de severidad del EE (STEES) que evalúa aspectos de la edad, estado de la conciencia, tipo de convulsiones e historia previa de epilepsia ha mostrado ser útil en la práctica cotidiana 60, El STEES con un puntaje de 3 o menor tiene un valor predictivo negativo del 96 % para mortalidad, pobre pronóstico neurológico y necesidad de inducción del coma 61.
En un estudio prospectivo se encontró que una edad joven, historia previa de epilepsia y un bajo número de anestésicos utilizados para el manejo del EE refractario están relacionados con un mejor pronóstico de los pacientes 62. La etiología del EE también se considera de valor pronóstico, siendo las peores las relacionadas con etiología hipóxica además tumor cerebral (mortalidad 18% vs. 6,8 %) 63.
EE refractario y superrefractario
Alrededor del 40 % de los casos de EE no responden a los tratamientos de primera y segunda línea, estos son considerados refractarios, esta condición supone una mayor mortalidad y es un indicador de mal pronóstico. Una categoría especial es el EE refractario de nueva aparición, que afecta a personas previamente sanas. La etiología tumoral, inflamatoria, infecciosa y autoinmunes suele estar presente en estos casos 64.
Recientemente se ha descrito la existencia de una categoría adicional, el EE superrefractario que se define como la existencia de crisis 24 horas o más luego del inicio de medicamentos anestésicos, estos casos suelen estar relacionados con un daño de las estructuras a nivel cerebral y suelen relacionarse a un mal pronóstico 65. No obstante, son varios los casos en los cuales no logra identificarse una causa 66. El abordaje semiológico correcto permite la identificación de las características de la convulsión y su origen lo cual es importante en estos casos 67.
Manejo del EE
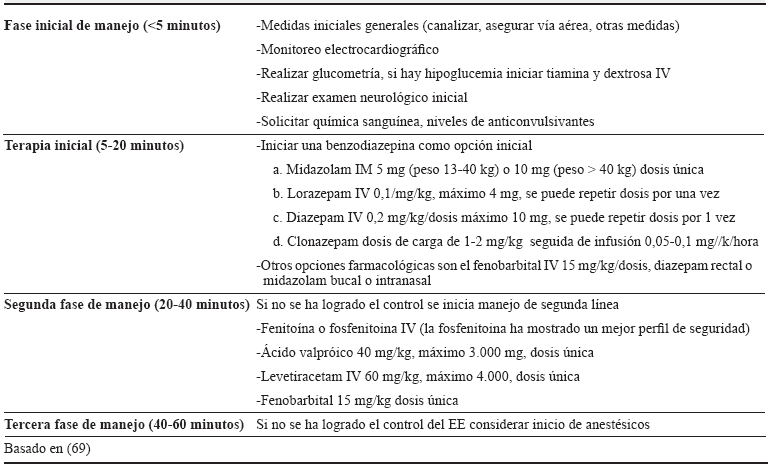
El tratamiento del EE comienza con las medidas de soporte vital, aplicables a todo paciente con deterioro del nivel de conciencia. Inmediatamente, después el objetivo del tratamiento es finalizar la crisis lo más pronto posible, mediante el uso de fármacos y corrigiendo la causa de base, corregir las complicaciones sistémicas y prevenir las recurrencias (tabla 3) 68.
El control de la vía aérea es prioritario y cuidadoso. En la mayoría de los pacientes, a pesar de las apneas que se suceden durante las crisis, puede realizarse una adecuada ventilación y oxigenación manteniendo permeable la vía aérea e iniciar la oxigenoterapia. Se intubará cuando exista evidencia clínica o gasométrica de compromiso respiratorio.
Monitorizar signos vitales y glucemia.
Obtener una vía venosa y realizar analítica.
Administrar tiamina 100 mg y glucosa al 50 % 50 ml (si la glucemia está baja).
Otros: colocar sonda nasogástrica si hay intoxicación, disminuir la hipertermia, realizar imagen cerebral, punción lumbar si se sospecha infección, identificación y tratamiento etiológico del EE.
Manejo prehospitalario
Existe evidencia que ha evaluado diferentes alternativas terapéuticas prehospitalarias para el control del EE. Se recomienda la administración de lorazepam intravenoso como manejo de primera línea en todos los pacientes, en casos en los cuales no se disponga de la vía intravenosa se recomienda la administración oral de midazolam 70. El midazolam por vía oral muestra un perfil de seguridad y eficacia similar al diazepam por vía rectal en el ambiente prehospitalario 71.
En un ensayo clínico se demostró que el midazolam por vía intramuscular es más seguro e igualmente eficaz que el intravenoso en el manejo prehospitalario 72, resultados similares fueron también documentados en el manejo del EE en niños 73. Esto tiene importantes implicaciones para el trabajo clínico teniendo en cuenta que es necesario reducir la tasa de eventos adversos con la administración del medicamento. El clonazepam ha mostrado ser igualmente efectivo que el midazolam y el lorazepam 74. Sin embargo, un meta-análisis reciente, ha mostrado que ante la no disponibilidad de vía venosa, el uso del midazolam es superior a otras vías de administración en términos de tiempo para el control del EE 75.
Consideraciones sobre la farmacoterapia
El estudio de la eficacia y seguridad de los medicamentos en el manejo del EE es un campo activo de investigación. Muestra de ello es el número de ensayos clínicos terminados y en curso. En esta sección se mostrarán los resultados de los estudios más importantes.
El ácido valpróico ha mostrado ser eficaz en el manejo del EE en el 70 % de los pacientes. Se recomienda su aplicación en bolo inicial de 15 a 45 mg/kg (6 mg/kg/min) seguido por una infusión de 1-3 mg/kg/h 76. El uso del ácido valpróico como medicamento de primera o segunda línea ha mostrado tener la misma eficacia 77.
En un estudio retrospectivo se evaluó la eficacia de la fenitoína, ácido valpróico y levetiracetam como medicamentos de segunda línea en el EE. El ácido valpróico mostró las menores tasas de falla terapéutica (25,4 %), seguido por la fenitoína (41,4 %) y la mayor frecuencia de falla se dio con el levetiracetam (48,3 %) 78. Sin embargo un estudio prospectivo encontró que el levetiracetam IV tiene una eficacia del 78 % en el control del EE 79. Igualmente en un ensayo clínico, se documentó que cuando se utiliza el levetiracetam el fallo terapéutico ocurre en el 22 %, comparado con el ácido valpróico y fenitoína en los cuales este evento ocurre en el 32 % de los casos 80. En un estudio en niños no se encontró que el lorazepam tenga ventajas sobre el diazepam en el manejo del EE 81. En ese sentido la decisión del medicamento a usar puede derivarse de la experiencia del médico tratante y la disponibilidad de los mismos. En niños la evidencia muestra que cualquiera de las benzodiazepinas posee la misma efectividad en el control del EE, sin embargo, el lorazepam ha mostrado necesitar una menor dosis y menos anticonvulsivantes adicionales 74. El clonazepam ha mostrado ser superior a otros anticonvulsivantes en el manejo del EE generalizado 82.
Existe evidencia que sugiere que la fosfenitoina a pesar de un mayor costo puede ofrecer un mejor rendimiento de costo-beneficio si se tiene en cuenta una menor presentación de reacciones adversas y un mejor pronóstico neurológico reportado a largo plazo 83.
Los episodios de EE secundarios a una epilepsia mio-clónica juvenil no son frecuentes y son exacerbados por episodios de deprivación del sueño e inadecuado manejo farmacológico. En esos casos el manejo con ácido valpróico y benzodiazepinas suele ser muy útil 84.
En el estadio temprano el lorazepam y midazolam por vía intravenosa son las mejores opciones terapéuticas, teniendo en cuenta el perfil de eficacia y seguridad. La fenitoína y el fenobarbital son los medicamentos más comúnmente utilizados como manejo de segunda línea. Sin embargo, estos medicamentos tienen efectos secundarios (como depresión de la actividad respiratoria) que en ocasiones hacen que estos medicamentos no sean de fácil uso. El ácido valpróico, levetiracetam y lacosamida son empleados en estos casos 85. Si bien no existen ensayos clínicos que evalúen cada uno de estos medicamentos, la evidencia proveniente de estudios observacionales permite pensar que el uso del ácido valpróico como manejo de segunda línea es superior a los demás medicamentos (eficacia de 78 %) 86.
En casos de EE refractario el manejo sugerido consiste en la inducción de un coma barbitúrico (tiopental o fenobarbital) o no barbitúrico (midazolam en niños o propofol en adultos). En los casos que continúan siendo refractarios se consideran otros tratamientos que incluyen el inicio de anestesia general, inducción de la hipotermia, inicio de corticoides, aplicación de magnesio IV 4 g en infusión 2-6 g/h (y piridoxina IV en niños 30 mg/kg) y el drenaje de líquido cefalorraquídeo 87. En los casos de EE superrefractario se indica el uso de ketamina, isofluoranos, topiramato, metilprednisolona, dieta cetogénica en relación 4:1, terapia electroconvulsiva, hipotermia entre los 33 y 35 grados y estimulación del nervio vagal 88. Estos casos suponen un reto importante para el clínico en su manejo. La evidencia experimental reciente ha mostrado que en los casos de EE refractario la polimedicación que incluya un medicamento anticolinérgico puede ofrecer ventajas en su manejo, sin embargo, esta información debe ser validada mediante estudios clínicos 89.
En la actualidad el uso de levetiracetam y lacosamida ha aumentado por los resultados clínicos que se producen con su indicación. El levetiracetam ha mostrado beneficios similares a la fenitoína en el manejo del EE 90, su uso en monoterapia o en combinación con otros medicamentos como la fenitoína, clonazepam y la carbamazepina se considera de acuerdo al perfil de riesgo del paciente y los posibles efectos secundarios que puedan aparecer 91,92. En los casos de EE refractario el uso de la lacosamida ha mostrado mejorar el control de la crisis, alrededor del 51 % de estos pacientes logran la remisión. Igualmente el levetiracetam también es un medicamento útil dada la alta tasa de remisión de casos refractarios que se logran. En la actualidad existen ensayos clínicos en curso que permitirán resolver algunas de las dudas existentes en torno a la eficacia de estos medicamentos 93.
Los cannabinoides han mostrado, en estudios experimentales, tener utilidad en el manejo de la epilepsia, especialmente en casos refractarios dado que regulan la excitabilidad neuronal. Si bien la información sobre la eficacia de este grupo farmacológico es limitada, en la actualidad cursan varios ensayos clínicos tendientes a esclarecer la eficacia de su manejo 94.
En mujeres que deseen el embarazo o que se encuentren en gestación no se recomienda la interrupción del medicamento antiepiléptico pero si el suplemento con ácido fólico, la consejería sobre los efectos adversos que pueden tener los medicamentos en el embarazo y el control periódico mediante la realización de ecografías y exámenes de extensión 95,96.
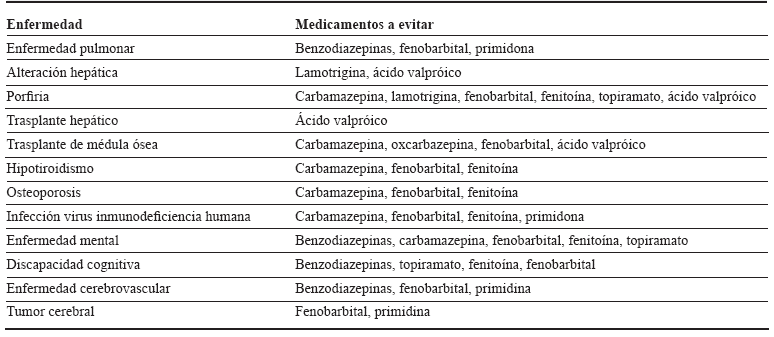
Algunos medicamentos no deben ser empleados en ciertas condiciones clínicas, bien sea por la alteración del estado clínico de los pacientes o bien por los medicamentos que habitualmente se utilizan en su manejo, esta información debe ser conocida por el clínico para evitar eventos adversos en el paciente 97,98 (tabla 4).
El uso combinado de medicamentos antiepilépticos con el mismo mecanismo de acción incrementa el riesgo de reacciones adversas, se considera una buena práctica la combinación de medicamentos con un distinto mecanismo de acción, lo cual incrementa la probabilidad de lograr un manejo exitoso 99.
Otras medidas terapéuticas
Se ha sugerido que los ácidos grasos son los principales componentes de la dieta cetogénica que explican su eficacia en los casos de EE. Si bien su mecanismo de acción exacto se desconoce, se reconoce que puede tener un efecto similar al ácido valproico (depresión de los niveles del fosfoinositido intracelular) 100. El uso de la dieta disminuye la necesidad de medicamentos utilizados para el control del EE (4 vs. 2) 101. En un ensayo clínico publicado recientemente, la dieta cetogénica mostró ser útil en lograr el control del 79 % de los casos de EE refractario, sin embargo, son también frecuentes las complicaciones metabólicas 102. Los estudios disponibles en la actualidad son de bajo tamaño muestral, a futuro la realización de estudios de mayor tamaño permitirán determinar con certeza la relación riesgo/beneficio de la introducción de la dieta cetogénica en casos de EE refractario.
También se ha propuesto el uso de la hipotermia inducida. Un estudio multicéntrico mostró resultados modestos para esta medida, siendo únicamente inferior el riesgo de progresión del EE en el primer día (OR 0,40 IC95 % 0,20, 0,79), otros desenlaces no han sido ser superiores con el uso de la hipotermia 103.
La plasmaféresis como alternativa terapéutica para el EE ha sido evaluada por algunos investigadores. En la actualidad su utilidad en el manejo de los casos de EE refractario se reserva a casos de sospecha de enfermedad autoinmune aunque posee un bajo nivel de evidencia 104. Otras medidas incluyen el uso de otros medicamentos en estatus refractario como: ketamina, anticálcicos, corticoides, gamaglobulina, entre otros.
CONCLUSIÓN
El manejo del EE es urgente. Las complejidades de los mecanismos fisiopatológicos que se encuentran detrás de su desarrollo y las secuelas a largo plazo que puede producir hacen que sea necesario su rápido control. El perfil epidemiológico muestra que la frecuencia del EE es mayor en niños y adultos mayores con leve predominio en hombres, no obstante, no se ha realizado una caracterización en nuestro medio. Una variedad de condiciones sistémicas y propias del sistema nervioso central pueden conducir a su desarrollo, la identificación de la causa de base es necesaria para el abordaje terapéutico del paciente, es importante tener en cuenta que en los pacientes con antecedente de epilepsia la no adherencia al manejo es la causa más común de EE. El manejo del EE incluye medicamentos de primera y segunda línea con los cuales se logra el control de entre el 60 y 70% de los casos. En casos refractarios es necesario considerar el uso de anestésicos y la corrección de la causa de base.