GENERALIDADES
El virus de Epstein-Barr humano (VEB) pertenece a la familia de los herpesvirus y está conformado por una doble cadena de ADN. Como otros virus de dicha familia, esta infección puede entrar en una fase latente, con episodios de reactivación periódica. Las manifestaciones clínicas dependen de la edad y el estado de inmunocompetencia 1,2.
El ciclo viral inicia con la infección de las células inmaduras de los linfocitos B que se encuentran en la cavidad oral, lo que genera la activación e hipermaduración de estas células y la producción de anticuerpos. El virus utiliza la información genética de estas células maduras para guardar información a largo plazo. Al aumentar el número de linfocitos B infectados se genera una proliferación de linfocitos T citotóxicos, encargados de eliminar los linfocitos B. Sin embargo, se produce la reactivación de los linfocitos B infectados por el virus y esto genera el desorden linfoproliferativo 1,3.
ELVEB al comprometer el sistema nervioso produce: primero, la infección del SNC está determinada por la infección de las neuronas, las células gliales y las células endoteliales. Segundo, la generación de la afectación de los linfocitos lleva a la liberación de citoquinas proinflamatorias, lo cual causa daño neuronal. Tercero, la actividad de los linfocitos T citotóxicos contra los linfocitos B infectados en el sistema nervioso central produce inflamación del parénquima cerebral 1,4.
EPIDEMIOLOGÍA
El VEB es un herpesvirus que se caracteriza por establecer una infección latente de por vida en los linfocitos B. En la infancia, la primoinfección por VEB suele ser asintomática o inespecífica y la frecuencia de presentación como una mononucleosis infecciosa aumenta con la edad hasta alrededor del 50 % de las primoinfecciones en la adolescencia. Se estima que para la edad adulta el 90-95 % de la población ya ha tenido infección por el VEB 5,6.
El VEB tiene una importante relación con varias neoplasias malignas, como el linfoma de Burkitt, el carcinoma nasofaríngeo y las enfermedades linfoproliferativas. Así mismo, se ha establecido como un importante factor de riesgo medioambiental para el desarrollo de esclerosis múltiple 7.
MANIFESTACIONES CLÍNICAS
Las personas infectadas pueden presentarse con síntomas sistémicos, tales como: fiebre, fatiga, odinofagia, linfadenopatía, hepatoesplenomegalia y exantema ocasional. Estos síntomas duran semanas con posterior recuperación. En la mayoría de las personas que mueren por esta infección, el fallecimiento se debe a causas neurológicas, sobre todo en pacientes inmunocompetentes 6,8.
En ocasiones el VEB compromete el hígado y produce hepatitis, también esplenomegalia, y a nivel cerebral produce encefalitis. Entre otros hallazgos en sangre periférica se encuentra la leucocitosis con reacción leucemoide; es posible observar leucocitos atípicos 8.
Dentro de las manifestaciones a nivel del sistema nervioso central (SNC) y periférico (SNP) figuran:
Meningitis aséptica: aparece como complicación de la infección aguda por VEB. Se puede presentar con cefalea, fiebre y rigidez nucal, con o sin otras manifestaciones típicas de la mononucleosis. Suele ser autolimitada 1,4,8.
Encefalitis: se caracteriza por presentar fiebre, alteración del estado mental, convulsiones, cambios del comportamiento y déficit neurológico focal. Puede estar asociada a otros tipos de sintomatología, como mioclonusopsoclonus, encefalitis de tallo, síndrome de Alicia en el país de las maravillas y psicosis 1,4,8.
Neuropatía craneal: se presenta principalmente con parálisis facial periférica, que puede ser bilateral. En otros casos, menos frecuentes, puede existir hipoacusia, afectación del nervio hipogloso, e incluso existen reportes de neuritis óptica. Sin embargo, estos síntomas vienen acompañados de síntomas sistémicos, como se explicó 1,4,8.
Mielitis transversa: es una complicación rara, con presentación de inicio agudo, debilidad progresiva de miembros inferiores o de las cuatro extremidades y posterior alteración sensitiva. En la mayoría de los casos previamente se presentan síntomas generales como malestar general, fiebre y odinofagia 1.
Ataxia: se presenta sobre todo en pacientes pediátricos y adultos jóvenes, inicia con síntomas sistémicos y posteriormente se presenta disartria escandida, dismetría y ataxia, lo que mejora en semanas, pero hay casos reportados de recaídas que no requieren manejo y evolucionan con recuperación progresiva y completa 1,4,8.
Manifestaciones psiquiátricas: el VEB se puede acompañar de síntomas psiquiátricos, como cambios del comportamiento con alteración del control de impulsos, alucinaciones e incluso síntomas depresivos. Estos síntomas pueden persistir luego de la resolución de la infección. Se desconoce el mecanismo fisiopatológico 1,5,9.
Hemiplejía: se puede presentar en pacientes pediátricos y adultos, tiene un comportamiento clínico similar a un evento cerebrovascular y se acompaña de síntomas sistémicos, inicialmente, con neuroimágenes normales, que después se recupera en corto tiempo 1,4,8.
Síndrome de Guillain-Barré: la infección por VEB se ha asociado con el síndrome de Guillain-Barré, aunque usualmente no acompaña al cuadro clínico de mononucleosis. Puede llegar a ser fatal, en algunos casos inicia con neuropatía craneal, luego con arreflexia, parálisis flácida completa, con necesidad de intubación orotraqueal en menos de tres días 1,5,10.
Otras manifestaciones neurológicas: se han reportado otros tipos de presentación con síntomas del sistema nervioso central combinados con síntomas periféricos como mielorradiculitis, encefalomielorradiculitis y meningoencefaloceleradiculitis. También se han descrito casos de neuropatía autonómica aguda y radiculoplexopatía lumbosacra o braquial 1,5-12.
Desórdenes linfoproliferativos: entre los desórdenes linfoproliferativos está el linfoma primario del sistema nervioso central (LPSNC), que usualmente aparece en pacientes ancianos e inmunosuprimidos. El efecto oncogénico del virus tiene un rol importante en la producción de tumores, de hecho se descubrió que los linfomas primarios del SNC están relacionados con este virus. El LPSNC tiene una prevalencia mayor en hombres entre la tercera y la cuarta década de la vida, así como en personas con SIDA. Se presenta con alteración en el estado de la conciencia y apatía, asociado con otros signos neurológicos focales como debilidad, convulsiones y cefalea. Su pronóstico es desfavorable y con pobre recuperación. El linfoma Burkitt, el desorden linfoproliferativo ligado al X y el desorden linfoproliferativo postrasplante también entran en esta categoría 1,5,8.
Síndrome uveo meníngeo: es la causa más común de síndrome enmascarado ocular, al inicio se presenta como una lesión inflamatoria que posteriormente no responde a manejo inmunosupresor y progresa. Se asocia en particular con el linfoma primario del sistema nervioso central y el linfoma sistémico metastásico. Se presenta entre la sexta y la séptima década de la vida, con predominio en mujeres. Los pacientes inician con síntomas visuales como visión borrosa y miodesopsias, y el examen físico revela subpigmentos blanco-amarillo con vitritis bilateral, que representan cúmulos de células linfoides malignas de tipo B. La entidad puede ser diagnosticada erróneamente en su fase inicial como uveítis y con tratamiento de corticoides, pero posteriormente progresa a un linfoma maligno, con síntomas neurológicos asociados que pueden corresponder a meningitis 13,14.
DIAGNÓSTICO
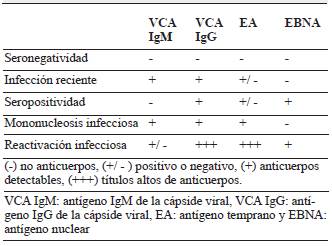
Serología: tras la sospecha clínica es necesario la confirmación por medio de un método diagnóstico. La PCR del VEB en líquido cefalorraquídeo o sérica, no es específica porque puede estar presente en la fase latente. Por esta razón es necesario la tamización serológica. Los exámenes del suero incluyen antígeno IgM de la cápside viral (VCA IgM), antígeno IgG de la cápside viral (VCA IgG), antígeno temprano (EA) y antígeno nuclear de EB (EBNA), que se interpretan como se indica en el cuadro anexo (tabla 1) 4,8.
Resonancia cerebral magnética: los hallazgos son inespecíficos, se pueden encontrar hiperintensidades en T2 simétricas en la sustancia negra, tronco encefálico, cuerpo calloso y médula espinal; incluso hay lesiones en el cerebelo que restringen la difusión con edema perilesional. La imagen puede ser normal, lo que se correlaciona con un mejor pronóstico 1,4,5.
Electroencefalograma: puede mostrar cambios como enlentecimiento difuso o focal y en ocasiones descargas periódicas que semejan los hallazgos en encefalitis por herpes simplex 1,4,8.
Líquido cefalorraquídeo (LCR): suele haber pleocitosis y leve hiperproteinorraquia con glucosa normal. Esta distribución cambia si se trata de un linfoma primario de SNC relacionado con VEB (bajo conteo de leucocitos con alta carga viral) o si la manifestación es una complicación postinfecciosa (pleocitosis con baja carga viral) 1,4,8.
TRATAMIENTO
El pronóstico de la infección es bueno, con un 85 % de los pacientes que se recuperan a su estado basal. No existen guías ni medicamentos aprobados para el manejo de encefalitis asociadas con esta infección, sin embargo, hay reportes de casos y prácticas sustentadas en opinión de expertos que sugieren el inicio de manejo con antivirales como el aciclovir (10 mg/kg/dosis IV cada 8 horas por 7-10 días). No hay recomendaciones para el uso de corticosteroides 4,5.
CITOMEGALOVIRUS
La infección debido a alguno de los integrantes de la familia de los herpesvirus, en este caso el citomegalovirus, no solo tiene afectación sistémica sino, como se ha descubierto en los últimos años, gran afinidad por el SNC, sobre todo en pacientes inmunocomprometidos. Por ello, es relevante sospecharlo cuando se presenten síntomas iniciales, para poner en práctica métodos diagnósticos específicos y así identificar y tratar de manera oportuna esta infección, evitando complicaciones neurológicas graves. En este acá pite se tratará más específicamente al respecto, para tener herramientas claves para identificarlo.
INTRODUCCIÓN
El citomegalovirus (CMV) pertenece a la familia de los herpesvirus y se conforma por una cápside que rodea una doble cadena de DNA. Su transmisión es por contacto con secreciones infectadas (saliva, orina o genitales), leche materna o transfusiones. Inicialmente, el virus infecta el epitelio o el endotelio y se replica in situ. Posteriormente, hay activación de citoquinas que atraen leucocitos, seguido de la viremia, lo que promueve la infección de células susceptibles, principalmente fibroblastos, células epiteliales, endoteliales, del músculo liso y neuronas. En el huésped inmunocompetente, la infección sistémica es controlada por el sistema inmune, pero el virus no es eliminado sino "suprimido" y pasa a estar en fase latente 15.
La infección en el SNC ocurre de forma más común en el paciente inmunosuprimido, principalmente en aquellos con infección por el virus de inmunodeficiencia humana (VIH), trasplante de médula ósea, trasplante de órgano sólido y cáncer. La infección en el paciente sano es en su mayoría asintomática o se asocia con un síndrome similar a la mononucleosis 16,17.
EPIDEMIOLOGÍA
La seroprevalencia alrededor del mundo varía entre 40-100 % en la población adulta, y va aumentando con la edad. La relación es inversa con respecto al desarrollo socioeconómico, con mayor prevalencia en África y algunos países de Asia. En el paciente con VIH, la infección por CMV ocurre con conteos de linfocitos CD4 por debajo de 100 células/μl. En este grupo de pacientes, con la introducción de la terapia antirretroviral de alta eficiencia (HAART), se disminuyó de forma significativa el número de casos desde 1996 15,17,18.
MANIFESTACIONES CLÍNICAS
Encefalitis: se manifiesta con síntomas como cefalea, fiebre, letargia, focalización neurológica y convulsiones. La evolución de la enfermedad es variable, desde un curso benigno que no deja secuelas hasta llevar a la mortalidad. En el huésped inmunocompetente es muy poco prevalente y se ha visto que se asocia con la primoinfección más que con una reactivación. En pacientes inmunocomprometidos aparecen otras manifestaciones, como alteración de la memoria, de la atención o de la concentración, afectación de nervios craneales y ataxia. Con algunos de estos síntomas al inicio de la pandemia del SIDA, se configuraba el diagnóstico de demencia por VIH, pero al revisar las autopsias de estos pacientes se encontró que en un gran porcentaje la etiología era una infección por CMV También se ha visto la aparición de encefalitis posteriormente al inicio de terapia antirretroviral en el síndrome de reconstitución inmune inflamatoria (IRIS), donde hay un empeoramiento paradójico al mejorar el sistema inmune 15,16,19.
Ventriculitis: ocurre tardíamente en el curso de la inmunosupresión o VIH y se caracteriza por alteración cognitiva, de pares craneanos y compromiso ependimario. Aproximadamente el 80 % hace alteración del sodio, ya sea hiponatremia, o bien hipernatremia. Suele asociarse con mal pronóstico, sobre todo en pacientes con conteo de CD4 menores a 100 células/μl, aquellos que toman altas dosis de corticoides y pacientes que tienen trasplantes alogénicos con rechazo severo de huésped contra injerto médula ósea/células sanguíneas periféricas 15,20.
Lesión ocupante de espacio: estas lesiones se describen como formas pseudotumorales en las que se observan inclusiones citomegálicas. Generalmente se manifiesta con síntomas de focalización neurológica y el pronóstico es desfavorable 15.
Mielitis: se puede presentar como mielitis transversa con para o tetraplejia, retención urinaria y déficit sensitivo.
Síndrome de Guillain-Barré (SGB): el CMV es considerado el segundo agente infeccioso más frecuente como etiología del GBS y el primero si incluimos únicamente los virus. En la literatura hay algunos reportes y series de casos de pacientes inmunocompetentes que tras una infección aguda por CMV desarrollan debilidad flácida ascendente 18,19,21.
Mononeuropatía múltiple: en el paciente con VIH inicialmente puede aparecer alteración sensitiva multifocal que, en pocas semanas a meses, progresa a una neuropatía sensoriomotora. Resulta muy incapacitante y los troncos nerviosos que principalmente afecta son: el ciático poplíteo externo, radial, cutáneo del muslo, cubital, circunflejo y mediano. La electromiografía y las neuroconducciones muestran una neuropatía axonal de carácter asimétrico 17,22.
Radiculopatía: se presenta sobre todo en pacientes con diagnósticos de VIH, que inicia con la afectación de múltiples raíces nerviosas lumbosacras. Primero, aparece dolor en miembros inferiores con posterior progresión a retención urinaria, debilidad flácida en piernas y pérdida de los reflejos. También, puede haber compromiso simultáneo de médula espinal con raíces, sobre todo a nivel lumbosacro. Aparece como una complicación infrecuente en pacientes con VIH, suele iniciarse con una paraparesia flácida asimétrica que se instaura de forma progresiva y afecta tanto a los músculos distales como a los proximales; se instaura en pocos días o 2-3 semanas. También se asocia con retención urinaria, estreñimiento, arreflexia rotuliana, aquileana e hipoalgesia en dermatomas lumbosacros. En casos avanzados puede aparecer afectación radicular cervicotorácica e incluso neuropatía craneal 22,23.
Síndromes uveo meníngeos: es la infección más común en los pacientes con VIH. Se presenta inicial-mente con visión borrosa en uno o ambos ojos, con focos granulares de infección en la periferia de la retina que a veces se asocia con vitritis, la cual progresa de días a semanas, genera necrosis retiniana que se puede acompañar de hemorragias, ventrículoencefalitis, encefalitis y vasculitis del SNC 13,14.
DIAGNÓSTICO
El diagnóstico se basa principalmente en los hallazgos clínicos así como las imágenes y los estudios virológicos.
Neuroimagen: en la encefalitis no hay alteraciones específicas, pero se pueden observar anormalidades, como: lesiones hiperintensas difusas de carácter nodular en T2 a nivel de hipocampo, cerebelo, puente y núcleos de la base. En el T1 con contraste puede haber realce en anillo. En la ventriculitis pueden encontrarse alteraciones como realce ependimario, lesiones en anillo subependimarias, atrofia de sustancia blanca periven-tricular y aumento progresivo del tamaño ventricular. Las lesiones hiperintensas en T1 pueden corresponder a lesiones hemorrágicas que aparecen en casos de rechazo de huésped injerto. Dentro de otros hallazgos, puede haber una lesión ocupante de espacio, principalmente en los hemisferios cerebrales, con edema perilesional y realce en anillo 15,22.
Resonancia magnética nuclear de columna: se puede observar engrosamiento de la cauda equina en imágenes sin contraste y realce de las leptomeninges en las raíces dorsales, además de realce difuso de la cauda equina en toda la superficie del cono en imágenes postcontraste 15,22.
Líquido cefalorraquídeo (LCR): se caracteriza por pleocitosis de polimorfonucleares o mononucleares, con aumento de las proteínas e hipoglucorraquia. Estos hallazgos se presentan sobre todo en ventrículoencefalitis 15,22.
Marcadores serológicos: el método de elección para el diagnóstico de la infección por CMV en SN es la reacción en cadena de la polimerasa (PCR) en LCR, que alcanza una sensibilidad del 93 % y especificidad del 87 %. Cabe aclarar que este estudio no sirve para diferenciar infecciones activas de latentes. La detección de anticuerpos IgG e IgM séricos se utiliza para diferenciar infecciones agudas de infecciones previas. La presencia de anticuerpos IgM y la baja avidez de IgG se encuentran en la infección aguda; esta reacción dura hasta 17 semanas, posteriormente hay conversión a IgG hasta que madura completamente hasta las 25 semanas. Otro examen a nivel sérico es la detección del antígeno en neutrófilos utilizando anticuerpos monoclonales contra la matriz proteica del virus PP65. Sin embargo, tiene varias limitantes, la primera es su especificidad, que depende de la técnica usada en el laboratorio. La segunda, en pacientes inmunocomprometidos, el número de neutrófilos no da un conteo preciso de este examen, y la tercera, se tiene que hacer rápidamente apenas se tenga la muestra, en menos de 6-8 horas. La recomendación es además de hacer la PCR, tomar el cultivo en LCR, ya que a pesar de que tiene una baja sensibilidad que es cercana al 18 %, la especificidad es del 100 % 15-17.
TRATAMIENTO
Se recomienda iniciar el tratamiento con ganciclovir o foscarnet, la elección entre estos dos medicamentos depende de si hay falla renal y de la condición hematológica. La terapia combinada se puede usar si hay evidencia de que el paciente recibió antes terapia antiviral contra el CMV o si la enfermedad progresa a pesar de estar en monoterapia. Si se utiliza la terapia dual y aun así no hay mejoría, se recomienda usar cidofovir. Sobre la dosificación, mecanismo de acción y efectos adversos (tabla 2) 15.