Introducción
El género Ceroplastes Gray es uno de los más importantes de insectos chupadores y antiguos grupos de plagas del orden Hemiptera: Coccidae (Gullan, 1999; Kondo y Gómez, 2002). Este grupo de hemípteros incluye todos los miembros de la superfamilia Coccoidea, está compuesta de unas 32 familias (Kondo et al., 2008) y son reconocibles por presentar una cubierta cerosa gruesa que cubre el cuerpo de la hembra adulta (Marin y Cisneros, 1994). A su vez, las hembras se caracterizan por la presencia de un par de placas anales, las cuales se abren para excretar la miel de rocío (Takumasa et al., 2010; Takumasa, 2001). Este rocío que promueve el desarrollo de la fumagina (Capnodium sp.) genera condiciones perjudiciales a las plántulas y árboles, lo que reduce su capacidad fotosintética y, consecuentemente, baja su producción.
Indirectamente, insectos del género Ceroplastes pueden causar un daño estético cuando infestan directamente el fruto, o cuando indirectamente la fumagina crece sobre los frutos cubiertos por la miel de rocío que estos excretan (Takumasa et al., 2010; Ríos et al., 2022). En este sentido, mucho antes de iniciar programas de control biológico, es necesario realizar estudios sobre enemigos naturales de Ceroplastes, tal es el caso de los himenópteros parasíticos.
En el Laboratorio de Producción y Sanidad Vegetal de Jaén, España, en investigaciones realizadas por Ruiz (2010) se identificaron desde 2005 a 2008 más de 32 especies parasitoides procedentes de la especie Ceroplastes rusci L., 1758 en la higuera. Entre ellas se destacan a) Baryscapus ceraplastophilus, Domenichini, 1965 (Hymenoptera: Eulophidae); b) un hiperparásito a través de Scutellista sp., que es Scutellista caerulea, Fonscolombe, 1832 (Hymenoptera: Pteromalidae); c) y a la especie Aprostocetus ceroplastae Girault, 1916 (Hymenoptera: Eulophidae).
En investigaciones realizadas en Corpoica por Takumasa et al. (2010), se observó un gran número de parasitoides atacando especies comunes de la escama Ceroplastes, como es el caso del parasitoide Scutellista sp. (Hymenoptera: Pteromalidae). Por otro lado, León et al. (1999) realizaron estudios sobre la presencia de parasitoides naturales de insectos dañinos de los cítricos, entre ellas Ceroplastes, en cuatro zonas productoras en el piedemonte llanero del departamento del Meta, Colombia; como resultado de estos estudios se registró una especie del género Metaphycus (Hymenoptera: Encyrtidae).
Los escasos estudios de comportamiento y enemigos naturales de C. floridensis (Comstock) en cultivos de guayaba agria en Montería-Córdoba, fue la razón para realizar una investigación preliminar sobre los principales insectos parasitoides asociados al insecto plaga, para que a futuro dichos parasitoides sean usados en el control biológico en dicho agroecosistema.
Materiales y métodos
El estudio se llevó a cabo en predios de la Universidad de Córdoba, ubicada a en la ciudad de Montería- Córdoba, Colombia (8°47'16''N 75°51'28''O). Esta región presenta época de lluvias entre mayo a noviembre y época seca de diciembre a abril, con temperatura anual promedio de 28 °C, precipitaciones de 1380 mm, evapotranspiración potencial de 1240 y humedad relativa promedio de 81 %.
Para realizar el muestreo se tomaron 30 muestras al azar de las partes vegetales (tallos, ramas y hojas) infestadas del cultivo de guayaba agria (Psidium araca L.) con presencia de diferentes estados de desarrollo de Ceroplastes floridensis. Posteriormente, las muestras fueron almacenadas en bolsas de papel Kraft, para facilitar la absorción de humedad.
Para la captura de la entomofauna aérea asociada al cultivo y en los estratos herbáceos aledaños, se utilizaron redes entomológicas seleccionando aleatoriamente 10 puntos en los cuales se realizaron 10 pases dobles de jama (pdj).
El material colectado se separó en los siguientes procedimientos: 1) se colocaron escamas de C. floridensis para realizarles 3 observaciones diarias, la primera en horas de la mañana, la segunda en horas del mediodía y la última en horas de la tarde, con ello se analizaron sus aspectos de movilidad, anclaje, preferencias de ubicación de ninfas y hembras. 2) De igual forma se tomaron 50 individuos de los diferentes estados y se montaron en cajas plásticas tapadas con tela de tull de menos 1 mm de diámetro del agujero, que fueron mantenidos en confinamiento dentro del recipiente hasta obtener el desarrollo y emergencia total de los parasitoides, los cuales, una vez emergidos, se extraían con un frasco aspirador.
3) Estos parasitoides se sacrificaron en el laboratorio por medio de la técnica de refrigeración y luego fueron transferidos a viales con alcohol glicerinado al 70 % y algunos se preservaron en seco para su clasificación. 4) Se procedió a montar el material en seco en alfileres entomológicos y sobre triángulos de papel opalina cortados con una perforadora especial.
5) La entomofauna aérea asociada al cultivo y a las zonas aledañas fue sacrificada directamente por medio de la técnica de refrigeración y posteriormente preparación, montaje y preservación para clasificarla y tener un registro de comparación de aquellos individuos que emergieron en el laboratorio.
Durante la fase de laboratorio el material colectado se separó a morfoespecies o a unidades taxonómicas reconocibles y se conformó una colección de referencia de Hymenoptera Parasítica, que se encuentra actualmente disponible en el laboratorio de entomología del programa de Ingeniería Agronómica de la Universidad de Córdoba. Los ejemplares analizados en el laboratorio fueron identificados hasta la categoría taxonómica más específica posible utilizando claves taxonómicas (Fernández y Sharkey, 2006; Borror y White, 1998; Triplehorn y Johnson, 2005) y con ayuda de un estereoscopio (Advanced optical JSZ6S con cámara incorporada Infinity 1). El estudio comprende un análisis descriptivo y preliminar de las principales especies de himenópteros parasitoides, cuya dinámica poblacional será la base para futuras investigaciones de las especies involucradas.
Resultados y discusión
Comportamiento de Ceroplastes floridensis
Los adultos presentaron un tamaño entre 4-6 mm; la hembra fue áptera. En los muestreos realizados solo se pudieron encontrar ninfas y hembras en gran número sobre los tallos, ramas y hojas, lo que causó la caída prematura de las hojas y la muerte de las ramas de los árboles (Figura 1). Estos resultados son comparables con los reportados por Gullan y Martin (2003), quienes afirmaron que ninfas y hembras de la especie se alimentan, particularmente, succionando la savia extraída del floema o del parénquima y causan algunos daños a las plantas, como la reducción de su vigor y la pérdida de sus estructuras.

Figura 1 Sintomatología de Ceroplastes floridensis sobre hojas, ramas y tallos en cultivos de guayaba agria.
Se determinó que los huevos de C. floridensis presentaron forma ovalada con 0.3 mm de longitud y 0.1 mm de ancho. Su proceso de oviposición se da en los meses de septiembre-octubre y son protegidos bajo el cuerpo, en especial en ovisacos producidos en el extremo posterior del cuerpo (Figura 2); el corion se rompe longitudinalmente y el neonato emerge ayudado por una serie de contracciones.
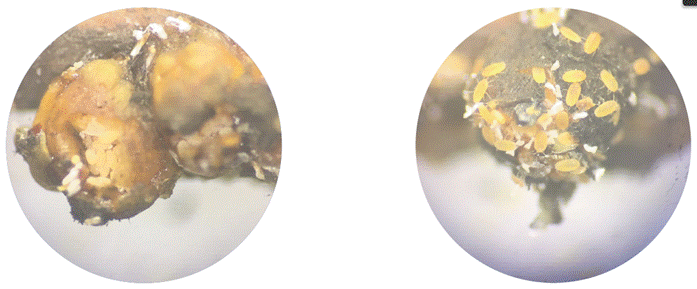
Figura 2 Masa de huevos de Ceroplastes floridensis protegidas dentro del ovisaco, y emergencias de ninfas en cultivos de guayaba agria.
Estos resultados se asemejan a los reportados por Gullan y Martin (2003) y por Ríos et al. (2022), quienes afirman que la hembra puede retener los huevos en su tracto reproductivo hasta que los neonatos estén completamente desarrollados para su emergencia.
La gran mayoría de ninfas que se establecieron en el haz de las hojas fueron capaces de caminar, pues se desplazaron a otras partes de la planta para alimentarse (Figura 3). Este comportamiento se asemeja a los reportados por Marín y Cisneros (1994) y por Ríos et al. (2022) en un estudio sobre el ciclo de desarrollo de Ceroplastes floridensis y C. cirripediformis, quienes mencionaron que las ninfas recién emergidas preferentemente se localizan en las hojas a lo largo de las nervaduras, con mayor frecuencia en el haz; mientras que muy pocos individuos se localizan en el envés.

Figura 3 Ninfas de Ceroplastes floridensis ubicadas en el haz de las hojas en cultivos de guayaba agria.
Las ninfas recién eclosionadas presentaron un cuerpo ovalado con 0.4 mm de longitud y color amarillo, cubiertas de polvo ceroso blanco. Cuando alcanzaron una longitud de 0.8 mm, las ninfas se fijaron en las estructuras de la planta y se observaron los primeros signos de secreción de cera seca blanca en la parte dorsal del cuerpo. Cuando las ninfas alcanzaron una longitud de 1.6 mm, se observó su desplazamiento y su cuerpo se caracterizó por tener una cubierta de cera húmeda. Luego de esta fase, las ninfas alcanzaron una longitud promedio entre 4.2-4.8 mm, y la mayoría de los individuos se ubicaron en ramas y tallos de la planta.
En las observaciones realizadas a los diferentes estados inmaduros de C. cirripediformis se estableció que la hormiga Azteca sp. (Hymenoptera: Formicidae) actúa como agente de dispersión, y es compensada con segregaciones de mielecilla por parte de las ninfas. Este resultado fue previamente descrito por Delabie (2001), González-Hernández et al. (1999), y Gullan y Kosztarab (1997), quienes, en experimentos con plantas cultivadas, demostraron que las hormigas que cuidan a los cóccidos; le facilitan su capacidad daño en los cultivos.
En relación con estos resultados, Marín y Cisneros (1994) y Ríos et al. (2022) mencionan que la secreción azucarada de las ninfas posteriormente favorece el desarrollo de un moho negro llamado fumagina (Capnodium sp.). Sin embargo, ensayos realizados por Ripa et al. (2007) en la Región Metropolitana de Buenos Aires (Argentina) demuestran que al controlar la hormiga el nivel de parasitismo aumenta a más del doble, lo que puede reducir la densidad de la plaga en un plazo de 4 a 6 meses. Este control puede ser mantenido indefinidamente, mientras se excluya el acceso de las hormigas a los árboles.
Himenópteros parasitoides asociados a C. floridensis
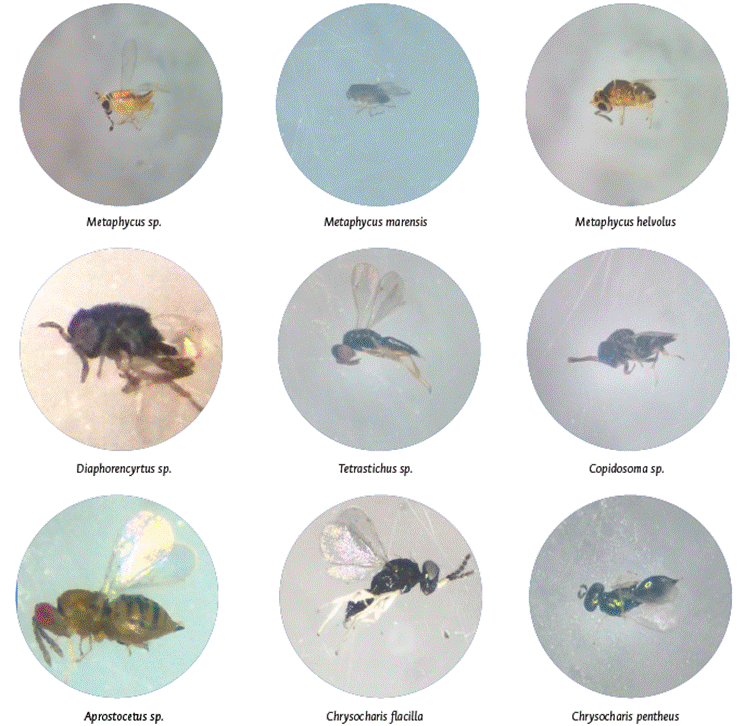
En lo que respecta a los parasitoides, las especies identificadas fueron Metaphycus sp.; Metaphycus marensis; Metaphycus helvolus; Diaphorencyrtus sp.; Copidosoma sp.; Chrysocharis flacilla; Chrysocharis pentheus; Tetrastichus sp., Aprostocetus sp. (Figura 4).
Caracterización de las especies de parasitoides asociados a C. floridensis
De las tres especies registradas del género Metaphycus y que ejercían acción sobre C. floridensis, se pudo notar que Metaphycus sp. son pequeñas avispas de tamaño cercano a 1mm de color anaranjado con bandas oscuras transversales en sus patas y antenas; estas fueron agrupadas de acuerdo con sus comportamientos como endoparasitoide gregario facultativo, debido a que el número de parasitoides emergidos se promediaban entre 8-10 individuos, los cuales provenían de cóccidos adultos de gran tamaño. Por su parte las especies Metaphycus marensis y Metaphycus helvolus se comportaron como un parasitoide solitario (originando un individuo por hospedero parasitado) sobre ninfas de 0.4 mm y 0.8 mm de longitud.
Estos resultados se asemejan a los observados por Lampson y Morse (1992), quienes reportan que las ninfas parasitadas por Metaphycus mueren antes del tercer instar, disminuyendo así la contaminación de frutos con mielecilla, ya que es el tercer instar el que produce la mayor cantidad de esta.
Otros estudios reportan que el género Metaphycus, de la familia Encyrtidae, es controlador efectivo de Ceroplastes: según León et al. (1999) y García Mari (2012), M. helvolus (Compere) sería controlador en cultivos de cítricos, particularmente, a su vez M. lounsburyi (Howard) también sería controlador de este cultivo, según Argov y Rössler (1993)) y Stratopoulou y Kapatos (1998). Además, se reportan 5 especies más pertenecientes a este género que se han registrado en Brasil, pero solo M. flavus (Howard) se ha asociado con las escamas (Noyes, 2013).
Guerrieri y Noyes (2000) caracterizan a Metaphycus como una de la especie más empleadas en programas de lucha biológica, lo que ha hecho que su distribución sea cada vez más cosmopolita, debido a que tiene una amplia gama de especies hospedadoras, casi todas de cóccidos. Del mismo modo Arbaiza (2002) expresa que Ceroplastes cuenta con un excelente parasitoide, pues se considera a Metaphycus como uno de los principales enemigos naturales con un nivel de parasitismo hasta del 50 %.
Durante la evaluación de la emergencia de parasitoides obtenidos en el laboratorio, se observó la presencia de Diaphorencyrtus sp. (Hymenoptera: Encyrtidae) parasitando ninfas de C. floridensis; este es el primer registro de la especie actuando sobre la escama en Colombia. Anteriores investigaciones realizadas por Arias-Ortega (2016) en el Centro de Investigación y Cría de Enemigos Naturales de la Universidad de Caldas registraron por primera vez a Diaphorencyrtus sp. como parasitoides primarios del psílido Diaphorina citri, que es causante de grandes pérdidas de frutos en cultivos comerciales. De igual forma se reporta en Estados Unidos (Rohrig y Hall, 2012; Matsunaga, 2014) y en México (Cortez- Mondaca et al., 2010; Cortez et al., 2011).
De acuerdo con su comportamiento, Diaphorencyrtus sp. se clasifica como un endoparasitoide koinobionte y, además, en el estudio se vio actuando sobre ninfas de 0.4 mm y 0.8 mm de longitud; las ninfas del C. floridensis que son parasitadas continuaron alimentándose y desarrollándose hasta que el parasitoide se acercó al final de su estado larval y emergió por el extremo posterior de las ninfas de C. floridensis.
Una de las clasificaciones de los parasitoides asociados a C. floridensis que llama la atención es la especie Copidosoma sp., que es considerado como parasitoide principal de lepidópteros, pero no existe registro alguno sobre cóccidos. En nuestras observaciones se registró su emergencia en los adultos de C. floridensis confinado en el laboratorio; su reconocimiento se estableció de acuerdo con los caracteres morfológicos típicos del género, como ser de cuerpos de 0.7 mm de longitud; generalmente oscuro metálico; antena insertada en la parte baja de la cabeza; escapo antenal amarillo; antenas de 11 segmentos con setas o pelos cortos que son ligeramente filiformes; escutelo redondeado; espolón mesotibial largo; fémur posterior; y tibia oscura a excepción de estrechas bandas amarillas en los ápices.
Estos resultados se asemejan a los reportados por Grbic (2003), quien afirma que aquellas son avispas con una longitud que varía entre 0.7 y 4.0 mm (incluido el ovipositor). Tiene cuerpo con brillos metálicos; mandíbulas con tres dientes agudos; antena con funículo de seis segmentos; clava de uno o tres segmentos; ala anterior con vena marginal puntiforme; vena estigmal sin uncus desarrollado y con seis sensilas simétricamente arregladas en un cuadrado; y el ovipositor salido. Son parasitoides poliembriónicos de huevo-prepupa de varias familias de Lepidoptera.
Del género Copidosoma se han descrito cerca de 200 especies (Noyes, 2012), de las cuales se registran 13 especies en el neotrópico (López Pérez, 2003), 4 de ellas en el Caribe: C. capsicum Burks (de Trinidad y Puerto Rico), y C. cubense López, C. floridanum (Ashmead) y C. truncatellum (Dalman) de Cuba (aunque este último registro puede ser una identificación errónea de C. floridanum) (López Pérez, 2003).
Por su parte, las especies Chrysocharis flacilla y Chrysocharis pentheus se obtuvieron también de adultos de C. floridensis confinadas en el laboratorio; este es el primer registro que se tiene de las especies parasitando adultos. En cuanto a la morfología del género, se puede decir que su tamaño es de 1.65 mm de longitud y color verde, algunas veces marcado con azul oscuro (incluyendo tórax, gáster y cabeza); antena marrón; escapo amarillo, muchas veces blancos; todas las patas (incluidas las coxas) blancas; alas hialinas; ojos rojizos; y ocelos anaranjados.
Durante el proceso de emergencia de los parasitoides de C. floridensis se destaca Aprostocetus sp., endoparasitoide solitario de cuerpo amarillo, ojos rojos, abdomen redondo y antenas filiformes. De su comportamiento se pudo evidenciar que ejerció su modo de acción sobre los adultos de la escama; de ello no existe reporte. Es poca la información disponible sobre su biología y comportamiento, por tanto, esta nueva información sobre Aprostocetus sp. se hace vital para mejorar su uso en programas de control biológico.
Por último, se identificó a la especie Tetrastichus sp. como endoparasitoide gregario emergido de adultos de C. floridensis; esta especie ha sido estudiada como agente de control biológico de lepidópteros plaga, principalmente de insectos de las familias Plutellidae, Noctuidae y Crambidae (Cruz et al., 2011; Costa et al., 2014).
Conclusiones
Dentro de la caracterización de los principales parasitoides que presentaron una acción directa sobre C. floridensis en el cultivo de guayaba agria se destacan las especies Metaphycus sp.; Copidosoma sp.; Chrysocharis flacilla; Chrysocharis pentheus; Tetrastichus sp. y Aprostocetus sp., que actuaban directamente sobre los adultos del cóccidos.
En cuanto a las especies Metaphycus marensis; Metaphycus helvolus y Diaphorencyrtus sp. expresaron su comportamiento específicamente sobre las ninfas. Es necesario resaltar que Diaphorencyrtus sp. se reporta como el primer registro que actúa sobre la escama en Colombia.