INTRODUCCIÓN
La fascioliasis perjudica a animales herbívoros, omnívoros y ocasionalmente al hombre (Marcos et al. 2004; Mas-Coma 2004). Esta parasitosis es producida por dos especies de trematodos digenéticos: F. hepatica (América, Europa, África, Asia y Oceanía) y Fasciola gigantica (África, Asia, Sur de Europa, Turquía, Cercano Oriente, Armenia y América del Norte). Se cree que F. hepatica es de origen europeo, donde se ha encontrado en poblaciones humanas prehistóricas del periodo meso-lítico y neolítico hace 5.000-5.100 años (Ashrafi et al. 2014; Mas-Coma 2004), así como en el valle de Saale-Unstrut en Alemania tres mil años antes de Cristo. Se ha notificado desde 1950 en 51 países. Alrededor del mundo estarían infectadas 2,4 a 17 millones de personas (Mantari et al. 2012) y 91 millones se encontrarían con riesgo de infectarse, en incremento desde 1980, en especial en poblaciones pobres (Marcos et al. 2005a; Marcos et al. 2006). Se constituye como un problema de salud pública, además de una enfermedad tropical desatendida (López et al. 2012; Zumaquero et al. 2013); y se describen amplias zonas endémicas e hiperendémicas con prevalencias por encima de 50% (Marcos et al. 2005a). Las más altas prevalencias se dan principalmente en valles andinos hasta 4.500 msnm y la propagación sucede sobre todo en localidades del sector rural donde se practica la agricultura.
Los escolares son los más afectados (Ashrafi et al. 2014; Martínez et al. 2006; Valencia et al. 2005). El compromiso del cuadro clínico depende de la cantidad de parásitos (López et al. 2012) y constituye un factor de morbilidad relacionado con el estado nutricional (León y Cabanillas 2014).
Las técnicas coprológicas y serológicas son las principales herramientas para el diagnóstico. El hallazgo de huevos en muestras fecales sigue siendo la estrategia más adecuada para el diagnóstico y la estimación de la intensidad, pero las técnicas inmunológicas son aplicables en todas las etapas de la enfermedad, principalmente en el periodo invasivo o agudo (Ashrafi et al. 2014).
Además, cabe destacar la ausencia de paralelismo entre la fascioliasis humana y animal en cuanto a prevalencias e intensidades. Este hecho es consecuencia de las diferencias de comportamiento, hábitos, tradiciones y alimentación según las distintas regiones, características sociales y culturas del mundo. Entre los aspectos que subyacen a la mencionada heterogeneidad, destacan las capacidades de adaptación de los parásitos a diferentes pisos ecológicos, especies de ganado y animales domésticos involucrados y su manejo, características generales del comportamiento humano y fuentes de infección humana (Mas-Coma et al. 2018).
El objetivo de esta revisión literaria es mostrar por primera vez la realidad de la infección por F. hepatica en Perú frente al resto del mundo, considerando los riesgos de infección en niños de edad escolar. Para ello se efectuó un estudio de tipo bibliométrico, descriptivo y transversal, recopilando publicaciones hasta 2021 sobre estudios de fascioliasis en niños de edad escolar de Perú y el mundo.
MATERIALES Y MÉTODOS
Se desarrolló un estudio de naturaleza biblio-métrica, descriptivo y transversal, mediante la recopilación de publicaciones de los años 2000-2022, como artículos originales, comunicaciones cortas y reportes de casos, utilizando como estrategia de pesquisa en internet la combinación de palabras clave y operadores booleanos empleados en las bases de datos de Scopus, Science Direct, Web of Knowledge, Proquest y Scielo, así como tesis de repositorios universitarios de Perú. Las palabras clave fueron: Fasciola hepatica, fascioliasis, fasciolosis y fasciola, y se agregó continuamente la palabra niños, tanto en español como en inglés. Por otro lado, se tomó como criterio de selección las publicaciones con estudios de prevalencia o incidencia con base en diagnósticos serológicos o coprológicos por su mayor difusión.
Generalidades
Agente causal y ciclo de vida
La clasificación taxonómica de F. hepatica es la siguiente. Reino: Animalia; filo: Pla-tyhelminthes; clase: Trematoda; subclase: Digenea; orden: Echinostomida; familia: Fasciolidae; género: Fasciola; especie: F. hepatica (Vignau et al. 2005).
Es un parásito plano de 20-40 mm de largo por 10-15 mm. Su ciclo de vida es heteroxénico por requerir huésped intermediario (Staff et al. 2003). Los adultos ponen tres mil huevos al día aproximadamente, siendo transportados por la bilis al intestino y expulsados, antes de embrionar, con las heces. El primer estadio juvenil (miracidio) se desarrolla en agua dulce donde emerge del huevo en 10-12 días a 20-26°C, pero en 60 días o más a 10°C. Al liberarse, en menos de 8 horas deberá asaltar a un huésped intermediario (caracol anfibio de la familia Lymnaeidae) (Mas-Coma et al. 1999). Los miracidios se introducen en el caracol en 30 minutos aproximadamente, mediante mecanismos enzimáticos y mecánicos, convirtiéndose en esporoquistes. Los caracoles, al ser infectados, quebrantan su fecundidad o son abatidos por la penetración a sus glándulas digestivas y las subsecuentes alteraciones metabólicas. Una vez adentro del molusco, la larva se desprende de los cilios, convirtiéndose en esporocisto, con reproducción asexual, produciendo varias docenas de redias en dos generaciones. Las cercarias miden 0,25-0,35 (µm y tienen cola movible de 0,5 (µm no bifurcada, de la cual se deshacen pocas horas después, produciendo una sustancia mucilaginosa con la que se adhieren a la vegetación acuática. Las cercarias libres nadan en agua dos horas aproximadamente, se fijan en la vegetación acuática y producen un revestimiento protector o quiste en su contorno. Algunas consiguen enquistarse en el agua y subsisten con las burbujas. En este estado enquistado se le llama metacercaria y mide cerca de 0,2 mm de diámetro, tornándose infectante para el huésped definitivo a los dos días (Marcos et al. 2004; Mas-Coma 2004).
Los huéspedes definitivos se contagian al tragar metacercarias conjuntamente con plantas o agua. Al digerirse la envoltura del quiste en el intestino delgado del huésped el parásito se estimula, traspasa la pared intestinal, y recorre la cavidad peritoneal un par de días mientras invade el parénquima hepático. El gusano sigue su camino a través del hígado durante 6-7 semanas e irrumpe los canales biliares cuando mide 4-14 mm de largo. Luego de 56-90 días de la infección, los huevos aparecen en las heces (Carrada y Escamilla 2005).
Clasificación epidemiológica de la fascioliasis
En muchas áreas, la fascioliasis humana es verdaderamente endémica, variando de hipoendémica a hiperendémica. En áreas endémicas, las elevadas prevalencias en personas no parecen estar asociadas con elevadas prevalencias en animales domésticos (Mas-Coma 2006). Existen dos clasificaciones de acuerdo con la presentación de casos:
Autóctonos: Casos aislados no constantes. Las personas se infectan en la zona donde viven y donde la fascioliasis animal se desenvuelve; tales casos brotan ocasionalmente.
Importados: Casos diagnosticados en zonas donde el parásito no está presente, incluso en animales. Estos casos son infectados en otras áreas endémicas (Ashrafi et al. 2014; Marcos et al. 2007).
Se distinguen tres tipos de situaciones endémicas en humanos:
Hipoendemia: Prevalencias 1%, con intensidades aritméticas medias 50 huevos por gramo de heces (hpg), donde la cantidad de casos es esporádica.
Mesoendemia: Prevalencias entre 1-10%, con intensidades entre 50300 hpg.
Hiperendemia: Prevalencias 10%, con intensidades 300 hpg (Ashrafi et al. 2014; Marcos et al. 2007; Mas-Coma 2004).
Fascioliasis animal en Perú
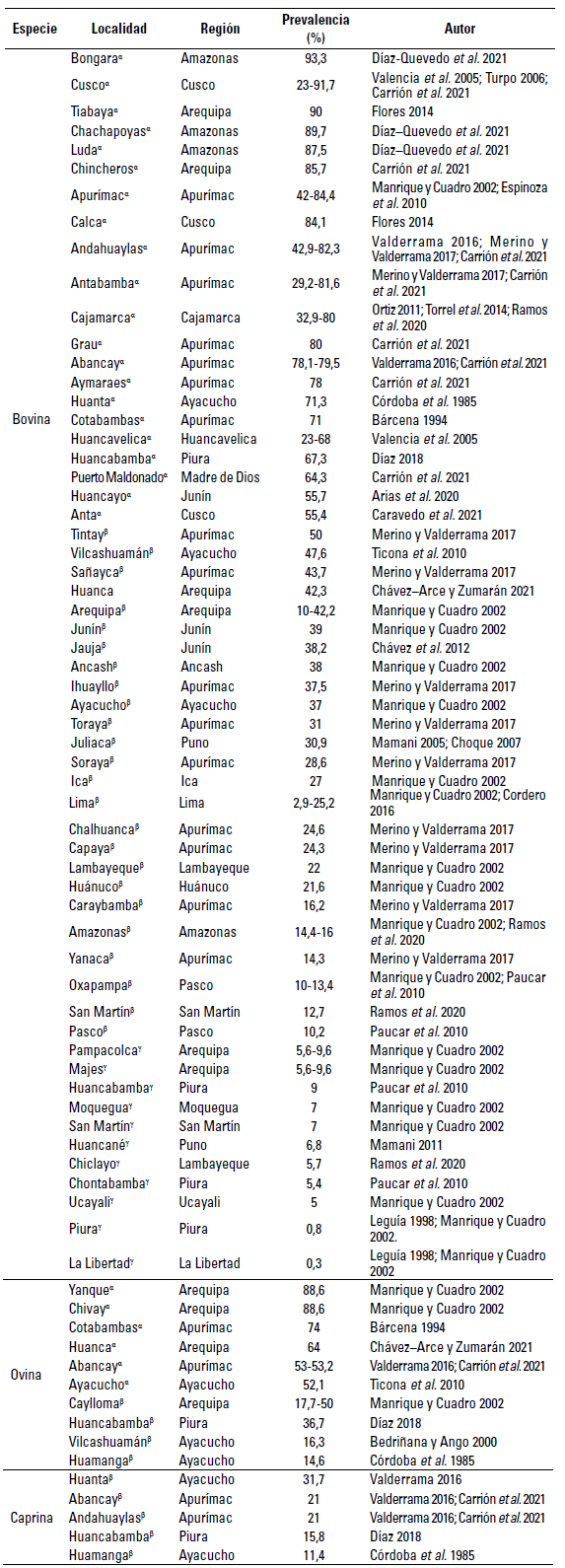
F. hepatica ha logrado difundirse en Perú debido a la importación de ganado europeo, mediante la adaptación a otras especies de mamíferos autóctonos como camélidos sudamericanos (Mas-Coma et al. 2013). La colonización de nuevas áreas se debe a las adaptaciones del parásito a una serie de caracoles limneidos. Existen mesoendemias e hiperendemias en zonas determinadas de todo el país (Esteban et al. 1998). Puede notarse que las zonas endémicas se hallan en regiones altoandinas (figura 1), de acuerdo con estudios experimentales que demostraron que los caracoles infectados subsisten más tiempo a mayor altitud, debido a que la etapa de expulsión de cercarias es mayor, al igual que el número de metacercarias producidas. Las poblaciones rurales más elevadas y apartadas de las urbes, con dificultoso acceso por carretera, pueden constituir un riesgo significativo de infección (González et al. 2011; Mas-Coma 2005); tal es así que en Perú, la prevalencia promedio de fascioliasis en bovinos, ovinos y caprinos, diagnosticada por evaluación post mórtem, es de 42,8, 57,9 y 20,2%, respectivamente (tabla 1), con un promedio general de 43,8%, considerado como mesoendémico por Valderrama (2016). Sin embargo, mediante la evaluación post mórtem, acorde con el Reglamento de Faenado de Animales de Abasto del Servicio Nacional de Sanidad Agraria de Perú, realizado en mataderos, se evidencia que la mayoría de localidades donde se diagnosticó esta parasitosis presenta niveles hiperendémicos de infección, especialmente en Bongara (93,3%), Cusco (91,7%) y Tiabaya (90%) para bovinos y Yanque y Chivay (88,6%, respectivamente) para ovinos.
FIGURA 1 Clasificación endémica de fascioliasis en niños de edad escolar en las diferentes provincias de Perú, las cuales se sitúan a lo largo de la Cordillera de Los Andes. Las regiones de costa y selva no presentan reportes (excepto Lima y Amazonas, respectivamente). Hiperendemia (rojo); mesoendemia (verde); hipoendemia (amarillo).
Fascioliasis en niños de edad escolar en Perú
Hasta la fecha se ha reportado fascioliasis en humanos en 11 de las 24 regiones del país, de las cuales Puno y Cajamarca presentan las prevalencias más altas (tabla 2).
TABLA 2 Prevalencia de fascioliasis en niños de edad escolar de Perú, de acuerdo con la altitud y el método de diagnóstico
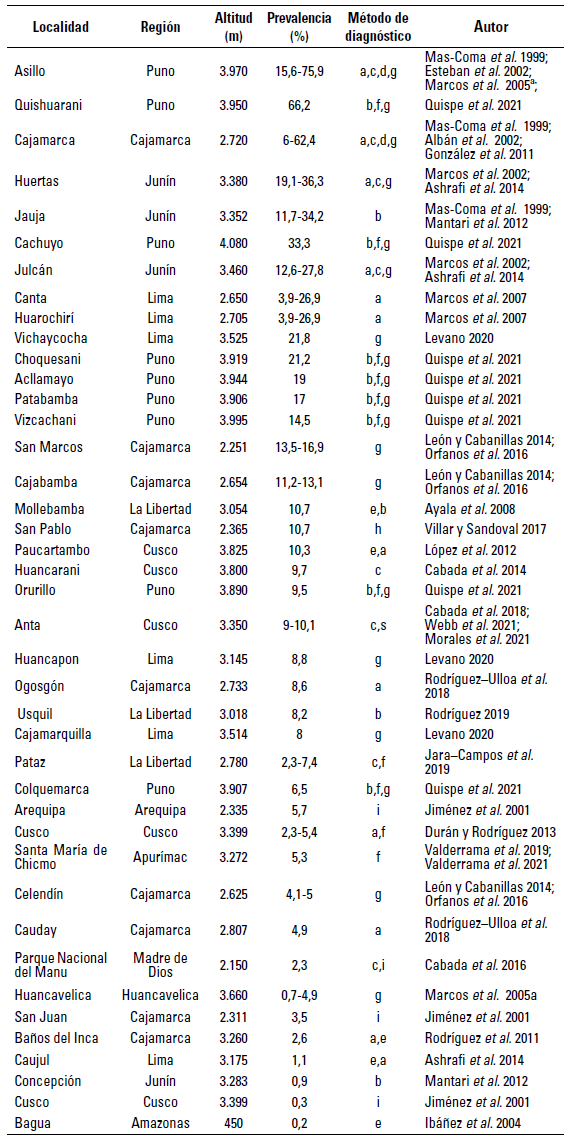
a=Sedimentación rápida de Lumbreras; b=Sedimentación rápida; c=Kato-Katz; d=Ziehl-Neelsen modificado; e=Prueba directa; f=Inmuno blot; g=Fas2-ELISA; h=Real-time PCR; i=Método de diagnóstico no especificado.
Fuente: elaboración propia.
La capacidad de este parásito para adaptarse a nuevos entornos ha contribuido claramente a su propagación, incluso en ambientes a más de 3.000 msnm. Ninguna otra enfermedad transmitida por vectores presenta esta amplia altitud (Mas-Coma et al. 2013), lo que puede corroborarse en la figura 2, donde se muestra que la prevalencia de fascioliasis en niños aumenta con la altitud (p<0,05).
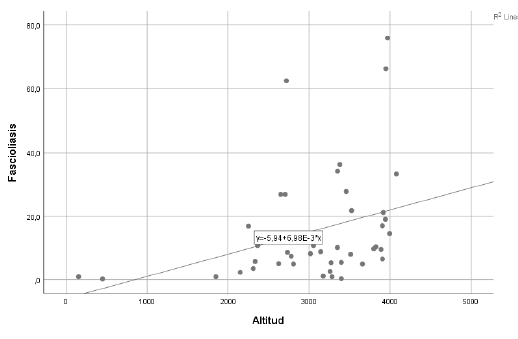
Fuente: elaboración propia.
FIGURA 2 Correlación entre fascioliasis (%) y altitud (msnm) de la residencia de los niños de edad escolar en Perú. r=0,34; p=0,026.
Se estima que 8 millones de personas del sector rural se encuentran en riesgo de contraer fascioliasis (Esteban et al. 1998). Las primeras referencias datan de 1924, cuando se describieron casos aislados en vías biliares extrahepáticas observadas en medio de operaciones quirúrgicas (Jiménez et al. 2001). Asimismo, uno de los primeros hallazgos de prevalencia se produjo en Azángaro, Puno, con 15,6%. En este lugar, se reportaron intensidades de 2.496 hpg (Esteban et al. 2002), donde la prevalencia por métodos serológicos y coprológicos en < 19 años de edad alcanza 61,4% y 75,9%, y en > 19 años 15,4% y 37,5% (Marco et al. 2005b); por lo que, junto con Cajamarca, son las regiones más hiperendémicas del país.
El análisis coprológico se basa en la pesquisa de huevos en muestra fecales, drenaje biliar o duodenal. Se ha usado el examen directo y métodos de concentración para el diagnóstico de la fase crónica. Asimismo, a través de métodos de Concentración Éter-Formol y la Técnica de Kato-Katz, se han repotado elevadas prevalencias, aunque esta última tiene reducida sensibilidad, limitando su empleo clínico. En 1975, fueron comparados 5 métodos de concentración para descubrir huevos; el Método de Concentración Éter-formol fue el de más bajo rendimiento. En 1962, se adaptaron innovaciones a un método de sedimentación, explicando los beneficios de su uso para el diagnóstico y vigilancia terapéutica de la fascioliasis humana en áreas endémicas (Esteban et al. 1998).
El ensayo serológico empleado para el diagnóstico de la fascioliasis es ELISA, con elevada sensibilidad (97%) y especificidad (96,6%); al mismo tiempo, detecta casos en fase aguda. Del mismo modo, se utiliza ELISA Fas2, que posee una sensibilidad inferior (94,7%), pero superior especificidad (100%). El diagnóstico también puede ser complementado con otros ensayos confirmatorios como la técnica de sedimentación rápida y Kato-Katz (León y Cabanillas 2014; Marcos et al. 2007). Consecuentemente, la prevalencia promedio de fascioliasis en niños de edad escolar en Perú utilizando los diversos métodos de diagnóstico alcanza niveles hiperendémicos (15,5%).
Fascioliasis en niños de edad escolar alrededor del mundo
La infección en humanos se ha reportado en numerosos países, especialmente del continente americano, donde las mayores prevalencias corresponden a Perú, Bolivia y Venezuela (Marcos et al. 2004; Marcos et al. 2007). La mayoría de países en América se encuentran en niveles hiperendémicos de infección, a excepción de Brasil, Puerto Rico, Ecuador, Cuba, Colombia (mesoendémicos) y Chile (hipoendémico) (tabla 3).
En América, las prevalencias más elevadas se dan en Perú y Bolivia, en localidades ubicadas entre 154 a 4.080 msnm, donde 350 mil personas han sido infectadas y existe una población de aproximadamente 1 millón de individuos en riesgo (Esteban et al. 1998). Las zonas endémicas pueden ser reducidas, como en Bolivia, o ser difundidas, como en Perú. En Bolivia, se encontró 15,4% de prevalencia global, con variaciones locales entre 0-68%. Sin embargo, en un área hiperendémica se halló una prevalencia de 75% en niños, 41% en adultos y una incidencia de 67% (Esteban et al. 2002). Ecuador presenta características similares a las de Perú, pero no existen datos concretos, a excepción de un reporte de 6% de prevalencia (Trueba et al. 2000), sin embargo, alrededor de 1% de la población rural que vive en áreas endémicas se encuentra en riesgo y se estima que aproximadamente 20 mil personas están infectadas. En Chile, la fascioliasis es hipoendémica en Valparaíso y Viña del Mar, así como en las Regiones V, VI y VII. En Argentina, Uruguay, Brasil, Colombia y Venezuela, parece ser focal y esporádica (Esteban et al. 1998). Existen reportes de fascioliasis importada en Argentina, Canadá y Estados Unidos, los cuales corresponden a pacientes inmigrantes de México, Puerto Rico, Haití, República Dominicana, Perú, Portugal, Irlanda, Cabo Verde, Etiopía, Egipto, Yemen, Uzbekistán, Taiwán y Tailandia. Las infecciones importadas en Estados Unidos provienen de México, Puerto Rico, Haití y República Dominicana. También se ha reportado en refugiados del Sudeste de Asia (Esteban et al. 1997).
TABLA 3 Prevalencia de fascioliasis en niños de países endémicos de América, Asia, África y Europa según nivel endémico y método de diagnóstico

∞=Zona hiperendémica, β=Zona mesoendémica, γ=Zona hipoendémica.
s=Estudio serológico, c=Estudio coprológico, n=No especificado.
*Asia y Europa
Fuente: elaboración propia.
En las islas del Caribe de América Central, es un problema de salud pública, sobre todo en Puerto Rico y Cuba. En Pinar del Río, en Cuba, más de 10 mil individuos fueron infectados entre 1947 y 1948, y un nuevo brote afectó a 81 sujetos en 1995; asimismo, en Villa Clara, un brote en más de mil sujetos se dio en 1983 (Esteban et al. 1998).
En el continente asiático, Camboya es hiperendémico (46,5%) (Bless et al. 2015), pero la mayoría de casos reportados los últimos 30 años se dieron en Irán, China, Turquía, Corea, Japón, Tailandia, India, Yemen, Israel y Arabia Saudita. La fascioliasis también es un problema de salud pública en países del Cercano Oriente que rodean el mar Caspio, como Irán, con epidemias que afectan hasta 10 mil sujetos y una población de alrededor de 6 millones en riesgo. Camboya, Irak, Israel, Líbano, Nepal, Filipinas, Siria y Vietnam presentan menos de 100 casos documentados por la OMS en 1995 (Esteban et al. 1998). Los países vecinos como Azerbaiyán, Georgia, Turkmenistán, Tayikistán, Uzbekistán y Afganistán, entre otros, también presentan fascioliasis. Las tierras altas del Himalaya son apropiadas para la transmisión, de acuerdo con la capacidad del parásito para colonizar grandes altitudes como en países andinos. La presencia de fascioliasis en colinas de Nepal Koshi es bien conocida. Sin embargo, los casos en Japón y Corea son ocasionales. En Vietnam, más de 500 casos han sido diagnosticados entre 1997 y 2000, la mayoría de los sujetos eran de provincias centrales y meridionales, especialmente de zonas montañosas y costeras centrales. Por otro lado, también se han reportado casos importados en viajeros que visitaron Hong Kong, Singapur, Afganistán, Egipto y zonas tropicales. En una zona no endémica como Kuwait puede encontrarse fascioliasis en expatriados procedentes de zonas endémicas; asimismo, en Arabia Saudita se ha diagnosticado en trabajadores inmigrantes (Esteban et al. 1997).
En África se han reportado pocos casos, aunque los estudios realizados son insuficientes para obtener una visión significativa. La mayoría de casos han sido reportados en Tanzania y Egipto, donde la fascioliasis se ha configurado en un emergente problema de salud. Algunas zonas rurales pueden considerarse endémicas con prevalencias entre 7-17%. La población en riesgo asciende a 27,7 millones de individuos y los infectados son al menos 83 mil. Países como Costa de Marfil, Madagascar, Malí y Mozambique con 100 casos documentados y Etiopía, con 100-1.000 casos, son también considerados (Esteban et al. 1998). En Marruecos, Túnez y Argelia (Norte de África) se distinguen epidemias en personas procedentes de Europa. Asimismo, pacientes infectados en islas de Cabo Verde se reportaron en Senegal (Esteban et al. 1997).
También se han diagnosticado casos en 19 países europeos, aunque solo existen reportes de prevalencias en Portugal y Francia. Además, junto a la antigua Unión Soviética (incluyendo su parte de Asia), España y Reino Unido son los que reportan la mayoría de casos. En los demás países parecen ser esporádicos (Esteban et al. 1998). En Europa se han hallado muchos casos importados (Esteban et al. 1997). Francia es considerado endémico, ya que entre 1950 y1983 se reportaron 3.297 casos, la mayoría de ellos registrados en Lyon, Bretaña, Norte-Paso de Calais y Sureste. La enfermedad también es endémica en el norte de Portugal, donde se reportaron 561 casos en tres comunidades. En España parece estar subestimada y se distribuye principalmente en poblaciones asiladas del País Vasco, Castilla y León, Cantabria, Rioja y Navarra. En la antigua Unión Soviética, casi todos los casos reportados fueron de Asia meridional, en Tadzhik, cerca de la frontera con Afganistán. En Reino Unido, se reportaron 44 casos en 1969. Países como Hungría y Turquía, con 100 casos, son también considerados (Esteban et al. 1998).
Por tanto, se estima que alrededor del mundo la prevalencia promedio de fascioliasis en niños de edad escolar es de 17,1% (tabla 3).
Factores asociados a fascioliasis en niños
Las variables socioculturales afectan la salud en etapas críticas a lo largo de la vida, y existen múltiples niveles de exposición (Phimpraphai et al. 2018). Existen diversos factores asociados a fascioliasis en niños de edad escolar, similares alrededor del mundo, los cuales se muestran en la tabla 4 y se describen a continuación:
TABLA 4 Factores asociados a fascioliasis en niños de edad escolar en el continente americano y el resto del mundo

Fuente: elaboración propia.
Edad y género: la fascioliasis es frecuente en personas de 0 a 19 años, debido a la insuficiente inmunidad adquirida por esta población para enfrentar la infección. En muchas investigaciones, dos terceras partes de los infectados fueron mujeres, probablemente por la mayor frecuencia en labores de campo y menor participación en centros educativos rurales (Albán et al. 2002; Marcos et al. 2005a; Marcos et al. 2007).
Características de la vivienda: los factores socioeconómicos, epidemiológicos y ecológicos hacen que las localidades del sector rural logren contextos propicios para que los niños tengan fascioliasis (Marcos et al. 2005a), debido al deficiente acceso a servicios básicos como agua y electrificación. Asimismo, diversos estudios encontraron asociación entre vivir cerca de acequias o cultivos y fascioliasis; por lo que, la proximidad a acequias acrecentaría la posibilidad de infección, ya que los niños suelen tener contacto con agua contaminada con metacercarias. Además, el desecho de deposiciones en silos es un elemento protector de serología positiva, debido probablemente a que los niños que defecan en silos poseen hábitos higiénicos superiores a aquellos que defecan en el campo, ríos o acequias (Marcos et al. 2004).
Consumo de comidas y bebidas: los estilos de vida y los hábitos alimenticios, tales como consumo de alimentos y bebidas, actúan como factores de riesgo (Espinoza et al. 2010; Marcos et al. 2002, Marcos et al. 2004; Marcos et al. 2005a; Marcos et al. 2006; Zumaquero et al. 2013), ya que las metacercarias se localizan en reservorios de agua dulce y de corriente lenta. Asimismo, en zonas rurales la carencia de agua potable motiva el consumo de agua sin hervir. Al mismo tiempo, el agua contaminada puede difundirse por los canales de regadío y acequias, contaminando vegetación que se consume como alimento para las personas, a las que, además, podría contagiar (Ayala et al. 2008; Ashrafi et al. 2014).
Crianza de animales: el parásito F. hepatica demanda de un reservorio acuático y un huésped intermediario para consumar su ciclo de vida. Comúnmente, es descrita como una trematodiasis relacionada a bovinos y ovinos. No obstante, en porcinos y burros se ha confirmado el potencial de expulsar y dispersar huevos viables aptos para infectar al caracol limneido. Igualmente, se ha informado su presentación en caprinos, equinos, conejos, cuyes, ratones, alpacas, llamas y vicuñas (Ayala et al. 2008; Jiménez et al. 2001). Los animales, como hospederos definitivos, se encuentran en riesgo de reinfección continua, ejerciendo en el proceso epidemiológico un rol transcendental en la propagación de la fascioliasis. La deficiente implementación de programas de control veterinario ocasiona que se sostenga la endemia (Marcos et al. 2004; Marcos et al. 2005a). En consecuencia, la convivencia con animales domésticos, especialmente bovinos y porcinos, incrementa el riesgo de infección en niños (Marcos et al. 2005a; Valderrama et al. 2019).
Coinfección con enteroparásitos: la manifestación de parásitos coinfectantes hace que el análisis de las consecuencias de la fascioliasis en el desarrollo del niño sea difícil (Zumaquero et al. 2013). Los niños con poliparasitismo e infectados con protozoarios presentan mayor riesgo de fascioliasis (Valderrama et al. 2021). Tal como se muestra en la tabla 3, los enteroparásitos más frecuentes en niños de edad escolar son Giardia lamblia/intestinalis, Ascaris lumbricoides, Blastocystis hominis, Trichuris trichiura, Entamoeba histolytica/Entamoeba dispar, Enterobius vermicularis, Hymenolepis nana, Dicrocoelium dendriticum, entre otros (Marcos et al. 2004, Marcos et al. 2006; Steinmanna et al. 2010; Tezer et al. 2013; Zumaquero et al. 2013).
Signos clínicos: los síntomas más comúnmente relacionados a fascioliasis incluyen complicaciones intestinales, anorexia, dolor abdominal, fiebre, eosinofilia y hepatomegalia en la fase aguda (Ayala et al. 2008; Marcos et al. 2005a). Sin embargo, en un cuadro crónico existirá dolor abdominal de localización epigástrica, vómitos e ictericia como signos clínicos característicos (León y Cabanillas 2014; Loja et al. 2003), conjuntamente con náuseas, intolerancia a los alimentos grasos, cólico biliar y anemia (Mas-Coma 2004).
La presentación crónica se da en la mayoría de los casos donde el dolor abdominal es el síntoma predominante, acompañado a veces de prurito e ictericia. Los casos avanzados son poco frecuentes debido al dificultoso acceso de los pobladores para acudir a los centros de salud. Es posible que el parásito intervenga en la generación de hematomas hepáticos al penetrar la cápsula de Glisson y el parénquima hepático (Albán et al. 2002). En la tabla 4 se muestran organizadamente las signo-sintomatologías por daño hepático, presentación clínica en laboratorio y por imágenes, trastornos gastrointestinales, del sistema respiratorio y sistema nervioso, donde el signo clínico más reportado es el dolor abdominal, seguido de cefalea, vómitos y fiebre.
Estado nutricional: la disminución de peso es un factor asociado a fascioliasis, lo que implica que una persona con bajo peso, especialmente con delgadez severa, posea una mayor posibilidad de llegar a ser diagnosticado como positivo, sin considerar si esta condición está relacionada con la fase crónica de la enfermedad (León y Cabanillas 2014; Valderrama 2021). Asimismo, numerosas investigaciones demuestran la asociación entre parasitismo y peso/edad/ talla de niños (Ordóñez et al. 2002).
CONCLUSIONES
Muchas localidades de la sierra peruana alcanzan niveles hiperendémicos de fascioliasis en bovinos y ovinos. Por otro lado, se han reportado casos en niños de edad escolar, en 11 de las 24 regiones del país, desde los 154 a 4.080 msnm, lo cual demuestra que la prevalencia incrementa respecto a la altitud. Puno y Cajamarca presentan las prevalencias más altas.
Perú, Bolivia, Camboya y Venezuela son los países alrededor del mundo con mayor prevalencia de fascioliasis en niños de edad escolar.
Se han reportado como factores asociados a fascioliasis el sexo y la edad de los niños, labores agrícolas, características de la vivienda, consumo de comidas y bebidas, crianza de animales, coinfección con parásitos intestinales, signo-sintomatologías por daño hepático, presentaciones clínicas por laboratorio y por imágenes, trastornos gastrointestinales, del sistema respiratorio y nervioso y estado nutricional.
La fascioliasis, a pesar de su distribución mundial y de disponer de medidas de análisis específicas, todavía presenta problemas de diagnóstico, si se considera que la sintomatología deriva de la fase de la infección y de otras afecciones que manifiesten cuadros afines. Sin embargo, el signo clínico más reportado es el dolor abdominal.