INTRODUCCIÓN
Para la investigación de muchos trastornos hematopoyéticos se cuenta con procedimientos diagnósticos complementarios, como la aspiración y la biopsia de médula ósea (Afkhami et al. 2014). Por un lado, el aspirado es idóneo para detallar morfología celular, realizar recuento diferencial, evaluar celularidad global, tipificar blastos, valorar depósitos de hierro y reconocer microorganismos; adicionalmente, partiendo de esta muestra se aplican técnicas de biología molecular, citogenética, cultivos microbiológicos e inmunofenotipo por citometría de flujo o inmunohistoquímica (Bauer y Harr 2022; Dogan y Demircioglu 2022). Por otro lado, en la biopsia se evalúan arquitectura, fibrosis medular, lesiones focales, granulomas, linfomas, metástasis de diferentes tipos de cáncer, patrones infiltrativos en síndromes linfoproliferativos y estructura ósea, vasos y estroma, principalmente a partir de técnicas de inmunohistoquímica. Así, la elección de una o ambas técnicas dependerá de la condición clínica a estudiar (Gilotra et al. 2017).
La aspiración y biopsia de médula ósea se realiza en diferentes sitios anatómicos y la elección de uno de estos se encuentra sujeta a factores como masa muscular, tejido adiposo, edad, tamaño, raza y condición del paciente. Los puntos utilizados con mayor frecuencia son esternón, húmero, fémur e ilion (Raskin y Messick 2012). Dado que se trata de procedimientos invasivos, se requiere suministrar anestésico local y sedar o anestesiar al paciente. De esta manera, está contraindicado en aquellos con reacciones desfavorables a estos medicamentos, y debe evitarse en trastornos hemorrágicos graves y coagulopatía intravascular diseminada grave. No está contraindicado en cuadros de trombocitopenia, ya que puede convertirse en la herramienta principal para establecer si esta es de origen central (Stacy y Harvey 2017). En humanos, se indica la transfusión de plaquetas antes del procedimiento, cuando el recuento es inferior a 20 x103/µl (Rindy y Chambers 2020; Stensby et al. 2021). La complicación más frecuente descrita en caninos, felinos y humanos durante y después de la obtención de una muestra medular es el dolor; sin embargo, se ha encontrado que está asociado a la no aplicación de anestesia local, también se han descrito en menor medida casos de hemorragia e infección (Guillot et al. 2011; Karacan et al. 2017; Woods et al. 2021).
Son múltiples las indicaciones para evaluar la médula ósea: anomalías persistentes o no explicables en el hemograma, como leucopenia, anemia no regenerativa, trombocitopenia, pancitopenia, leucocitosis y trombocitosis; también se solicita ante la sospecha de un tumor hematopoyético, mieloptisis, linfadenopatía y fiebre de origen desconocido o alteraciones bioquímicas, como hipercalcemia inexplicable e hiper-proteinemia con gammapatía monoclonal o policlonal (Bain 2001; Byers 2017; Kohart et al. 2017; Mylonakis y Hatzis 2014). En general, son presentaciones inespecíficas y comunes al hombre, caninos y felinos; no obstante, cuando se descartan etiologías frecuentes que permitan comprenderlas, el examen de la médula ósea será imperativo y realmente útil para definir el diagnóstico (Bedu-Addo et al. 2013). El objetivo de esta revisión es presentar un panorama general de las indicaciones más frecuentes para la evaluación morfológica de la médula ósea en caninos y felinos y hallazgos reportados en la literatura.
MÉTODO
Se realizó una búsqueda de artículos originales en las bases de datos PubMed, ScienceDirect, Scopus, SciELO y Lilacs. Se utilizaron términos MeSh para reducir la búsqueda a artículos de interés: bone marrow neoplasms, bone marrow examination, congenital bone marrow failure syndromes, bone marrow failure disorders; estos se combinaron con el operador booleano AND con las palabras dog y cat. Con el propósito de definir las indicaciones más frecuentes para la evaluación morfológica de la médula ósea en caninos y felinos, se incluyeron publicaciones con un mínimo de cinco pacientes, sin limitar por periodo de publicación.
Las indicaciones para evaluar la médula ósea en caninos y felinos son heterogéneas, los autores usualmente las describen de acuerdo con manifestaciones clínicas o anormalidades persistentes en exámenes complementarios (Abella-Bourgès et al. 2005; Mylonakis y Hatzis 2014; Raskin y Messick 2012; Stacy y Harvey 2017). Sin embargo, para favorecer su abordaje junto con la diferenciación de los hallazgos comunes en el análisis de este tejido, se agrupan como trastornos malignos y benignos (Berg 2021; Khoury et al. 2022). Los primeros reúnen aquellas condiciones clínicas que orientan a la sospecha de procesos proliferativos descontrolados que se originan a nivel medular o de otro tejido u órgano y los segundos acogen afecciones que se presentan con respuesta periférica, pero que comprometen de forma secundaria un órgano o tejido, como la médula ósea, y que, generalmente, no revisten gravedad o presentan mejor respuesta terapéutica (Beck 2008).
Trastornos benignos
La anemia es una manifestación frecuente en la clínica de pequeñas especies y es secundaria a múltiples condiciones clínicas. En procesos benignos, se debe a la carencia de vitaminas o minerales, a cuadros de infección crónica o aguda por hemoparásitos, hemorragia, exposición a toxinas, tratamientos farmacológicos y trastornos autoinmunitarios (Chikazawa y Dunning 2016; Hanisch et al. 2018; Naigamwalla et al. 2012; Ramaiah 2018). Teniendo en cuenta las múltiples afecciones relacionadas con el desarrollo de anemia, la evaluación de la médula ósea no se encuentra indicada a menos que la causa no pueda ser explicada mediante valoración clínica o exámenes complementarios no invasivos. Sin embargo, en casos de anemia hemolítica inmunomediada, se han descrito cambios en muestras medulares, tales como dismielopoyesis, mielonecrosis, mielofibrosis, edema intersticial, hemorragia, inflamación aguda y síndrome hemofagocítico, que implican variaciones terapéuticas (Weiss 2008).
También se han encontrado hipoplasia eritroide y diseritropoyesis, las cuales pueden explicarse por la destrucción no solo de eritrocitos maduros, sino de precursores eritroides medulares mediados por inmunoglobulinas (Akiyoshi et al. 2021).
Por otra parte, ciertos microorganismos pueden causar infección con compromiso medular, lo cual lleva a que, en algunos casos, su diagnóstico se realice a partir de muestras de médula ósea (Mylonakis y Hatzis 2014). De este modo, la leishmaniasis, enfermedad producida por un parásito intracelular obligado en macrófagos y células dendríticas, ocasiona afecciones cutáneas o viscerales. En cuadros clínicos sistémicos, los protozoos migran a diferentes tejidos, incluida la médula ósea, y desarrollan alteraciones hematológicas, como anemia marcada, disminución del recuento de eosinófilos, linfocitos y monocitos (Nicolato et al. 2013). Cuando no es posible identificar los amastigotes en piel o sangre, la evaluación de la médula ósea es crucial para la observación o detección de estos (Joob y Wiwanitkit 2017). De esta manera, se han descrito múltiples cambios en la médula ósea en relación con el proceso infeccioso, como hipoplasia de la serie eritroide, formación de granulomas, reducción de células hematopoyéticas, principalmente precursores monocíticos, aumento de tejido adiposo y hallazgo de eritrofagocitosis (Momo et al. 2014).
Asimismo, Hepatozoon spp. puede migrar a la médula ósea y producir alteraciones como neutropenia y trombocitopenia persistentes. Se ha descrito la presencia de diferentes estadios intracelulares o extracelulares en este tejido, así como hiperplasia monocítica, aumento de la fagocitosis y relación mieloide eritroide disminuida; al contrario, otros autores han descrito hiperplasia mieloide con megacariocitos normales en morfología y número (Marchetti et al. 2009; Shimokawa Miyama et al. 2011). De igual forma, Babesia spp. puede infiltrar la médula ósea y en algunas infecciones subclínicas se requiere citología de aspirado medular con el objetivo de demostrar su presencia. Las observaciones celulares incluyen serie mieloide normal e hiperplasia eritroide, consecuente con la hemólisis ocasionada por este parásito (Van de Maele et al. 2008).
Por otro lado, la histoplasmosis es una enfermedad causada por un hongo dimórfico intracelular facultativo de macrófagos y monocitos, afinidad que le permite generar cuadros de micosis sistémica en los que se puede ver comprometida la médula ósea (Brömel y Sykes 2005). Es una condición más común en felinos y se expresa con un cuadro clínico muy inespecífico, con o sin citopenias; se requiere evaluación medular cuando no ha sido posible la identificación del microorganismo en sangre u otro tejido y se han descrito eritrofagocitosis, principalmente sobre eritrocitos maduros que sobre precursores (Schaefer et al. 2019).
En relación con bacterias, están las infecciones por Ehrlichia spp. y Anaplasma spp. , dos microorganismos intracelulares obligados, que en la progresión a fase crónica producen cuadros clínicos indistinguibles, con múltiples alteraciones en la médula ósea. Usualmente, la infección se refleja con pancitopenia o bicitopenia en sangre periférica, manifestaciones que requieren la evaluación de la médula ósea para su estudio. Se han descrito hipoplasia, disminución en el índice mieloide eritroide, reducción marcada de tejido hematopoyé-tico y aumento en el número de adipocitos (Holanda et al. 2019; Mylonakis et al. 2010; Neves et al. 2021). En menor medida, se ha reportado el hallazgo de bacterias del género Mycobacterium en aspirados de médula ósea de caninos y felinos con cuadros clínicos inespecíficos (Campora et al. 2011; Latimer et al. 1997; O'Toole et al. 2005).
Otros trastornos benignos para evaluación de la médula ósea incluyen el diagnóstico diferencial en alteraciones hematológicas inducidas por intoxicaciones, infecciones de origen viral, como distemper o parvovirus, sepsis, enfermedad renal crónica y el seguimiento de terapias con medicamentos inmunosupresores o quimioterapéuticos (Borin-Crivellenti et al. 2014; Girardi et al. 2017; Mylonakis y Hatzis 2014; Ramaiah 2018; Salem et al. 2010; Torres et al. 2017). Asimismo, en el campo de la toxicología forense, se ha descrito el uso de médula ósea canina y felina para la detección de plaguicidas ante la sospecha de envenenamiento (Marcelino et al. 2020).
Trastornos malignos
Entre las condiciones malignas se encuentran los trastornos linfoproliferativos, como leucemias linfoides agudas o crónicas, y el mieloma múltiple; y las enfermedades mieloproliferativas, como leucemias mieloides agudas, crónicas y mielodisplásicas (Khoury et al. 2022).
En el abordaje de la anemia desde la malignidad, existe un panorama con cuadros clínicos más severos. Es común cuando el paciente cursa con una neoplasia hematológica, principalmente de carácter agudo, por lo cual es necesario realizar un examen de la médula ósea para definir la enfermedad (Aceña Fabián y Gascón Pérez 2001).
La neoplasia mielodisplásica se caracteriza por citopenias periféricas y metabolismo alterado del hierro. En la médula ósea se identifican cambios displásicos, sideroblastos en anillo y variaciones en los patrones de maduración, y, aunque no son clasificados como condiciones malignas, cuando estas alteraciones morfológicas superan más del 10% de la línea celular, se las considera parte del desarrollo de neoplasias. La mielodisplasia es más frecuente en felinos positivos al virus de la leucemia felina (Ide et al. 2003; Marchi et al. 2021; Shimoda et al. 2000).
Las neoplasias hematológicas se agrupan según la línea que está comprometida. En ese orden se encuentran las alteraciones mieloproliferativas y linfoproliferativas (Aceña Fabián y Gascón Pérez 2001). Entre las primeras, las leucemias mieloides agudas son de curso rápido; se caracterizan por leucocitosis marcada, anemia y trombocitopenia, y se pueden originar a partir de mieloblastos, monoblastos o megacarioblastos. El diagnóstico se hace a través del aspirado de médula ósea, donde se observa más del 20% de blastos y cambios displásicos (Davis et al. 2018; Ledieu et al. 2005).
Ahora bien, en las leucemias mieloides crónicas hay un aumento en la proliferación celular con tendencia a la maduración, y en la evaluación de la médula ósea es común encontrar aumento en las líneas mieloide granulocítica y megacariocítica con un bajo porcentaje de blastos, inferior al 7%, hipoplasia eritroide y displasia de las demás líneas celulares. El predominio celular dependerá del tipo de línea mieloide afectada (Azakami et al. 2019; Gelain et al. 2006; Marino et al. 2017).
Un trastorno mieloproliferativo crónico poco frecuente en caninos y felinos es la policitemia vera, que se caracteriza por un aumento en la producción de células rojas sin aumento de los niveles de eritropoyetina en sangre (Beurlet et al. 2011). En este cuadro se han observado médulas óseas hipercelulares con predominio de serie eritroide (Kay et al. 2018). Por otro lado, la trombocitemia esencial es una neoplasia mieloproliferativa en la que hay aumento en la producción de megacariocitos, lo que conlleva trombocitosis en la periferia. El diagnóstico de ambos trastornos se da a partir de la evaluación de la médula ósea y la identificación de la mutación (V617F), que se localiza en la región que codifica el dominio pseudoquinasa de la proteína JAK2 (Beurlet et al. 2011; Mizukoshi et al. 2006).
Finalmente, entre los trastornos mielo-proliferativos está la mielofibrosis, distinguida por la proliferación de fibroblastos que reemplazan el tejido hematopoyético. En muestras de médula ósea en las que se sospecha esta enfermedad, es importante evaluar la celularidad global y el contenido de fibras de reticulina; esta última es la base para la gradación de la fibrosis (Montes-Moreno et al. 2014). Comúnmente, el desarrollo de mielofibrosis es secundario a leucemias, linfomas agudos, necrosis medular, anemia hemolítica inmunomediada y terapias farmacológicas a largo plazo (Iwanaga et al. 2012; Weiss y Smith 2002).
En cuanto a los trastornos linfoproliferativos, las leucemias linfoides agudas son más frecuentes en perros y gatos; en estos últimos se asocia con la infección por el virus de la leucemia felina. Estas neoplasias cursan con leucocitosis marcadas a expensas de blastos circulantes, anemia y trombocitopenia (Aceña Fabián y Gascón Pérez 2001). Por otra parte, entre los trastornos linfoproliferativos crónicos de células maduras, la leucemia linfoide crónica cursa con linfocitosis en periferia, con valores superiores a las 10.000 células por mm3. En ambos grupos de enfermedades, el diagnóstico hematológico se realiza a través del examen de la médula ósea (Vail et al. 2007). Asimismo, el mieloma múltiple es una neoplasia de células B diferenciadas en plasmocitos, que se caracteriza por hiperproteinemia a expensas de globulinas monoclonales. El diagnóstico se realiza mediante el mie-lograma, en el cual se observan recuentos de células plasmáticas clonales, superiores al 5% (Vail et al. 2007).
Por último, la neoplasia hematológica más frecuente en caninos es el linfoma. Puede surgir de cualquier tejido, principalmente linfoide, como linfonodos, bazo y médula ósea. En esta enfermedad, el aspirado de médula ósea se utiliza para clasificar los casos como estadio V, en el que hay presencia de linfocitos neoplásicos que infiltran la médula ósea (Aresu et al. 2015; Aubry et al. 2014).
RESULTADOS
Indicaciones frecuentes descritas en la literatura
En cuanto a caninos y felinos, son escasas las publicaciones que reúnen información general de las indicaciones más frecuentes para la realización de aspirados o biopsias de médula ósea; por tanto, no hay claridad si el predominio es de trastornos benignos o malignos. Sin embargo, Weiss (2006) evaluó de manera retrospectiva la prevalencia de trastornos medulares en 717 reportes de muestras de médula ósea de caninos, realizados durante ocho años en un hospital veterinario de Minnesota, y halló, con mayor frecuencia, anemia no regenerativa inmunomediada, aplasia pura de glóbulos rojos, necrosis de médula ósea, mielofibrosis y síndrome hemofagocítico. Observó, además, casos de dismielopoyesis y síndromes mielodisplásicos. Las neoplasias más frecuentes fueron leucemia aguda, leucemia crónica y linfoma maligno en estadio V.
Al aplicar los criterios de búsqueda, se encontraron un total de 27 estudios, estos fueron publicados en los últimos 41 años y el 70% de estos fueron en caninos. Se dividieron en indicaciones benignas o malignas para la evaluación de la médula ósea (tabla 1).
TABLA 1 Características de especie, número de individuos y tipo de trastorno en artículos seleccionados
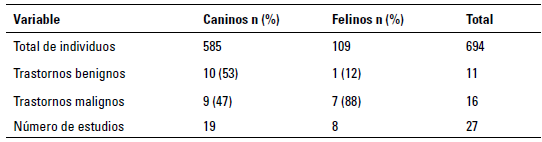
Fuente: elaboración propia.
Entre las publicaciones de hallazgos benignos, la mayoría fueron indicaciones para el diagnóstico diferencial o complementario de enfermedades infecciosas, leishmaniasis, ehrlichiosis y anaplasmosis en pacientes positivos por serología en zonas endémicas para el agente causal. Los objetivos de la evaluación de la médula ósea en estos casos fueron la identificación morfológica de los microorganismos en este tejido, así como la caracterización de los cambios celulares que permitieran comprender las anormalidades en sangre periférica que presentaban los pacientes (Savani et al. 2005; Steindel et al. 2013). Adicionalmente, en el caso de la leishmaniasis, se buscó identificar si los hallazgos en la médula ósea podrían asociarse con la carga parasitaria, al pronóstico, a la presentación clínica o al grado de progresión de la enfermedad (Momo et al. 2014; Nicolato et al. 2013). Se encontró que, en casos de ehrlichiosis y anaplasmosis, el paciente puede desarrollar pancitopenia periférica; en este escenario es preciso evaluar la presencia de mielofibrosis en la médula ósea (Mylonakis et al. 2010).
Entre otras indicaciones benignas para emplear aspirado de médula ósea, se encuentra el diagnóstico de citopenias persistentes e inexplicables en caninos o la asociación de estas con la infección por el virus de la inmunodeficiencia felina; la mayoría cursaba con anemias moderadas a severas y trombocitopenia. El análisis cuantitativo y cualitativo de los hallazgos permitió definir cuadros de hiperplasia, hipoplasia o médulas óseas sin cambios aparentes y concluir que el uso de esta herramienta diagnóstica cobra mayor relevancia en pacientes que cursan con bicitopenia o pancitopenia (Dircks et al. 2009; Fujino et al. 2009; Girardi et al. 2017; Miller y Lunn 2007). Adicionalmente, en pacientes con anemia no regenerativa persistente, se diagnosticó anemia inmunomediada dada por un mecanismo de fagocitosis de precursores eritroides en médula ósea (Lucidi et al. 2017).
Por otra parte, 16 estudios se asociaron con indicaciones malignas, cinco de estos se realizaron con el objetivo de evaluar infiltración de neoplasias en tejido medular, principalmente linfomas para estadificación según criterios de la Organización Mundial de la Salud. En los casos de infiltración, fue común la presencia de citopenia periférica (Aresu et al. 2015; Aubry et al. 2014; Purzycka et al. 2020). En uno de los estudios se evaluó la presencia de leucemia en pacientes diagnosticados con linfoma multicéntrico (Raskin y Krehbiel 1989); otro reportó mastocitosis sistémica con infiltración medular (Marconato et al. 2008).
Asimismo, en las indicaciones malignas, tres de los estudios confirmaron el diagnóstico de neoplasias linfoproliferativas crónicas, leucemia linfoide crónica y mieloma múltiple en felinos. En el primero, los pacientes cursaron con marcada linfocitosis en sangre, pérdida de peso y letargia (Campbell et al. 2013). En el segundo, las manifestaciones clínicas más frecuentes incluyeron dolor y anorexia con alteración en pruebas bioquímicas, como hipergammaglobulinemia, azotemia renal e hipercalcemia. En estos estudios, el aspirado de médula ósea permitió hacer el diagnóstico diferencial del mieloma múltiple frente a infecciones crónicas, como leishmaniasis, ehrlichiosis, peritonitis infecciosa felina, amiloidosis y linfoma de células B (Hanna 2005; Patel et al. 2005).
En felinos, uno de los estudios evaluó la citopenia periférica y halló síndrome mielodisplásico, en cuyo caso la mayoría de los pacientes cursaba con bicitopenia o pancitopenia y cambios displásicos en neutrófilos, eritrocitos y plaquetas (Shimoda et al. 2000). Otro de los estudios describió cuadros de anemia grave, con aplasia pura de células rojas; en la clínica, los pacientes manifestaban letargo y anorexia; los aspirados de médula ósea tenían en común la ausencia de precursores eritroides identificables y una alta proporción de linfocitos pequeños, sin anomalías en megacariocitos o células mieloides (Stokol y Blue 1999).
En los demás estudios con indicación maligna, se requirió la evaluación de la médula ósea para el diagnóstico de neoplasia mieloproliferativa, la mayoría leucemias agudas. En estos casos, los pacientes presentaron anemia, trombocitopenia y leucocitosis marcada con o sin presencia de blastos en circulación y síntomas como pérdida de peso, hepatoesplenomegalia y letargo (Antognoni et al. 2003; Cristo et al. 2019; Davis et al. 2018; Jain et al. 1981; Tochetto et al. 2011).
En una de las publicaciones, se estudió la mielofibrosis en caninos, los cuales presentaron anemia no regenerativa, leu-copenia y pancitopenia. El diagnóstico de esta condición se asoció con anemia hemolítica inmunomediada, neoplasia, tratamiento farmacológico de larga duración y ehrlichiosis (Weiss y Smith 2002).
El contraste de la información disponible en caninos y felinos frente a los humanos es significativo, por ejemplo, la publicación realizada por Bashawri (2002) partió de 1.813 reportes de biopsias y aspirados de médula ósea llevados a cabo en un periodo de doce años en un hospital del Reino de Arabia Saudita y describió como indicaciones más frecuentes el diagnóstico y manejo de la leucemia aguda (22,2%), la estadificación de linfomas (15,2%), pancitopenia (11,9%), trombocitopenia (9,5%), anemia persistente (8,3%), fiebre de origen desconocido (7,2%), linfadenopatía (6,6%) y hepatoesplenomegalia (4,4%) (Bashawri 2002).
Asimismo, con la implementación de herramientas complementarias como citoquímica (Raskin et al. 2022), biología molecular para detectar clonalidad o mutaciones puntuales, inmunofenotipo por citometría de flujo o inmunohistoquímica y citogenética (Evans 2023; Figueiredo et al. 2012; Jaensch et al. 2022; Stokol et al. 2017) ha sido posible avanzar en diagnósticos más exactos, con terapias dirigidas que cuenten con mayor seguridad y eficacia, buscando acercarse a la frecuencia de solicitud y disponibilidad con la que se cuenta en medicina humana (Haran et al. 2020; Pawlak et al. 2013; Schiffman y Breen 2015).
CONCLUSIONES
La evaluación de la médula ósea en medicina veterinaria es escasa, siendo más frecuente en caninos que en felinos, pese a que las anormalidades hematológicas son comunes en ambas especies. Esto se relaciona con la etiología viral en las alteraciones periféricas en felinos; sin embargo, el esclarecimiento de la condición en curso es de gran importancia para definir tratamientos específicos para cada paciente.
La anemia es común a múltiples enfermedades; no obstante, el abordaje de la condición sin explicación o después de un manejo terapéutico sin respuesta o resistente a este requiere aspirado o biopsia de médula ósea como instrumento de diagnóstico.
La indicación del examen de médula ósea es más común para evaluar procesos malignos, siendo indispensable para concluir el diagnóstico, pronóstico, estadificación y seguimiento.
Asimismo, las manifestaciones clínicas causadas por algunos microorganismos son diversas e inespecíficas, y ante la sospecha de infección con compromiso medular, reflejada como alteraciones persistentes en el hemograma sin otra explicación, se requiere la evaluación de la médula ósea, ya que permite no solo hacer el diagnóstico diferencial, sino evaluar el grado de afectación y compromiso medular en el paciente.
La información disponible en el área de veterinaria contrasta con la medicina humana en cuanto a periodicidad, actualización y avances, esto a pesar de la frecuencia de alteraciones hematológicas en los pacientes caninos y felinos, así como el bajo riesgo para la obtención de la muestra. Con este escenario, es conveniente desarrollar más estudios que favorezcan el aumento en la implementación y el progreso de la evaluación medular.















