La enfermedad de Chagas, o tripanosomiasis americana, es causada por el protozoario hemoflagelado Trypanosoma cruzi. El principal mecanismo de transmisión en países endémicos es vectorial, y en él participan hemípteros como Triatoma barberi y T. dimidiata1. El segundo mecanismo en importancia incluye la transmisión por transfusión sanguínea y la transmisión congénita, la cual se da en promedio en 5 % de los nacimientos en países endémicos. Estas dos vías son las más importantes para la transmisión de la enfermedad de Chagas 2. Se estima que existen entre 8 y 10 millones de pacientes en estado crónico en el mundo y que anualmente ocurren 50.000 nuevos casos 3, con 25 millones de personas en riesgo de contraer la infección en los países endémicos, una incidencia estimada de 42.500 casos anuales por transmisión vectorial y 21.000 muertes al año 4,5.
La enfermedad de Chagas se considera como la tercera infección parasitaria más común en todo el mundo, y es la más importante en Latinoamérica. También es una enfermedad emergente en los Estados Unidos de América (EUA), en Canadá y en los países europeos (España, Holanda, Suiza), así como en Australia y Japón 6,7. Históricamente, los inmigrantes se han considerado un factor clave para la diseminación de la enfermedad de Chagas a otros países, así como el hecho de que migran a temprana edad 8. Los movimientos migratorios en busca de empleo de los habitantes de zonas rurales donde la infección es más frecuente, los llevan, incluso, a las áreas urbanas del mismo país, o más allá de las fronteras de Latinoamérica, lo cual ha cambiado considerablemente la epidemiología de la enfermedad, que ha dejado de ser exclusiva de esta región 9.
La prevalencia de la enfermedad en estos países no endémicos es proporcional al número de inmigrantes procedentes de áreas endémicas y la prevalencia de portadores está determinada, a su vez, por la prevalencia en el país de origen 10. Estados Unidos no debe clasificarse como un país no endémico de la enfermedad, ya que se han reportado 11 especies de triatominos dentro de su territorio y reservorios selváticos como mapaches, zarigüeyas (tlacuaches) y animales domésticos, además de que existen casos autóctonos de la enfermedad reportados en el país 11,12 y casi 300 mil habitantes infectados con T. cruzi13.
En los últimos 15 años se ha registrado la mayor migración de Latinoamérica hacia Europa; en este periodo, 10 % de la población española pasó a estar compuesta por inmigrantes, y cerca de 1,5 millones de ellos son originarios de Latinoamérica 14. Se calcula que en Europa hay entre 68.000 y 123.000 pacientes infectados con T. cruzi, pero hasta el 2009 solo se habían reportado 4.290 casos 8,9, en tanto que el número de personas afectadas por la enfermedad de Chagas en otros países oscila entre 140 (en Australia) y 12.000 (en Inglaterra) 15. El número real de personas infectadas por T. cruzi se ha subestimado en países como Estados Unidos y Canadá debido a la escasez de datos sobre la cifra real de migrantes que ingresan a su territorio, por lo cual la determinación de la verdadera seroprevalencia de la infección chagásica en estos países representa un reto 13.
En este contexto, el objetivo principal de este estudio fue determinar la presencia de anticuerpos anti- T. cruzi en migrantes centroamericanos y mexicanos en su trayecto hacia Estados Unidos y Canadá.
Materiales y métodos
Se hizo un estudio de corte transversal con un muestreo dirigido que incluyó el total de los 120 migrantes en tránsito hacia los Estados Unidos o Canadá acogidos en la casa de hospedaje temporal ubicada en la ciudad de Celaya Guanajuato, México. El grupo estaba compuesto por personas procedentes del sur de México y de Centroamérica. La participación en el estudio fue voluntaria, y se respetaron los derechos humanos y la integridad personal de los participantes; además, todos firmaron el consentimiento informado. Se excluyeron aquellas personas que se negaron a participar en el estudio, así como los menores de edad que no obtuvieron el consentimiento de sus padres o tutores.
Se aplicó una encuesta socioeconómica para determinar los factores asociados al riesgo de transmisión vectorial (presencia referida de triatominos). Las preguntas se diseñaron de acuerdo con la metodología descrita en la Norma Oficial Mexicana NOM-032-SSA2-2002 16, y se agregaron otras sobre la identificación de vectores y el conocimiento de la enfermedad utilizando como ayuda visual ilustraciones a color en tamaño real de las especies de triatominos conocidas en la región de origen 17.
La toma de muestras se hizo por punción venosa utilizando el sistema Vacutainer® (1,5 ml, aproximadamente). El suero se separó por centrifugación (1.200g durante 10 minutos) y se almacenó a -20 °C 18.
En el análisis de las muestras se emplearon dos pruebas diagnósticas, lo cual se ajusta a lo señalado en la norma oficial 16.
Para la prueba ELISA se utilizó el estuche comercial recombinante Chagatest ELISA 4.0® (Wiener Lab Group, Rosario, Argentina), siguiendo las instrucciones del fabricante. La absorbancia (densidad óptica) se midió con un espectrofotómetro de microplacas a 450/620 nm (Multiscan MS®; Thermo Labsystem, Waltham, MA). La línea de corte para separar los casos seropositivos se calculó usando la ecuación LC=CN+0,3 de densidad óptica, donde CN corresponde al promedio de absorbancia de los controles negativos.
La segunda técnica utilizada fue la de hemaglutinación indirecta (HAI) (Serodia-Chagas®, Fujirebio Inc., Tokio, Japón). Se consideraron positivas todas aquellas muestras reactivas a una dilución mayor o igual a 1:32.
Con ambas técnicas se utilizaron como controles positivos sueros de pacientes crónicos de enfermedad de Chagas de Brasil y México, proporcionados por el Instituto Nacional de Cardiología “Ignacio Chávez” y el CINVESTAV-IPN de México, en tanto que como controles negativos se utilizaron sueros de individuos sanos. Cada determinación se hizo por duplicado en las dos pruebas, incluidos los controles positivos y negativos 19,20.
Análisis estadístico
En el análisis estadístico se elaboraron tablas de contingencia con la prueba de χ2 para determinar la asociación entre las características de las viviendas analizadas en la encuesta y el reconocimiento de los vectores como principal vía de transmisión de la enfermedad en el país de origen de los participantes. Para ello, se utilizó el programa SPSS®, versión 17 (Chicago, IL).
Consideraciones éticas
Se contó con el consentimiento informado de cada participante. La aplicación de encuestas y la toma de muestras de sangre se hicieron con apoyo del personal médico. Se brindó ayuda médica gratuita a los participantes y se siguieron las normas de bioética establecidas en la Declaración de Helsinki de la Asociación Médica Mundial en la versión adoptada en la LII Asamblea General de Edimburgo del 2000. El protocolo fue aprobado por el Comité de Ética de la Universidad Autónoma de Nuevo León.
Resultados
Del total de 120 migrantes analizados, 97 (80,8 %) procedían de Centroamérica, principalmente de Honduras (53/120; 44,2 %), El Salvador (25/120; 20,8 %) y México (23/120; 19,2 %). La mayoría de los participantes eran de sexo masculino (103/120; 85,8 %), y sus edades oscilaban entre los 18 y los 45 años. El número de mujeres fue menor (17/120; 14,2 %), con edades entre los 18 y los 33 años (cuadro 1). La seroprevalencia general fue de 20 % (24/120).
La mayor seroprevalencia de anticuerpos anti-T. cruzi fue de 37,5 % (6/16) y correspondió a los migrantes originarios de Guatemala, seguidos de los procedentes de Honduras, con 22,6 % (12/53), y de El Salvador, con una seroprevalencia de 16 % (4/25), en tanto que la de aquellos provenientes de México fue de 8,7 % (2/23) (cuadro 1 y cuadro 2).
Cuadro 1 Población migrante según lugar de origen, y seroprevalencia por sexo, edad y destino final. Entre paréntesis se presenta el número de casos positivos por sexo y edad.
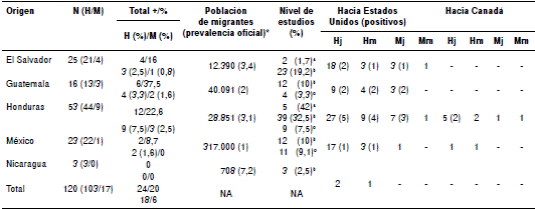
H: hombre; M: mujer; j: jóvenes (18-30 años); m=maduros (31-45); * OPS y CDC (Estimación cuantitativa de la enfermedad de Chagas en las Américas) (20,21); a: analfabetas; b: educación primaria/secundaria; c: carrera técnica/preparatoria
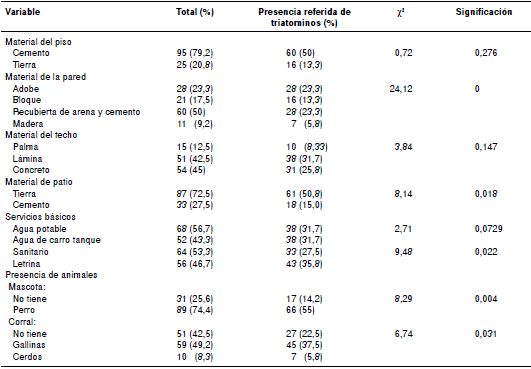
Cuadro 2 Encuestas socioeconómicas sobre las condiciones de vivienda de los migrantes latinoamericanos que propician la presencia de triatominos en sus hogares
De los 24 participantes con anticuerpos anti-T. cruzi, 18 (75 %) eran de sexo masculino, y seis (25%) eran mujeres, todas con edades que fluctuaban entre los 18 y los 30 años. En cuanto a los hombres seropositivos, diez (55,6 %) tenían edades entre los 18 y los 30 años, mientras que los ocho (44,4 %) restantes tenían entre los 31 y los 45 años de edad (cuadro 1).
Según los resultados de las encuestas aplicadas a los migrantes, 89 (74,1 %) de ellos tenían educación básica solamente, 24 (20 %) tenían carreras técnicas y siete (5,8 %) eran analfabetas (cuadro 1). De los 120 migrantes encuestados, 105 (87,5 %) reconocieron el vector de la enfermedad de Chagas y 62 (59 %) afirmaron haber sido picados por estos.
Según el análisis de las encuestas socioeconómicas hechas para determinar la importancia de la presencia de los vectores como principal vía de transmisión de la enfermedad, los materiales de construcción de las paredes de las viviendas, así como la presencia de mascotas (perros) en los hogares (p≤0,01), resultaron variables muy significativas. En cuanto al material de construcción del patio, los servicios básicos precarios, así como la cría de animales dentro de corrales en la periferia de los hogares, resultaron significativas (p≤0,05) (cuadro 2).
Discusión
La enfermedad de Chagas sigue siendo una enfermedad desatendida y un problema de salud pública, tanto en países desarrollados como en aquellos en desarrollo. Aunque es endémica en el continente americano 20,21, su distribución mundial ha cambiado significativamente debido a los movimientos migratorios 22.
Según los datos reportados por el Banco Mundial, los países de Latinoamérica y el Caribe, incluido México, presentan los mayores índices de pobreza extrema y los niveles más bajos de expectativas para satisfacer sus necesidades básicas en el futuro 23, lo cual explica la migración. El 100 % de los participantes en este estudio aseguró que el hambre, la falta de oportunidades laborales en su país de origen y el precario nivel socioeconómico, eran las principales razones para migrar. Al trasladarse a otras regiones esperaban elevar la calidad de vida de sus familias, aun cuando esto los obligara a ingresar como indocumentados a otros países y enfrentar todos los peligros de inseguridad, incomodidad y hambre inherentes a su situación.
En este estudio, el 20 % de los migrantes que resultaron con anticuerpos para la enfermedad de Chagas desconocía que la tenía, aunque el 87,5 % conocía los vectores. Al no conocer las consecuencias de la enfermedad de Chagas, los migrantes seropositivos pueden actuar como fuentes de transmisión en regiones no endémicas, principalmente las mujeres embarazadas y los donantes de sangre 24.
Una de las principales limitaciones para obtener estimaciones precisas de la enfermedad de Chagas, es que se desconoce la seroprevalencia de esta infección en las poblaciones migrantes que habitan en Estados Unidos, Canadá y otros países del continente europeo. Dicha seroprevalencia probablemente difiere de los reportes en los países de Latinoamérica y está estrechamente vinculada con el país y la región de origen 25.
En el caso de países con un alto índice de recepción de migrantes, la seroprevalencia es bastante alta 6. Además de los Estados Unidos, en otros países como Canadá, Austria, Bélgica, Croacia, Dinamarca, Francia, Alemania, Italia, los Países Bajos, Portugal, Rumania, España, Suecia, Suiza y el Reino Unido, se han reportado casos importados de la enfermedad de Chagas 26.
En Estados Unidos, la detección de T. cruzi en donantes de sangre se inició en el 2007 debido al aumento de los casos reportados de enfermedad de Chagas en 42 estados, destacándose California, Florida, Nuevo México y Texas, los cuales presentaron las mayores seroprevalencias para la enfermedad en donantes de sangre 13. Aunque los movimientos migratorios hacia Canadá de personas originarias de países endémicos son menores, se han reportado casos positivos de enfermedad de Chagas en las provincias de Manitoba y de Quebec, los cuales se detectaron durante el proceso de tamización para donantes de sangre 27.
Aunque la población de la muestra en este estudio puede no ser representativa, la seroprevalencia general calculada del 20 % (cuadro 1) concuerda con los reportes de seroprevalencia para países como México. En el caso de Guatemala y Honduras, se calculó una prevalencia mucho mayor a la reportada 21. Sin embargo, se ha señalado que la prevalencia de la enfermedad de Chagas presenta grandes variaciones, incluso dentro de un mismo país, debido a que los gradientes de endemismo de la enfermedad dependen de la zona estudiada 28,29.
Los datos obtenidos en este estudio obligan a no subestimar el número de infecciones con T. cruzi entre los migrantes que llegan a esos países y entre aquellos que se desplazan hacia países del continente europeo o, en su defecto, se quedan en algún estado de la República Mexicana, lo cual altera la seroprevalencia calculada para dichos territorios 21. En este estudio, el 78,3 % de los participantes correspondía a migrantes clasificados como adultos jóvenes, y el 21,7 %, a migrantes clasificados como adultos maduros (cuadro 1). Se ha señalado la posibilidad de que la edad promedio de la población migrante difiera de la de la población general, según el país de origen. Es decir, una población migrante probablemente contendrá un menor número de adultos maduros, y estos podrían presentar una prevalencia de la enfermedad superior a la de la población general, pero también es probable que incluya un mayor número de adultos jóvenes, cuya prevalencia de la enfermedad sería inferior a la de la población general 13. Tal posibilidad difiere de lo reportado en este estudio, en el que 14,2 % de las personas positivas correspondía a adultos jóvenes, por lo que su seroprevalencia fue mayor a la reportada para la población general en sus países de origen.
El mayor número de los migrantes incluidos en el estudio provenía de Honduras, seguido de El Salvador, México, Guatemala y Nicaragua; en 90,8 % de los casos el destino final eran los Estados Unidos y, en 9,2 %, Canadá (cuadro 1). Estas cifras contrastan con el origen de los migrantes que llegan a Europa, donde se destaca Bolivia en primer lugar 30.
La seroprevalencia reportada en donantes latinoamericanos en Estados Unidos es de 0,07 % 31 y, en Canadá, de 1 % en migrantes latinoamericanos y refugiados 32. Aunque en ambos países la seroprevalencia calculada es baja, puede aumentar el riesgo de contraer la enfermedad de Chagas mediante transfusión sanguínea o por vía congénita.
El resultado del análisis estadístico de las encuestas socioeconómicas aplicadas en este estudio subraya lo difícil que resulta la eliminación de la enfermedad de Chagas transmitida por vía vectorial en los países endémicos. Entre los factores que contribuyen con esta situación, se destacan las precarias condiciones de vivienda de la población y el limitado acceso a los servicios de salud, lo que, aunado a la ausencia de síntomas durante la enfermedad, eleva las probabilidades de que las personas desconozcan que son positivas para T. cruzi cuando migran de su país de origen hacia zonas no endémicas. De esta manera, el parásito puede diseminarse, ya sea por vía congénita o por transfusión sanguínea 33.
Hay países, o zonas dentro de un mismo país, que reciben grandes oleadas de inmigrantes debido al desarrollo económico que ofrecen, lo cual sugiere que los patrones de migración de personas de diferentes regiones pueden ejercer una influencia en la prevalencia de la enfermedad de Chagas. Por lo tanto, los sistemas de salud de países no endémicos deben estar preparados para responder ante la enfermedad y evitar nuevos casos de infección, principalmente por transmisión congénita o transfusión sanguínea de migrantes de zonas endémicas, adoptando medidas preventivas y de control que pueden aplicarse a los pacientes en las diferentes etapas de la enfermedad.
México, como país de libre tránsito para centroamericanos, también sufre las consecuencias al recibir migrantes infectados que se quedan durante meses o un tiempo indefinido en el país o que son deportados de los Estados Unidos hacia los estados fronterizos y se quedan a vivir allí en condiciones de pobreza. Se requiere una mayor atención diagnóstica, de prevención y atención médica de estas poblaciones.














