Introducción
Según el reporte de las Naciones Unidas, en el año 2015 se presentaron 2.1 millones de infecciones nuevas por VIH, alcanzando un estimado de 36,7 millones de personas que viven con VIH; de estas, 17 millones reciben tratamiento antirretroviral1 . Así mismo, hubo una reducción del 35% de infecciones nuevas por VIH, desde el año 2000 y de un 45% de muertes relacionadas con SIDA desde el 2004, y la cobertura de terapia antirretroviral (TARV) desde el 2010 ha aumentado en un 84%2 .
En Latinoamérica y Caribe, en el 2014 se reportó una reducción del 17% en el número de infecciones nuevas por VIH y de un 31% en el número de muertes por SIDA con respecto al año 2000. Ya para el 2015, el número de personas infectadas por VIH fue de 2 millones, con 1.1 millones bajo tratamiento antirretroviral lográndose una cobertura del 55% [47-64%]1,2.
En Colombia, se estima que 150.000 personas están infectadas por VIH, con una prevalencia de 0.5% en adultos entre 15-y 49 años y han ocurrido 2300 muertes por SIDA3 .
Con el advenimiento de la terapia antirretroviral se ha logrado un impacto significativo sobre la morbilidad y mortalidad en pacientes infectados con VIH, pero paralelamente surge y se incrementa la resistencia del virus, lo cual afecta la efectividad del tratamiento4,5. A nivel mundial, la resistencia del VIH a los medicamentos se considera un problema creciente, por lo cual la Organización Mundial de la Salud (OMS) recomienda la vigilancia de la farmacorresistencia del VIH como un componente de los programas de TARV6 . El estudio genotípico de resistencias es una herramienta útil a la hora de elegir la TARV óptima que garantice resultados clínicos deseados como alcanzar la supresión viral y reducir de morbilidad asociada7 . Actualmente la mayoría de las guías para el uso de ARV recomiendan el uso de las pruebas de resistencia antes de iniciar TARV8-10.
En el contexto de farmacorresistencia del VIH, se describen como resistencias primarias o transmitidas aquellas que se presentan sin una exposición previa a TARV11. Las resistencias primarias pueden desarrollarse como resistencias de Novo o resistencias naturales por la presencia de polimorfismos que en codones específicos disminuyen la susceptibilidad a los ARV, es el caso del VIH- 2 resistente a los análogos no nucleosídicos de la transcriptasa reversa (NNRTIs); así como, consecuencia de la amplia variabilidad genética del virus que predispone al desarrollo de mutaciones de resistencia (mutaciones darwinianas) o por el resultado de la transmisión o infección de cepas de VIH drogo resistente12.
Para fines de este artículo, hablamos de resistencias primarias como sinónimo de resistencias transmitidas.
Se considera que la prevalencia de resistencia primaria es alta cuando más del 15% de las muestras estudiadas presenta mutaciones, moderada cuando la prevalencia oscila entre 5 y 15% y baja cuando es menor del 5%. Con lo anterior y debido a la emergencia del desarrollo de resistencias del VIH, la OMS desarrolló una estrategia mundial para el monitoreo y vigilancia de la farmacorresistencia del VIH y recomienda la realización del estudio genotípico de resistencia previo al inicio del tratamiento antirretroviral cuando la prevalencia está por encima del 5%11,13,14.
En países de altos ingresos, como Australia, Japón, Norteamérica y Europa, la presencia de mutaciones de resistencias en pacientes no expuestos a TARV o Naïve alcanza el 10-17%11. Estudios reportan diferentes prevalencias de resistencia transmitidas alrededor del mundo (Europa 2%-14%, Norte América 8-18%), afectando principalmente los inhibidores de transcriptasas reversa no Nucleosídicos15-17, siendo significativamente mayor entre más reciente haya sido la adquisición de la infección retroviral (1 año) y aun mayor en personas con infección retroviral aguda17-20. En regiones como África y Asia, se ha estimado una prevalencia de resistencias trasmitidas del 2.8% al 5.6%21. Estudios sobre resistencia a antirretrovirales en pacientes naïve en América Latina y el Caribe entre el 2000 y el 2015, reportan prevalencia general de resistencias transmitidas del 7.7% (95% CI: 7.2%-8.2%), encontrándose un incremento de la frecuencia de resistencias transmitidas al comparar los periodos 2000- 2005 vs 2006-2015 (6.0% vs 8.2%) (p<0.0001) asociado a un incremento en la afectación de los NNRTIs (1.8% vs 4.2%, p<0.0001) y una disminución de resistencias a los análogos nucleosídicos (NRTIs) al comparar los periodos 2000-2005 vs 2006-2015 (4.5% vs 2.3 %, p<0.0001)22.
En Colombia se han reportado frecuencias de resistencias en pacientes naïve que oscilan entre 5.8% y 6.6%, siendo las mutaciones más comunes encontradas la K103N/S, la M184V, F77L y M46L, y con afectación de más de una clase de medicamentos antirretrovirales en 1.4% a 2.9% de los pacientes19,23, de igual manera, se observó una asociación entre el recuento de CD4<200 células/mm3 y enfermedad avanzada por VIH categoría C de la clasificación CDC con la presencia de resistencias primarias23, así como relación entre tiempo menor a un año desde la probable infección retroviral aguda y mayor presencia de resistencias transmitidas19.
En Colombia, en las guías de práctica clínica aún no se recomienda el genotipo de resistencias del VIH previo a la primera exposición a TARV, solo es recomendado después de la primera falla virológica en pacientes expuestos a medicamentos antirretrovirales24. Esto se debe a que hay poca evidencia sobre la prevalencia de resistencias transmitidas en nuestro país y son pocos los estudios que se han realizado hasta el momento. Se hace necesario entonces la generación de evidencia que aporte a establecer la necesidad y pertinencia de pruebas genotípicas previas a la iniciación de la primera combinación de TARV. Bajo esta premisa los datos presentados en el presente estudio hacen parte de una actualización de información cuya primera parte fue publicada con datos de resistencias en pacientes naïve obtenidos mediante genotipos realizados entre 2008 y 2010 (19), que se complementa con información de genotipos previos al inicio de TARV realizados entre los años 2011 y 2015.
Por lo cual, el objetivo de este estudio fue determinar la frecuencia de resistencias transmitidas en una muestra de pacientes VIH+, procedentes de Cali y de otros municipios del Valle del Cauca (suroccidente colombiano), no expuestos a TARV, atendidos en una clínica especializada en VIH/SIDA en Cali-Colombia, durante los años 2008 a 2015, así como comparar los hallazgos según periodos de tiempo de realización del genotipo (2008-2011 vs 2012-2015) y según el tiempo probable transcurrido entre la infección retroviral y el momento del genotipo (<1 año vs >1 año).
Materiales y métodos
Se realizó un estudio descriptivo de corte transversal en 342 pacientes mayores de 18 años con infección confirmada por VIH-1, sin exposición previa a TARV, con prueba de genotipo de resistencias previo al inicio de TARV y que se encontraban en el programa de atención integral de la Corporación de Lucha Contra el Sida (CLS) entre los años 2008 a 2015. Previo al uso de la información se obtuvo de cada participante un consentimiento informado para el uso anónimo de los datos de la historia clínica.
La población objeto de estudio corresponde a personas con VIH/SIDA, procedentes de Cali y de otros municipios del Valle del Cauca, no expuestos previamente a TARV, que fueron remitidos a la CLS para su ingreso a la atención integral especializada ambulatoria y TARV. La ausencia de exposición a medicamentos ARV se basó en indagación a los pacientes y verificación de historia de exposición previa a medicamentos con las instituciones referentes.
Se excluyeron pacientes con información relevante incompleta o sin información del estudio genotípico de resistencia, así como pacientes con estudios genotípicos cuyo resultado fue no tipificable o incompletamente tipificable para la determinación de mutaciones de resistencia relevantes. La muestra inicial fue de 349 pacientes elegibles, de los cuales 7 fueron excluidos por pobre calidad de las secuencias (genotipos no tipificables o con tipificación incompleta). Se incluyó un total de 342 pacientes Naïve con genotipos previos al inicio de su primer tratamiento ARV.
Se recolectaron datos sociodemográficos, hábitos y datos relacionados con el VIH por medio de las historias clínicas de los pacientes como niveles de carga viral, conteo de linfocitos CD4 o CD4/CD8 al momento del genotipo y tiempo probable de infección.
Pruebas genotípicas de resistencia y análisis de las mutaciones de resistencia
La prueba de genotipo de resistencias se obtuvo por medio de muestras de sangre que fueron tomadas por el laboratorio de la Cruz Roja Colombiana, seccional Valle y remitidas y secuenciadas por el laboratorio central de referencia de la CLS, Centro de Análisis Molecular de Bogotá por medio de los sistemas TRUGENE® HIV-1 y ViroSeq.
Las mutaciones de resistencia se definieron a partir de la lista de Bennet-OMS-200913 y la IAS-USA 201514 y las mutaciones encontradas se analizaron en la base de datos HIVdb Stanford considerándose una disminución de la susceptibilidad del virus frente a cualquier medicamento con 15 o más puntos totales de acuerdo con las recomendaciones de la OMS25.
Se definieron dos grupos de pacientes acorde con el tiempo probable de infección retroviral menor de un año (<año) y mayor a un año(≥1 año) con respecto al momento del genotipo, para lo cual se consideraron criterios similares a los definidos en otros estudios17-19,26, como son: Fecha de diagnóstico, síntomas y/o signos de posible infección retroviral aguda reportados en historia clínica, antecedentes de exposición(es) de riesgo, prueba previa VIH negativa con subsiguiente seroconversión (ELISA/Western Blot), conteo de linfocitos CD4 o razón CD4/CD8 al momento del genotipo.
Análisis estadístico
Los análisis estadísticos se llevaron a cabo en el software STATA, versión 12.1. Se hizo un análisis descriptivo, con cálculo de frecuencias, porcentajes y comparación según las características sociodemográficas, hábitos, datos clínicos de VIH-1 y la presencia de mutaciones de resistencias. Al final se conformaron dos grupos de pacientes, según el tiempo transcurrido entre la probable infección/reinfección retroviral y el momento de toma del genotipo: 1. Aquellos con menos de un año, y 2. Quienes completaban 1 o más años entre los dos momentos. Se usaron tablas de contingencia, prueba de comparación de proporciones test chi-cuadrado o comparación de promedios t-student. Para las pruebas estadísticas se definió un nivel de significancia de 0.05.
Aspectos éticos
La participación en el estudio fue completamente voluntaria, y se obtuvo un consentimiento informado por escrito de cada participante para el uso de la información registrada en la historia clínica. Este estudio fue revisado, aprobado y supervisado, por el comité institucional de ética para investigación en humanos de la CLS (IRB Number: IRB00005732), acta de aprobación número 018 del 7 de marzo de 2011.
Resultados
Características de los participantes del estudio
Sociodemográficas y hábitos: La edad promedio al momento del genotipo fue 32±10,5 años, siendo la mayoría hombres (74%), procedentes de Cali (60%), de estratos socioeconómicos medio y bajo (29% y 47% respectivamente). La mayoría con estudios hasta secundaria (61%) y universitarios (38%). 58% solteros, con afiliación al régimen contributivo (57%) y subsidiado (43%) de la seguridad social de salud de Colombia.
En cuanto a hábitos, el 36% reportaron consumo de alcohol, 24% consumo de cigarrillos y 8% consumo de sustancias psicoactivas (SPA).
Comportamientos sexuales: Siempre usaban condón al momento de sus relaciones sexuales el 1.5%, el 37% eran homosexuales y 26% bisexuales. La principal vía de transmisión del VIH fue la vía de transmisión sexual (92%).
Antecedentes patológicos: Según la clasificación clínica del CDC 27, la mayoría (77,7%) se encontraban en estadio A, siendo el 55,9% estadio A2, y un 23% presentaban enfermedad avanzada con CD4<200. El 14% con hospitalizaciones previas al momento del genotipo.
Tenían antecedente de infecciones de transmisión sexual el 39%, así mismo, el 35% de los participantes con pareja VIH+, de las cuales el 16% se encontraba bajo terapia antirretroviral, aunque en el 73% no se obtuvo este dato.
La carga viral al momento del diagnóstico tuvo una mediana de 24.325 copias/mL (rango intercuartil 7.497- 81.558), con CD4 en 361.5 células/mm3 (rango intercuartil 244 - 531), CD8 en 939.5 células/mm3 (rango intercuartil 680 - 1336), y razón CD4/CD8 de 0.35 (0.22-0.58).
Al momento del genotipo, la mediana de carga viral fue 26.802 copias/mL (rango intercuartil 8.800 - 95.930, CD4 343 células/mm3 (rango intercuartil 229 - 472), CD8 975 células/ mm3 (684 - 1392) y razón CD4/CD8 de 0.32 (0.20-0.50).
El tiempo probable de infección fue menor de un año en el 28% (n=96) y 72% (n=246) tuvieron tiempo probable de infección igual o mayor a un año.
Mutaciones encontradas
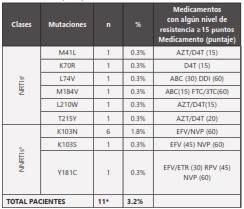
Según la lista de Bennett OMS-2009 (13), la frecuencia de mutaciones de resistencias transmitidas que confieren afectación de la susceptibilidad a los ARV mayor o igual a 15 puntos (según HIVdb Stanford) fue 3.2%, siendo la mutación más frecuente la K103N/S (2.1%) con afectación del grupo de los NNRTIs. (Tabla 1).
Tabla 1 Mutaciones de la Organización Mundial de la Salud 2009 (Bennett et al.) encontradas en participantes del estudio
a. Análogos nucleosídicos de la transcriptasa reversa.
b. Análogos no nucleosídicos de la transcriptasa reversa.
*9 pacientes con 1 mutación, 1 paciente con 2 mutaciones (K103N y K103S),
1 paciente con 3 mutaciones (M41L, L210W y T215Y).
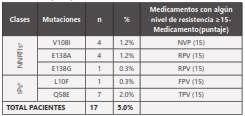
Según la lista de IAS-USA 2015 14, la frecuencia de mutaciones de resistencias fue del 5.0%, con las mutaciones más frecuentemente encontradas que fueron la Q58E (2%), V108I y E138A (1.2%), sin encontrarse mutaciones adicionales a las encontradas según la lista de Bennett OMS 2009 que confieran resistencias para los NRTIs (Tabla 2).
Prevalencias de resistencias a los antirretrovirales
Considerando tanto las mutaciones de lista de Bennett OMS2009 como las mutaciones de la lista IAS-USA 2015 (según mutaciones encontradas y analizadas en base de datos del virus de inmunodeficiencia humana de Stanford), el porcentaje de resistencias transmitidas alcanzó el 7.9%.
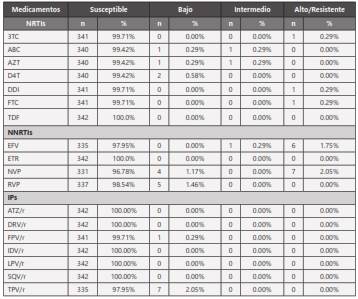
No se presentó afectación a ningún medicamento de las familias de ARV en el 92.1% de los pacientes. La familia de los NNRTIs fue la más afectada (4.4%), seguida de los IPs (2.3%) y los NRTIs (1.2%); no se encontró afectación a más de una familia ARV.
Los medicamentos antirretrovirales que con mayor frecuencia tuvieron algún nivel de afectación de la susceptibilidad fueron: Efavirenz (2%), Nevirapina (3.2%), Rilpivirina (1.5%), Abacavir, Zidovudina y Estavudina (0.6%); Lamivudina, Didanosina y Emtricitabina (0.3%); Tipranavir/r (2%) y Fosamprenavir/r (0.3%). (Tabla 3).
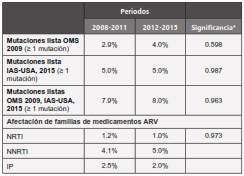
Al comparar por períodos (2008-2011 vs 2012-2015) de toma del genotipo, las prevalencias de las diversas mutaciones y las afectaciones de medicamentos ARV, no se encontraron diferencias estadísticamente significativas (Tabla 4).
Sub-análisis según tiempo transcurrido entre la infección retroviral y el momento del genotipo.
Comparaciones entre los dos grupos según tiempo probable entre la infección retroviral y el momento del genotipo: Al conformar, caracterizar y comparar los dos grupos de pacientes participantes (aquellos con <1 año y quienes contaban con ≥1 año entre la probable infección retroviral inicial y el momento del genotipo), según se observa en la tabla 5, se encontraron significativas diferencias tanto en las características generales como en cuanto al estado clínico, virológico e inmunológico al momento del genotipo, a saber: menor edad promedio, mayor frecuencia de procedencia del área urbana de Cali y más alta escolaridad, lo mismo que mejor estado clínico, más alta carga viral y mayores conteos de linfocitos T-CD4+ con mejor razón CD4/CD8 al momento del genotipo en el primer grupo de pacientes con <1 año transcurrido desde la infección retroviral inicial.
Tabla 5 Comparación entre pacientes con infección <1 año y =1 año características generales según tiempo de infección.
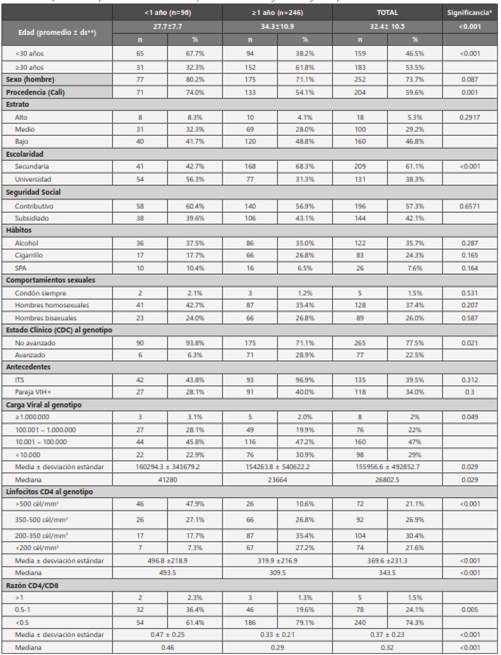
*Significancia: Estadístico valor p calculado para variables categóricas a través de test chi-2, y para variables cuantitativas mediante t-student.
**ds: Desviación estándar.
En similar sentido, según se observa en la tabla 6, se encontró significativa diferencia (p=0.008) entre los dos grupos en cuanto a la frecuencia de mutaciones transmitidas (según la lista de OMS-Bennett), siendo mayor en aquellos pacientes con infección retroviral <1 año (7.3%) que entre quienes tenían ≥1 año al momento del genotipo (1.6%). Sin embargo, al sumar mutaciones de la lista IAS USA-Johnson a las de la lista de OMS-Bennett, la diferencia en la frecuencia de mutaciones entre los dos grupos no alcanzó a ser estadísticamente significativa (1 o más mutaciones en <1 año (11/96=11.5%) y 1 o más mutaciones en >1 año (16/246=6.5%); p=0.0999).
Tabla 6 Lista de mutaciones Bennett encontradas según tiempo de infección.
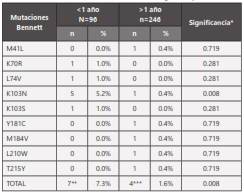
*Significancia: Estadístico valor p calculado para variables categóricas a través de test chi-2
**En el grupo con <1 año, 7 pacientes presentaron 8 mutaciones (1 con 2).
***En el grupo con =1 año, 4 pacientes presentaron 6 mutaciones (1 con 3).
Discusión
La farmacorresistencia en pacientes sin exposición a TARV, tiene importancia en la selección de un tratamiento antirretroviral de primera línea eficaz, en el impacto en la morbimortalidad de los pacientes y en el riesgo de transmisión de cepas resistentes del VIH-111. La frecuencia de mutaciones de resistencias transmitidas varía de acuerdo con la lista de mutaciones que se utilice. Las mutaciones de Bennett OMS-2009 corresponden a un listado estandarizado de 93 mutaciones (34 para los NRTIs en 15 posiciones de la retro transcriptasa-RT,19 para los NNRTIs en 10 posiciones de la RT y 40 para los IPs en 18 posiciones de la proteasa) que son indicadoras de resistencias transmitidas a pacientes no expuestos a ARVs (naïve) puesto que incluyen mutaciones no polimórficas que tienen una prevalencia de al menos 0.5% en uno o más subtipos de individuos expuestos a TARV, descartando posibles mutaciones que se desarrollan de forma natural y permitiendo así estimar de manera precisa la epidemiología de las resistencias transmitidas del VIH y hacer comparaciones entre distintas regiones28. Basados en esta lista, la OMS también ha establecido un umbral de frecuencia de mutaciones de ≥5%, a partir del cual recomienda universalmente el uso del genotipo al momento de cada diagnóstico y/o al iniciar el primer tratamiento ARV13.
Es importante mencionar que dicho umbral se estableció teniendo en cuenta estudios de costo efectividad realizados en países de altos ingresos. En países de bajos o medianos ingresos como el nuestro, aunque no disponemos de dichos estudios, los datos recolectados hasta el momento sobre la prevalencia de resistencias en pacientes naïve podrían sugerir un mayor beneficio con la implementación de dicha prueba19,23.
La lista de la IAS-USA 2015 incluye mutaciones que predicen resistencias a los ARVs en pacientes expuestos a tratamiento ARV y, al sumarlas a las de Bennett OMS 2009, proporcionan un mayor chance para detectar mutaciones de resistencia que puedan provenir de una fuente transmisora expuesta a dichos medicamentos29.
En nuestro estudio, teniendo en cuenta las mutaciones el listado OMS 2009, la frecuencia global de mutaciones de resistencia fue del 3.2%. Sin embargo, al incluir mutaciones de la lista de la IAS-USA 2015, la frecuencia general de resistencias alcanzó el 7.9%, siendo estas frecuencias más bajas que las reportadas en el periodo 2008-201019.
La familia de antirretrovirales más frecuentemente afectada fue la de los NNRTIs, con las mutaciones K103N/S, V108I y E138A como las más frecuentes, lo cual resultó consistente con otros estudios previos en Colombia19,23.
Para los IPs la mutación más frecuentemente encontrada fue la Q58E (n=7, 2.0%), no perteneciente a la lista de OMS-Bennett 2009 y solamente a la lista de IAS-USA-Johnson 2015, pero la cual no resulta clínicamente relevante puesto que afecta solamente la susceptibilidad de Tipranavir, antirretroviral actualmente en desuso.
Teniendo en cuenta solamente la lista de OMS-2009, para la familia de los NRTIs, la mayoría de las mutaciones encontradas fueron timidínicas (M41L, K70R, L210W, T215D) y otorgan resistencia a zidovudina y estavudina. Aunque la estavudina se encuentra prácticamente en total desuso en la actualidad y la zidovudina ya no es un componente recomendado como tratamiento ARV de primera línea en pacientes naïve, estas mutaciones que afectan la eficacia de estos dos medicamentos cobran gran importancia puesto que hoy en día, se siguen utilizando en Colombia (datos Cuenta de Alto Costo - BD Resolución 4725/2011 y 783/2012. Fecha medición: 31 de enero de 2015) adicionalmente, se sabe que desde hace mucho tiempo la zidovudina o la estavudina siempre se han usado en conjunto con lamivudina, medicamento que es mucho más susceptible a la aparición de mutaciones como la M184V cuando hay replicación viral activa en presencia de medicamentos, es muy probable que la mayoría de las personas naïve, cuyo virus presenta las mutaciones timidínicas descritas también tengan la M184V que puede encontrarse “archivada” por la ausencia de tratamiento ARV (especialmente de lamivudina) y por lo tanto no ser visible en la secuenciación genotípica. Además, debe destacarse la presencia simultánea de tres de dichas mutaciones (M41L, L210W y T215Y) en un mismo paciente, las cuales, al sumarlas en el algoritmo de Stanford, no solo incrementan el nivel de resistencia a zidovudina, estavudina y abacavir sino que alcanzan a otorgar un nivel intermedio de resistencia al tenofovir.
Solo en dos pacientes (0.6%) se encontraron las mutaciones no timidínicas L74V que afecta primariamente a abacavir y didanosina con alto nivel de resistencia, y la M184V que afecta con alto nivel de resistencia a FTC, 3TC y con bajo nivel de resistencia a ABC. Lo anterior se parece más a nuestro estudio previo para el período 2008-2010, en el cual ningún participante presentó la mutación M184V19, situación que en ambos casos sería esperable puesto que la M184V es una mutación que se archiva rápidamente sin la exposición a TARV y la mayoría de nuestros participantes tuvieron un tiempo probable de infección mayor de 1 año. Sin embargo, difiere de lo encontrado en un estudio realizado previamente en Colombia, en el cual esta mutación estuvo presente en el 2.9% a pesar de que el tiempo promedio transcurrido entre el diagnóstico y el momento del genotipo fue de 6 años23.
Del total de mutaciones de la lista de OMS-Bennett 2009, las más frecuentemente encontradas fueron aquellas que generan resistencia del virus a los análogos no nucleosídicos de la transcriptasa reversa (NNRTIs) de primera generación, especialmente efavirenz y nevirapina, específicamente la K103N (n=6, 1.8%), la K103S (n=1, 0.3%) y la Y181C (n=1, 0.3%), esta última con la importancia de afectar, además de efavirenz y nevirapina, a las nuevas generaciones de NNRTIs etravirina y rilpivirina. Con respecto a la mutación K103N, posiblemente una de las más frecuentemente encontradas en pacientes expuestos a efavirenz o nevirapina siempre en compañía de lamivudina y otro NRTI, pero con problemas de cumplimiento con el tratamiento que llevan a falla virológica19, a diferencia de la M184V, puede aparecer aún más rápidamente pero perdurar visible sin “archivarse” en el genotipo bien sea de la posible fuente transmisora o en el paciente naïve a quien le sea transmitida, aún en ausencia del efavirenz o la nevirapina; lo anterior tiene la importancia de tener en cuenta que muchas personas que presentan la mutación K103N pueden tener archivada la mutación M184V, con la consecuente afectación de la susceptibilidad del virus tanto a los NNRTIs mencionados como a algunos de los NRTIs de amplio uso dentro del primer tratamiento, tales como lamivudina, emtricitabina y abacavir30,31.
Adicionalmente, de la lista de IAS-USA-Johnson 2015, aparecieron las mutaciones V108I con bajo nivel de resistencia a nevirapina (n=4, 1.2%), así como la E138A (n=4, 1.2%) y la E138G (n=1, 0.3%), estas dos últimas con bajo nivel de resistencia a rilpivirina; ninguna de estas mutaciones tiene ahora mucha relevancia clínica pues en la actualidad ni la nevirapina ni la rilpivirina pertenecen al armamento terapéutico de primera línea para pacientes naïve en Colombia24.
Con respecto a la complejidad de las resistencias, ésta luce moderada puesto que no se encontró afectación de más de una familia de medicamentos, pero con la salvedad que el grupo más frecuentemente afectado fue el correspondiente a los NNRTIs de primera generación (efavirenz y nevirapina) que hacen parte de los esquemas de tratamiento de primera línea para pacientes sin exposición previa a antirretrovirales24. En segundo lugar aparecen los NRTIs pero principalmente a expensas de afectación intermedia o alta de la susceptibilidad a AZT, D4T y DDI, que actualmente se encuentran o están cercanos a entrar en desuso, y con baja afectación de ABC que sí permanece con alta y creciente inclusión dentro de las combinaciones preferidas para el primer tratamiento de pacientes naïve24. Cabe destacar también la presencia de tres mutaciones timidínicas transmitidas a un mismo paciente (M41L, L210W y T215Y) generando resistencia intermedia al tenofovir, siendo esta asociación de TAMs la que mayor afectación de la susceptibilidad confiere a TDF32.
En cuanto al grado de afectación de cada uno de los diferentes medicamentos para los cuales se secuenció el genoma viral en busca de mutaciones que confieren alguna resistencia, se destaca que los NNRTIs de primera generación nevirapina y efavirenz, además de ser los más frecuentemente afectados, también presentaron los más altos niveles de resistencia, por la alta frecuencia de aparición de la mutación K103N, pero también resulta importante que en un solo paciente se encontró nivel intermedio/alto a los NNRTIs de reciente generación etravirina y rilpivirina, por la presencia de la mutación Y181C; mutación que ha sido reportada con mayor frecuencia en pacientes con fracaso virológico con NNRTIs alcanzando frecuencias de 21-41%32,33.
Frente a los inhibidores de proteasa reforzados, no se encontraron mutaciones que predijeran resistencia intermedia o alta a ninguno de dichos medicamentos; solo se observó un caso de resistencia baja al fosamprenavir (por la presencia de la mutación L10F) que no forma parte de ninguno de los esquemas preferidos o alternativos de primera línea en Colombia24 así como otros 7 pacientes con resistencia baja al tipranavir (por la mutación Q58E), medicamento que no está disponible en Colombia, por lo que estos hallazgos carecen de relevancia clínica en el momento actual.
La ausencia de diferencias en las prevalencias de mutaciones y afectación de medicamentos ARV entre los dos períodos (2008-2011 vs 2012-2015), podría explicarse en parte por la baja prevalencia global encontrada, pero principalmente porque al menos desde el año 2001-2002 la combinación más utilizada en Colombia ha sido y continúa siendo basada en un NNRTI (preferiblemente efavirenz y en segundo lugar nevirapina) acompañado por dos NRTIs (generalmente zidovudina + lamivudina y más recientemente abacavir + lamivudina, sin desestimar que en el pasado también se utilizó con frecuencia estavudina y/o didanosina), y aquellas personas VIH+ que no han cumplido adecuadamente con su tratamiento son precisamente quienes inducen la aparición de mutaciones que causan afectación de la susceptibilidad del virus a los ARV, las cuales pueden ser luego transmitidas a otras personas durante la infección retroviral.
Al comparar las diferentes características generales entre los pacientes con tiempo probable de infección retroviral <1 año y ≥1 año, se observaron importantes diferencias ya descritas y estadísticamente significativas, tales como la edad, la procedencia urbana y la escolaridad, pero principalmente el estado clínico (según clasificación de los CDC), la carga viral, el conteo de linfocitos T-CD4+ y razón CD4+/CD8+ al momento del genotipo, todas las cuales son consistentes con la presencia más reciente de la infección retroviral en aquellos pacientes que fueron clasificados con <1 año. En cuanto a los hallazgos de frecuencias de mutaciones que generan resistencias según la lista de Bennett OMS 2009, se observó una significativa diferencia (p=0.008) entre aquellos con infección <1 año y los pacientes con ≥1 año, resultados que van en la misma dirección de un estudio multicéntrico de mutaciones transmitidas en 19 países europeos17, en el cual se observó una notoria diferencia en la prevalencia de mutaciones entre quienes tenían infección reciente (≥1 año) (8.7%) (p=0.006. Sin embargo, aún en los últimos años, en Colombia gran parte de los pacientes que ingresan a programas especializados de atención integral se presentan con enfermedad avanzada por el VIH, o por lo menos con la infección retroviral por más de un año (Datos Cuenta de Alto Costo - BD Resolución 4725/2011 y 783/2012. Fecha medición: 31 de enero de 2015)), lo cual dificulta la captación de personas con infección reciente (menor de 6 meses o menor de 1 año) o aguda, en quienes el rendimiento diagnóstico del estudio genotípico de resistencias arrojaría mejores resultados20.
Así las cosas, la frecuencia encontrada de mutaciones transmitidas en pacientes con <1 año de infección, supera el umbral de ≥5% definido por la OMS para recomendar el uso del genotipo al diagnóstico y/o previo al inicio del primer tratamiento en ese tipo de pacientes13. Al comparar los dos grupos en cuanto a las frecuencias de mutaciones según la sumatoria de las listas de OMS e IAS-USA, aunque fueron más altas, no se observó diferencia importante entre las dos (p=0.0999), lo cual difiere de lo encontrado en el estudio realizado en la CLS durante el periodo 2008-2010, cuando hubo una mayor frecuencia de mutaciones en aquellos pacientes con tiempo probable de infección menor de un año19.
De otro lado, si se tienen en cuenta solamente las mutaciones que pueden disminuir la susceptibilidad del virus a los medicamentos preferidos por las Guías de práctica clínica de Colombia24 para el primer esquema de tratamiento en pacientes sin exposición previa o naïve (abacavir/lamivudina o tenofovir/emtricitabina + efavirenz o atazanavir/ritonavir o darunavir/ritonavir o raltegravir), posiblemente el genotipo se recomendaría solamente para quienes probablemente tengan menos de un año de infección retroviral (con prevalencia de mutaciones transmitidas de 7.3% según la lista de Bennett o 11.5% según OMS + IAS-USA), mas no en quienes tengan uno o más años desde la adquisición de la infección (con prevalencia de mutaciones transmitidas de 1.6% según lista de OMS o 6.5% según OMS + IAS-USA) (p=0.008 por Bennett-OMS), pero se estaría desestimando el aporte de las mutaciones timidínicas halladas para el uso de zidovudina dentro de regímenes alternativos aún de alto uso.
Entonces, en aquellos pacientes con probable infección <1 año y teniendo en cuenta solamente la lista de Bennett, sería claramente recomendado el genotipo al momento del diagnóstico y/o inmediatamente previo al inicio del primer tratamiento ARV, especialmente en los más jóvenes, de procedencia urbana y más alta escolaridad, con carga viral, conteo de linfocitos T-CD4+ y razón CD4/CD8 mayores, y principalmente cuando el primer esquema de tratamiento se compondrá de dos NRTIs acompañados de un NNRTI de primera generación preferidos según las recomendaciones de la OMS y la Organización Panamericana de la Salud para la región de Latinoamérica y el Caribe. Si tomamos en cuenta las mutaciones pertenecientes a la lista de la IAS USA 2015, la frecuencia es aún mayor, pero no hay una diferencia estadísticamente significativa según el tiempo probable de infección.
Cabe mencionar que la muestra no es probabilística, lo que disminuye su representatividad; así mismo, y a pesar de nuestros mayores esfuerzos, existe la posibilidad de que algunos participantes hayan sido erróneamente clasificados como ARV naïve, aunque esto fue minimizado mediante cuidadosas revisiones de las historias clínicas y entrevistas con los pacientes. Por otra parte, debido a la falta de disponibilidad de archivos electrónicos de las secuencias de nucleótidos, los genotipos no pudieron ser reanalizados para determinar subtipos del VIH; sin embargo, en Colombia el subtipo B es fuertemente predominante y es muy probable que la mayoría de los casos pertenecen a tal subtipo. El estudio presenta una limitación geográfica que impide la extrapolación de las conclusiones a la población colombiana de personas VIH+ Naïve, debida a la inclusión solamente de datos de personas procedentes de Cali y el Valle del Cauca. Por otro lado, dada la baja tasa global de mutaciones según Bennett 13 no fue posible por falta de poder estadístico, evaluar tendencias de cambios en el comportamiento de las mutaciones por periodos de tiempo.
Conclusiones
Teniendo en cuenta el umbral de prevalencia de resistencias transmitidas recomendado por la OMS, la implementación del genotipo de resistencias en pacientes sin exposición previa a TARV o naïve al momento del diagnóstico y/o antes de iniciar tratamiento antirretroviral, se justificaría en aquellos con tiempo probable de infección menor de un año.
Aunque en los esquemas de primera línea recomendados en las guías colombianas de práctica clínica se excluye actualmente a medicamentos como zidovudina y nevirapina, éstos continúan haciendo parte del arsenal de medicamentos antirretrovirales de inicio (Cuenta de Alto Costo - BD Resolución 4725/2011 y 783/2012. Fecha medición: 31 de enero de 2015) por lo que no podemos pasar por alto la frecuencia de mutaciones timidínicas que afectan la susceptibilidad a zidovudina (AZT).