I INTRODUCCIÓN
Las zonas desérticas y semidesérticas mexicanas presentes en los estados de Sonora y Chihuahua, las Selvas Bajas Caducifolias y la zona de depresión del Balsas, contienen una gran diversidad de cactáceas. Las zonas con mayor diversidad en el centro de México son el Valle de Tehuacán-Cuicatlán y la Barranca de Metztitlán. Sin embargo, es alarmante el número de especies de cactáceas mexicanas que se encuentran en alguna categoría de riesgo de extinción (Bravo 1978, Bravo-Hollis y Scheinvar 2002, Kunte y Subík 2004, Arias et al. 2005, Rodríguez 2006, Jiménez 2011, Salas-Cruz 2014, Villanueva et al. 2016, Flores-Tabango et al. 2017). La propagación de las cactáceas es básicamente por semilla, no obstante, es fundamental evaluar otras formas. Los ensayos de germinación permiten determinar el potencial máximo de germinación de un lote de semillas (ISTA 2005) y al mismo tiempo, estimar su desempeño en condiciones de campo. La germinación en laboratorio constituye un primer indicio de la calidad de las semillas. Sin embargo, hay que señalar que, en muchos casos, los resultados que se obtienen en condiciones controladas de laboratorio difieren de los que se hacen en condiciones de campo. El tiempo que las semillas pueden permanecer viables puede ser muy variable y depende en gran parte, de las condiciones de almacenamiento en las que se encuentran.
La viabilidad se puede conservar adecuadamente en condiciones controladas y donde la actividad metabólica del embrión se encuentra reducida y pueden influir factores ambientales y genéticos en ella. No obstante, la viabilidad tiende a disminuir con el tiempo, lo que puede afectar el rendimiento potencial máximo de las semillas, incluyendo semillas de la familia de las cactáceas que tienen importancia a nivel mundial (Cota 1985). La viabilidad de semillas es un atributo que se ha estudiado mucho en cultivos con importancia económica como trigo, maíz, frijol y cebolla (ISTA 2005), sin embargo, en cactáceas se ha generado poca información. La viabilidad determina la posibilidad de una semilla de germinar y desde un punto de vista sustentable, es imposible obtener plantas de interés comercial si no se parte de una semilla de calidad; un cultivo puede resultar de una calidad inferior a la semilla sembrada, pero nunca mejor que ella.
Se hace necesaria la investigación dirigida a conocer la capacidad germinativa de la semilla especialmente si se refiere a especies endémicas y silvestres mexicanas como Echinocactus. platyacanthus (Link & Otto), Ferocactus pilosus, Galeotti (Werderm), Lophophora. williamsii (Lem. Ex Salm-Dyck) JM Coult, y Echinocactus grusonii (Hildm). de tal manera que una vez determinada la calidad de la semilla, mediante la técnica topográfica con tetrazolio, servirá para su posterior propagación, conservación y reintroducción a su hábitat natural. Además, desde el punto de vista social y económico, las cactáceas son fundamentales como fuente de forraje de muchos animales, mantienen equilibrio en los ecosistemas (Gurvich 2010), se utilizan como materia prima para construcción (Flores y Macías 2008), sirven de fuente de alimento en la gastronomía humana y ofrecen diferentes usos etnobotánicos (Schulze 2004). Para evaluar y cuantificar la viabilidad se pueden realizar diferentes pruebas, entre las que destaca la estándar de germinación que es directa y la del 2, 3, 5 cloruro de trifenil Tetrazolio que es indirecta.
Echinocactus y Ferocactus son géneros endémicos de México (Kunte y Subik 2004, Alanís y Velazco 2008, Trópicos c2011). Las especies Echinocactus platyacanthus, Ferocactus pilosus, Lophophora williamsii y Echinocactus grusonii se distribuyen en el centro y norte de México. En general estas cuatro especies tenían una distribución amplia, aunque en la actualidad, han sufrido sobrexplotación y recolección indiscriminada. La especie L williamsii se emplea en ceremonias religiosas y principalmente como planta medicinal; E. platyacanthus, F. pilosus y E. grusonii sirven como plantas de ornato, alimento para humanos y para el ganado. Las tres últimas están en peligro de extinción y L. williamsii se encuentra en protección especial según la norma del gobierno mexicano NOM-059-ECOL-2010 (Kunte y Subík 2004, SEMARNAT 2010, Trópicos c2011). Las cuatro especies se encuentran en el apéndice II de CITES (CITES c2009) y E. grusonii está en peligro crítico según la UICN (CONABIO c2014); por lo que es necesario contar con métodos de propagación eficientes para la conservación de sus poblaciones (Amador-AKA et al. 2013).
La semilla es la etapa más importante en el ciclo de vida de las plantas superiores para su supervivencia; la latencia y la germinación son mecanismos naturales que aseguran esta permanencia de las poblaciones y a menudo le ayudan a sobrevivir largos periodos con condiciones desfavorables; el embrión está protegido por una o varias capas de otros tejidos (Vozzo 2010). Para eliminar los estados de latencia, se han usado varios tratamientos; por ejemplo, mediante escarificación mecánica y química (con ácido sulfúrico) o con escarificación biológica, cuando las semillas pasan por el tracto digestivo de aves u otros animales, la aplicación de reguladores de crecimiento como las giberelinas y el lavado o fermentación de la semilla. Los objetivos de este trabajo, que se realizó en noviembre de 2019, fueron evaluar la viabilidad con tetrazolio, la germinación y el índice de velocidad germinativa in vitro y ex vitro de semillas con y sin escarificación de cuatro especies de cactáceas.
1 MATERIALES Y MÉTODOS
Material vegetal
Se utilizaron semillas de las cactáceas, E. grusonii, E. platyacanthus, F. pilosus y L. williamsii donadas por la Facultad de Estudios Superiores de Iztacala - Laboratorio de Cactología del Jardín Botánico del Instituto de Biología de la Universidad Nacional Autónoma de México y del Centro Ecoturístico y de Educación Ambiental Sierra de Guadalupe.
Viabilidad con 2, 3, 5 cloruro de trifenil tetrazolio
Para determinar de manera indirecta el potencial de germinación, las semillas se sometieron a la prueba de tetrazolio (TZ) o topográfica que se caracteriza por la obtención de diferentes grados de tinción en los embriones, los que indican el nivel de viabilidad. Se utilizaron 40 semillas por especie y se pre-acondicionaron mediante remojo en agua destilada durante 48 h. Los embriones se extrajeron haciendo cortes a las semillas y luego se colocaron en soluciones de cloruro de tetrazolio (Sigma®) (ISTA 2005); en concentraciones de 0,1 0,5 y 1,0 % con un pH de 7,0 y una temperatura de 40 °C siguiendo el procedimiento de Suárez et al. (2012). Dada la disponibilidad de material la concentración de 0,1 % se aplicó a las cuatro especies, mientras las otras dos concentraciones solo a las Echinocactus y a F. pilosus. Se obtuvieron imágenes digitales de los embriones usando un microscopio Tessovar Carls Zeiss con cámara digital para microscopía PAXcam 3. Las imágenes se editaron con el programa GIMP 2.8.4. (Academia Video cursos On line c2019). Para la morfometría se empleó el programa Image Tool versión 3.0 (Wilcox et al. 2002).
Germinación in vitro.
Al momento de la siembra in vitro, las semillas de E. gru-sonii, E. platyacanthus, L. williamsii y F. pilosus tenían tres años de cosechadas. Se realizaron seis tratamientos, tres fueron in vitro y tres en sustratos. La siembra in vitro se realizó en medio de cultivo basal de Murashige y Skoog (1962) con las concentraciones de sales al 0 (testigo), 50 y 100 % complementado con glicina (2,0 mgL-1), mio-ino-sitol (100,0 mgL-1), tiamina HCl (0,4 mgL-1), piridoxina (0,5 mgL-1), ácido nicotínico (2,0 mgL-1) y sacarosa (30,0 gL-1). El pH fue de 5,7-5,8, ajustándose con 0,1 N de hidróxido de sodio o 0,1 N de ácido clorhídrico. El medio de cultivo se colocó en frascos de vidrio tipo Gerber (25 ml) y se esterilizó en autoclave a 121 °C durante 20 min. La duración de los tratamientos fue 40 días después de la siembra.
Germinación ex vitro
Para esta evaluación, se utilizaron tres sustratos: arena (A), composta con tezontle (2:1/C-T) y tierra de monte con tezontle (2:1/TM-T) esterilizados en autoclave por 1 h; los sustratos se colocaron en cajas de plástico con tapa transparente con pequeños orificios. Los frascos y las cajas se colocaron en el área de incubación a una temperatura de 27 °C±2 con luz constante y a una intensidad luminosa de 62,5 umol-m-2-s-1. El último conteo de plántulas en estos tratamientos fue a los 25 días.
Desinfección
Para la siembra in vitro, las semillas seleccionadas se desinfectaron sumergiéndolas en una solución de Captan y Bactrimicin (2,0 g L-1) en agua destilada por 2 h; posteriormente en agua jabonosa por 40 min, se pasaron a alcohol al 70 % por 1 min; se desinfectaron en cloro comercial al 20 % por 20 minutos y finalmente se enjuagaron tres veces en agua destilada esterilizada.
Para la siembra ex vitro se siguió el mismo procedimiento, con la excepción del cloro comercial que se usó al 15 % por 20 min. y tres enjuagues con agua destilada esterilizada. Para favorecer la velocidad y sincronía de la germinación, las semillas de las dos especies de Echinocactus se escarificaron de acuerdo con el método de Rosas-López y Collazo-Ortega (2004); los tiempos de escarificación en ácido sulfúrico al 100 %, fueron el testigo (0) y 1 y 2 minutos para los seis tratamientos.
Se calculó el Índice de Velocidad de Germinación (IVG) (Maguire 1962) mediante la fórmula siguiente: IVG=Σ(ni/ ti); donde: ni = número de semillas germinadas en el i-ésimo día y ti = tiempo de días, para la germinación en el i-ésimo día. Se usó un diseño factorial completamente al azar con cinco repeticiones de diez semillas cada una. Se realizó un análisis de varianza y pruebas de medias (Tukey, P ≤ 0,05) con el programa estadístico SAS® (SAS Institute 1998).
RESULTADOS Y DISCUSIÓN
Viabilidad
Aunque no se detectaron diferencias de viabilidad entre las cuatro especies, con la prueba de tetrazolio, si hubo una tendencia numérica. Se compararon solo tres especies de cactáceas en función de la concentración de tetrazolio (Fig. 1). De la especie L. williamsii no se presenta información porque no hubo suficiente semilla. El mejor comportamiento de viabilidad se obtuvo con la concentración de 0,1 % de cloruro de tetrazolio para E. platyacanthus. Suarez (2012) con 0,5 y 1,0 % en pitahaya amarilla (Selenicereus megalanthus (Haw.) Britt & Rose), obtuvo tinción en todos sus embriones, mientras León de la Luz y Domínguez (1991) obtuvo solo el 90 % de viabilidad con 1,0 % de cloruro de tetrazolio en semillas de Stenocereus gummosus (Engelm.) A. Gibson & K.E. Horak). Masini et al. (2014) en semillas de Maihuenia patageonica ((Phil.) Britton & Rose y Maihueniopsis darwinii (Hensl.) F. Ritter obtuvieron con 1,0 % de cloruro de tetrazolio 73,3 % y 66,7 % de semillas viables, respectivamente. Hubo valores de viabilidad diferentes entre L. williamsii (65 %) y E. platyacanthus (85 %) a concentración de 0,1 %, que, al parecer, es la concentración adecuada para lograr viabilidad en dichas especies. Así sucedió para Cota (1985) en Ferocactus latispinus (Haworth) Britton & Rose, quien obtuvo 70 % de embriones viables con una concentración de 0,1 % de cloruro de tetrazolio.
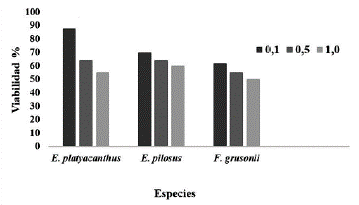
Figura 1 Viabilidad de embriones de tres especies de cactáceas teñidas con cloruro de tetrazolio en concentraciones de 0,1, 0,5 y 1,0 %. Valores con la misma letra son estadísticamente iguales de acuerdo con la prueba de Tukey, P ≤ 0,05.
En este trabajo, se observó variación en la coloración de embriones de las cuatro especies que se tiñeron de color rojo carmín intenso hasta un rojo suave o coral. Dicha variación puede significar que no todos los embriones estén vivos. Así ocurre con el trabajo de Cota (1985) en Ferocactus latispinus (Haworth) Britton & Rose, quien obtuvo 70 % de embriones viables con una concentración de 0,1 % de cloruro de tetrazolio. La diferencia de respuesta puede deberse a una mayor o menor actividad enzimática en los embriones, que produjo también una mayor presencia de formazán, resultado de la variación natural entre las especies estudiadas.
Suarez (2012) en pitahaya amarilla (Selenicereus megalanthus), con 0,1 % obtuvo una tinción reducida de los embriones. Esta respuesta se atribuyó a una concentración baja de deshidrogenasas en las semillas, que impidió la reacción con el tetrazolio. Un aspecto importante que influye en la cantidad de tinción es la edad de la semilla y al respecto, Cota (1985) menciona que el envejecimiento en los tejidos puede ocasionar coloraciones pálidas o moteadas que frecuentemente coinciden con semillas de bajo vigor. Las variaciones en la coloración rojiza que hubo en las cuatro especies, tanto en intensidad como en uniformidad con 0,1% (Fig. 2), probablemente se debe a la condición fisiológica o metabólica de cada especie, dando por resultado una mayor o menor actividad de las enzimas deshidrogenasas, que reaccionan con la presencia del cloruro de tetrazolio y originando la presencia de formazán que es la coloración rojiza del tejido vivo. Se observan unos embriones completamente teñidos de rojo intenso que parecen negros y de coloración rojo suave o rosa. Estos resultados son similares a los que menciona Salazar et al. (2018) en su trabajo con Linum usitatissimum. A este respecto, Elizalde et al. (2017) señalan que en Hechtia perotensis se obtuvieron semillas vigorosas con los embriones teñidos de color rojo intenso con el tejido sano y suponen que la permeabilidad de las membranas celulares fue óptima y que los embriones teñidos con una coloración rojo suave o rosa es el resultado de una penetración, de la solución de tetrazolio, lenta y uniforme, pero son fisiológicamente sanos. Estos resultados fueron similares a los reportados por Espitia-Camacho et al. (2017) en especies como Chromolaena odorata (L.) R.M. King y H. Rob y Cariniana pyriformi Miers. Con base en lo anterior, se puede inferir que las diferencias en la coloración de los embriones de este trabajo se deben probablemente a la edad que tenían las semillas.
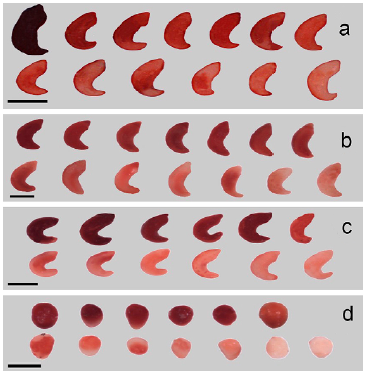
Figura 2 Viabilidad de embriones de cuatro cactáceas según la respuesta a la tinción con cloruro de tetrazolio a 0,1 % en a E. platyacanthus b. E. grusonii, c. F. pilosus y d. L. williamsii. Escala =1 mm.
En este trabajo las diferentes tonalidades de los embriones, en tres de las cuatro especies, se observaron en las concentraciones de 0,1, 0,5 y 1,0 % (Figs. 2, 3 y 4, respectivamente). En este sentido, Lima et al. (2010) e ISTA (2014) mencionan que las variaciones en la intensidad de tinción ocurren debido a que la sal de tetrazolio permite determinar también la presencia, localización y por ende naturaleza de las alteraciones de los tejidos de las semillas. De acuerdo con Días y Alves (2008), las variaciones en color son indicios de declinación en la actividad de las deshidrogenasas probablemente por la condición fisiológica o metabólica de cada especie. Prieto et al. (2015) manifiestan que la prueba del tetrazolio se basa en la actividad de las enzimas hidrolasas, particularmente deshidrogenasas del ácido málico que reducen la sal de tetrazolio a formazán en los tejidos viables de las semillas. Aragón et al. (2011) estiman que la tinción no es confiable en especies de semilla muy pequeña como es el caso de E. platyacantus y se apoyan en la afirmación de Flores et al. (2006) quienes determinaron que los embriones se tiñen totalmente aun cuando no sean viables. Debemos recordar que el uso de tetrazolio como un indicador de viabilidad es la prueba rápida para estimar la viabilidad de semillas y su vigor y está basada en las alteraciones de color (coloración roja) en los tejidos vivos en contacto con la solución de tetrazolio, lo que refleja el grado de actividad del sistema enzimático de la deshidrogenasa relacionado estrechamente con la respiración celular y por tanto indica la viabilidad de las semillas (Corbineau 2012). Al respecto, Monroy et al. (2017) consideran, en Opuntia que, si bien la coloración roja intensa indica que las células están vivas, es posible que cuando la actividad los sistemas enzimáticos decrece debido al deterioro de la semilla, la coloración de embriones es rosa pálido, lo cual para ellos significa baja viabilidad. Sarmento et al. (2013) y Pereira et al. (2017) señalan que el exceso del tiempo de contacto del embrión con la solución puede resultar en una coloración incluso si las semillas no son viables. El empleo de tetrazolio puede ser afectado por diversos factores como se mencionó, pero sirve para identificar el potencial fisiológico de la semilla (Filho 2015).
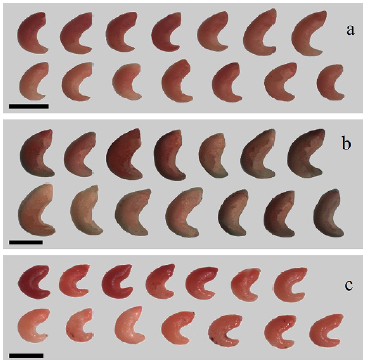
Figura 3 Viabilidad de embriones de tres especies de cactáceas según la respuesta a la tinción con 0,5 % de cloruro de tetrazolio en a E. grusonii, b E. platyacanthus y c F. pilosus. Escala = 1 mm.
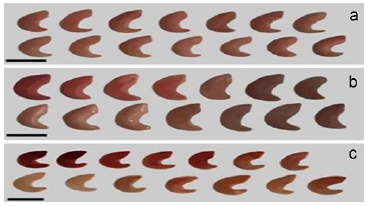
Figura 4 Viabilidad de embriones de tres especies de cactáceas según la respuesta a la tinción con 1,0 % de cloruro de tetrazolio en a E. grusonii, b E. platyacanthus y c F. pilosus. Escala = 1 mm
Los patrones de tinción de los embriones de las cuatro especies indican que la concentración de 0,1 % fue la más adecuada sin escarificar las semillas. En esta concentración se tiñeron el mayor número de embriones y correspondió a un mayor porcentaje de germinación. En F. pilosus, E. platyacanthus, E grusonii y L. williamsii el porcentaje de embriones viables fue menor en comparación con el porcentaje de semillas germinadas en los sustratos.
Germinación in vitro
La germinación en las diferentes concentraciones de sales del medio MS se presentó entre los 13 y los 34 días después de la siembra. En L. williamsii y en F. pilosus la germinación inició a los trece días en los tratamientos de 0, 50 y 100 %; en E. platyacanthus la respuesta fue entre los días 16, 17 y 24 para 100, 50 ,0 % de MS, respectivamente; en E. grusonii, la germinación ocurrió de la manera siguiente: 34 días para las semillas sembradas en sales al 100 % y 13 días para las sembradas en la concentración de sales al 50 %. Rosas-López y Collazo-Ortega (2004) mencionan que, en E. platyacanthus y en Polaskia chichipe (Rol. Goss.) Backeb, el inicio de germinación se dio a los doce y 18 días, respectivamente en MS con las sales al 50 %. Se observaron diferencias de germinación entre especies y entre tratamientos (Fig. 5). En la prueba de medias, los valores más altos fueron para la especie F. pilosus y los más bajos para E. grusonii. El mejor sustrato para E. pilosus fue tierra de monte-Tezontle (TM-t) con 98 % de germinación; en el caso de E. platyacanthus con arena con 94 %; para L. williamsii fue TM-t con 82 % y E. grusonii con 64 % de germinación. Estos resultados contrastan con los obtenidos por Rosas-López y Collazo-Ortega (2004) principalmente con E. platyacanthus y P. chichipe cultivados en suelo-tepojal donde obtuvieron porcentajes de 30 y 50 % de germinación, respectivamente.
En cuanto a los valores de germinación, por ejemplo, para F. pilosus fue de 72 % con el 100 % de sales de MS; sin embargo, las semillas de L. williamsii y las dos especies de Echinocactus, respondieron mejor al germinar en sales al 50 % y los valores obtenidos para E. platyacanthus fueron de 36 %; para E. grusonii fue de 18 %, y para L. williamsii de 42 % (Fig. 5). Al respecto Elías-Rocha et al. (1998) cultivaron semillas de Mammillaria candida (Scheidw) Britton & Rose, en las sales de MS al 50 y 100 % y obtuvieron porcentajes de germinación similares. Mata Rosas et al. (2001) en Turbinicarpus laui (Glass et Foster) registraron porcentajes de 40 y 50 en sales de MS al 100 y 50 %, respectivamente, mientras que Garza-Padrón et al. (2005) en Acanthocereus occidentalis (Britton and Rose) obtuvieron un 90 % de germinación con MS al 100 %, lo que se considera un porcentaje alto. Santos (2005) con Ferocactus glaucescens (Britton and Rose) obtuvo una germinación de 48 %, valor que se consideró bajo e indicó que pudo deberse al producto utilizado para la desinfección de la semilla. Además, este autor menciona que el agente desinfectante, en algunos casos daña los tejidos y disminuye la capacidad de germinación. No obstante, es conveniente considerar, como factor importante al soluto contenido en el MS (sales al 50 %) que causa que el potencial hídrico disminuya, y aun cuando favorece el crecimiento por los nutrimentos, limita la accesibilidad al agua y por lo tanto la germinación es baja.
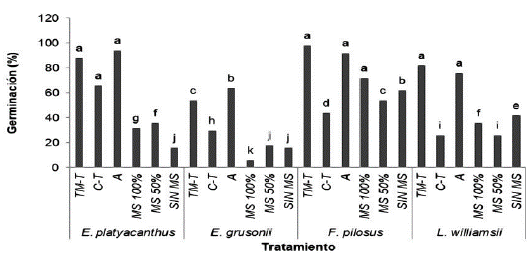
Figura 5 Porcentaje de germinación in vitro con diferentes tratamientos de sustratos y con y sin sales de medio Murashige y Skoog en cuatro especies de cactáceas. TM-T= Tierra de monte y tezontle; C-T=composta y tezontle; A= arena; MS= sales TM-T= Tierra de monte y tezontle; C-T=composta y tezontle; A= arena; MS= sales de medio básico Murashige y Skoog en concentraciones de 100 % y 50 %; SIN MS= sin sales del medio Murashige y Skoog. Valores con la misma letra son estadísticamente iguales de acuerdo con la prueba de Tukey con una P ≤ 0,05.
Semillas de F. pilosus, E. platyacanthus, L. williamsii y E. grusonii inoculadas en agua-agar registraron 62, 16, 42 y 16 % de germinación respectivamente. Rosas-López y Collazo Ortega (2004) obtuvieron en E. platyacanthus y en P. chichipe con agar sin nutrientes 80 y 60 % de germinación respectivamente.
En esta situación, es posible que la ausencia de los solutos (sales en el medio MS) origine un potencial hídrico mayor de tal manera que las semillas puedan disponer de más cantidad de agua, esta condición solo acelera el mecanismo de la germinación, pero no el crecimiento de las plántulas causado por la carencia de nutrientes. Los medios de cultivo utilizados en este trabajo, MS y agar fueron sólidos lo que significa que hay menor porosidad y, por lo tanto, una menor oxigenación lo que influyó en un menor desarrollo de las plántulas en comparación con los sustratos (TM-T, C-T y A) lo que no permitió a las semillas absorber el agua adecuadamente, reduciendo la germinación.
Las plántulas más vigorosas y con desarrollo rápido se obtuvieron en el medio al 100 %, comparativamente con el medio sin nutrientes (0 %), en donde se desarrollaron plántulas con menor vigor y con crecimiento más lento (Fig. 6). Elías-Rocha et al. (1998) mencionan que las semillas de las plantas de Mammillaria candida sembradas en dos concentraciones de sales de MS (50 y 100 %), germinaron al mismo tiempo, pero las plántulas obtenidas en el medio completo de sales fueron más vigorosas.
Germinación ex vitro
La germinación en sustratos (ex vitro) se inició entre los días cuatro al 17. En L. williamsii, F. pilosus, E. platya-canthus y E. grusonii ocurrió entre los días cuatro a siete en los sustratos tierra de monte-tezontle (TM-T) y arena (A) y entre los días nueve y 17 cuando se germinó con sustrato composta-tezontle (C-T). Hubo retraso en germinación en el sustrato C-T, comparándolo con los demás sustratos. Las semillas germinaron más rápido en los sustratos comparativamente con el medio MS. Rosas-López y Collazo Ortega (2004) obtuvieron en E. platyacanthus y P. chichipe, un menor tiempo de germinación con tres y cuatro días en el sustrato de suelo-tepojal.

Figura 6 Apariencia de las plántulas cultivadas en diferentes concentraciones de sales MS. a. E. grusonii, b. E. platyacanthus, c. F. pilosus y d. L. williamsii. Escalas indicadas con letra K corresponden a 1 mm, las demás a 5 mm. MS 100 %= sales de medio Murashige y Skoog; MS 50 % = sales de Murashige y Skoog a la mitad de su concentración; MS 0 %= sustrato sin sales
Se observó que en los tratamientos de tierra de monte-tezontle (TM-T) y composta-tezontle (C-T), comparados con la arena, las plántulas fueron vigorosas, lo que favoreció un desarrollo más rápido (Fig. 7).

Figura 7 Apariencia de plántulas germinadas diferentes substratos. a. E. grusonii, b. E. platyacanthus, c. F. pilosus y d L. williamsii (d). TM-T= Tierra de monte - tezontle; C-T= composta -tezontle; A= arena (A); la escala es de 5 mm.
Newell et al. (2003), en especies de cactáceas australianas, indicaron que el empleo de sustratos de diferente porosidad para germinación de las semillas fue más eficiente que las sembradas en medio básico MS solidificado con agar por tener mayor capacidad de aireación. En sustratos como turba, arena y perlita = IVS, el desarrollo de la raíz es mejor que in vitro y en el sustrato (IVS) principalmente comparándolos con el medio sólido in vitro. Además, se incrementa la adaptación de las plántulas.
Índice de Velocidad Germinativa (IVG)
Este índice mide el vigor de plántulas y los valores registrados para las cuatro especies fueron: L. williamsii en arena de 4,27 semillas por día, seguido por F. pilosus en arena y tierra de monte-tezontle con 4,18 y 4,03 semillas por día, respectivamente mientras que en E. grusonii con agua y agar sin las sales del medio MS las semillas no germinaron (Fig. 8).
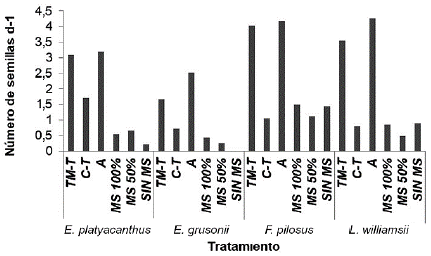
Figura 8 Indice de Velocidad Germinativa (IVG) con diferentes tratamientos de sales de MS y sustratos en cuatro especies de cactáceas. TM-T= tierra de monte y tezontle; C-T= composta-tezontle; A= arena; MS=sales del medio MS en concentraciones de 100 %, 50 %; SIN MS= sin sales de medio MS.
Salas-Cruz et al. (2011) trabajando en cultivo in vitro obtuvieron un IVG en Astrophytum myriostigma (Lem) de 5,27, de 5,16 para A. capricorne (A. Dietr) Britton & Rose, en Escobaria dasyacantha (Engelm.) Britton & Rose de 4,4, en Echinocereus reichenbachii (Terscheck ex Walp.) J.N.Haage de 3,36, en Sclerocactus scheeri (Salm-Dyck) NP Taylor de 3,26 y en Mammillaria prolifera (Mill.) Haw. de 2,85. Las semillas que germinan en los primeros días tienen mayor vigor y aquéllas que presentaron mayor porcentaje de germinación también coincidieron con una mayor velocidad de germinación, por lo que estos parámetros permiten tener una idea del nivel potencial de vigor de las semillas de estas especies, que es sinónimo de mejor calidad fisiológica y, por tanto, con una mayor oportunidad de generar plántulas normales.
Escarificación con ácido sulfúrico
Los tratamientos de escarificación se hicieron solo en las especies E. platyacanthus y E. grusonii. En general, la escarificación mejoró cuando las semillas se trataron por uno y dos min en ácido sulfúrico al 100 % (Fig. 9); en agua y agar con escarificación no germinaron las semillas de las dos especies. Entre especies y tratamientos hubo diferencias significativas en la prueba de medias: la germinación de E. grusonii con escarificación resultó mejor con 1 min en ácido sulfúrico y sembradas en A y TM-T. En los sustratos, se obtuvo un aumento en el número de semillas germinadas con escarificación. Sin embargo, no se observó lo mismo con E. platyacanthus usando el mismo tiempo de escarificación (Fig. 9). Rosas-López y Collazo-Ortega (2004) reportaron, en Polaskia chichipe que el mejor tratamiento fue el testigo usando suelo-tepojal (50 % de germinación) y en E. platyacanthus el mejor fue con ácido por 1h en suelo-tepojal (90 % de germinación). En general, la semilla escarificada y germinada en los diferentes sustratos produjo mayor germinación en las cuatro especies.
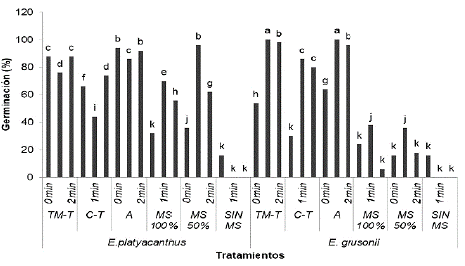
Figura 9 Porcentaje de germinación de E. platyacanthus y E. grusonii en diferentes tratamientos de escarificación de 1 y 2 min con ácido sulfúrico al 100 %, sustratos y concentraciones de sales de medio MS (100 %, 50 %). TM-T= tierra de monte y tezontle; C-T= composta y tezontle; A=arena; sales de medio MS. Valores con letra diferente son estadísticamente diferentes de acuerdo a la prueba de Tukey, con una P ≤ 0,05
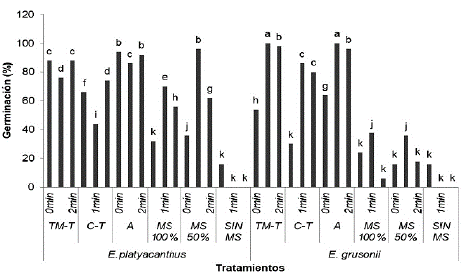
Figura 10 Indice de Velocidad Germinativa (IVG) en diferentes tratamientos de escarificación con ácido sulfúrico al 100 %, sustratos y concentración de sales MS en E. platyacanthus y E. grusonii. TM-T= tierra de monte y tezontle; C-T= composta y tezontle; A=arena; sales de medio MS. (Tukey, P ≤ 0,05).
Semillas de E. platyacanthus inoculadas en sales de MS (50 %) con 1 min en el ácido sulfúrico germinaron un 96 %, por lo que se asume que esta especie necesita ser escarificada para inducir la germinación. Moebius-Goldammer et al. (2003) germinaron el 70 % de semillas de Ariocarpus kots-chobeyanus (Lem) escarificadas por dos minutos con ácido sulfúrico y sembrados en sales de MS al 100 %; de Medeiros et al. (2006) en Notocactus magnificus (F.Ritter) F.H. Brandt, obtuvieron porcentajes de 13 % de germinación en sales de MS al 100 %; sin embargo, señalan que un bajo porcentaje de germinación puede deberse a factores como la viabilidad reducida inicial que de por sí puede presentar la semilla, así como el potencial osmótico inadecuado de la humedad del sustrato. Una vez más, se observa que en esta especie el porcentaje de germinación obtenido fue alto comparado con el de estos autores.
En cuanto al Índice de Velocidad de Germinación (IVG), las semillas de E. grusonii sembradas en sustratos TM-T y A con escarificación, registraron los valores más altos de número de semillas germinadas por día, mientras que en E. platyacanthus los sustratos TM-T y A con y sin escarificación resultaron con los valores más altos de número de semillas germinadas por día (Fig. 10). Lo que significa que el pretra-tamiento para romper latencia en estas especies también se refleja en un mejor vigor, lo que se asocia con el rompimiento de testas duras, eliminación de taninos e inhibidores que tienen las semillas de estas especies (Bravo 1978), aun considerando que la semilla tenía tres años de cosechada.
Conocer la viabilidad de la semilla y perpetuación de las especies de cactáceas mediante la germinación in vitro, debe ser considerada como una opción viable para la conservación y aprovechamiento sustentable que se puede aplicar en las cuatro especies motivo la investigación. Estos resultados se pueden extrapolar a otras especies de cactáceas amenazadas o en riesgo de extinción.















