INTRODUCCIÓN
La caña panelera ocupa el 6,5% del área agrícola cultivada en Colombia, con 203,919ha y un aporte del 1,95% al PIB nacional (Osorio, 2007). La producción se concentra en diferentes regiones del país, pero la región andina y los valles interandinos aportan el 90% de la producción (Mojica y Paredes, 2004).
Según FEDEPANELA (2009) existen inscritos 17.255 trapiches, de los cuales Nariño tiene 438, es decir 2,5% respecto al total de los inscritos. El departamento de Nariño cuenta con 21.576 hectáreas de caña sembrada, produce 148.874 toneladas de panela que representa 6% de la producción nacional (Martínez et al., 2005). El rendimiento de 6,9 t.ha-1, es 5% superior al promedio nacional; la producción de panela se concentra en la zona norte y occidente del departamento (Campuzano, 2000). En Nariño, la actividad panelera genera muchos empleos y bienestar para numerosas familias; cada hectárea cultivada requiere de 80 jornales por año, para un total de 1.726.080 jornales anuales y cada trapiche con una capacidad de 100kg de panela por hora genera 35 jornales, para un total de 5.675 jornales en planta (Rangel, 2006). Sin embargo y a pesar de la importancia socioeconómica, la agroindustria panelera presenta una serie de problemas tecnológicos que afecta cerca del 90% de las unidades productivas (Mojica y Paredes, 2004).
En ese sentido, el cultivo de caña en Albán-Nariño, se caracteriza por su bajo nivel de tecnificación, en ésta región predominan cultivos muy antiguos, con más de 20 años de edad, bajos índices de renovación, bajos niveles de utilización de fertilizantes y de herbicidas y el corte de la caña se realiza mediante la selección y cosecha de los tallos completamente maduros denominado entresacas (Rodríguez et al., 2004).
Este sistema de producción implica para el agricultor pocas labores de cultivo y generalmente, se limita a realizar el control manual de arvenses y la cosecha de la caña. Respecto a la elaboración de la panela, el nivel de tecnificación es bajo. El 75% de los trapiches presentan baja extracción de jugos. El promedio indica que la extracción está en un 46%, es decir, que por 100 kilos de caña molida se obtienen 46 kilos de jugo y 54 kilos de bagazo. Esta situación indica la gran cantidad de residuos que se generan y su impacto en el ambiente (Rodríguez et al., 2004).
Por lo anterior, es necesaria la búsqueda de alternativas que modifiquen su actual esquema de producción y presenten opciones ambientales, alternativas que llamen la atención de los productores y se constituyan en posibilidades económicas que hagan de la industria panelera, una opción viable en el cuidado del ambiente, en temas como la reducción de emisiones de CO2, la prestación de servicios ambientales, el adecuado manejo de residuos sólidos, especialmente del bagazo (Osorio, 2007).
Durante el proceso de producción de panela, el bagazo de caña es vertido a las quebradas, generando una problemática ambiental de alto impacto negativo sobre la calidad del agua y del suelo (Osorio et al., 2011). Por lo anterior la agroindustria panelera ha sido reconocida no solo a nivel nacional sino también internacional como altamente contaminante, en virtud que los procesos de degradación ambiental que produce, son generalmente de carácter irreversible (Osorio, 2007).
Sin embargo, es perentorio encontrar alternativas de uso para el bagazo, que permitan resolver la creciente producción del mismo como consecuencia del proyectado crecimiento de esta agroindustria, sino también para utilizarlo en la producción de abono por medio de procesos como el compostaje (Osorio, 2007).
El compostaje de residuos sólidos, es un proceso natural llevado a cabo por una diversidad de organismos, bajo el control de factores que afectan tanto su crecimiento como su actividad. La efectividad del proceso, depende en gran medida de las condiciones ambientales, el método utilizado y las materias primas empleadas que implican vigilancia constante para que estén en un rango optimo (Román et al., 2013).
Con el fin de acelerar el proceso de compostaje, se han utilizado inóculos preparados con varios microorganismos (Cariello et al., 2007; Tortarolo et al., 2008; Vásquez et al., 2010; Viteri et al., 2015) con activadores biológicos como vinazas (Castillo et al., 2015).
Los microorganismos, además de recuperar la biota del suelo, aportan nutrientes y sustancias biológicamente activas, como antibióticos y promotores de crecimiento vegetal (giberelinas, citoquininas, ácido indolacético y sus derivados) que favorecen el reciclaje de minerales, el desarrollo de los cultivos y evitan focos de contaminación (Gil et al., 2006).
El objetivo de esta investigación fue utilizar caldos microbianos para la descomposición de residuos de caña panelera Saccharum officinarum L. y su efecto fertilizante en plantas de Raphanus sativus L.
MATERIALES Y MÉTODOS
El trabajo se realizó en el invernadero de la Institución Educativa Politécnico Juan Bolaños del municipio de Albán, en el departamento de Nariño, situado a una altura de 1971 msnm, con una temperatura promedio de 18ºC y una precipitación promedia anual de 1200mm (Gómez, 2016). El invernadero con un área total de 500m2, está protegido con una polisombra de 65% de luz. La temperatura interna del invernadero es de 18°C en el día y en la noche de 10°C.
La metodología de preparación de caldos microbianos es propuesta por Sañudo et al. (2001), Sañudo y Valllejo (1992), para descomposición de residuos vegetales. Los materiales utilizados fueron, bagazo de caña del proceso de molienda de la industria panelera, suministrado por los trapiches del municipio de Albán. Se necesitaron de 750 kilos de bagazo de caña, para formar cinco grupos. Por tratamiento, la cantidad de 150 kilos se dividió en tres repeticiones cada una de 50 kilos, que se sometieron a remojó con el caldo correspondiente, en dosis de 5 litros y conteniendo inóculo microbiano.
Se trabajó con un Diseño Completamente al Azar, con cinco tratamientos y tres repeticiones. Los tratamientos consistieron en:
Tratamiento 1 (Testigo). En el que los residuos sólidos, se humedecen periódicamente con agua corriente hasta la época de transformación a un bioabono.
Tratamiento 2 (Caldo 1). En un recipiente con capacidad de 50 litros, se elaboró un caldo con 5 kilos de estiércol fresco de ganado, más 2,5 kilos de residuos sólidos descompuestos, más 1 litro de leche cruda, más un kilo de melaza, más 25cm3 de agua oxigenada, llenando con agua hasta el volumen final, para tapar herméticamente y dejar fermentar por 10 días.
Tratamiento 3 (Caldo 2). Se utilizaron los mismos componentes del tratamiento dos y se adicionaron 150g de urea, 150g de sulfato de amonio y 200g de nitrato de potasio comerciales.
Tratamiento 4 (Caldo 3). Se utilizaron los mismos componentes del tratamiento dos agregando dos kilos de fosforita Huila más 250g de abono comercial (13-26-6).
Tratamiento 5 (Caldo 4). Consta de la suma de los constituyentes minerales de los caldos 2 y 3, que se adicionan al caldo más estiércol, residuos descompuestos, leche, melaza, más agua oxigenada y agua con concentración ya mencionada.
Evaluación de las características físicas y químicas. De cada pila, se tomaron muestras para hacer los análisis respectivos en cuanto a: pH, humedad, materia orgánica, carbono total, nitrógeno total, fósforo, potasio, calcio y magnesio, de acuerdo con la metodología seguidas en los Laboratorios de Suelo Agrícolas, Química Analítica y Bromatología de la Universidad de Nariño para sustratos orgánicos (Calvache, 2000).
Efecto fertilizante de los abonos. Se trabajó con un suelo procedente de la vereda San Luis del municipio de Albán, departamento de Nariño, subgrupo Acrudoxic Hapludands, cuyas características principales son: suelos superficiales a moderadamente profundos, abundante vidrio volcánico, de textura franco arenosa o arenosa franca. Presentan reacción ligeramente ácida (pH 5,63), son muy pobres en fósforo (2,00mg/kg), altos contenidos de materia orgánica (15,8%), nitrógeno total (0,51%), capacidad de intercambio catiónico (33,3cmol+/kg) (IGAC, 2003).
Se estableció un Diseño Completamente al Azar en Parcelas divididas con cinco repeticiones, teniendo en cuenta que el factor A correspondió a los cinco abonos producidos y el factor B a las dosis 0, 1000, 2000 y 4000 kg/ha.
Cada unidad experimental consistió de una bolsa de polietileno calibre 8 con capacidad de 2kg de suelo esterilizado. Las dosis de cada abono, se colocaron en los primeros 3cm del suelo de cada bolsa, mezclando uniformemente (Pérez et al., 2009). En cada bolsa se sembraron cinco semillas de Raphanus sativus L. y en el momento de la emergencia se hizo raleo dejando una plántula.
Después de 45 días, se hizo la cosecha de las plantas, se determinó la longitud y peso total de toda la planta, el peso de la parte aérea y de las raíces, obteniendo los promedios por planta para cada unidad experimental.
Análisis estadístico. se efectuó un Análisis de Varianza y la Prueba de Comparación de Medias de Tukey para aquellas variables donde se realizó la hipótesis nula, con el programa estadístico INFOSTAT versión 2.1 (2010) (Balzarini et al., 2008).
RESULTADOS Y DISCUSIÓN
Según el Análisis de Varianza en la Tabla 1, se encontraron diferencias altamente significativas entre tratamientos para las evaluaciones de pH, humedad, materia orgánica, carbono, nitrógeno, fósforo, potasio, calcio y magnesio.
Tabla 1 Análisis de Varianza para las características físicas y químicas de abonos orgánicos a partir de residuos sólidos con el enriquecimiento de caldos microbianos.

**= diferencias altamente significativas
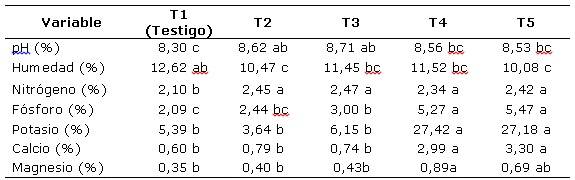
pH. De acuerdo con la Tabla 2 el pH de los abonos orgánicos osciló entre 8,30 y 8,71, siendo menor en el testigo (8,30, pero sin diferencias significativas respecto a los tratamientos T4 (8,56) y T5 (8,53). Sin embargo, tuvo diferencias significativas respecto a T2 (8,62) y T3 (8,71).
Tabla 2 Comparación de Promedios para algunas Características Físicas y Químicas de abonos orgánicos a partir de residuos sólidos.
Promedios con letras diferentes difieren significativamente, prueba Tukey (P≤ 0,05).
Los resultados obtenidos muestran que hay efecto buffer de la materia orgánica (Jaramillo, 2002). El pH obtenido en los abonos orgánicos, indica que la incorporación de éstos en el suelo, favorece poblaciones microbianas, principalmente, bacterias y actinomicetos que son responsables de la mayoría de cambios bioquímicos (Gómez, 2000).
Al respecto, Julca et al. (2006) afirman que el pH puede tener importancia en la retención de las bacterias en el suelo. La mayor parte de bacterias y actinomicetos se desarrollan mejor a pH neutro y ligeramente alcalino; en cambio, los hongos se desarrollan a un pH más amplio (Fassbender y Bornemisza, 1994). También existe la posibilidad que la materia orgánica por su carga negativa, adsorba y retenga a estos microorganismos de manera significativa (Goyal y Gerba, 1979). Dighton et al. (1997) señalan que los factores abióticos del suelo pueden tener un papel importante en la dispersión de los microorganismos del suelo.
Fósforo. Los menores contenidos de fósforo se obtienen en el tratamiento testigo (2,09%), sin diferencias significativas con el tratamiento T2 (2,44%), pero con diferencias significativas con relación a los demás tratamientos con 3,00 a 5,47% de P2O5.
Los tratamientos en los cuales los caldos contenían roca fosfórica (T4 y T5) al iniciar el proceso de fermentación, tuvieron un incremento de P2O5 a 5,27 y 5,47%, con ganancias de 3,18 y 3,38%, y con respecto a T1, de 2,83%.
El empleo de rocas fosfóricas que contienen fosfatos apátiticos (fosfatos tricálcicos), resulta una medida ecológicamente eficiente, porque en los caldos existen poblaciones microbianas capaces de solubilizar el fósforo insoluble a formas solubles como fosfato monocálcico y ácido ortofosfórico, porque se forman ácidos orgánicos como el cítrico y el oxálico de origen microbiano (Blasco y Burbano, 2015).
Paredes y Espinosa (2010), afirman que la solubilización del fosfato por los ácidos orgánicos depende del pH de los abonos incorporados y la mineralogía del suelo. Existen dos mecanismos para que esto ocurra. El primero es un intercambio del ácido, por ejemplo, los H+ provenientes del citrato se intercambian por el P ligado a la superficie de los cristales de Al(OH)3 o Fe(OH)3 los cuales se reducen y liberan al P (Andrews, 1990; Halder et al., 1990). El segundo mecanismo depende de la concentración de los ácidos orgánicos producidos por las bacterias solubilizadoras de fósforo, el cual involucra la formación de complejos con iones de metales provenientes de la roca fosfórica (Singh y Amberger, 1998).
Humedad. El mayor contenido de humedad (12,62%) lo tuvo el tratamiento testigo (T1), con diferencias significativas respecto a los tratamientos T2 (10,47) y T5 (10,08), pero sin diferencias significativas con respecto a T3 (11,45) y T4 (11,52) (Tabla 2).
Al valor de humedad del testigo (T1), indica que aún no ha ocurrido una maduración del abono, donde producen reacciones de hidrólisis para degradar moléculas orgánicas complejas hasta los 90 días de iniciado el proceso de degradación bioquímica de los residuos orgánicos.
Sin embargo, también hay contenidos de humedad similares en los tratamientos T3 y T4, lo que al parecer es contradictorio, pero está indicando la ocurrencia de altas poblaciones microbianas y por lo tanto, una actividad postmaduración, lo cual es beneficio cuando el abono orgánico se incorpora al suelo, porque a la vez que se favorece la humedad del sustrato, se aporta mayor biomasa microbiana que continua con los cambios bioquímicos en el suelo (Suquilanda, 1996).
Nitrógeno. Los contenidos de nitrógeno variaron de 2,09 a 2,47%. El menor valor (2,10%) correspondió al tratamiento testigo (T1) con diferencias significativas respecto a los tratamientos en los que se emplearon caldos microbianos con 2,34 (T4) a 2,47% (T1), sin diferencias significativas entre ellos (Tabla 2).
Paul, (2014), afirma que los hongos, los actinomicetes y muchas bacterias son capaces de producir enzimas extracelulares que hidrolizan dichos polímeros. Así, dan lugar a compuestos más sencillos que pueden ser utilizados por ellos y por otros que no poseen capacidad celulolítica o proteolítica, y expanden el uso de los compuestos carbonados a un grupo más amplio de organismos del suelo.
Potasio. En los tratamientos T4 y T5, en los cuales se adicionó una fuente de elementos mayores secundarios y microelementos conteniendo potasio, los valores de este elemento fueron de 27,42 y 27,18%, los cuales superaron estadísticamente los contenidos que se obtuvieron con los otros tratamientos, los cuales oscilaron entre 3,64 y 6,15%, sin diferencias significativas, entre estos (Tabla 2). Al respecto Blasco y Burbano (2015), opinan que la mineralización del potasio debe atribuirse a la descomposición de la materia orgánica y a la formación de ácidos orgánicos por los microorganismos que reaccionan con los minerales potásicos meteorizando las estructuras cristalinas.
Calcio. Los tratamientos T4 y T5 con contenidos de 2,99 y 3,30% de calcio, mostraron diferencias significativas con respecto a los tratamientos T1 y T3 que con 0,60 a 0,79% de calcio, no mostraron diferencias significativas entre sí (Tabla 2).
La adición de roca fosfórica a los caldos microbianos con los cuales se enriquecieron los residuos orgánicos es beneficiosa, pues hay incrementos significativos en los contenidos del calcio soluble. Si se compara únicamente con el testigo, los incrementos son del orden de 2,38% para el tratamiento T4 y de 2,69% para el tratamiento T5. Lo anteriormente expuesto es válido por cuanto una población notable de la microbiota heterótrofa produce solubilización de los fosfatos tricálcicos contenidos en las rocas hacia fosfatos monocálcicos y ácidos ortofosfóricos, con la liberación del ion calcio (Jaramillo, 2002).
Magnesio. De acuerdo con la Tabla 2, el tratamiento T4 con 0,89% de magnesio, no difirió con T5 con 0,69%, pero sí mostró diferencias significativas respecto a los tratamientos T1 (0,35%), T2 (0,40%) y T3 (0,43%).
En el tratamiento T4, el magnesio es aportado al caldo a través de la roca fosfórica y la fuente de elementos mayores y menores, además de la melaza y la leche, incrementan en 0,54% el contenido de magnesio, por lo tanto, es una fuente económica del elemento para la fertilización a los cultivos que mantienen la relación 1:4 respecto al calcio.
Acción fertilizante de los abonos orgánicos. En la Tabla 3 se observan diferencias estadísticas significativas entre tratamientos (abonos orgánicos) para el peso radical, así como diferencias altamente significativas entre subtratamientos (dosis), para longitud aérea de la planta (LA), peso aéreo (PA) y de raíces (PR), la interacción tratamientos por subtratamientos no fue significativa.
Tabla 3 Cuadrados Medios del Análisis de Varianza para longitud y peso de R. sativus sembrado con tres dosis de cinco abonos orgánicos.

ns = No existen diferencias significativas. * = Significativo a un α de 0,05. ** = Significativo a un α de 0,01. LA= Longitud parte aérea de la planta. PA= Peso parte aérea de la planta. LR= Longitud de la raíz de la planta. PR= Peso de raíces de la planta
Longitud parte aérea (LA). No se obtuvieron diferencias significativas entre tratamientos, ni la interacción fue significativa. Sin embargo, se encontraron diferencias altamente significativas entre los subtratamientos (Tabla 3).
La Prueba de Comparación de Medias (Tabla 4), indica que el subtratamiento tres (ST4) correspondiente a la aplicación de 2,0t/ha y el subtratamiento cuatro (ST4) (4,0t/ha) con 25,90 y 25,43cm de LA respectivamente, difirieren estadísticamente del subtratamiento uno (ST1) (0 t/ha) y subtratamiento dos (ST2) (1 t/ha), que permitieron una longitud de 21,80 y 23,32cm, en su orden.
Este comportamiento obedece a que los componentes de los abonos orgánicos son fundamentalmente sustancias húmicas, de las cuales se conocen sus efectos y participación en los distintos procesos fisiológicos-bioquímicos en las plantas, con intervención positiva en la respiración y velocidad de las reacciones enzimáticas del Ciclo de Krebs, lo cual propicia una mayor producción de ATP, así como también en efectos selectivos sobre la síntesis proteica y aumento de la actividad de diversas enzimas (Nardi et al., 2002)
Tabla 4 Comparación de los promedios de longitud parte aérea y radical (cm) de rábano sembrado con tres dosis de cinco abonos orgánicos.

Promedios con letras diferentes difieren significativamente, prueba Tukey (P≤ 0,05), STi= Subtratamiento i-ésimo con i=1, i=2, i=3,i=4,
Peso parte aérea de la planta. No se observaron diferencias significativas entre tratamientos, ni la interacción fue significativa (Tabla 5), sin embargo, se muestran diferencias estadísticas altamente significativas entre subtratamientos.
Tabla 5 Comparación de pesos promedios (g) de la parte aérea y radical de la planta de rábano sembrado con tres dosis de cinco abonos.

Promedios con letras diferentes difieren significativamente, prueba Tukey (P≤ 0,05). STi= Subtratamiento i-ésimo con i=1, i=2, i=3,
La prueba de comparación de medias (Tabla 5), indica que el ST3 y el ST4 con 12,29 y 11,91g de peso aéreo, respectivamente, difirieren del ST1 y el ST2, que obtuvieron una longitud de 10,51 y 11,03 cm, respectivamente.
Este comportamiento se relaciona con la actividad y población de microorganismos que contribuyen en la disponibilidad de nutrimentos para las plantas (Ávila et al., 2010).
Al respecto, Angarita (2000), demostró que al adicionar un compuesto orgánico al suelo, aumentaban el pH, el porcentaje de microorganismos y nutrimentos; de igual forma, observó una estrecha relación entre la calidad del sustrato, el peso de la parte aérea de las plantas y la población microbiana del suelo.
Peso de raíces de la planta. No se observaron diferencias significativas entre tratamientos y la interacción fue no significativa (Tabla 3), sin embargo, se muestran diferencias estadísticas altamente significativas entre subtratamientos.
La Prueba de Comparación de Medias de Tukey (Tabla 5) indica que el ST3 y el ST4, con 7,17 y 7,06g de peso de raíces, en su orden, difirieren estadísticamente del ST1 y ST2, que permitieron un peso de 5,73 y 6,25g, respectivamente. Lo anterior se relaciona con el efecto positivo de los ácidos húmicos y fúlvicos. Kononova (1967) y Stevenson (1994) señalan el efecto estimulante de los ácidos húmicos y los fulvoácidos en la formación de raíces al acelerar la diferenciación del punto de crecimiento.
CONCLUSIONES
La aplicación del caldo microbiano sobre los residuos sólidos de caña panelera permite obtener un abono orgánico de buen contenido de materia orgánica, nitrógeno, fósforo, potasio, calcio y magnesio.
Con la aplicación del abono orgánico enriquecido, se consiguió una mayor longitud de la parte aérea de R. sativus, lo cual se tradujo en mayor peso de la parte aérea y de la parte radical.














