Introducción
La falla renal aguda es una patología relativamente frecuente en los pacientes con COVID-191, y de la misma manera puede ser de trascendental importancia la detección del virus en los pacientes con insuficiencia renal crónica, pacientes en diálisis y trasplantados renales; de ahí la importancia de su identificación precoz y el abordaje diagnóstico y terapéutico adecuados.
En un estudio retrospectivo realizado en China, en los 113 pacientes que fallecieron de una cohorte de 799 pacientes, se encontró que el 25% de aquellos presentó como complicación de infección por COVID-19 falla renal aguda (AKI)2; en otra cohorte con 109 pacientes fallecidos, el 18% de los pacientes también la desarrollaron como complicación3. Yang et al.4 estudiaron 710 pacientes con COVID-19, de los cuales 52 eran pacientes críticamente enfermos; de estos, el 23% desarrollaron falla renal aguda.
Huang et al.5 documentaron que el 4% de los pacientes infectados por COVID-19 desarrolló falla renal aguda; el diagnóstico se hizo clasificando según el nivel más elevado de creatinina sérica o gasto urinario; para esto se utilizó la clasificación KDIGO. Por otro lado, en un estudio con 109 pacientes positivos para COVID-19, el 18,3% desarrolló falla renal aguda3. Cheng et al.6, en una cohorte de 701 pacientes con COVID-19, encontraron que el 5,1% desarrolló falla renal aguda; la incidencia de falla renal aguda fue significativamente mayor en pacientes con creatinina sérica de base elevada (11,9%) frente a pacientes con valores de base normales (4%).
Todos los estudios previos establecen la existencia de relación directa entre la falla renal aguda y el peor pronóstico de los pacientes, además de que encuentran que la enfermedad renal al ingreso representa un mayor riesgo de deterioro y, por lo mismo, es un indicador para valorar supervivencia y pronóstico6,7.
En un análisis realizado por la Sociedad Coreana de Enfermedades Infecciosas se reunió información sobre 54 pacientes fallecidos por COVID-19; 5 de ellos (9,3%) eran pacientes con enfermedad renal crónica8. En otro estudio, de un total de 138 pacientes con COVID-19, quienes se caracterizaron clínicamente, 2,9% tenían enfermedad renal crónica9; cifra importante si se tiene en cuenta que los pacientes en diálisis presentan características de ser en su mayoría añosos y tener comorbilidades como diabetes, falla cardíaca, enfermedad vascular periférica, entre otras10; además de su mayor riesgo de desarrollar infección pulmonar y neumonía grave por COVID-19 en comparación con la población general.
Recientemente el Centro para el Control y la Prevención de Enfermedades (CDC) de China publicó un artículo de 44.672 casos de infección por COVID-19 donde determinan los factores de riesgo para mortalidad: edad mayor a 60 años (26,4%), enfermedades cardiovasculares (10,5%), diabetes mellitus (7,3%), hipertensión arterial (6%) y enfermedades pulmonares crónicas (6,3%). Entre las más frecuentes de nuestros pacientes, se encuentra la enfermedad renal crónica; sin embargo, los reportes de China sugieren un curso menos agresivo en los pacientes en diálisis comparados con los pacientes trasplantados y en relación con la población general a pesar del estado de inmunosupresión propio de la enfermedad renal y sus comorbilidades5.
Metodología
Se realizó una revisión narrativa, la cual buscó estudios que describieran diversos aspectos clínicos y paraclínicos de pacientes con enfermedad renal aguda y crónica con infección por COVID-19; se tuvo en cuenta que refirieran algún método o evaluación encaminado al abordaje general y específico de complicaciones en el contexto de la enfermedad renal. El resultado principal fue recolectar toda la información disponible acerca del diagnóstico, el manejo terapéutico en diferentes contextos y el uso de la terapia renal en pacientes con enfermedad renal crónica en el contexto de la infección por COVID-19. Se incluyeron todos los documentos que cumplieran con las características descritas.
Fueron utilizadas bases de datos como Medline (PubMed), Embase y Google Scholar. La búsqueda se realizó entre el 1 y el 14 de abril del 2020. Se utilizaron las siguientes fórmulas de búsqueda: (COVID 19 OR CORONAVIRUS) AND (RENAL PATIENT) AND (KIDNEY) (COMPLICATION OR CLINICAL COURSE OR RISK FACTORS OR PREVENTION OR MONITORING) AND (DIALYSIS OR RENAL REPLACEMENT THERAPY) AND (ECMO) AND (SEPSIS OR SEPTIC SHOCK) AND (ACUTE KIDNEY INJURYI) AND (CHRONIC KIDNEY DISEASE) AND(HYDROXYCHLOROQUINE) AND (CHLOROQUINE) AND (REMDESIVIR) AND (IVERMECTINA), [(COVID 19 OR CORONAVIRUS) AND (RENAL PATIENT) AND (REM-DESIVIR DOSE) AND (ANTIBIOTICS AND ANTIFUNGAL) AND (GLUCOCORTICOID OR CORTICOIDS AND TOCILIZUMAB). Adicionalmente se revisaron documentos expedidos por la Organización Mundial de la Salud y el Centro para el Control y la Prevención de Enfermedades de los Estados Unidos; no se utilizaron filtros en la búsqueda.
Selección de estudios: Los registros reportados por las bases de datos fueron revisados por los autores. En primera medida se obtuvo el resumen de los manuscritos, los resultados fueron revisados y posteriormente, se realizó la búsqueda de los artículos in extenso evaluando el cumplimiento de los criterios descritos anteriormente para de la revisión de la literatura.
Resultados
De la búsqueda se obtuvo un total de 126 referencias seleccionadas para la construcción del contenido temático.
Fisiopatología
A medida que la infección por COVID-19 progresa se desarrollan complicaciones, de preponderancia en paciente s críticamente enfermos con manejo en Unidad de Cuidados Intensivos; aquellas incluyen shock, sepsis, lesión cardíaca aguda, falla renal aguda e incluso disfunción multiorgánica2,9,11. El mal pronóstico y las complicaciones por COVID-19 se relacionan con pacientes adultos mayores o con comorbilidades (50-70% de los casos fatales)12.
El desarrollo de falla renal aguda en pacientes con COVID-19 se ha asociado a la inflamación inducida por la enfermedad o la presencia de SARS-CoV-2, o bien puede tratarse de efectos sinérgicos que producen daño en los riñones13.
Es importante resaltar que la falla renal aguda se ha relacionado estrechamente con aumento de la mortalidad y en general se reporta en pacientes críticamente enfermos4,6.
Una posible explicación que se postuló por Cheng et al.6 frente a la alta prevalencia de falla renal aguda en pacientes con COVID-19 es que una porción de los pacientes tienen historia de enfermedad renal crónica; estos pacientes permanecen en un estado proinflamatorio con defectos funcionales en la respuesta inmunitaria innata y de respuesta adaptativa por inmunidad celular, que a su vez los pone en riesgo constante de desarrollar infección del tracto respiratorio superior y neumonía. Sin embargo, se hace énfasis en que el ingreso hospitalario temprano podría prevenir el desarrollo de complicaciones y empeoramiento clínico que llevan a desenlaces fatales para los pacientes.
La etiología de falla renal aguda en el contexto de infección por COVID - 19 parece ser multifactorial y se explica de la siguiente forma:
La infección por COVID-19 puede facilitar respuestas citopatológicas directas del tejido renal
La presencia de COVID-19 genera daño celular directo al invadir las células tubulares renales y el intersticio glomerular14,15. Esto se sustenta en la detección de fragmentos de coronavirus en sangre urinaria por medio de PCR en el caso de SARS16,17.
Varios estudios han reportado que el COVID-19 usa la misma enzima convertidora de angiotensina 2 unida a la membrana (ECA2) que el SARS-CoV para obtener acceso a las células18. La proteína del pico (S) del S ARS -CoV-2 s e une a la enzima convertidora de angiotensina 2 (ECA2), un receptor de la célula huésped, y la proteína S se activa y escinde por las serina proteasas transmembrana celulares (TMPRSS), lo que permite que el virus libere péptidos de fusión para unirse a la membrana y finalmente entrar a la célula7,19. Los receptores para la enzima convertidora de angiotensina 2 son mucho más abundantes en el tejido de órganos urinario s que e n los órganos respiratorios6; el coronavirus entra a las células renales por la vía dependiente de la ECA2.
La elevada proporción de ECA2 presente en el tejido renal conlleva alto riesgo de infección y daño por COVID-19 debido a las altas concentraciones de la enzima14,20; así, Wang et al. postulan que teniendo en cuenta la ubicación de los receptores ECA2 en todo el cuerpo, es de esperarse que el COVID-19 pueda invadir el pulmón, el tracto respiratorio superior, el íleon, el corazón y los riñones, lo cual puede provocar disnea, diarrea, daño cardíaco agudo y falla renal aguda, especialmente por la viremia21.
Pan et al.7 realizaron secuenciamiento de ARN para identificar el tipo de células renales que eran huéspedes del virus, identificando claramente a los podocitos y a las células del túbulo recto proximal como células huésped del virus en el riñón. Los podocitos y las células del túbulo recto proximal desempeñan funcione s críticas en la filtración, reabsorción y excreción de orina7. Los podocitos en particular son vulnerables a agentes infecciosos, y su daño induce con facilidad proteinuria severa22. Por lo anterior concluyen que los efectos citopatológicos del COVID-19 en los podocitos y células del túbulo recto proximal pueden causar falla renal aguda en el contexto de infección por COVID-197.
El depósito de complejos inmunes compuestos por antígeno viral o depósito de linfocitos T específicos o anticuerpos puede dañar directamente el tejido renal. Sin embargo no ha sido demostrado y los estudios en SARS-CoV-2 fueron negativos6.
Tormenta de citoquinas y mediadores inflamatorios inducidos por el virus SARS-CoV-2 pueden generar efectos indirectos en el tejido renal como hipoxia, shock y rabdomiólisis6; estos tres mecanismos estarían relacionados con la muerte de los pacientes con COVID-199,20. Se demostró en 2009 que pacientes con infección por el virus H1N1 tenían niveles elevados de creatinina quinasa (CK)23. Wang et al.9 caracterizaron 138 pacientes con COVID-19, encontrando también niveles elevados de CK.
Relacionado a la respuesta inmune, se ha postulado que la sepsis produce síndrome de tormenta de citoquinas16 y, en consecuencia, necrosis tubular aguda y disfunción multiorgánica14,19. En un estudio realizado en pacientes fallecidos por SARS-CoV se encontró en el tejido renal presencia de necrosis tubular desde mínima a severa; sin embargo, la causa de muerte en los 7 casos fue daño alveolar difuso24.
Se ha postulado la intervención de algunos mediadores inflamatorios como IL-2, IL-7, IL-10, factor estimulante de colonias de granulocitos, proteína inducible por interferón 10 y altas concentraciones de monocitos en pacientes graves19.
Infecciones sobrepuestas ocurren frecuentemente durante las hospitalizaciones en unidades de cuidado intensivo; al metabolizars e en sangre los lipopolisacáridos de la membrana de las bacterias Gram-negativas, se convierten en endotoxinas generando choque como se demostró en la cohorte de China, donde 6,4% de 1099 pacientes con COVID-19 grave cursaron con choque séptico que contribuyó al desarrollo de falla renal en la sepsis7,25.
Presencia de COVID-19 en sangre se considera un proceso clave que lleva a falla renal aguda8.
Deshidratación debido a fiebre o menor ingesta de líquidos en personas mayores tiene múltiples consecuencias a nivel renal. Sumado a ello, los pacientes con COVID-19 con anorexia, a menudo acompañados de diarrea y diaforesis, fácilmente llegan a estados de hipovolemia e hipoperfusión renal19. La deshidratación actúa directamente en la reducción de la filtración glomerular; si no es severa, puede corregirse hidratando al paciente; de ser severa, puede generar isquemia, shock y finalmente necrosis tubular aguda que lleva a falla renal14.
Otros factores a tener en cuenta, en pacientes muy graves y críticamente enfermos, es la mayor susceptibilidad a desarrollar shock séptico que puede agravar la insuficiencia respiratoria y el estado inflamatorio19.
Y finalmente, la alteración de la estrecha relación corazón-riñón puede contribuir a la insuficiencia renal aguda como consecuencia de la presentación de miocarditis viral aguda por COVID-19; inicialmente se produce hipotensión con disminución del flujo plasmático renal efectivo, que produce efectos en la reducción de la tasa de filtración glomerular25.
Factores de riesgo, prevención y seguimiento de la función renal en pacientes con infección por SARS-CoV-2 (COVID-19)
Los factores de alto riego para desarrollar AKI en infección por COVID-19 marcan señales de alarma que sugieren especial atención en la volemia (mantener euvolemia) para asegurar una perfusión renal efectiva y excluir del plan de manejo cualquier medicamento nefrotóxico1; incluyen factores generales para el desarrollo de AKI en la población no infectada; algunos descritos1,14,26 incluyen:
Adulto mayor
Deshidratación o menor ingesta de líquidos
Hipertensión arterial
Enfermedad coronaria
Enfermedad renal crónica
Enfermedad cerebrovascular
Enfermedades crónicas del sistema respiratorio
Enfermedades crónicas del sistema gastrointestinal
Hipovolemia
Shock
Medicación con nefrotóxicos
Para la identificación temprana se recomienda la toma diaria de creatinina sérica y el seguimiento continuo del gasto urinario y otros parámetros de la función renal como hematuria, proteinuria, tasa de filtrado glomerular, nitrógeno ureico en sangre, dímero D e incluso tomografía computarizada (TC), según consideraciones del médico tratante1,26. El estudio de cohorte prospectivo de Cheng et al.27 con 701 pacientes con COVID-19 reportó que BUN y creatinina sérica estaban elevados en el 14,4% y 13,1% de los pacientes, respectivamente, y el 13,1% de ellos presentaba tasa de filtrado glomerular menor de 60 ml/min/1,73 m2; además de que el PTT prolongado y el dímero D anormal fueron más comunes en pacientes con creatinina sérica elevada.
En el estudio multicéntrico de Ming et al.26 que incluyó 193 pacientes con COVID-19, se encontraron anormalidades en TC renal indicativas de inflamación y edema del parénquima renal; además se concluyó que los pacientes con COVID-19 que desarrollaron AKI tenían un riesgo de mortalidad de aproximadamente 5,3 veces mayor que aquellos sin AKI, más alto que el de enfermedades crónicas comórbidas (1,5 veces). Hay hallazgos que indican que los marcadores séricos de función renal elevados se asocian a mayor mortalidad, así como el hecho de tener diagnóstico de AKI y de ser mayor de 65 años, ser de sexo masculino y tener enfermedad grave por COVID-1926-28.
Diagnóstico
Se basa principalmente en manifestaciones clínicas, antecedentes epidemiológicos y pruebas de laboratorio indicativas de AKI (creatinina sérica aumenta 1,5 veces dentro de 7 días y/o producción de orina menor de 0,5 ml/kg/h por más de 6 h) según las indicaciones KDIGO (Kidney Disease: Improving Global Outcomes); debe ir acompañado de la detección por PCR fluorescente en tiempo real de los genes virales positivos para el ácido nucleico de SARS-CoV-2 (COVID-19)29.
Es de anotar que en un estudio que involucró 701 pacientes, al ingreso, el 43,9% de ellos presentó proteinuria y el 26,7% tenía algún grado de hematuria, mientras que la prevalencia de creatinina aumentada fue de solo el 14,4%, nitrógeno ureico elevado 13,3% y filtración glomerular estimada de menos de 60 ml/min de solo el 13,1%. Se demuestra así que se requiere toma de uroanálisis con regularidad en los pacientes con diagnóstico de infección por COVID-19 para determinar injuria renal y se debe enfatizar en pacientes con síntomas respiratorios leves y alteraciones en la función renal una vez entren a la estancia hospitalaria, pues esta se asocia con mayor tasa de mortalidad27.
Cao et al.30 informaron que las anomalías de laboratorio más comunes fueron la disminución de los linfocitos totales, el tiempo prolongado de protrombina y los niveles elevados de lactato deshidrogenasa en la neumonía por COVID-19. Debido a que los pacientes de hemodiálisis tienen trastornos de la función de linfocitos y neutrófilos, pueden tener presentaciones atípicas; la linfopenia es común en pacientes con infección por COVID-19 y podría ser un factor crítico asociado con la gravedad y mortalidad de la enfermedad en pacientes generales; sin embargo, dado que los recuentos bajos de linfocitos en pacientes de hemodiálisis son crónicos, la linfopenia probablemente no sea útil para identificar individuos con infección por el virus del SARS-CoV-231. La procalcitonina tiene limitaciones similares, con niveles crónicamente elevados en pacientes en hemodiálisis incluso en ausencia de enfermedad aguda grave32. Dadas estas limitaciones y la alta prevalencia de afecciones comórbidas, el diagnóstico de neumonía por COVID-19 en pacientes en hemodiálisis depende de la epidemiología clínica, los hallazgos radiográficos y las pruebas de ácido nucleico viral5.
Otras manifestaciones clínicas en estudio
-
Neurológicas: Respecto a las manifestaciones neurológicas presentadas en pacientes con COVID-19 la información aún es escasa y de baja calidad; los estudios han encontrado en ellos la presentación de alteraciones neurológicas inespecíficas como cefalea, vértigo o confusión, así como manifestaciones específicas de tipo convulsiones clínicas o subclínicas, estatus epiléptico o problemas cerebrovasculares como consecuencia de estados secundarios al COVID-19 como hipoxia, falla orgánica, y alteraciones metabólicas y electrolíticas33.
En pacientes enfermos críticamente y que presente alteraciones del estado mental es necesario descartarse estado epiléptico no convulsivo, utilizando monitoreo continuo mediante EEG en conjunto con los criterios del consenso de Salzburgo para el diagnóstico33. Existe alta sospecha de que COVID-19 tenga neurotropismo y pueda ser un factor de riesgo importante para el futuro desarrollo de trastornos neurodegenerativos por la respuesta inflamatoria provocada.34 El COVID-19 podría causar afectaciones neurológicas de primera mano, empeorar las afectaciones preexistentes y/o aumentar el riego de lesión al sistema nervioso.34 Es indispensable realizar más y mejores estudios para comprobar el papel del virus en los pacientes neurológicos.
Cardíacas: El SARS-CoV-2 puede facilitar el desarrollo de complicaciones cardiovasculares y se ha relacionado principalmente con enfermedad coronaria aguda e infarto agudo de miocardio3,35. En un estudio de 121 pacientes con diagnóstico de SARS, 12 de ellos tuvieron complicaciones cardiovasculares; entre las más frecuentes estaban: taquicardia (72%), hipotensión (50%), bradicardia (15%)11, cardiomegalia transitoria (11%) y fibrilación auricular paroxística en un paciente36.
La participación de ECA2 en el ingreso del virus a la célula juega un papel importante en los efectos sistémicos de la infección viral37; este receptor del huésped se expresa en múltiples tejidos, incluyendo pulmón, corazón y riñón38; ECA2 se encarga de la degradación de la angiotensina 2 (que está involucrada en la vasoconstricción sistémica, la inflamación, el estrés oxidativo y la fibrosis) a angiotensina - (Ang- 1-7)39, la cual tiene efectos contrarios (vasodilatación, antiinflamatorio, liberación de óxido nítrico, antifibrótico) al unirse al receptor MAS39,40. Se teoriza que la disrupción del sistema renina-angiotensina por la pérdida de ECA2, acompañado del daño tisular en los pulmones y los efectos proinflamatorios severos, es la causa del daño severo de tejido cardiaco que conduce a miocarditis, arritmias y síndrome coronario agudo37; adicionalmente, en el riñón ECA2 se expresa en epitelio apical del túbulo proximal en mayor intensidad y en los podocitos en menor intensidad41; la pérdida de ECA2 se relaciona con una alteración del transporte de sodio que, acompañado con los efectos sistémicos ya mencionados, puede incidir en alteraciones en el volumen y en la presión arterial pudiendo exacerbar la hipertensión arterial38,39.
Entre los factores de riesgo para desarrollar enfermedad grave o severa por COVID-19 están la enfermedad cardiovascular y la hipertensión11. En un estudio retrospectivo de 113 pacientes fallecidos por COVID-19 en Wuhan se encontró que la hipertensión crónica y otras comorbilidades cardiovasculares eran más frecuentes en el grupo de pacientes fallecidos; este grupo de pacientes era más propenso a desarrollar complicaciones cardíacas, principalmente enfermedad coronaria aguda y falla cardíaca2. En un análisis de 54 casos de mortalidad por COVID-19 la comorbilidad de base más frecuente es la hipertensión y enfermedades cardíacas, seguidas de diabetes y enfermedad neurológica8. El diagnóstico de daño cardíaco se hizo con base en la elevación de troponina I por encima del percentil 99 o con la existencia de anormalidades en ecocardiograma o electrocardiograma5. En casos de fatalidad por COVID-19 en su mayoría ocurren por SDRA, AKI o enfermedad coronaria aguda3,42.
Teniendo en cuenta lo anterior, es importante reconocer la enfermedad cardiovascular a la hora de abordar pacientes con enfermedad renal, ya que se ha demostrado también que la enfermedad renal concomitante o AKI en pacientes con COVID-19 es un factor de mal pronóstico importante7,11, además de la relación entre corazón y riñón ligada al receptor ECA2. Sin embargo, este tema se sale de los objetivos de la presente revisión y se recomienda hacer un estudio completo en otro documento.
Manejo farmacológico
Las medidas terapéuticas en el manejo de esta entidad pueden tener impacto en la función del riñón normal y en el contexto de un paciente con lesión renal aguda y/o crónica, por lo que se deberán considerar ciertos aspectos para formular alguno de los tratamientos posibles. Indicadores como la tasa de filtración glomerular (TFG), el estadio de la enfermedad renal crónica y la necesidad de terapia dialítica son necesarios para la prescripción farmacológica en pacientes con enfermedad renal e infección por COVID-1920,43.
Es necesario recordar que el arsenal terapéutico en el manejo de los pacientes con COVID-19 debe hacerse teniendo en cuenta las dos fases de la evolución de la enfermedad: la fase 1 está relacionada con la replicación viral y su efecto citopático, en donde se recomiendan los medicamentos antivirales; y la fase 2, dada después de los siete días que aparece el compromiso pulmonar progresivo y la necesidad ascendente de suplencia de oxígeno con posible evolución a requerimiento de ventilación mecánica, se relaciona con el síndrome hiperinflamatorio y gran liberación de citoquinas con alto riesgo de muerte; en esta etapa pueden ser útiles los medicamentos inmunosupresores e inmunomoduladores44. Entre el arsenal terapéutico se encuentran:
Cloroquina e hidroxicloroquina: Son fármacos derivados de aminoquinolonas, usualmente con un amplio espectro de indicaciones (antimaláricos, DMARD, inmunosupresión); estos medicamentos han mostrado evidencia de actividad contra SARS-CoV-245, por lo cual son uno de los primeros medicamentos autorizados para usar en pacientes con infección por COVID-1946. Se preconizan varios mecanismos de acción, entre ellos la inhibición de una etapa previa al ingreso del ciclo viral al interferir con las partículas virales que se unen a su receptor celular de la superficie celular45,47. Se demostró que la cloroquina inhibe la quinona reductasa 2, una vecina estructural de UDP-N-acetilglucosamina 2-epimerasas57, involucradas en la biosíntesis de los ácidos siálicos, disminuyendo la posibilidad de infección por virus como el coronavirus humano HCoV-O43 y los ortomixovirus, los cuales usan restos de ácido siálico como receptores47. In vitro los efectos antivirales antiSARS-CoV-1 de la cloroquina se consideran atribuibles a un déficit en la glucosilación de un receptor de la superficie celular del virus, la enzima convertidora de angiotensina 2 (ACE2) en las células Vera48; adicionalmente, mediante la alcalinización, la cloroquina puede dañar otras fases de la replicación impidiendo la endocitosis y/o la elevación rápida del pH endosómico con la finalidad de anular la fusión virus-endosoma47,49.
No hay dosis definidas en paciente renal. En un estudio sobre los efectos adversos de la cloroquina recomiendan que debido a que en insuficiencia renal reduce la tasa de aclaramiento y aumenta la biodisponibilidad, si la tasa de filtración glomerular es menor de 10 ml/min, se debe usar la mitad de la dosis recomendada50; la dosis usual en adulto sin enfermedad renal es de 500 mg cada 12 horas (300 mg base cada 12 horas)51.
En cuanto a la hidroxicloroquina, esta no es un fármaco dializable y la etiqueta del fabricante no refiere la necesidad de una ajuste renal; sin embargo, se recomienda actuar con precaución en el contexto de enfermedad renal, ya que puede ser necesaria la reducción de la dosis52. Algunos autores proponen dosis de 150 mg/día si TFG se encuentra entre 30 y 50 ml/min y dosis entre 50 y 100 mg/día, usando con precaución si TFG < 3053; otros proponen aumentar el intervalo de las dosis54. La dosis actual de hidroxicloroquina para adulto en manejo de COVID-19 es una carga de 400 mg cada 12 horas, continuando con 200 mg cada 12 horas por 5 días (contando el primer día de la dosis de carga)51. Se debe tener precaución con los efecto s adverso s que incluye n retinopatía, insuficiencia hepática y miopatías50,52.
Lopinavir/ritonavir: Es un fármaco inhibidor de proteasas usado como tratamiento en pacientes con VIH; en el caso de los pacientes con infección de COVID-19 generalmente se usa en combinación con otras opciones terapéuticas para el manejo de la infección grave51. La eliminación renal de este medicamento se considera insignificante, por lo cual no se considera un ajuste del tratamiento en pacientes renales29; adicional a esto, lopinavir/ritonavir no es eliminado durante la hemodiálisis55. Las guías actuales sugieren su uso en combinación con otros fármacos; se requiere de mayor investigación y estudios fuertes metodológicamente para clarificar su eficacia.
Se realizó un estudio aleatorizado con 199 pacientes hospitalizados, con enfermedad grave, en quienes se administró lopinavir/ritonavir, en los cuales no se pudo hallar beneficio significativo en cuanto a la progresión de la mejoría clínica56; sin embargo, se encontró que una mayor proporción de pacientes tratados con lopinovir/ritonavir experimentaron mejoría clínica al día 14 (45,5%) comparados con el 30% en el grupo control. Concluyendo, los autores proponen que este hallazgo justificaría la utilización de esta terapia antiviral en el subgrupo de pacientes de alto riesgo56.
En un estudio retrospectivo con 94 pacientes se encontró una mejoría paraclínica usando combinaciones de lopinavir/ritonavir con ?-interferón y/o ribavirina57; adicionalmente, se documentó en un paciente tratado con lopinavir/ritonavir una negativizació n y reducción en la carga viral del SARS-CoV-2 al día siguiente de la prescripción del medicamento58. No se ha determinado una dosis en pacientes renales; la dosis en adultos es de 400/ 100mg cada 12 horas por 7 a 14 días51.
Darunavir/ritonavir y darunavir/cobicistat: Son posibles alternativas al lopinavir/ritonavir, teniendo en cuenta su mecanismo de acción similar56.
Remdesivir: Es un farmaco análogo de nucleósidos usado generalmente como anti viral; ha mostrado respuesta in vitro contra SARS-Cov-259; adicionalmente ha tenido una buena respuesta en modelos animales60. Se ha documentado un caso de un paciente con enfermedad severa por COVID-19 que posterior a la aplicación del remdesivir presentó mejoría clínica61.
Actualmente se están realizando ensayos clínicos para estudiar sus características farmacológicas, por lo que aún no se dispone del efecto del medicamento a nivel renal62-66. La Agencia de Medicina Europea aprobó el medicamento para uso compasivo (permite el uso de un medicamento no autorizado); los criterios de exclusión para la aplicación del medicamento incluyen una TFG < 30 ml/min y estar en diálisis o en hemofiltración veno-venosa66. La dosis estudiada para adultos es de una carga inicial de 200 mg IV el primer día y continuar con 100 mg cada día por 2 a 9 días más62-66.
En abril de 2019 se publica por Grein y cols.67 el artículo de uso compasivo de remdesivir (dosis de carga de 200 mg vía endovenosa seguida de dosis diaria de 100 mg durante los siguientes 9 días) en pacientes con saturación de oxígeno del 94% o menos, depuración de creatinina mayor de 30ml/min y transaminasas con valor menor a cinco veces el valor de referencia. Fueron analizados 53 pacientes, encontrando que el 68% tuvo mejoría clínica y el 15% empeoró; tras el seguimiento a 28 días se vio incidencia acumulada de mejoría en el 84% de pacientes además de menor frecuencia de ventilación mecánica y una mortalidad del 13% (en comparación con 22% que fue el promedio registrado en Wuhan).
Ivermectina: Antiparasitario de amplio espectro, en un estudio australiano reciente se mostró que la ivermectina puede efectivamente bloquear el crecimiento de SARS-CoV-2 en un cultivo de células dentro de las 48 horas posteriores a la administración de una sola dosis; se logra así una reducción del 93% de viriones en el sobrenadante y un 99,8% de disminución de ARN viral asociado a las células con el tratamiento con ivermectina. Lo anterior indicó que el tratamiento con este medicamento resultó en la pérdida de todo el material viral en 48 horas; si se administra a los pacientes en una etapa temprana de la infección, podría ayudar a limitar la carga viral, prevenir la progresión grave de la enfermedad y limitar la transmisión de persona a persona68. Es de notar que el anterior estudio solo mostró la efectividad de la ivermectina in vitro contra el SARS-CoV-2, no in vivo; por lo tanto, son necesarios más estudios para investigar la efectividad en humanos al igual que su toxicidad.
El mecanismo exacto de cómo puede tener su efecto antiviral no es conocido complemente, pero se sabe que en otros virus inhibe la importación nuclear de proteínas virales y del huésped68. Caly et al. hacen la recomendación de que la ivermectina «merece una investigación más a fondo por sus posibles beneficios en los seres humanos»; el documento ha suscitado un amplio interés en los sitios web médicos y veterinarios, que a menudo describen incorrectamente el medicamento como un tratamiento o cura para el COVID-1968; tales declaraciones inapropiadas han dado lugar a una advertencia de la FDA de los Estados Unidos en cuanto a que la ivermectina en los productos veterinarios no debe utilizarse para la terapia humana69.
La promesa in vitro conduce al fracaso clínico en la gran mayoría de los casos, y en el entorno volátil de la pandemia actual, es fundamental que seamos sensibles a las implicaciones de nuestra comunicación y apliquemos nuestros recursos a los compuestos con más probabilidades de éxito70.
Plasma convaleciente: El plasma convaleciente ha sido utilizado para proporcionar inmunidad inmediata y mejorar la supervivencia de pacientes con síndrome de dificultad respiratoria aguda de etiología viral71, dado que los anticuerpos antivirales del tipo inmunoglobulinas que se encuentran en el plasma convaleciente de pacientes recuperados pueden tratar eficazmente a pacientes con infecciones virales72.
Los anticuerpos presentan efectos terapéuticos a través de varios mecanismos; los anticuerpos pueden unirse a un patógeno en específico neutralizando su efectividad directamente, mientras que otras vías mediadas por anticuerpos como la activación del complemento, dependiente de citotoxicidad celular y fagocitosis, también pueden contribuir a su efecto terapéutico73. Por otro lado, se ha postulado que e l plasma convaleciente puede suprimir la viremia11.
El plasma convaleciente ha sido utilizado en SARS-1 y MERS73. Teniendo en cuenta las similitudes entre SARS, MERS y COVID-19, el plasma convaleciente podría tener potencial inmunoterapéutico en el tratamiento de infección por COVID-1911. En una serie de cinco casos estudiados por Shen y cols.74 la administración de plasma convaleciente con anticuerpos neutralizantes resultó en mejoría clínica; después del tratamiento , los valores de los biomarcado re s inflamatorios PCR, procalcitonina e IL-6 de los pacientes 1, 2, 4 y 5 disminuyeron; los valores de PCR y procalcitonina del paciente 3 disminuyeron74.
Los principales efectos esperados con la administración de plasma convaleciente son mejoría clínica, reducción de las lesiones pulmonares en TAC, mejora en laboratorios (linfocitopenia, PCR, función hepática), aumento de SO2 y aumento de títulos de anticuerpos con eliminación del ARN de SARS-CoV-275. La terapia con plasma de pacientes convalecientes en pacientes graves por COVID-19 durante el curso temprano de la enfermedad puede dar algunos beneficios clínicos, incluida una reducción de la carga viral en plasma de aproximadamente 100.000 copias/ml hasta niveles indetectables 24 horas después de la transfusión de plasma; por lo tanto, es probable que sea una opción prometedora para el tratamiento y la prevención de la infección por SARS-CoV-2, aunque esto no se ha probado72,73.
La transfusión de plasma puede causar efectos adversos, por lo que el uso de plasma convaleciente se indica como último recurso para mejorar la tasa de supervivencia de pacientes graves con COVID-19. La dosis y el momento de tratamiento, así como las indicaciones terapéuticas, siguen siendo inciertas11.
Esta terapia con plasma puede ser más eficaz si se administra a los pacientes con COVID-19 de forma temprana para eliminar el virus antes de que cause daños graves en sus pulmones; sin embargo, existe una pequeña posibilidad de riesgo al utilizar dicho tratamiento, ya que puede contagiar de algún patógeno de transmisión sanguínea como el virus de la inmunodeficiencia humana, la hepatitis B (VHB) o la hepatitis C76,77.
Antibióticos y antifúngicos: Un estudio pequeño realizado en pacientes infectados con COVID-19 tratados con azitromicina y/o hidroxicloroquina demostró que la combinación de los fármacos se asoció con una mayor probabilidad de negativizar la RT-PCR desde el tercer día de tratamiento en comparación con los controles que recibieron hidroxicloroquina sola78.
Actualmente en pacientes renales con infección por COVID 19 no hay información acerca de dosis de antibióticos y antifúngicos, por el momento se debería seguir los ajustes renales usuales de los mismos encontrados en la Tabla 1 79 y la Tabla 2.
Tabla 1 Ajustes de dosis de Antibióticos por Tasa de Filtración Glomerular, tabla modificada de Guía de Práctica Clínica para el diagnóstico y tratamiento de la Enfermedad Renal Crónica 201679
| Ajustes de dosis de antibióticos según tasa de filtración glomerular34,47 | |
|---|---|
| Grupos de antibióticos | Ajuste a dosis |
| Penicilina | En TFG <15ml/min/1,73m2 presenta:
|
| Aminoglucósidos | Si TFG <60ml/min/1,73m2 reducir la dosis y/o incrementar progresivamente.
|
| Macrólidos | Ajuste de Eritromicina: CrCl < 10 ml/min administrar 50 - 75% de la dosis Se debe garantizar la dosis pos diálisis Ajuste Azitromicina: se ha mostrado un aumento del 33% en la exposicion sistemica de este medicamento cuando TFG < 10 mL/min. Ajuste Claritromicina: Si TFG < 30 mL/min reducir dosis Oral o IV (250 - 500 mg) a TFG < 10 mL/min se presenta vomito a altas dosis de claritromicina. |
| Fluoroquinolonas | En TFG <15ml/min/1,73m2 la dosis deberá reducirse en un 50% Uso a largo plazo en pacientes con enfermedad renal puede generar nauseas |
| Tetraciclinas | Reducir dosis si TFG <45ml/min/1,73m2 (En lesión renal puede generar nefrotoxicidad e incrementar azoemia, hiperfosfatasemia y acidosis) |
Tabla 2 Ajustes de dosis de Antifungicos por Tasa de Filtración Glomerular.
| Ajustes de dosis de antifúngicos según tasa de filtración glomerular34,47 | |
|---|---|
| Antifúngicos | Ajuste a dosis |
| Anfotericina B | Si existe otra alternativa cambiar antifúngico si TFG <60ml/min/1,73m2*.
|
| Fluconazol |
|
| Flucitocina | Si TFG <60ml/min/1,73m2 reducir la dosis de flucitocina* |
* Recomendaciones de Guía de Práctica Clínica Colombiana para el diagnóstico y tratamiento de la Enfermedad Renal Crónica 2016.
Glucocorticoides: Actualmente el uso de corticoides no se recomienda, ya que puede retrasar la eliminación del virus aumentando la duración de la viremia16,80. No hay suficiente evidencia a favor de su uso rutinario. Experiencias previas de su uso con el virus MERS-CoV demostraron mayor probabilidad de efectos adversos (usos de ventilación mecánica, vasopresor, terapia de reemplazo renal)81. Se han reportado ciclos cortos de metilprednisolona para prevenir SDRA en pacientes en China con COVID-1929; sin embargo, faltan estudios para clarificar su función en esta infección, por lo tanto, salvo otras indicaciones, su uso rutinario está contraindicado.
Tocilizumab: El rol de la IL-6 en combinación con otras citocinas proinflamatorias parece tener un papel prominente en el desarrollo del síndrome de liberación de citosinas, para lo cual se ha utilizado el tocilizumab (TCZ), un anticuerpo monoclonal humano IL-6 recombinante que se une a los receptores específicos de IL-6 solubles en la membrana celular bloqueando de esta manera la señalización y, por lo tanto, su respuesta inflamatoria mediada82. Recientemente, Wei Haiming, et al. llevaron a cabo un estudio retrospectivo de intervención en 20 paciente s con COVID-19 para evaluar la eficacia del tocilizumab en pacientes con manifestaciones severas, donde demuestran que a los pocos días desaparece la fiebre, los demás síntomas mejoran drásticamente y el 75% de los pacientes mejoran sus parámetros d e o xi g e nación; ad e más , las opacidades tomográficas revierten en el 90,5% de los sujetos y el porcentaje de linfocitos retorna a valor normal en el 52,6%; todo esto sugiere que el TCZ, administrado a dosis de 400 mg/día83,84, puede ser efectivo en pacientes con COVID-19 severo.
Indicaciones de terapia de reemplazo renal (TRR) en pacientes con COVID-19
La proporción de terapia de reemplazo renal continua (TRRC) en pacientes con COVID-19 se encuentra entre 1,5% y 9,0%, haciendo parte del manejo de los pacientes graves y críticos que están en UCI. Dicha terapia ha mostrado reducir la tasa de mortalidad1,85. De hecho, la TRR se encuentra indicada en pacientes con síndrome de respuesta inflamatoria sistémica, síndrome de disfunción multiorgánica, síndrome de tormenta de citoquinas y pacientes con AKI que cumplen con KDIGO grado 2 o superior1,29,86,87, además de sepsis con compromiso renal, hipervolemia y alteración ácido base.
En cuanto al paciente que presenta neumonía atípica por COVID-19, síndrome respiratorio agudo severo y síndrome de dificultad respiratoria severa85, se recomienda seguir las pautas de terapia de reemplazo renal continua (TRRC) y las indicaciones específicas de anticoagulación, documentadas en la Tabla 3 85.
Tabla 3 TRRC en paciente con neumonía por COVID-19. Información tomada de: El Centro Nacional de Control y Control de Calidad Médica Profesional para Enfermedades Renales, la Asociación de Promoción Médica de China, la División de Tecnología de Ingeniería y Tratamiento de Purificación de Sangre85.
Modalidad de elección para TRR en pacientes candidatos con COVID-19
La modalidad de terapia de reemplazo renal tiene que estar primero supeditada a la disponibilidad del recurso local más que a una norma. Teniendo en cuenta que el síndrome de liberación de cito-quinas puede jugar un papel determinante en la evolución y el pronóstico de los paciente s con COVID-19 grave, no hay duda de que las terapias basadas en convección pueden ser superiores a las terapias basadas en difusión en la remoción de moléculas de citoquina de gran tamaño; sin embargo, la evidencia que se tiene en la actualidad no es concluyente11. La mayor experiencia hasta ahora es con la terapia de reemplazo renal continua y las modalidades de diálisis lentas de baja eficiencia (SLED) para aquellos pacientes cuya condición hemodinámica y de enfermedad no permita la realización de terapias intermitentes como la hemodiálisis convencional25.
Las terapias continuas de reemplazo renal por hemofiltración venovenosa continua y hemodiafiltración venovenosa continua pueden contribuir a la resolución de la insuficiencia orgánica86. En su estudio multicéntrico, Choi et al.88 evaluaron el efecto de la TRR sobre los resultados de AKI grave después de un paro cardíaco fuera del hospital a partir de la mortalidad a 6 meses; los hallazgos concluyen que las intervenciones de diálisis se asocian con un menor riesgo de muerte en pacientes con AKI en estadio 3, tratados con TRR.
Cuando se busca eliminar mediadores inflamatorios se recomienda elegir filtros con propiedades de adsorción diseñados para eliminar citocinas, como lo son la membrana AN69ST y la membrana oXiris1,86; Ghani et al.89 en su investigación reportan que tras hemofiltración a volumen de 6L/hora, hubo eliminación significativa de IL-6 y se vio favorecida la evaluación SOFA de los pacientes con sepsis.
La elección de TRRC para pacientes con neumonía atípica por SARS-CoV-2 (COVID-19) es la hemofiltración venovenosa continua 20-25 ml/(kg*h); para el tratamiento de desequilibrio hidroelectrolítico severo y trastornos de equilibro ácido-base se puede emplear la hemodiafiltración venovenosa continua; si se desea eliminar sobrecarga de volumen severa, es útil la ultrafiltración continua lenta a una tasa de ultrafiltración de 2-5 ml/min (no debe excederse de 4L); y en caso de estado inflamatorio, la alternativa es hemofiltración venovenosa continua mayor o igual a 35 ml/(kg*h)85.
Con el crecimiento de la pandemia, los requerimientos de terapias de reemplazo renal van a aumentar drásticamente; y si consideramos que los dispositivos médicos para las terapias son escasos y las necesidades son mayores, deben tomarse medidas pertinentes. La Asociación Americana de Nefrología (ASN) en su publicación de marzo de 2020 propone que ante tal eventualidad se reduzcan los tiempos de hemodiálisis a 3 horas y se reduzcan las terapias de reemplazo continuas a 10 horas, aumentando la dosis a 50 ml/kh hora de ser necesario, e incluso se ha sugerido diálisis peritoneal90,91.
Terapias adicionales utilizadas recientemente como la hemoperfusión han mostrado beneficios en la sobrevida en pacientes con sepsis puesto que las citoquinas son removidas de manera eficiente5; un reciente metaanálisis que incluyó 17 estudios demostró que la hemoperfusión con polimixina B reduce la mortalidad en los pacientes con sepsis severa y choque séptico; sin embargo, no existen hasta la fecha estudios representativos en el caso de COVID-1925.
Manejo de los pacientes con enfermedad renal crónica avanzada que tengan indicación de diálisis y adquieran la infección por COVID-19
Las instalaciones que ofrezcan servicio de diálisis deben realizar búsqueda activa de casos en sus usuarios, evaluando la presencia de signos o síntomas de infección respiratoria que puedan crear la sospecha de un caso probable. Esta evaluación debe darse a todos los pacientes antes de ingresar al área de diálisis.
Es recomendable realizar educación de los pacientes para que sean ellos quienes llamen oportunamente al sitio para informar la aparición de síntomas probables de infección y la instalación se prepare para su llegada92 (CDC). Todas las personas sospechosas o confirmadas con COVID-19 deben portar mascarillas adecuadas (quirúrgicas o N95) durante toda su estadía16,92 y cumplir con las recomendaciones generales de higiene.
Los pacientes sintácticos deben portar mascarilla quirúrgica o N95 para evitar ser un foco de contagio; idealmente deben dializarse en una habitación separada de los demás con la puerta cerrada, de preferencia la habitación de aislamiento para los pacientes con hepatitis B92. Si no es posible, el paciente debe recibir la diálisis en la sala conjunta, ocupando el sitio que esté en la esquina o la estación del final, lejos del sitio de mayor flujo de personas. Lo pacientes deben continuar recibiendo diálisis en su centro y horario tal como se ha preestablecido. La máquina de diálisis debe ser desinfectada tan pronto como el paciente haya dejado de usarla. El paciente no debe utilizar el transporte público para llegar al centro de diálisis, ni compartir transporte con sus compañeros de diálisis16,92.
Telemedicina para ERC
La telemedicina tiene como objetivo que los pacientes puedan acceder al servicio de salud, realizar seguimiento y evaluación clínica y basado en ello tomar decisiones, ya sea por parte del paciente o que involucren los centros asistenciales.93,94 La pandemia por coronavirus ha dificultado el acceso de los servicios; por lo tanto, el uso de la telemedicina es una opción razonable para los pacientes con ERC.93 El paciente debe ser educado en cuanto a su enfermedad, el reconocimiento de los factores de riesgo, el uso de la aplicación y el uso de los fármacos, y se le deben brindar herramientas que le permitan resolver inquietudes e informarse93,95.
La telemedicina puede ser implementada por medios digitales, mensajes de texto, aplicaciones celulares, llamadas, plataformas de respuesta interactiva, videoconferencias y/o envío de videos pregrabados94. Para la toma de signos vitales pueden utilizarse dispositivos electrónicos capaces de informarlos en tiempo real o también dicha toma puede ser realizada por el paciente capacitado o personal asistencial, como un enfermero o el médico de atención primaria96.
El manejo de la enfermedad crónica retrasa la progresión de la enfermedad, ayuda a prevenir las complicaciones metabólicas y disminuye el riesgo de resultados asociados a enfermedad cardiovascular94.
Manejo de las unidades de diálisis durante la pandemia por COVID-19
Los pacientes deben seguir asistiendo al centro de diálisis y en los horarios habituales87. Debe realizarse educación continua al personal de salud y los pacientes que acuden a la unidad de diálisis sobre el lavado de manos y la higiene de las vías respiras y su importancia. El personal de salud debe ser educado en el correcto uso, la postura y el desecho de los elementos de protección personal92.
La unidad debe estar preparada para la gran afluencia de pacientes probables o confirmados con coronavirus; debe adoptar medidas como preparar la sala de espera con la señalización adecuada, dejar un espacio de 6 pies entre personas y proveer de desinfectante de manos a cada persona que allí se encuentre. Además, deben realizar búsqueda de fiebre y otros síntomas respiratorios a cada paciente antes de ingresar al área de tratamiento de diálisis e identificar a los pacientes que informaron con antelación a su llegada sobre sus síntomas para tomar las acciones oportunas92.
Se debe ser riguroso en la desinfección del lugar y las máquinas de diálisis, así como mantener buena ventilación. En la medida de lo posible todos los pacientes deben utilizar tapabocas; sin embargo, esto representaría un alto gasto en los recursos, por lo cual solo los pacientes sintomáticos respiratorios deben portarlos87.
Cuando se identifique un caso o posible caso la máquina debe desinfectarse inmediatamente, los desechos de cualquier paciente sospechoso deben eliminarse como material biológico peligroso, las áreas de contacto con otros pacientes deben desalojarse y no podrán usarse hasta que estén completamente desinfectadas. Se recomienda que el personal de salud continúe con sus turnos habituales y que exista un listado de remplazo de cada persona que opere en la unidad para que en caso de enfermedad pueda ser suplido su puesto y no disminuya la capacidad de la unidad16.
Se debe hacer esfuerzos en la optimización de la cantidad de elementos de protección personal, priorizando las batas de aislamiento para procedimientos que generen aerosoles o en los cuales se encuentren en contacto con líquidos corporales. Se debe hacer uso extendido de los elementos de protección para los ojos y la cara16.
Manejo en casos sospechosos: En la Tabla 4 97 se encuentran las consideraciones al respecto.
Tabla 4 Manejo de casos sospechosos en el centro de hemodiálisis y en diálisis peritoneal. Tomado De Sequera cols.97
Otras terapias extracorpóreas
Las terapias extracorpóreas parecen ofrecer una alternativa de soporte cuando se desarrolla la falla multiorgánica; hacen referencia a un grupo de técnicas que proporcionan intercambio de gases extracorpóreos o soporte circulatorio para pacientes con insuficiencia respiratoria o cardíaca98,99. Dentro de estas terapias, además de la terapia de reemplazo renal, se encuentran:
Oxigenación por membrana extracorpórea (ECMO): Desde 1970 se venían utilizando dispositivos de oxigenación extracorpórea (ECMO), pero solo en los últimos años, con el advenimiento de las epidemias virales, se han intensificado y perfeccionado los mismos; la ECMO se desarrolló a partir de su uso como «terapia de rescate» para convertirse en una opción de tratamiento aceptada para pacientes con SDRA grave100-102. En el 2009, durante la pandemia de H1N1, en un estudio retrospectivo multicéntrico en nueva Zelanda y Australia, con limitaciones epidemiológicas (no se ha establecido como estudio comparativo entre la ventilación mecánica y ECMO), se calculó que el 17 % de los pacientes recibieron ECMO como terapia y solo 17% murieron; a partir de ese momento se ha aumentado el uso de esta modalidad de terapia103,104.
Existen dos modalidades de ECMO: veno-venosa y veno-arterial105. La primera modalidad se recomienda como posible estrategia de tratamiento para hipoxia medular renal secundaria a daño alveolar y síndrome compartimental renal secundario a la presión pico alta en las vías respiratorias e hipertensión intraabdominal25. La modalidad veno-arterial se usa en pacientes con insuficiencia cardíaca o circulatoria aguda para restablecer la perfusión y la función del órgano terminal, y para unir la recuperación, el soporte cardíaco definitivo o el trasplante de corazón106. Se recomienda en el caso de que se desarrolle síndrome cardiorrenal tipo I25.
Los pacientes en terapia de ECMO pueden presentar complicaciones secundarias a su uso como hemorragias graves, y complicaciones vasculares, alteraciones neurológicas y mayor riesgo de infecciones intrahospitalarias; por otro lado se ha descrito que los pacientes en ECMO como en las demás terapias de reemplazo renal presentan respuesta inflamatoria sistémica por la exposición de la sangre a la superficie del circuito107; activando la cascada inflamatoria que podrían aumentar los riesgos de mortalidad en los pacientes con COVID-19 en la cual, como describimos en párrafos anteriores, la descarga de citoquinas juega un papel importante en la evolución tórpida de la enfermedad102,107,108.
Las posibles razones por las cuales las ECMO no han podido demostrar de manera contundente su eficacia pueden estar determinadas por diferentes variables como el uso prolongado en ventilación mecánica convencional previa a ECMO, indicando que tal vez el uso temprano de esta modalidad de terapia puede asegurar rápidamente el descanso de los pulmones debido a la ventilación altamente protectora, antes de que la enfermedad pudiera evolucionar hacia la fibrosis destructiva108.
Hemoperfusión (HP): La HP es utilizada en el contexto de intoxicaciones específicas o endotoxemia105. Al igual de la TRR, está recomendada como posible terapia para la lesión renal aguda secundaria a la tormenta de citoquinas25.
Plasmaféris (PFE): La plasmaférisis con afinidad a la lectina es otra terapia extracorpórea adyuvante; mediante la PEF la sangre corre hacia un filtro de plasma, y ??el plasma filtrado que contiene copias virales pasa a través de una matriz de lectinas106. Esto se debe a la afinidad entre la envoltura viral y las lectinas109.
Cabe aclarar que el uso de terapias extracorpóreas en pacientes con COVID-19 aún no han sido ampliamente estudiado. Se necesitan estudios con mayor soporte y evidencia para recomendar fuertemente su uso en pacientes con complicaciones secundarias a la infección por COVID-19.
Indicaciones de trasplante renal y medidas en paciente infectado con COVID-19
Los pacientes con trasplante renal tienen mayor riesgo de infección por COVID-19 al igual que por otras infecciones virales debido al estado de inmunosupresión inducido por la terapia para prevenir el rechazo del trasplante110.
Se reportó un caso de infección por COVID-19 en pacientes trasplantados en la serie de Wuhan, China, y posteriormente, a inicios de abril de 2020, se publicó una serie de siete casos en Reino Unido. En muchos pacientes se ha documentado la misma clínica que en la población general; sin embargo, la linfadenopatía que presentan estos pacientes es inducida por los fármacos que reciben, por lo que no es útil para el diagnóstico110. Más recientemente, en el análisis de 39 pacientes receptores de riñón hecho por Akalin et al., se encontró fiebre, recuentos bajos de CD3, CD4 y CD8 y progresión clínica más rápida que la de la población general, además de mortalidad temprana (a las 3 semanas) del 28%; sus hallazgos indican un aumento considerable en la morbimortalidad para esta población111.
Los pacientes deben mantener una adecuada higiene de manos ya sea realizando lavado con agua y jabón o mediante el uso de desinfectantes que contengan alcohol con concentración de por lo menos 60%; se debe realizar limpieza de la casa y desinfección de los objetos que utilice; evitar el contacto con personas que tengan síntomas respiratorios ; permanece r en casa y en lo posible tener valoraciones a través de telemedicina; seguir una dieta saludable y evitar el consumo de alcohol o tabaco, pues además de ser dañinos potencian la inmunodepresión; evitar compartir comida y cualquier utensilio con otras personas, y llegado el caso, de s infectarlos110. En caso de tener cualquier sintomatología sugestiva de COVID19 se recomienda consultar mediante vía telefónica si los síntomas son leves; en caso de síntomas moderados a severos o fiebre de más de 38 °C o estado de fragilidad, el paciente deberá consultar de inmediato al servicio de urgencias110.
En pacientes que estén en cuarentena domiciliaria debe iniciarse terapia con levofloxacina después de la evaluación médica, realizándose a la par reducción empírica de ciclosporina. Se debe mantener una hidratación adecuada y pue de usarse paracetamol para el control de la fiebre18.
En cuanto al manejo con corticoides existe controversia acerca de su uso. Reportes de caso de pacientes con trasplante renal y coronavirus han planteado la opción de cambiar transitoriamente el tratamiento con inmunomoduladores a corticoide s sistémico s basados en el concepto de que los corticoides permiten mejor acción de los linfocito s T para la eliminación del virus y continúan evitando el rechazo del trasplante112,113; sin embargo , también existen reportes donde informan disminución del aclaramiento viral a nivel pulmonar cuando se utilizan, por lo tanto, debe darse uso conservador y bajo criterio clínico de corticoides18.
Al igual que en el resto de los pacientes infectados con coronavirus, no existe evidencia suficiente para recomendar un manejo terapéutico específico para estos pacientes; se ha evaluado el uso de lopinavir/ritonavir, antimaláricos, anti cuerpos monoclonales e interferón, entre otros, y en ninguno se ha encontrado el suficiente grado de evidencia para ser recomendado18,110.
El manejo inmunosupresor en los pacientes trasplantados infectados con COVID-19 se convierte en un desafío y se deben considerar condiciones como la edad, el tiempo de trasplante y la gravedad de la enfermedad al igual que la presencia de comorbilidades110.
En caso de infecciones, Banerjee et al.114, según la gravedad de las mismas, recomiendan una conducta específica, la cual se encuentra en la Tabla 5 114
Tabla 5 Modificaciones en el manejo de pacientes trasplantados con infección por COVID-19. Tomado de Banerje y cols114.
| Infección leve | Se recomienda manejo en casa con control estrecho, además debe mantener las terapias y de ser necesario, modificar las dosis de inmunosupresores teniendo en cuenta el riesgo de mayo ingreso a la estancia hospitalaria. Los autores proponen:
|
| Infección grave (que requieren intubación y ventilación) | Se recomienda: El gran riesgo es la pérdida del órgano trasplantado, pero en mayor la gravedad de la infección por COVID-19, la cual va acompañada de alta tasa de mortalidad. |
Por el momento no se ha registrado que el COVID -19 sea transmitido al paciente receptor debido al trasplante; en las epidemias pasadas de MERS y SARS se documentaron casos en los cuales se dio la transmisión donante -receptor110. No se recomienda el trasplante de donante s cadavéricos muerto s o donantes vi vos con infección reciente o pasada, y en general, por la alta dosis de inmunosupresión que requieren los receptores durante los primeros tres meses postrasplante, lo aconsejable es aplazar dichos procedimientos, ya que está latente la posibilidad de presentar una infección grave114.
Indicaciones del inicio de líquidos IV y dosis en paciente con lesión renal y covid-19
La Campaña de Sobreviviendo a la Sepsis, en su guía de manejo del paciente con enfermedad crítica por COVID -19, sugiere que en adultos se usen cristaloides balanceados sobre no balanceados; esto debido al costo-beneficio115. En caso de no tener disponibilidad de ninguno de los anteriores, se sugiere la utilización de solución salina al 0,9%. Para pacientes con lesión renal no se han encontrado diferencias significativas en cuanto a la mortalidad al utilizar alguno de los dos (OR:0,92)116. Para evaluar la respuesta a líquidos se deben medir parámetros como la temperatura, el tiempo de llenado capilar y la medición de lactato sérico115.
En cuanto a las estrategias de reposición de líquidos en pacientes con COVID-19, aun no existe evidencia directa; la guía115 recomienda la estrategia conservadora (volúmenes bajos) sobre la liberal, basándose en estudio s indirectos de SDRA relacionado con shock. En 9 ensayos clínicos se encontró que no hubo diferencia entre el uso de fluidoterapia conservadora vs. liberal en cuanto a la mortalidad en personas con sepsis117; sin embargo, en un metaanálisis de 11 ECA118, se observó que la estrategia conservadora utilizada en niños y adultos se asoció con menor estancia en uso y menor tiempo de uso de ventilador. Hasta el momento no hay datos con suficiente evidencia que soporten el uso de la estrategia liberal.
En cuanto a la población con falla renal, la guía no hace mucho énfasis en el manejo de esta patología relacionada con infección por COVID-19 y sepsis. En una revisión sistemática que incluyó 5 ECA, el riesgo de muerte en pacientes con SDRA que recibieron terapia conservadora vs. liberal fue similar, incluso en los pacientes con lesión renal118.
A pesar de que en el shock séptico el manejo inicial es la reanimación con líquidos, en el contexto de un paciente con falla renal, la regla de «a mayor hidratación, mejor respuesta» no funciona de la misma manera, el exceso de hidratación conlleva a una sobrecarga de líquidos que conlleva a edema tisular contribuyendo así a la disfunción orgánica119.
Finalmente, la guía115 recomienda no utilizar almidones de hidroxietilo, dextranos ni albúmina, teniendo en cuenta previos resultados indirectos, debido a que hacen poca o ninguna diferencia en la mortalidad frente a los cristaloides120, y en el caso de los dextranos, son de mayor costo y pueden asociarse a mayor riesgo de sangrado.
El manejo del shock se especifica en la Figura 1, puntualizando el uso de cristaloides no más de 30 ml/kg.
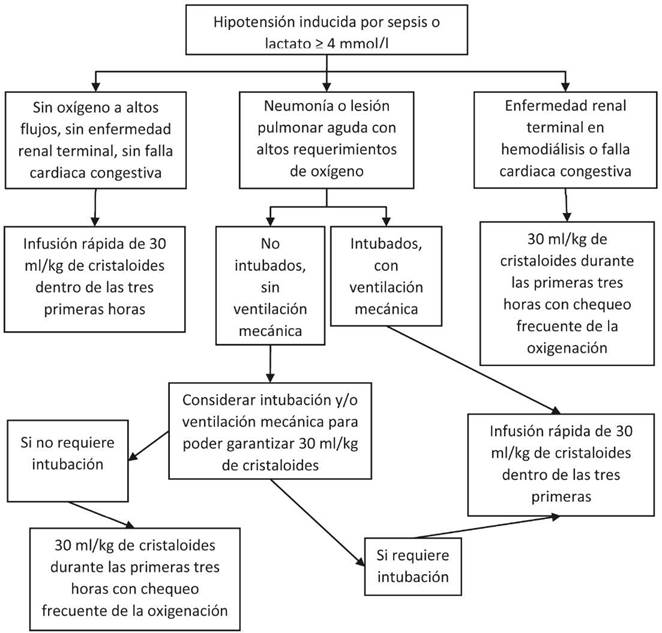
Figura 1 Reanimación hídrica en adultos con choque séptico según la campaña «Sobrevivir a la sepsis» 2016. Tomado de: Manejo de fluidos intravenosos: del uso indiscriminado y empírico al manejo racional y científico121.
Manejo del shock en paciente con lesión renal y COVID-19
El paciente con falla renal se maneja similar a un paciente sin esta comorbilidad o complicación; sin embargo, es importante hacer énfasis en la interacción de fármacos como los antivirales si la falla renal es concomitante a la infección por COVID-19 relacionado con shock115.
Ya una vez puntualizada la reanimación hídrica, la guía de manejo del paciente con enfermedad crítica por C OV ID-19115 sugiere el siguiente manejo:
Vasopresores
Uso de norepinefrina como agente vasoactivo de primera línea, sobre otros agentes, para el manejo de paciente con COVID-19 y shock. Para ello la evidencia se basó en las recomendaciones de la Guía de práctica clínica de la Sociedad Escandinava de Anestesiología y Medicina de Cuidados Intensivos122 donde concluyen hacer uso de norepinefrina en lugar de otros vasopresores como tratamiento de primera línea para la mayoría de los pacientes adultos críticos con insuficiencia circulatoria aguda. Por su parte, una revisión sistemática demostró que no hay diferencias sustanciales en la mortalidad total entre varios vasopresores123.
Como segunda línea, sugieren el uso de vasopresina o epinefrina; su elección se basa en la disponibilidad y las contraindicaciones para los dos agentes. Con la vasopresina, la isquemia digital puede ser una preocupación; con epinefrina, la taquicardia y el exceso de producción de lactato pueden ser consideraciones115.
Es importante puntualizar que la guía basa sus recomendaciones en estudios previos que no guardan relación directa con shock y COVID-19 en pacientes con falla renal; esto debido a que hasta el momento no hay estudios que soporten o evidencien algún cambio del manejo.
Uso de inmunoglobulina intravenosa
La guía no recomienda el uso rutinario de inmunoglobulinas debido a que en primer lugar no existen datos de eficacia disponibles124, y en segundo lugar su uso se ha visto asociado a mayor riesgo de eventos adversos graves, dentro de ellos, insuficiencia renal125.
Uso de óxido nítrico inhalado
En el caso de los pacientes con ventilación mecánica, no se recomienda el uso rutinario de óxido nítrico inhalado115. Esta recomendación se basa en los hallazgos de una revisión sistemática que demostró que este medicamento inhalado en el contexto de un SDRA no se asocia con diminución de la mortalidad (RR=1,59) pero sí con el riesgo que generar lesión renal aguda126.
Conclusiones
La falla renal en el contexto de la infección por COVID-19 representa un aspecto importante a estudiar, debido a que, por un lado, en su forma aguda se relaciona como complicación secundaria a los fenómenos fisiopatológicos y sistémicos causados por el virus; y por el otro lado, en su forma crónica se encuentra en estrecha relación con las comorbilidades que se han visto asociadas a un panorama crítico.
Los pacientes en hemodiálisis son una población con posibilidad de presentar formas atípicas de la infección, ya que se encuentran con linfopenia y altos niveles de pro calcitonina; por lo tanto, estos parámetros paraclínicos no son confiables al momento de establecer el diagnóstico. Por otra parte, es recomendable hacer uro análisis de manera regular para determinar injuria renal en pacientes con COVID-19; además, para instaurar el manejo farmacológico es importante tener en cuenta ciertos indicadores como la TFG, el estadio de la enfermedad y la necesidad de diálisis. En cuanto a los fármacos a utilizar, la cloroquina no tiene dosis sugerida en esta población; la hidroxicloroquina se debe usar con precaución por sus efectos adversos a nivel renal; lopinavir/ritonavir no necesita de ajuste para paciente renal, y remdesivir no debe administrarse en pacientes con diálisis o hemofiltración veno-venosa. Los antibióticos se deben usar en caso de coinfección bacteriana y se sugieren determinados ajustes según TFG.
En cuanto a las terapias de reemplazo renal, han demostrado ser favorecedoras en contextos como sepsis e insuficiencia orgánica. En los casos de neumonía atípica es recomendable la hemodiafiltración veno-venosa continua; como alternativas, podría emplearse la diálisis peritoneal.
En cuanto a los pacientes dialíticos que tengan que desplazarse a un centro médico para el procedimiento y que, además, se encuentren con sospecha o confirmación de COVID-19, es imprescindible la educación con respecto al uso de EPP y estrategias de prevención de contagio tanto para los pacientes como para el personal de salud a cargo.
En el contexto de sepsis y shock séptico en pacientes con enfermedad renal de base o secundaria, se sugiere seguir las pautas de tratamientos sugeridas por la guía enfocada en pacientes con COVID-19 de la Campaña de Sobreviviendo a la Sepsis; sin embargo, aún faltan estudios y evidencia que soporte el manejo en este contexto de esta población.















