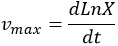INTRODUCCIÓN
Las bacterias ácido-lácticas se ubican en la familia Lactobacillaceae, la cual se caracteriza porque sus miembros pueden ser bacilos largos o cortos, aunque también cocos que se dividen como los bacilos, solamente en un plano, produciendo cadenas o tétradas de forma ocasional y filamentos, falsamente llamados ramificados 1. Las bacterias acido lácticas (BAL) son conocidas por exhibir múltiples efectos en el huésped, entre los cuales están: el mantenimiento de la homeostasis intestinal, la regulación del sistema inmune, reducción de los síntomas alérgicos, la prevención de las infecciones bacterianas y virales, y el alivio de los síntomas de enfermedades infecciosas 2. Las bacterias lácticas producen un sinnúmero de sustancias capaces de inhibir el crecimiento de microorganismos patógenos, entre ellos ácidos orgánicos y peróxido de hidrógeno (H2O2) como mecanismo de protección frente al oxígeno, mediante la acción de oxidasas o NADH peroxidasas. En este sentido, L. gasseri es un microorganismo Gram-positivo intestinal autóctono que constituye la mayor parte de las especies de Lactobacillus homofermentativas que ocupan el tracto gastrointestinal humano, con una sobresaliente producción de ácido láctico, péptidos antibacterianos, a saber, bacteriocinas 3 y es responsable de la inducción de producción de IgA en el intestino, un factor importante en la prevención de la invasión dañina de microorganismos y toxinas a través de las células epiteliales en el intestino delgado, el sitio inicial de la adhesión y la infección de patógenos en el intestino 4.
Por su parte, Staphylococcus epidermidis es un microorganismo oportunista que se encuentra frecuentemente en el medio ambiente, en la piel sana del pezón y mucosas, ocasionando solo en situaciones de debilidad del huésped, casos de patogenicidad. No produce toxinas, no produce coagulasa, no fermenta el manitol, y no forma el pigmento amarillo. A su vez es reconocido por causar infecciones nosocomiales. Desde el punto de vista pecuario, aunque por lo general las infecciones mamarias por S. epidermidis suelen ser leves o de tipo subclínico, se ha demostrado también que pueden causar procesos más graves y persistentes y provoca un aumento en el recuento de células somáticas y una disminución en la calidad y producción de la leche, debido al daño causado al tejido mamario 5,6.
La presente investigación tuvo como objetivo el determinar, valorar e identificar los parámetros de la cinética de crecimiento de Lactobacillus gasseri y su efecto probiótico sobre Staphylococcus epidermidis.
MATERIALES Y MÉTODOS
La investigación se realizó en los laboratorios de microbiología del grupo de investigación FiseProbiotec y en los laboratorios especializados de la Universidad de Nariño (Colombia), ubicados en la ciudad de Pasto. Se utilizaron las cepas Lactobacillus gasseri ATCC® 19992 y Staphylococcus epidermidis ATCC® 12228. La reconstitución de cada cepa se efectuó de acuerdo con las instrucciones del fabricante. Para la conservación de la cepa láctica se realizó un repique en medio sólido (agar MRS) y en medio líquido (caldo MRS) cada 5 y 8 días. Por su parte, para la cepa patógena se realizó un repique en medio líquido (caldo BHI) y en medio sólido (agar Mueller Hinton) cada 5 y 8 días. Se incubaron a 37ºC por 24 horas, posteriormente se conservaron en refrigeración a 4ºC. Bajo este lineamiento, la cepa láctica L. gasseri se cultivó teniendo en cuenta el siguiente procedimiento: se tomó en un Erlenmeyer 40 ml de caldo MRS y se depositó una cantidad de la cepa, incubándose posterior a esto por 24 h a 37°C; una vez terminada la incubación, se tomaron 4 ml del incubado, y se depositaron en otros 40 ml de caldo MRS, finalmente se incubó en iguales condiciones. De acuerdo con la metodología propuesta por Crueger y Crueger 7 se realizó el ajuste del inóculo, el cual consiste en tomar 90 ml de caldo MRS y añadir 10 ml de inóculo teniendo en cuenta la regla. Terminada la incubación se realiza lectura de 1 ml mediante espectrofotometría (625 nm), una vez la población sea superior a la establecida, se adiciona caldo estéril según la propuesta de Guerrero ajustada por Jurado-Gámez et al. 8.
Se evaluó la susceptibilidad de L. gasseri y S. epidermidis a los siguientes antibióticos: penicilina (P 10 IU), ciprofloxacina (CIP 5 µg), gentamicina (CN 10 μg), ampicilina (AMP 10 μg), dicloxacilina (DCX 1 μg), y trimetropin sulfa-metoxasol (COT 25 μg) con el método de Kirby-Bauer (9). Para esta prueba se ajustaron las cepas a 0,5 en la escala de McFarland, posteriormente se sembró distribuyendo el contenido con ayuda de un hisopo estéril en cajas Petri con agar Mueller Hinton. Seguidamente, se tomaron los discos de antibióticos con una pinza estéril y se colocaron con una leve presión en el agar con el fin de lograr la adhesión de los mismos; finalmente se invirtieron las cajas Petri y se pasó a incubar a 37ºC por 18 h. Una vez transcurrido este tiempo, se observó y midió el halo formado entre el borde del disco y el máximo de inhibición.
Se determinó el efecto de inhibición de L. gasseri sobre S. epidermidis mediante la metodología de Tagg y McGiven 10. Para esto se tomó una azada de L. gasseri ajustada a la escala de McFarland a 0,5 y se sembró en cajas Petri con agar MRS y azul de anilina, trabajándose en concentraciones de 75, 100 y 150 μl, a continuación se llevó a incubación a 37°C por 24 h; en este sentido, la cepa patógena se ajustó también a la escala de McFarland a 0,5, y se sembró en cajas Petri con agar Mueller Hinton. Por último, se pasó a tomar discos de agar MRS con la cepa láctica, y se depositaron en las cajas incubadas con la cepa patógena, se llevó a incubación a 32ºC por 12 horas. Una vez terminado el periodo de incubación, el tamaño del halo fue medido desde el borde del disco de agar hasta el extremo del halo producido por la inhibición de la cepa patógena, de tal manera que el halo fuera igual o superior a 2 mm 11. De igual manera, se determinó el efecto del sobrenadante de L. gasseri sobre el crecimiento de S. epidermidis bajo la metodología de Kirby Bauer modificada 9. Para tal efecto se obtuvo el sobrenadante de la cepa láctica L. gasseri ajustada a 4 (725 nm) en la escala de McFarland, dicho sobrenadante se depositó en tubos eppendorf con un contenido de 1,0 ml, para ser centrifugados a una temperatura de 4ºC a 15.000 rpm durante 15 minutos, terminado el proceso de centrifugación se trabajó el sobrenadante de la siguiente manera: usando cilindros estériles de aproximadamente 6 mm de diámetro, en los cuales se depositaron concentraciones de 75, 100 y 150 μl, y mediante papel pads, sobre los cuales se depositaron las mismas concentraciones, en ambos casos se utilizó el sobrenadante sin filtrar y filtrado con membrana de 0,25 μm; los dos métodos de discos y cilindros fueron colocados con la cepa patógena y se incubaron a 37ºC por 24 h.
Se evaluó el crecimiento de L. gasseri a concentraciones de 0,5, 2 y 3% de sales biliares bovinas, y 0,5, 2 y 3% de bilis bovina 12. Para ello se sembró la cepa láctica en caldo MRS por un periodo de 24 h, pasado este tiempo se inoculó nuevamente en caldo MRS con las concentraciones citadas de sales biliares y bilis bovina, posteriormente se sembró en agar MRS con azul de anilina y se incubó a 32°C por 48 h. Se determinó producción de gas por la metodología propuesta por Cai et al. 13 y la reacción de catalasa mediante la metodología de Dahl et al. 14. Se determinó el crecimiento de la cepa láctica a pH de 2,5, 3,0 y 6,5 durante 3 horas, con mediciones cada hora; la incubación se realizó en medio MRS comercial a 37°C por 48 horas, el ajuste del pH se realizó con ácido tartárico, con el fin de inhibir el efecto del ácido láctico. Se evaluó el crecimiento de L. gasseri a 38 y 45°C, según lo establecido por Crueger y Crueger 7; para ello, primero se determinó el tiempo necesario para obtener la fase exponencial de crecimiento en la cepa láctica; con esta información se realizó una nueva inoculación, la cual se ajustó a 0,125 en escala de McFarland y se incubó hasta las 12:00 horas (fase exponencial). Enseguida se realizaron diluciones de 10-1 hasta 10-12 con agua peptonada, se sembraron en cajas de petri con azul de anilina y se inició en la dilución 10-6 hasta 10-12 a 37°C por 48 horas, para finalmente determinar el recuento de UFC/mL.
Los parámetros cinéticos de L. gasseri se evaluaron en medio MRS comercial. Se tomó un Erlenmeyer con 540 ml de medio y se adicionó 60 ml de inóculo de L. gasseri, el preparado se incubó a 37°C por 24 horas con agitación constante a 100 rpm. No se controló el pH por la resistencia de la cepa a bajos niveles. Se tomaron muestras y mediciones cada tres horas para determinar conteo de microorganismos viables en placa (UFC/mL), azúcar consumida, proteína consumida y ácido láctico.
Para determinar el conteo de microorganismos viables en placa se tomó 1 ml de muestra en 9 ml de agua peptonada al 0,1% y se hicieron diluciones decimales; de las diluciones comprendidas entre 10-6 y 10-12, se hizo la siembra en cajas de Petri con agar MRS y azul de anilina. Las cajas fueron incubadas a temperatura entre 37˚C y fueron observadas entre las 24 y 48 horas, teniéndose en cuenta únicamente las cajas Petri con conteos entre 30 y 300 colonias, el número de colonias fue multiplicado por el inverso de la dilución y por 10 para obtener UFC/ 150 μL 15. Para determinar el pH se utilizó el potenciómetro digital (JENCO® VisionPlus). La determinación del consumo de azúcar se realizó por la metodología de Dubois et al. 16, la cual consistió en preparar diferentes concentraciones de glucosa para crear una curva patrón mediante los valores obtenidos de las muestras observadas a una densidad óptica de 625 nm. Los valores se graficaron contra la concentración en mg/l y finalmente se obtuvieron los valores de la línea recta. El consumo de proteína fue determinado por la metodología de Lowry et al. 17, para esta determinación se realizó una curva de calibración mediante seroalbúmina bovina y se determinó la absorbancia en espectrofotómetro a 625 nm. Los valores obtenidos se graficaron contra la concentración para obtener la ecuación de la línea recta. La determinación de producción de ácido láctico se realizó por titulación de hidróxidos de sodio. La biomasa fue determinada por el método propuesto por Crueger y Crueger 7. Para ello se estableció la velocidad máxima de crecimiento mediante la siguiente ecuación:
Se tomó una muestra de sobrenadante de L. gasseri por HPLC-DAD (high performance liquid chromatography o cromatografía líquida de alta eficacia). Se determinó el contenido de péptidos y ácido láctico. La muestra para análisis se preparó de la siguiente forma: se cultivó la cepa en caldo MRS por 24 horas a temperatura entre 37°C, posteriormente se ajustó por espectrofotometría a una densidad óptica 1,00 en escala McFarland patrón 4, equivalente a una concentración de 1,2 x 109 bacterias/ml. Luego, se trasfirieron muestras en tubos eppendorf y se centrifugaron a 13.500 rpm durante 30 minutos a 4°C. Por último, el sobrenadante se filtró utilizando membranas PVDF de 0,2 μm; y para el caso de aminoácidos se determinó por HPLC-PDA; este último análisis también se realizó para S. epidermidis. Para esta determinación se cultivaron las cepas en caldo MRS y BHI respectivamente por 24 horas a temperatura entre 37°C, posteriormente se ajustó por espectrofotometría a una densidad óptica 1,00 en escala McFarland patrón 4. Luego se trasfirieron muestras en tubos eppendorf manteniéndolas a una temperatura de 4°C. Seguidamente se pasó por filtros de jeringa de PVDF, Pall de 0,25µm, 1,0 mL de muestra. Posteriormente se adicionó HCL 6N y se centrifugó por 15 minutos a 9000 rpm. La información fue recolectada y analizada en el programa Microsoft Excel 2013; sin embargo, las variables de cinética de fermentación, tales como UFC/150 μL sobre produccion de ácido láctico y pH se evaluaron mediante un diseño de medidas repetidas en el tiempo con el paquete estadístico SPSS 19.
RESULTADOS
Los resultados de sensibilidad a los antibióticos se encuentran en la tabla 1 y figura 1(a). Se puede observar en los resultados que L. gasseri presentó resistencia a los antibióticos gentamicina y dicloxacilina y fue sensible a penicilina, ciprofloxacina, ampicilina y trimetropin sulfa-metoxasol. Por su parte, Staphylococcus epidermidis mostró resistencia a los antibióticos penicilina, gentamicina y dicloxacilina, y fue sensible a ciprofloxacina, ampicilina y trimetropin sulfa- metoxasol.
Tabla 1 Susceptibilidad de L. gasseri y S. epidermidis a antibióticos.

p: penicilina; cip: ciprofloxacina; cn: gentamicina; dcx: dicloxacilina; amp: ampicilina; cot: trimetoprimsulfametaxasol; S: sensible; R: resistente; a: Manual para antibiograma LABORCLIM; b: Centro de control dee productos para diagnósticos Ltda. CECON; c: Manual de pruebas de susceptibilidad antimicrobiana; d: Jurado et al. (2014).
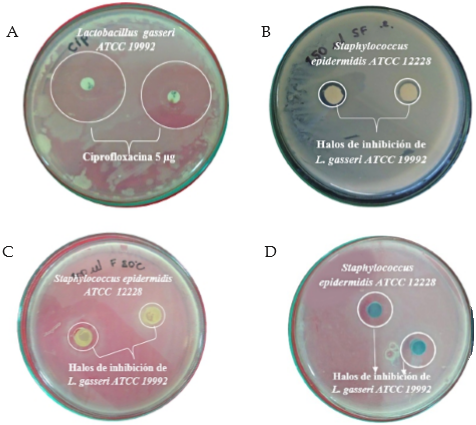
Figura 1 A. Halos de inhibición de antibiótico; B. Efecto del sobrenadante método discos modificado de L. gasseri sobre S. epidermidis; C. Efecto del sobrenadante método difusión en cilindro plástico de L. gasseri sobre S. epidermidis. D. Discos de agar impregnados de Lactobacillus gasseri.
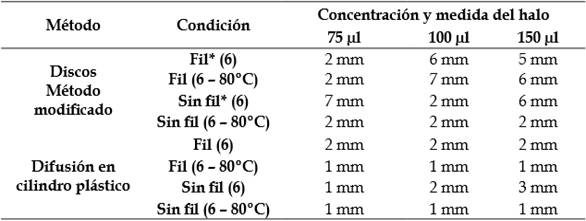
Los resultados observados en las pruebas de inhibición de L. gasseri y su sobrenadante, mostraron una eficaz acción sobre la cepa patógena S. epidermidis, en las concentraciones de 75, 100 y 150 μl, con halos de 8, 7 y 5 mm (Figura 1 (d)) y con halos de 5, 6 y 7 mm para su sobrenadante (Tabla 2, Figura 1 (b-c)).
Tabla 2 Halos de inhibición del sobrenadante de Lactobacillus gasseri frente a Staphylococcus epidermidis.
En cuanto a la viabilidad y crecimiento de la cepa láctica, bajo condiciones como sales biliares y bilis bovina, se observaron crecimientos de 2,8 x 106, 1,2 x 108 y 1,7 x 1012 UFC/150 μL a concentraciones de 0.5, 2 y 3% de sales biliares; y 5,2 x108, 2,5 x 106 y 1,9x 1012 UFC/150 μL a concentraciones de 0,5, 2 y 3% de bilis bovina. En el caso de la prueba de catalasa y producción de gas, las dos fueron negativas.
Se evaluó la viabilidad de L. gasseri en diferentes temperaturas, la cual mostró crecimientos adecuados con valores mínimos de 2,8 x 107 y máximos de 3,0 x 1012 UFC/150μL a temperaturas de 38 y 45°C.
Se determinó el crecimiento de la cepa láctica, en diferentes concentraciones de pH, en donde se encontraron crecimientos de 3,0x1012 UFC/150 μL para todos los pH de 2,5, 3,0 y 6,5. En cuanto al efecto de las UFC/150 μL sobre el pH del medio de cultivo, L. gasseri presentó diferencias estadísticas significativas (p<0,05) a los tiempos 5 y 6, mostrando un pH de 4,296 y 4,112 respectivamente (Tabla 3).
Tabla 3 Efecto de las unidades formadoras de colonia (UFC/150 μL) sobre el pH del medio de cultivo Lactobacillus gasseri.

Letras distintas en las columnas indican diferencias estadísticas significativas (p < 0,05).
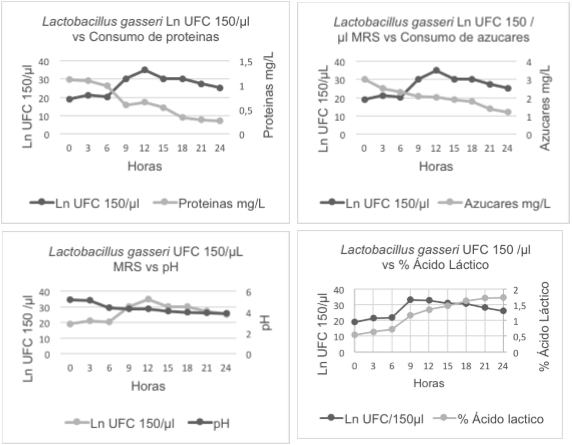
Los resultados de la cinética de fermentación, el pH, ácido láctico, el consumo de azúcar y proteína medidos durante el tiempo de fermentación se observan en la Figura 2 y en la tabla 4. El crecimiento de L. gasseri en medio MRS por 24 horas, se encontró la fase exponencial al tiempo 5 (12:00 horas), con valores de 3,0 x 1011 UFC/150 μ. Con un consumo se azúcares por parte de L. gasseri de 2,032 mg/l, el consumo de proteínas de 0,65 mg/l en la fase exponencial. En la determinación de porcentaje de ácido láctico para L. gasseri, se presentaron valores iniciales y finales de 0,48- 1,71 (Tabla 5), en la tabla se observa el efecto de las UFC/150 μL sobre él porcentaje de ácido láctico del medio de cultivo MRS, donde L. gasseri presentó diferencias estadísticas significativas (p<0,05) en todos los tiempos destacándose mayor porcentaje de ácido láctico (1,71) al tiempo 9.
Tabla 5 Efecto de las unidades formadoras de colonia (UFC/150μL) sobre el porcentaje de ácido láctico del medio de cultivo Lactobacillus gasseri.

Letras distintas en las columnas indican diferencias estadísticas significativas (p < 0,05).
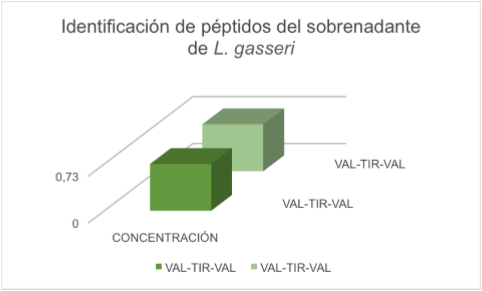
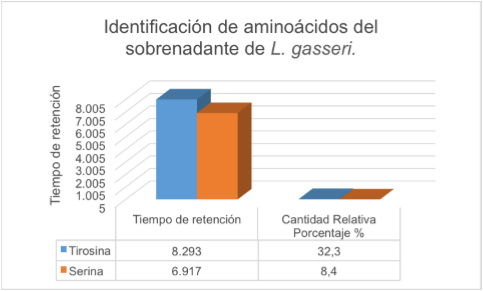
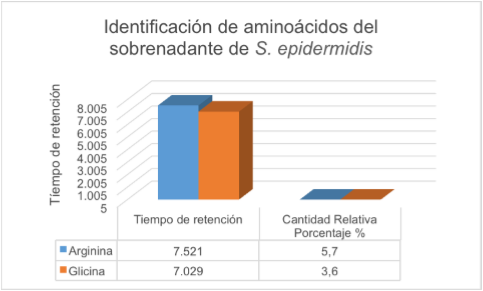
El análisis del sobrenadante de L. gasseri por HPLC mostró una cadena de péptidos VAL-TIRVAL en el tiempo 11,98 con una concentración de 0,73 mg/ml de muestra (tabla 6 y figura 3). En cuanto a los resultados de la identificación de aminoácidos del sobrenadante de la cepa láctica y la cepa patógena, en las tablas 7 y 8 y figuras 4 y 5, se puede observar que para L. gasseri el aminoácido que predominó porcentualmente fue Tirosina, 32,3%, y para S. epidermidis fue Arginina, 5,7%; siendo en L. gasseri el segundo aminoácido predominante Serina, con una cantidad relativa porcentual de 8,4%; por su parte, S. epidermidis presentó un segundo aminoácido correspondiente a Glicina, cuya cantidad relativa porcentual fue de 3,6%.
DISCUSIÓN
Para determinar la capacidad de las BAL, es importante que estén sujetas a diversas condiciones, presentes de manera natural en el animal, en este sentido, evaluando su viabilidad en diferentes ambientes presentes en el tracto gastrointestinal de los mismos. Para el caso de la prueba de antibióticos, Teuber et al. 18 manifiesta que, tanto las metodologías como los perfiles de susceptibilidad/resistencia a antibióticos están muy establecidas para la mayoría de los microorganismos patógenos, el mismo autor continúa afirmando que menor atención, sin embargo, se ha dedicado a otros grupos bacterianos, entre los que se pueden contar las bacterias lácticas. En este sentido, un parámetro importante a tener en cuenta son los criterios de resistencia de la cepa trabajada, debido a que la resistencia a antibióticos representa un peligro potencial cuando se encuentra en los microorganismos comensales o beneficiosos, ya que estos pudieran convertirse en reservorios desde dónde los determinantes podrían transferirse a los microorganismos oportunistas y a los patógenos 19. En general, según lo reportan Hambleton et al. 20. los Lactobacillus son sensibles a penicilina G, ampicilina, cefalosporinas y clindamicina. Dicho resultado muestra coincidencia con lo arrojado por la cepa láctica en estudio en cuanto sensibilidad a ampicilina y penicilina; por su parte, Zhou et al. 21, respecto al grupo de antimicrobianos inhibidores de la síntesis proteica, afirma que los Lactobacillus suelen ser más resistentes a los aminoglicósidos (kanamicina, gentamicina, neomicina y estreptomicina), que en contraste con la cepa láctica L. gasseri, muestra perfiles de resistencia coincidentes al antibiótico gentamicina. En cuanto a los perfiles de la cepa patógena S. epidermidis, al respecto Benavides-Plascencia et al. 22, encontraron en su estudio perfiles de resistencia y sensibilidad de diferentes cepas patógenas, entre ellas del género Staphylococcus, el cual presentó coincidencia en cuanto a perfiles de sensibilidad con algunos antibióticos trabajos, como ampicilina y trimetropinsulfametoxasol. Por otra parte, Jurado-Gámez et al. 8 encontraron perfiles de resistencia a la Dicloxacilina, similar al resultado reportado por la cepa patógena. Según Maranan et al. 23, el fenómeno biológico de la resistencia depende de la aparición y conservación de los genes de resistencia, como elementos génicos cromosómicos y extra cromosómicos.
En las pruebas de inhibición, dicha acción observada, puede estar relacionada a la capacidad de la cepa láctica de producir sustancias antimicrobianas, tales como ácidos orgánicos como el láctico y acético, diacetilo, reuterina y sustancias importantes de naturaleza proteica como las bacteriocinas 24. Lo anterior hace posible crear un medio ideal para su colonización y establecimiento intestinal, y de esta manera cumplir con su acción inhibitoria. 25. Un punto importante a mencionar, según Feria et al. 26, es que la producción de bacteriocinas ocurre de forma natural durante la fase logarítmica del desarrollo bacteriano o al final de la misma, guardando relación directa con la biomasa producida. En lo que respecta a la cepa L. gasseri en estudio, mostró halos de inhibición significativos en las concentraciones de 100 y 150 μl, tanto en la cepa láctica como en su sobrenadante evaluado mediante los métodos de discos método modificado y difusión en cilindro plástico respectivamente; dichos resultados son coincidentes con los obtenidos por Jurado-Gámez et al. 27, donde la cepa láctica mostró efectividad en el control de S. aureus, S. epidermidis y S. agalactiae; en este sentido las BAL son conocidas por producir, durante su crecimiento, sustancias que inhiben el crecimiento de otros microorganismos. Esta característica se utiliza para la destrucción de bacterias indeseables o patógenas en la fabricación de los alimentos. La mayor parte de estos compuestos no están caracterizados ni en cuanto a su naturaleza bioquímica ni en cuanto a su mecanismo de acción. Con frecuencia incluso, los productos activos no son más que metabolitos excretados por la bacteria como el ácido láctico o derivados del metabolismo del oxígeno como el H2O228. Lo anterior permite inferir que la bacteria es un buen competidor contra las bacterias patógenas susceptibles, presentándose como una alternativa para el manejo de mastitis ocasionada por estos microorganismos.
En las pruebas de viabilidad y crecimiento en sales biliares y bilis, L. gasseri mostró resistencia y crecimiento en todas las concentraciones propuestas; en efecto, lo anterior puede atribuirse a la capacidad de las BAL de soportar las diferentes condiciones que se presentan a lo largo del tracto gastrointestinal, y que en cierta manera, hacen posible su adaptación y respuesta favorable para el huésped; así, Urbanska et al. 29 encontró en su estudio resistencia por parte de las BAL a una concentración de 0,3% de sales biliares, resultado pertinente al presente estudio. Por su parte Ávila et al. 30 revelaron buenos crecimientos de cepas de Lactobacillus aislados del tracto intestinal de animales de granja en presencia de sales biliares al 0,15%; así mismo, Del Piano et al. 31 señalan que los probióticos deben ser capaces de sobrevivir el pasaje a través del estómago y el intestino delgado y estar presentes en suficiente cantidad para impactar el micro medio ambiente del colon, de modo que ellos deben tolerar las condiciones ácidas y ricas en proteasas del estómago y sobrevivir y crecer en presencia de ácido y sales biliares.
La prueba de catalasa de la cepa fue negativa, característica general del género Lactobacillus, y concuerda con De Roissart y Luquet 32, quienes describen que las cepas lácticas carecen de la enzima. Según Prescott et al. 33, la enzima catalasa degrada el peróxido de hidrógeno (H2O2) y para poder hacerlo requiere de un grupo porfirínico (citócromo), mismo que las BAL no pueden sintetizar; por tal motivo, las BAL no poseen catalasa y esto permite identificarlas como catalasa negativas, lo cual confirma la negatividad del resultado. Los resultados de la producción de gas para L. gasseri fueron negativos, constituyendo una importante característica probiótica de las bacterias lácticas utilizadas en la alimentación animal y que pueden evitar que el animal presente enfermedades como el meteorismo o timpanismo, del mismo modo cuando se utilizan cultivos iniciadores para producir embutidos crudo-curados, los cultivos no deben alterar las propiedades organolépticas del producto, como lo menciona Klingberg et al. 34, ni generar gases o producir ácido acético, como lo hacen las BAL heterofermentativas, porque ocasionan alteraciones organolépticas.
La temperatura es un factor tan importante en el crecimiento microbiano que incluso se ha tomado como parámetro de clasificación de microorganismos. En este sentido, se evaluó la viabilidad de L. gasseri en diferentes temperaturas, en las cuales logró completar su crecimiento. Al respecto, Mora y García 35 mencionan que los Lactobacillus pueden desarrollarse con límites de temperatura que oscilan entre 2 y 53°C, siendo su rango óptimo de crecimiento entre 30 a 40°C; lo anterior constituye una característica de gran importancia en la bacteria láctica trabajada, ya que permite que esta crezca a diferentes niveles de temperatura, lo que es un significativo beneficio en la aplicación de alimentos, así como también en el establecimiento de la misma en el huésped.
Con respecto a la viabilidad a diferentes concentraciones de pH (2,5, 3,0 y 6,5), a pesar de que fue viable la cepa láctica en todas la concentraciones propuestas, un resultado interesante fue el crecimiento de L. gasseri en la concentración de 2,5, debido a que la mayoría de microorganismos tienen una limitada capacidad de desarrollo en pH debajo de 3,0, aun así la cepa láctica en estudio demostró viabilidad a esta concentración. En relación, Jin et al. 36 afirman que los Lactobacillus son en general mucho más resistentes a la acidez que las bífidobacterias, teniendo los primeros un crecimiento moderado a pH 3,0 y relativamente bueno a pH 4,0. Igualmente, Ronka et al. 37 sostienen que los Lactobacillus son considerados intrínsecamente resistentes al ácido. Aunque existen diferencias entre las especies y cepas de microorganismos, generalmente presentan una mayor sensibilidad a los valores de pH por debajo de 3,0. Por su parte, Corcoran et al. 38 señalan que la tolerancia a un medio ácido es reconocida como una de las propiedades deseables utilizadas para seleccionar potencialmente cepas probióticas. Esta resistencia a pH bajos por parte de L. gasseri, no es solamente significativa por su aplicabilidad, sino que también representa un papel importante en el control de agentes patógenos, ya que favorece la inhibición de los mismos a lo largo del tracto intestinal, favoreciendo los sitios de adhesión de los microorganismos lácticos.
El valor obtenido durante la fase exponencial muestra que la cepa láctica posee características adecuadas de crecimiento en el medio MRS, además, el nivel de crecimiento es bueno para una posible producción de inóculos con miras a la obtención de probióticos, de acuerdo con ensayos reportados por Pérez-Luyo 39. Los resultados obtenidos a las 12 horas indican que la cepa alcanza niveles de crecimiento adecuados para colonizar la mucosa intestinal. En cuanto al consumo de azúcares por parte de L. gasseri, obtuvo un valor de 2,032 mg/l, lo cual permite inferir que la bacteria presentó un correcto aprovechamiento de los hidratos de carbono aportados por el medio MRS. Referente a lo anterior, Dellaglio et al. 40 señalan que algunos Lactobacillus permiten el empleo de una gran cantidad de fuentes de carbono, propiedad que resulta de un buen número de genes involucrados en el transporte y utilización del azúcar, este hecho va de la mano a lo encontrado en parámetro pH. Los valores encontrados indican que hay variación sin una tendencia evidente; así pues, se cree que puede existir una relación entre la fermentación de azucares y el pH, debido a que durante la fermentación los ácidos orgánicos resultantes se acumulan y se produce un gradual descenso del pH. El bajo pH (menor a 4,5-5,0) combinado con la alta concentración de ácidos orgánicos, principalmente ácido láctico, inhibe el crecimiento de microorganismos patógenos y de la mayoría de los microorganismos que alteran el producto. De esta forma, además de lograr que el producto sea seguro desde el punto de vista microbiológico, se extiende su tiempo de vida útil. Se determinó el consumo de proteínas cuyo valor fue de 0,65 mg/l en la fase exponencial, este consumo no muestra la tendencia como la que marca el consumo de azúcar, que es definida. Esta característica puede explicarse por la acción simultánea de la actividad proteolítica de la BAL y el consumo de proteínas. Jurado-Gámez et al. 41, encontraron un valor de proteína de 0,13 mg/L en medio MRS durante la fase exponencial para Lactobacillus gasseri, este valor difiere al reportado por L. gasseri en el presente, con un valor de 0,65 mg/L, característica importante en la observación del consumo de proteínas de la BAL.
En la determinación de porcentaje de ácido láctico, siguiendo los resultados por parte de Mishra y Lambert 42, la determinación de producción de ácidos orgánicos mostró que la cepa láctica es homofermentativa, dado que se encontró un porcentaje superior al 80% de ácido láctico en la muestra analizada. Este es un importante factor a tener en cuenta, debido a que el ácido láctico es el ácido con mayor poder de inhibición reportado en la literatura. Por su parte, González et al. 43 y Foo et al. 44 agregan que, debido al gran número de bacterias lácticas, sólo son de interés los géneros altamente productores de ácido láctico. Para la producción industrial de ácido láctico son de mayor importancia las bacterias lácticas homofermentativas, aquellas que sólo producen ácido láctico. Lo anterior resulta fundamental desde el contexto biotecnológico, ya que la cepa láctica en estudio mostró un comportamiento asociado a una importante producción del mismo, reportando un valor de 11,70g/L.
Con respecto los péptidos y aminoácidos encontrados de la cepa láctica, pueden estar relacionados a sustancias antimicrobianas. En este sentido, Leblanc et al. 45 señala que la capacidad proteolítica de las BAL juega un papel muy importante durante la fermentación de la leche, principalmente en el fraccionamiento de proteínas a péptidos y aminoácidos libres; algunos de estos péptidos presentan actividad biológica por lo que son considerados péptidos bioactivos. Siguiendo el concepto de péptidos bioactivos, es importante introducir la posible relación de los aminoácidos encontrados en el presente estudio, con la bacteriocina que produce la bacteria láctica, L. gasseri, conocida como gassericin A, así como también en casos aislados gassericin T y K7 46. Por consiguiente, autores como Trabi y Craik 47; Rivas y Andreu 48; Maqueda et al. 49 y Montalbán-López et al. 50, han reportado que la composición aminoacídica de las diferentes bacteriocinas producidas, en especial por una bacteria acido láctica, en este caso L. gasseri, pueden estar relacionadas al comportamiento antibacteriano de la misma; tal como lo reportan y afirman que esta bacteriocina es circular, constituida por ciclos continuos de uniones peptídicas, y por tanto, es una modificación que estabiliza su conformación nativa e incrementa la resistencia a la proteólisis. Así mismo, Sivonen et al. 51 señalan que la mayor parte de las proteínas circulares producidas por microorganismos son moléculas con actividad antimicrobiana (bacteriocinas, cianobactinas), caracterizadas por abundancia de aminoácidos hidrófobos y sin carga. Finalmente, es posible concluir que por lo mencionado, un punto importante es el contraste realizado de la cantidad relativa porcentual de la cepa láctica Lactobacillus gasseri y la cepa patógena Staphylococcus epidermidis, ya que mediante la composición aminoacídica del sobrenadante de la cepa láctica, es posible predecir el modo de acción de la misma sobre Staphylococcus epidermidis.
Se concluye que L. gasseri puede clasificarse como una bacteria con potencial probiótico, debido a la capacidad de inhibición sobre Staphylococcus epidermidis en condiciones in vitro, a su vez demostró viabilidad y un adecuado crecimiento en condiciones similares a las propuestas del tracto gastrointestinal en el presente estudio, lo anterior hace posible su evaluación en condiciones in vivo. Por otra parte, la identificación de los diferentes aminoácidos del sobrenadante en la cepa láctica L. gasseri hace posible determinar el modo de acción de los mismos, pues se asocian a actividad antimicrobiana, principalmente mediante péptidos bioactivos.