INTRODUCCIÓN
La explicación tradicional de las crisis focales epilépticas se hace a través del llamado modelo de áreas focales modulares y encapsuladas, las cuales tienen conexiones subcorticales que permiten la diseminación de la actividad anormal. Se postulan 3 tipos de áreas: a) La zona epileptógena (ZE) o foco epiléptico (FE), la cual sería el área fundamental de alteración o lesión implicada en la actividad eléctrica anómala, que daría origen a los fenómenos de activación para el reclutamiento hipersincrónico de la crisis; el FE también estaría involucrado en la actividad inhibitoria para finalizar la crisis 1,2. b) La zona de inicio de la crisis (ZIC), corresponde al área desde la cual se propaga la actividad eléctrica anómala; usualmente coincide con el FE 2,3. c) La zona sintomatológica (ZS), que sería el área elocuente de diseminación local de la actividad eléctrica, la cual genera los síntomas neurológicos; forman el substrato de la semiología de las crisis epilépticas focales y del análisis electro-clínico 1-6.
A pesar del relativo éxito de la cirugía del FE para el control de la epilepsia focal (EF), el modelo de áreas modulares capsulares ha sido criticado, dado el conocimiento creciente proporcionado por los estudios de la conectividad eléctrica cerebral, por lo cual se ha postulado una explicación basada en las propiedades intrínsecas de las redes neurales de la corteza cerebral para la comprensión de la actividad eléctrica de la EF, su diseminación eléctrica y sintomatológica 2,7. Esta actividad intrínseca de la red explicaría la organización eléctrica funcional inter-ictal que puede manifestarse en forma de comportamientos o expresiones cognitivas sutilmente diferentes. De igual forma se expone la propagación a través de mecanismos de sincronización y facilitación a otros nodos cercanos y distantes, no necesariamente conectados anatómicamente 2,7-11.
El modelo neuropsicológico tradicional explica las funciones cognitivas y sus alteraciones mediante el análisis clínico de los síntomas cognitivos, después de una lesión focal cerebral estable. Según este modelo modular, la actividad cognitiva depende de compartimientos funcionales encapsulados, centrados en la actividad de análisis y de síntesis de áreas cerebrales de asociación, las cuales están organizadas de forma jerárquica, lo que les confiere cierto nivel de especialización en una dimensión específica de cada función. De esta manera, cada área cortical tendría conexiones estructurales con otras zonas para garantizar la integridad de la función compleja. Las alteraciones funcionales se producirían tanto si la lesión ocurre en el área cortical o en los fascículos que conectan las diversas zonas de la corteza, produciendo síndromes de aislamiento funcional 12-14. Según este modelo las EF generarían más o menos alteraciones neuropsicológicas, específicas o generalizadas, relacionadas con la extensión del FE, las cuales se ponen en evidencia con la evaluación prequirúrgica. En el caso de las EF que afecten el lóbulo temporal (ELT), la función más alterada sería la memoria; en el caso de la epilepsia del lóbulo frontal (ELF), las funciones más afectadas serían la atención, el comportamiento motor y las funciones ejecutivas 15.
De otro lado, la neuropsicología cognitiva postula un modelo más allá de la localización, el cual se fundamenta en los postulados de los niveles de procesamiento de la información de la llamada psicología cognitiva o computacional. Según este modelo, las tareas neuropsicológicas tradicionales o, preferiblemente, las tareas cognitivas controladas, se ejecutan de una manera o de otra, con errores o sin ellos, o de forma más rápida o más lenta, dependiendo de los niveles de procesamiento que despliegue el individuo evaluado, según su familiaridad con el tipo de tarea y su estilo cognitivo. Esto será así independiente de si el individuo tiene o no una lesión cerebral 16-18. Lo anterior también ocurrirá cuando la actividad eléctrica asociada con el FE genera redes diferentes a las observadas en los sujetos sin esta actividad perturbadora, que necesariamente influyen en las redes responsables de los procesos cognitivos complejos. Este modelo neuropsicológico de los niveles de procesamiento de la información (neuropsicología cognitiva) parece ajustarse mejor a la explicación de redes neurales para la EF - tanto si se trata de síndromes de ELT como de síndromes de ELF - que el modelo tradicional de la neuropsicología conexionista 16,17.
La forma más frecuente de EF es la ELT. Entre el 65 % y el 80 % de los pacientes con EF, remitidos a evaluación especializada, corresponden a ELT, un tercio de ellos no responden a la medicación y son candidatos a cirugía de epilepsia. Hay eventos clínicos que suceden después de la descarga focal temporal durante la telemetría, como las llamadas auras uncinadas, gustativas, de dejà vus o de jamais vus, las autonómicas epigástricas con náuseas o vómitos, las auditivas, el miedo primario, la taquicardia y los automatismos oro-alimentarios. Estos síntomas específicos junto con un registro electroencefalográfico (EEG) confiable, durante la video-telemetría, tienen un valor de precisión localizadora para la ELT del 70 al 80 % (19,20).
Del grupo de pacientes con EF de localización extra-temporal, la más frecuente es la epilepsia del lóbulo frontal (ELF), el 40 % de estos casos son candidatos para cirugía de epilepsia. Las características clínicas observadas inmediatamente después de la actividad eléctrica focal frontal durante la video-telemetría son las siguientes: crisis muy frecuentes durante el sueño, movimientos distónicos, actividad hiper-motora, movimientos de pedaleo bilateral, crisis versivas, crisis motoras focales con o sin propagación jacksoniana. Las crisis de risa (gelástica) o de llanto son de más difícil localización, porque se pueden observar tanto en la ELT como en la ELF 21.
Según el modelo conexionista, la evaluación neuropsicológica prequirúrgica de la ELT supone alteraciones de la memoria, especialmente de la retención y el almacenamiento, por lesión focal del hipocampo y sus conexiones. En esa misma dirección, la ELF se asociaría a alteraciones de la atención, de la evocación y de la organización de las huellas de memoria, de la organización del comportamiento motor (apraxia ideational) y de las dimensiones de la función ejecutiva 15,22. Los pacientes con ELT izquierda presentarían usualmente alteraciones de la memoria verbal y aquellos con FE del lado derecho tendrían alteraciones de la memoria viso espacial de puntos. Sin embargo, la aparición de desenlaces cognitivos inesperados posquirúrgicos generan explicaciones poco claras, atribuibles a impactos a distancia de la lesión resecada, sin establecer con precisión la naturaleza de este impacto 23,25. Desde este modelo estructuralista, las alteraciones de las habilidades visoperceptuales, incluyendo las dificultades en el reconocimiento visual simultaneo y el reconocimiento de rostros, se relacionarían con las epilepsias del cuadrante posterior (ECP), por eso las tareas que exploran estas funciones sólo se incluyen en los protocolos de los pacientes con análisis electro-clínico que sugieren ECP 21,24-27.
En este estudio se intenta establecer cuáles serían las alteraciones viso-perceptuales en una muestra de pacientes adultos con síndromes electro-clínicos compatibles con ELT o con ELF, según la video-telemetría, residentes en la ciudad de Medellín, Colombia, comparados con un grupo de personas sin epilepsia. La hipótesis de trabajo que se postula sería la de que algunas habilidades viso-perceptuales y de la memoria visual estarían alteradas en los síndromes compatibles con epilepsias de localización anterior. Se intentará dar una explicación a estas alteraciones desde el modelo conexionista de la neuropsicología tradicional y desde el modelo de niveles de procesamiento interaccionista de la neuropsicología cognitiva.
Participantes
La muestra de pacientes estuvo conformada por 19 pacientes del programa de cirugía de epilepsia del Laboratorio de Correlación Electro-Clínica (CEC-LAB) de la IPS Universitaria de la Universidad de Antioquia-Clínica León XIII, de la ciudad de Medellín-Antioquia, Colombia; 10 (52,6 %) mujeres, con una mediana de edad de 43±12,3 (IC95 %: 37,1-48,9) años. Todos los pacientes habían sido estudiados con un protocolo neurológico para determinar de forma confiable la localización del foco epiléptico, como parte de la evaluación previa, que establecería los criterios de elección como candidatos a posible cirugía de epilepsia, utilizando equipos de 32 canales y video telemetría de 24 a 144 horas, con disminución progresiva de la medicación, hasta obtener el registro de al menos 3 eventos, durante el cual se realizaba una evaluación breve de la actividad cognitiva del paciente, para determinar su estado de conciencia, la comprensión y expresión del habla, la retención y evocación de información verbal y visual, el reconocimiento de objetos, la lectura y la escritura. Un panel de 2 neurólogos, expertos en semiología y electrofisiología de epilepsia, determinaron la localización del FE o ZE de manera inequívoca, de acuerdo con las características de la actividad eléctrica, la ZIC y su propagación, además del análisis de la semiología de la crisis, que definía la ZS. En este estudio sólo se incluyeron sujetos cuya concordancia electro-clínica en establecimiento del FE (ZE) fuese absolutamente clara, aunque se admite cierta imprecisión en la definición de su lateralidad.
Con este procedimiento 13 pacientes (68 %) fueron clasificados como síndrome electro-clínico compatible con ELT y 6 sujetos (32 %) como síndrome electro-clínico compatible con ELF. 11 pacientes (57,9 %) tuvieron una lateralización predominante izquierda de su FE, 6 (31,6%) el FE fue predominante derecho y en 2 (10,5 %) el FE se clasificó como bilateral. De estos pacientes, 6 (31,6 %) con síndromes ELT fueron sometidos a cirugía de epilepsia, confirmándose la validez de la localización. Por tratarse de epilepsias fármaco-resistentes, remitidos al programa de cirugía de epilepsia, la mayoría de los pacientes recibían politerapia (65 %) o monoterapia en altas dosis. La edad de inicio de la epilepsia fue de 19,5±12,2 (IC95 %: 12,2-26,8), el tiempo de evolución 23,2±13,5 (IC95 %:16,7-29,7), y el número de crisis por mes de 1,21±1,2 (IC95%: 0,64-1,8). Se seleccionaron además 16 personas sin epilepsia, 9 (47,4 %) mujeres, edad 41,8±12,7 (IC95 %:35,1-48,6). En las tablas 1 y 2 se resumen las características demográficas de los participantes, tanto de los sujetos sin epilepsia como de ambos grupos de EF (ELT y ELF).
Tabla 1 Características sociodemográficas de 16 controles y 19 pacientes con EF.
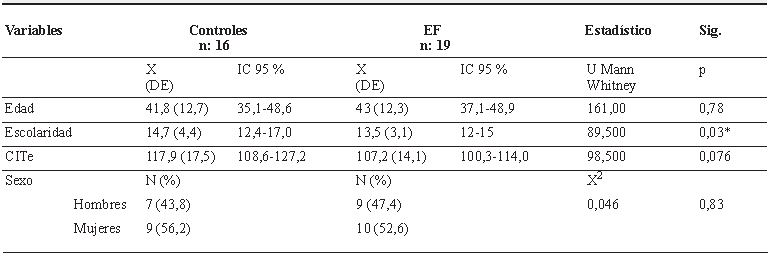
X: promedio. DE: desviación estándar. EF: Epilepsia focal. CITe: capacidad intelectual total estimada. n: frecuencia. X2: Chi-cuadrado. Nivel de significancia * p ≥ 0,05.
Tabla 2 Comparación de las características demográficas de 16 controles, comparados con 13 pacientes con ELT y 6 de ELF

X: promedio. DE: desviación estándar. ELT: Epilepsia lóbulo temporal. ELF: epilepsia lóbulo frontal. CITe: capacidad intelectual total estimada. n: frecuencia. X2: Chi-cuadrado. Nivel de significancia * p ≤ 0,05.
Se excluyeron participantes con historia de esquizofrenia, depresión mayor, retraso mental o que estuvieran tomando antipsicóticos, con diagnóstico de alcoholismo o de uso y abuso de substancias, o que tuviesen alteraciones sensoriales visuales, que no corrigieran con lentes, o con deficiencias auditivas que requirieran dispositivos externos, en ambos grupos. En el grupo de controles se excluyeron además personas con antecedentes personales de crisis epilépticas.
A los participantes se les aplicó un protocolo de evaluación de la capacidad intelectual total estimada (CITe) y de las habilidades viso-perceptuales, que incluyó tareas para el reconocimiento de objetos, imágenes esquemáticas, orientación de líneas, figuras superpuestas, rostros de personajes famosos y, finalmente, una tarea de memoria viso-espacial de puntos. Estas tareas no formaban parte del protocolo de evaluación neuropsicológica estandarizada, que se aplica de rutina, para el examen cognitivo pre-quirúrgico a los pacientes con síndromes compatibles con ELT y ELF. Las comparaciones se hicieron tanto entre los controles y los 19 pacientes de EF, como entre los controles y los 13 sujetos con síndrome compatible con ELT y los 6 pacientes con síndrome compatible con ELF.
Capacidad intelectual total estimada (CITe)
Escala Wechsler de Inteligencia (WAIS III): instrumento clínico para evaluar de manera individual la capacidad intelectual de personas entre los 16 y los 89 años. Se empleó la 3a edición 28. Para esta investigación, se obtuvieron las puntuaciones compuestas a partir de un prorrateo de las puntuaciones típicas de 4 sub-pruebas, 2 verbales (semejanzas y vocabulario) y 2 de ejecución (figuras incompletas y diseño con cubos), con lo cual se obtuvo la CITe, de acuerdo con lo recomendado por el compendio de pruebas neuropsicológicas, para objetivos investigativos 29.
Pruebas de análisis
Batería de habilidades viso-perceptuales:
Sub-pruebas del Test de Barcelona - Revisado (TBR): es un instrumento neuropsicológico diseñado para evaluar la lesión focal cerebral o la disfunción por problemas neurodegenerativos. Del TBR, se utilizaron sub-pruebas que sirven para evaluar dominios de las habilidades viso-perceptuales:
Denominación viso-verbal: a) Denominación de imágenes: evalúa el reconocimiento visual por descripción verbal. Se le presentan las imágenes al evaluado, quien debe definir cada una en un máximo de 30 segundos. Puntuación máxima 14, que se establece teniendo en cuenta el tiempo total para su ejecución. b) Denominación de objetos presentados visualmente: evalúa el reconocimiento visual de objetos. La misma consigna y tiempo límite del anterior. Puntuación máxima 6. Estas sub-pruebas permiten además hacer una estimación de la velocidad en el reconocimiento y en la denominación, que evaluaría la velocidad en el procesamiento cognitivo visual de entrada y verbal de producción.
Test de discriminación de imágenes superpuestas: evalúa la discriminación visual (reconocimiento perceptivo e integrativo de figura-fondo). Este test estuvo dividido en 3 partes, la primera para el reconocimiento de objetos reales, se presentan 4 imágenes complejas y el examinado debe identificar los 4 objetos superpuestos que se encuentran en cada imagen compleja, los cuales selecciona entre un conjunto de 8 opciones. La misma dinámica se utiliza con una imagen compleja con 4 dibujos superpuestos sin sentido y, otra tarjeta con 4 dibujos desde una perspectiva inusual. Puntuación máxima 24.
Orientación espacial de líneas: es una tarea clínica y de investigación, diseñada para valorar las funciones viso-perceptivas (orientación espacial) sin necesidad del uso de procesos motores. Hay dos maneras de administración (forma V y forma H), se presentan 30 estímulos con 5 reactivos de práctica, la persona debe elegir dos líneas que formen el ángulo que corresponda a la imagen previamente presentada. Puntuación máxima 30 30.
Test de memoria visual de puntos: evalúa la memoria secuencial viso-espacial en pacientes con ELT y con epilepsias extratemporales. El modo de administración es individual y, consiste en la presentación sucesiva de 8 tarjetas numeradas del 1 al 8, las cuales contienen un arreglo rectangular de líneas de cierre del rectángulo y sus dos diagonales. Cada tarjeta tiene 4 puntos negros y un punto blanco, el cual aparece en una posición diferente en cada una de las tarjetas (en la 1 en el centro, en la 2 en el ángulo superior a la derecha, en la 3 en el ángulo inferior de la derecha, etc). El evaluador muestra cada una de las 8 tarjetas de manera seriada, con un intervalo de 2 entre una y otra, le señala el número de la tarjeta y la colocación en el espacio del punto blanco. Se hace una primera presentación sin instruir que se va a memorizar la secuencia, por eso se supone que esta primera presentación evalúa memoria implícita o memoria operativa visual. La respuesta se da pidiéndole al sujeto que señale en una tarjeta con 9 puntos negros, que señale dónde observó el punto blanco en la tarjeta 1, en la 2, en la 3, etc. Se registran las respuestas del reconocimiento correcto o incorrecto de cada tarjeta. Se hacen presentaciones adicionales, como máximo 5 ensayos, o hasta cuando el sujeto identifique de manera correcta la secuencia de los 8 puntos blancos en relación con los 4 puntos negros de cada tarjeta. En los ensayos sucesivos sólo se muestran las tarjetas en las que la posición del punto blanco ha sido señalada de manera errónea. A los 5 minutos se hace un reconocimiento diferido de la posición de la secuencia de los 8 puntos blancos en el orden adecuado. Se supone que este reconocimiento diferido evalúa el almacenamiento en memoria visual a largo plazo. Puntuaciones: volumen inicial (span), volumen máximo, número de ensayos, evocación diferida a los 5 minutos 31.
Reconocimiento facial de rostros de personajes famosos: tarea que se construyó siguiendo las instrucciones sugeridas para la evaluación del reconocimiento de rostros, propuesta por Ardila y Ostrosky 32. La tarea consistió en la presentación de 20 imágenes fotográficas impresas en blanco y negro, luego de ser manipulada por computador su definición y contraste, disminuyendo el 50 % de los pixeles de la fotografía original de alta definición, de personajes públicos y muy conocidos de la política, las artes y el deporte. Al presentar la imagen estímulo, la persona debía emparejarla con un grupo de 40 fotografías de alta definición, entre las que estaban los personajes presentados y otros 20 personajes famosos, usados como distractores. Puntuación máxima 20.
PROCEDIMIENTOS
Inicialmente se hizo una revisión de la base de datos con los pacientes atendidos durante el año 2015. Se seleccionaron los pacientes con epilepsias focales que contaran con evaluación neurológica, neuropsicológica y estudios por video-telemetría. Se citaron los pacientes con EF y con 11 grados de escolaridad mínimo (bachillerato). Para el grupo control se buscaron personas externas o, se les pidió a los pacientes invitar algún familiar que tuviera características demográficas similares a las del grupo de pacientes. Con todos los participantes se coordinaron citas de aproximadamente hora y media, en el laboratorio de Psicología de la USB para la realización de una entrevista, con el fin de revisar los antecedentes clínicos, además se les aplicó la prueba de inteligencia prorrateada para excluir las personas con coeficiente intelectual menor de 85. Finalmente, quienes cumplieron con los criterios de inclusión, fueron evaluados con el protocolo neuropsicológico para habilidades viso-perceptuales y de memoria viso-espacial. Desde el primer llamado para citación se hizo la lectura de los objetivos de la investigación, lectura y discusión del consentimiento informado y su firma ante un testigo no vinculado al grupo investigador.
Declaración del impacto ambiental
La realización del proyecto de investigación y su difusión no generó riesgos a nivel social y/o ambiental para la ciudad de Medellín, ni en las instituciones participantes, ni en las viviendas de los pacientes.
Consentimiento informado
A los participantes de los dos grupos se les leyó un consentimiento informado, que incluía los objetivos del estudio. Este consentimiento informado había sido aprobado por los comités de bioética de la IPS Universitaria de la Universidad de Antioquia, Clínica León XIII y de la Universidad de San Buenaventura de Medellín. La participación fue voluntaria, no hubo compensación económica.
Confidencialidad
La entrevista y las pruebas neuropsicológicas se consideran procedimientos sin riesgo a nivel médico. Se garantizó el derecho a la intimidad, manejando la información recogida durante la evaluación a un nivel confidencial absoluto y se registró la base de datos usando un código que garantizara el anonimato de cada sujeto. La información personal recogida permanecerá en secreto y no será proporcionada a ninguna persona diferente al paciente o a los profesionales de la Clínica León XIII encargados del tratamiento. A los cuestionarios de las evaluaciones les fue asignado un código para no revelar la identidad de cada paciente. Sólo los investigadores estrictamente responsables con el estudio tendrán acceso al código y a la identidad verdadera para poder ser localizados en la base de datos. El participante pudo tener la certeza que su información personal y resultados nunca se divulgarán a través de ningún medio de manera individual.
Relaciones entre los investigadores, las instituciones y el respeto por los derechos de autor
Se estableció con claridad la autoría principal del proyecto de investigación, el derecho de los coautores para el respectivo reconocimiento en la difusión y en las publicaciones, garantizando el respeto por los derechos de autor, en las citaciones y lista de referencias. También se expresa el cumplimiento de los créditos y los reconocimientos explícitos de las instituciones que aportaron financiación para la realización del estudio.
Declaración de conflicto de intereses
Esta investigación se hizo con fines puramente académicos como un proyecto para que la autora principal cumpliera con su requisito de trabajo de grado para obtener su título de magíster en neuropsicología. Los autores y coautores no declaran ningún conflicto de intereses en la presentación de los datos de la investigación.
Análisis estadístico
Se describieron las características sociodemográficas, clínicas y el desempeño en las tareas de habilidades viso-perceptivas y memoria viso-espacial de los grupos de estudio. Con las variables categóricas se calcularon frecuencias y porcentajes, para las variables continuas se calculó el promedio como medida de tendencia central y la desviación estándar con su correspondiente intervalo de confianza (IC) del 95 % como mediciones de la dispersión/ precisión.
Para las comparaciones de las variables categóricas se calculó el Chi cuadrado. Se utilizó la prueba no paramétrica U de Mann Whitney para comparación de 2 grupos con variables que no tenían distribución normal según el test de Kolmogorov Smirnov. Por esa misma razón se usó la prueba no paramétrica de Kruskal Wallis, para la comparación de 3 grupos (controles, ELT y ELF). Para los análisis estadísticos se usó el software IBM SPSS statistics versión 23. Se estableció como nivel de significación estadística para el control del error tipo alfa un valor p < 0,05.
RESULTADOS
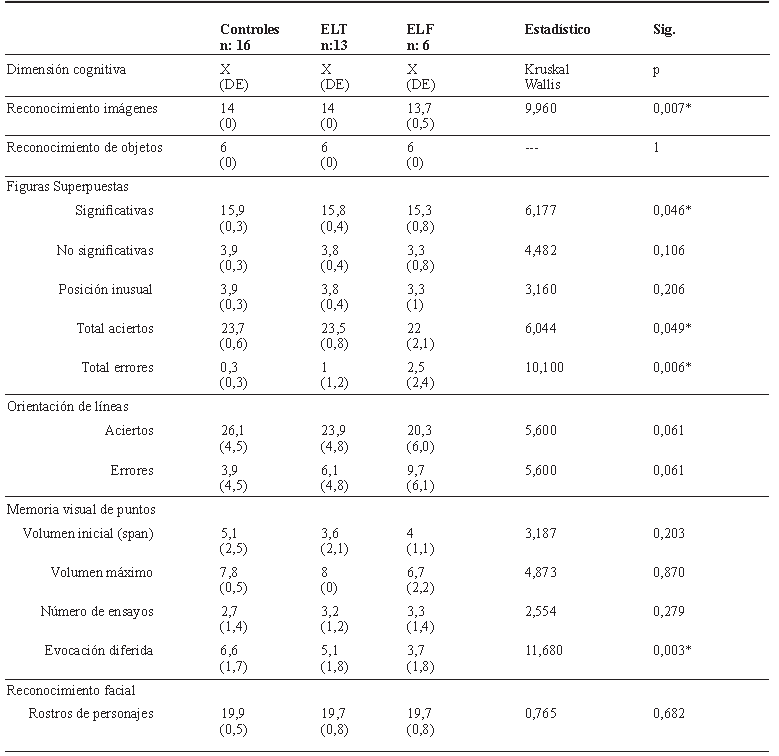
En el análisis de comparación entre los controles y los pacientes con EF se observó que los pacientes tuvieron un mayor número de errores al discriminar imágenes superpuestas, lo cual fue estadísticamente significativo (p < 0,05). También se observó una ejecución a los controles en la tarea de orientación viso-espacial de líneas, con un mayor número de errores, lo cual también fue estadísticamente significativo (p < 0,05). Además, se encontró una evocación inferior diferida por reconocimiento en la prueba de memoria visual de puntos (p < 0.05) (tabla 3).
Tabla 3 Ejecución en tareas de procesamiento viso-perceptual de 16 controles y 19 pacientes con EF
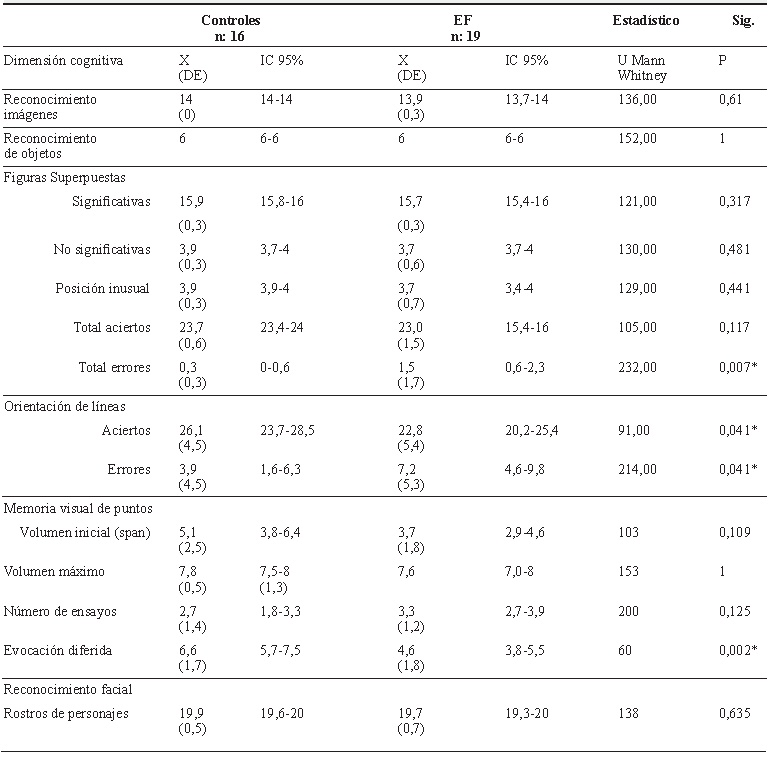
X: promedio. DE: desviación estándar. EF: epilepsia focal. Nivel de significancia * p ≤ 0,05.
Al hacer la comparación de los controles y de los pacientes con ELT y aquellos con ELF, se encontró una ejecución en la tarea de discriminación de imágenes de los pacientes con ELF, al compararse con los de ELT y los controles (ELF < ELT < control), lo cual fue estadísticamente significativo (p < 0,05). También se observó una menor puntuación en la identificación de figuras superpuestas significativas en los pacientes con ELF, mientras que los pacientes con ELT puntuaron igual a los controles; esto también fue estadísticamente significativo (p< 0,05). En la puntuación del total de aciertos de las figuras superpuestas hubo una puntuación significativamente menor de los pacientes de ELF en relación con los de ELT y los controles, con un mayor número significativo de errores (p < 0,05). También se observó una capacidad de evocación diferida significativamente más baja en los pacientes con ELF comparados con los pacientes de ELT y los controles (ELF < ELT < controles). Estos datos mostraron significación estadística (p < 0,05) (tabla 4)
DISCUSIÓN
En esta muestra de pacientes con EF se encontró un número significativamente mayor de errores en la tarea de figuras superpuestas; además, en la ejecución de la tarea de orientación viso-espacial de líneas, se observó un menor número de aciertos y un mayor número de errores. Lo anterior sugiere una alteración específicamente viso-perceptual en estos pacientes, dado que estas dos tareas no tienen guía verbal para su ejecución. Estos datos contrastan con lo esperado para pacientes con ELT o ELF, o anteriores. Los estudios informan alteraciones de la memoria - en el almacenamiento - en el caso de la ELT; o de la organización y la evocación, en el caso de la ELF 15,34. De igual manera se deben esperar alteraciones de la atención y de las dimensiones de las funciones ejecutivas en los pacientes con ELF y del lenguaje en la ELT izquierdo. Las altera ciones visoperceptuales no se consideran como hallazgos usuales 15,32-34. En esta muestra, en la que la mayoría de los pacientes tuvieron síndrome electro-clínico de ELT, se encontró, como era de esperarse, un reconocimiento diferido significativamente más bajo en la memoria visual de puntos. Sin embargo, a pesar de que en la mayoría de los pacientes (65 %) el predominio de la actividad inmediatamente pre-ictal del FE estaba localizado del lado izquierdo, la alteración significativa del almacenamiento de la memoria visual es un hallazgo relativamente inesperado o atípico; aunque nuestro análisis no está enfocado en el gradiente lateral de los hallazgos. No obstante, la mayoría de los autores - que se apoyan en el modelo modular - argumentan que la evaluación de la memoria verbal y la memoria visual con pruebas específicas permitiría la localización lateral del FE en los pacientes con ELT 15,22,24,25,32-34. Contrario a este supuesto, en un estudio con 426 pacientes diestros, se encontraron perfiles neuropsicológicos de la memoria visual y verbal atípicos hasta en un 75 % de los pacientes con ELT por esclerosis mesial (EM), con una alteración mayor de la memoria visual en pacientes con EM izquierda, y mayor trastorno de la memoria verbal en pacientes con EM derecha. Los desenlaces posquirúrgicos también fueron atípicos en el gradiente lateral de las tareas de memoria verbal y visual. Si bien, la severidad de las alteraciones de la memoria se relacionó más con la extensión de la hipocam-pectomía anterior que con la severidad o la atipicidad de los problemas de memoria prequirúrgicos 23.
Los hallazgos del estudio actual, los cuales pudieran considerarse atípicos, en relación con alteraciones de algunos procesos viso-perceptuales, en esta pequeña muestra de pacientes de EF anterior, no apoyarían el modelo focal modular encapsulado del FE o de la ZE, tal como si se tratara de una lesión focal cerebral estable. Este modelo ha sido asumido por la mayoría de los grupos de cirugía de epilepsia, y es el fundamento electro-clínico para tomar las decisiones de extirpación del FE 3-6,19-21,33-35. Este modelo se acopla a un modelo de funciones neurop-sicológicas modulares, encapsuladas y localizadas, y con integración a través de conexiones estructurales por fascículos anatómicamente bien definidos por neuro-imágenes, especialmente la resonancia magnética con tensión difusión 12-15,20-22,32-35.
Los hallazgos no esperados de algunas alteraciones en tareas viso-perceptuales, que supuestamente dependerían de regiones localizadas en áreas posteriores y que deberían asociarse a epilepsias del cuadrante posterior 26,27,35, estarían más a favor del modelo que asume al FE como una red, la cual estaría relacionada con una actividad eléctrica dinámica, tanto en estado ictal como en el período interictal, que tendría modificaciones en las actividades perceptuales y de memoria, generadas por los cambios de sincronización funcional de la actividad que se disemina a partir del FE, lo que no necesariamente se produce por conexiones estructurales 1,2,25. Esta dinámica permanente explicaría la actividad eléctrica cambiante del FE, a través de un modelo de redes neurales complejas, con excitaciones eléctricas altamente correlacionadas, tanto de forma lineal como difusa, con regiones vecinas y con áreas distantes, incluso sin que se necesiten conexiones a través de fascículos, para generar la sincronía alterada, tanto en estado ictal como interictal 1,2,9-11. De forma similar, hay modelos neuropsicológicos dinámicos, basados en la teoría de procesamiento variable de la información, que explican mejor las alteraciones de las ejecuciones de las tareas cognitivas, más allá del supuesto de su emergencia como producto de la actividad local de una zona cortical específica 17. Sin negar la localización de actividades específicas y modulares primarias para el procesamiento automático; los datos tienden a mostrar que hay muchas áreas corticales con conexiones eléctricas funcionales integradoras, lo cual se puede poner en evidencia a través de los análisis de sincronía y coherencia, lo que indica conectividad eléctrica focal o a distancia, incluso, sin que haya mediación de tractos anatómicos 12,17. Es claro, entonces, que la actividad cognitiva compleja se explica mejor con el modelo de procesamiento de información en módulos flexibles y dinámicos, eléctricamente y magnéticamente correlacionados, de forma lineal o difusa, que se modifican, dependiendo de la naturaleza de la información de entrada, su organización y su forma de presentación (contexto). Además de la red de esquemas internos de información almacenada en memoria, los cuales se activan con la nueva entrada; también deben desplegarse procesos de integración y organización en los analizadores perceptuales y motores, y abrirse rutas particulares para la síntesis comportamental, todo lo cual llevará a generar una respuesta de salida coherente con la nueva información 16-18,25.
Si bien durante los procesamientos automáticos es posible localizar actividades cognitivas que se procesan predominantemente por guía perceptual y atencional de abajo arriba; para una tarea novedosa la ruta de procesamiento de información se hará tanto de abajo arriba como de arriba abajo, complejizando las redes neurales que intervendrían, y su localización sería diseminada, requiriendo la participación simultánea y secuencial de áreas anteriores y posteriores 17,18. Así por ejemplo, para la tarea de discriminación de figuras superpuestas, en la que hemos colocado estímulos con componentes significativos de facilitación, así como componentes no significativos de distracción, y componentes confusos por sus posiciones inusuales, para una persona no familiarizada con este tipo de manipulaciones perceptua-les, probablemente requerirá la activación de los circuitos perceptuales viso-espaciales de entrada, con activación de los analizadores sensoriales de la retina, los relevos de análisis binocular en el cuerpo geniculado lateral, los analizadores organizados en columnas modulares y encapsuladas de contrastes de la corteza calcarina (área 17 de Brodman). Si el procesamiento fuese automático, probablemente habría una síntesis visual en las áreas 18 y 19 con una respuesta a través de conexiones directas con áreas fronto-temporales, hacia las áreas de producción del lenguaje (respuesta verbal), o de la actividad motora (respuesta por señalamiento). Estas conexiones llamadas fascículos longitudinales superior, medio e inferior han sido detalladamente descritos con tractografía con resonancia magnética del cerebro 12,20. Sin embargo, como la tarea ha sido manipulada para que no sea familiar y bloquear el procesamiento automático, necesariamente debe generarse un procesamiento complejo, para lo cual deben activarse mecanismos de control inhibitorio, que sería un proceso necesario para bloquear la respuesta prepotente automática inmediata. La integración perceptual motora debe hacerse en un nivel de procesamiento superior, probablemente más difuso, que tendrá que movilizar áreas motoras de rastreo visual y manual (áreas 6 y 8 de Brodman), para activar los movimientos sacádicos de los ojos y la orientación manual del estímulo. Además debe activar áreas de control secuencial y de estimación del tiempo, acoplar la información reverberante en memoria operativa con la información disponible en memoria a largo plazo, para redirigir el procesamiento de arriba abajo, y posteriormente hacer los ajustes indispensables para dar una respuesta adecuada al problema perceptual inusual planteado 16-18,36. Como se puede inferir, todas estas actividades dependerían de áreas diseminadas en la corteza cerebral; especialmente en los lóbulos frontales y temporales. La activación de redes complejas de gran amplitud y de actividad computacional intrincada se despliega. Esto se hace a partir de la sincronización simultánea y secuencial, una vez que el estímulo de entrada relacionado sincroniza la activación de la red posterior occipito-parietal, lo que conducirá a la sincronización de redes atencionales, de memoria y de procesamiento ejecutivo 36-39.
El modelo de redes de actividad intrínseca excitatoria, que llevaría al reclutamiento con hipersincronización ictal del FE, su propagación y su inhibición hasta llegar a la actividad por reorganización eléctrica interictal 7-11, se acopla mejor a este modelo neuropsicológico de niveles de procesamiento, con activaciones diferenciales de las redes de computación cognitiva 36-39. Desde esta perspectiva es posible explicar, de manera plausible, los llamados hallazgos inesperados (para el modelo de módulos encapsulados); como, por ejemplo, el observar que pacientes con ELF tengan más alteraciones en el almacenamiento de información visual que los pacientes con ELT, con una tarea que controla el proceso de almacenamiento, pues la respuesta se solicita por reconocimiento viso-espacial. Según el modelo tradicional, las alteraciones de la memoria de tipo frontal se generan por fallas en el esfuerzo de la evocación cuando no hay claves o no existe el apoyo externo del reconocimiento de la información. Es obvio que el modelo conexionista puede explicar la alteración cognitiva relacionada con la lesión focal. La estrategia que dio origen a la observación de los síntomas neuropsicológicos tradicionales y a la estructuración de los llamados síndromes neuropsicológicos clásicos provino de la observación detallada de pacientes con lesiones focales bien documentadas con neuro-imágenes, usando tareas protocolizadas y estandarizadas, para construir los llamados perfiles de lesión cortical. Sin embargo, es muy probable que este modelo no aplique de forma adecuada a las alteraciones cognitivas de la EF, cuya generación obedece a dinámicas electrofisiológicas que se difunden a través de redes de activación y computación de alta complejidad 1,2,16-18,36-40. Por eso se postula que el modelo de la neuropsicología cognitiva puede explicar mejor los niveles del procesamiento diferencial de la información visual, partiendo desde sus componentes, independizándola del procesamiento de la información semántica y de la información lexical en actividades de memoria para comprender sus modificaciones en los síndromes de ELT 41 . Al igual que se pudiera explicar la presencia de alteraciones de las habilidades en el reconocimiento de objetos y figuras, con disociación por preservación de la orientación visoespacial en un paciente con síndrome de ELT derecho durante el estado interictal. Y explicar la razón por la cual este impedimento despareció luego de un año de la hipo-campectomía anterior, al controlarse de manera completa las crisis epiléptica y de desaparecer la actividad epileptogénica 42 . Aunque hay numerosas conexiones anatómicas entre el hipocampo anterior y las áreas occipitales, no es usual encontrar informes acerca de este hallazgo de alteraciones visoperceptuales en pacientes con ELT. Es posible que esto ocurra porque no se buscan detalladamente. La aparición de estos problemas visoperceptuales, además de los esperados problemas de memoria visual, también pudieran ser producto de la correlación sincrónica de la actividad eléctrica del hipocampo con áreas de procesamiento visual en la corteza occipital y parietal. En fin, son hipótesis que ameritan un análisis más detallado de los procesos cognitivos en las EF, que vaya más allá de la localización de funciones específicas, relacionadas directamente con el FE, según el modelo neuropsicológico tradicional. Para romper con las limitaciones de este modelo, se necesitaría analizar con más detalle los procesos involucrados en cada tarea y analizar las medidas de conectividad cortical, correlacionadas con el foco epiléptico, tanto en estado ictal como interictal, incluyendo comparaciones entre la conectividad en reposo, que incluya las ventanas que tengan actividad visualmente normal, comparadas con las ventanas que presenten actividad anormal, como una nueva forma de buscar explicaciones mejores a los llamados hallazgos cognitivos inesperados, tanto en la etapa prequirúrgica como posquirúrgica de la EF.
Es obvio que este pequeño estudio transversal adolece de algunas fallas metodológicas que limitan su generalización y llevan a que sus resultados deban ser asumidos con bastante precaución. La muestra estudiada es pequeña, así que es probable que exista un error de tipo II de aceptación de hipótesis nula, o de igualdad entre grupos, de algunas variables en las que se observan tendencias de ejecuciones alteradas en los pacientes. No se pudo controlar estadísticamente ni por diseño la escolaridad de los grupos, a pesar de tener una Cíe similar. La definición del tipo de epilepsia fue por análisis electro-clínico, sin confirmar por cirugía, en la mayoría de la muestra; quiere decir que existe la probabilidad de un error en la localización precisa del FE, la cual ha sido estimada en alrededor del 20 %, aún en manos de epileptólogos expertos 19,21.