Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.25 no.1 Medellín Jan./Mar. 2012
Artículos originales
Experimental culture of Cyclopina sp with differentsmicroalgae’s species¤
Cultivo experimental de Cyclopina sp con diferentes especies de microalgas
Cultura experimental de Cyclopina sp com diferentes espécies de microalgas
Javier A Ruiz-Guzmán1, Profesional en Acuicultura; César A Jiménez Velásquez1, Profesional en Acuicultura; Catalino Gomes Romero1, Profesional en Acuicultura; Martha J Prieto Guevara1*, MSc.
1 Laboratorio de Alimento Vivo. Grupo de investigación CINPIC, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba.
(Recibido:31 agosto,2010; aceptado: 15 noviembre, 2011)
Summary
Copepods are the main natural prey for most marine fish and other marine crustaceans and their nauplius, thus playing a fundamental role in aquatic food webs. There is a need to investigate the potential of copepods species found in Colombian coasts for the development of marine aquaculture. Objective: evaluate the performance of the marine copepod Cyclopina sp fed with different microalgae species. Methods: experimental cultures were conducted in 10 L aquariums with an initial density of 2 copepods/ mL, constant aeration and 24 h light. Treatments consisted of feeding the copepods with a combination of two microalgae species in a 70:30 ratio, at concentrations of 4x105 cells/mL, as follows: T1 = Tetraselmis suecica + Isochrysis galbana, T2 = I. galbana. + Nannochloropsis oculata, T3 = N. oculata. + T. suecica, T4 = Yeast (Saccharomyces cerevisiae). Temperature (ºC), salinity (%), dissolved oxygen (mg/L), pH, were registered daily, and the growth and population dynamics were evaluated every 48 hours for 15 days. Results: the greater density of total copepods (10± 3 copepods/ml) and number of nauplii (6 ± 2 nauplii/ mL), were registered on day 15 in T1, being significantly different (p<0.05) from any other treatments. Conclusions: the best growth and reproduction were attained in copepod populations fed with the combination of microalgae T. suecica + I. galbana (T1).
Key words: copepod, phytoplankton, population growth.
Resumen
Los copépodos son la principal presa natural para la mayoría de larvas de peces y crustáceos marinos y sus nauplios como alimento vivo representan un papel fundamental en la sobrevivencia de las larvas. Objetivo: establecer el potencial de especies de copépodos presentes en las costas colombianas para el desarrollo de la piscicultura marina, siendo objetivo de esta investigación, evaluar el desempeño del copépodo marino Cyclopina sp alimentado con diferentes especies de microalgas. Métodos: cultivos experimentales se realizaron en acuarios con volumen útil de 10 litros, a densidad inicial de 2 copépodos/ ml, con aireación y luz constante. Combinaciones de microalgas (proporción 70:30) en concentración 4x105 cel/ml. Se usaron como tratamientos: T1 = Tetraselmis suecica + Isochrysis galbana, T2 = I. galbana + Nannochloropsis oculata, T3 = N. oculata + T. suecica, T4 = Levadura (Saccharomyces cerevisiae). Diariamente se registró la temperatura (ºC), salinidad (‰), oxígeno disuelto (mg/L), pH y se evaluaron cada 2 días el crecimiento y la composición poblacional durante el tiempo de cultivo. Resultados: la mayor densidad de copépodos totales (10 ± 3 copépodos/ml) y el mayor número de nauplios (6 ± 2 nauplios/ ml), se registraron el día 15 en T1, mostrando diferencias significativas (p<0.05) respecto a los demás tratamientos. Conclusión: los mejores crecimiento y composición poblacional, se registraron en las poblaciones alimentadas con la combinación de las microalgas T. suecica e I. galbana (T1).
Palabras clave: copépodo, crecimiento poblacional, fitoplancton.
Resumo
Os copépodos são a principal presa natural para a maioria de larvas de peixes e crustáceos marinhos e seus náuplios como alimento vivo desempenhan um papel fundamental na sobrevivência das larvas. Objetivo: estabelecer o potencial de espécies de copépodos presentes nas costas colombianas para o desenvolvimento da piscicultura marinha, sendo o objetivo desta pesquisa avaliar o desempenho do copépodo marinho Cyclopina sp alimentado com diferentes espécies de microalgas. Métodos: culturas experimentais foram realizadas em aquarios com volume útil de 10 litros, densidade inicial de 2 copépodos/ ml, com aeração e luz constante. Combinações de microalgas (proporção 70:30) em concentração 4x105 cel/ml, foram usadas como tratamentos: T1 = Tetraselmis suecica + Isochrysis galbana, T2 = I. galbana + Nannochloropsis oculata, T3 = N. oculata + T. suecica, T4 = Levadura (Saccharomyces cerevisiae). Foi registrada diariamente a temperatura (°C), salinidade (‰), oxigênio dissolvido (mg/L) e pH. A cada dois días foram avaliados o crescimento e composição populacional durante o tempo de cultivo. Resultados: a maior densidade de copépodos totais (10 ± 3 copépodos/ml) e o maior número de náuplios (6 ± 2 náuplios/ ml), foram registrados no día 15 do T1, apresentando diferença estatística significativa (p<0.05) em comparação com os outros tratamentos. Conclusõe: o maior crescimento e composição populacional foi registrado na população alimentada com a combinação de microalgas T. suecica e I. galbana (T1).
Palavras chave: copépodos, crescimento populacional, fitoplâncton.
¤ Para citar este artículo: Ruiz-Guzmán JA, Jiménez CA, Gomes C, Prieto MJ. Cultivo experimental de Cyclopina sp con diferentes especies de microalgas. Rev Colomb Cienc Pecu 2012; 25:97-105.
* Autor para correspondencia: Martha J Prieto Guevara. Universidad de Córdoba, Grupo de investigación CINPIC, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia Correo electrónico: alimvi@hotmail.com
Introducción
Los copépodos son principales constituyentes del plancton marino y por consiguiente la principal presa viva natural para la mayoría de larvas de peces y crustáceos (Støttrup, 2006). Esta condición los hace muy importantes como alimento vivo en larvicultura comercial, principalmente de peces marinos, donde han mostrado ser el alimento adecuado y preferido por las larvas (Payne y Rippingale, 2001; Hernández y Álvarez-Lajonchére, 2003). Los copépodos presentan superioridad nutricional en términos de altos niveles de proteína, mejor balance de aminoácidos y ácidos grasos esenciales respecto al rotífero Brachionus plicatilis y nauplios de Artemia (Payne et al., 2001; McKinnon et al., 2003), son también fuente de enzimas digestivas, carotenoides y otros componentes esenciales (Evjemo etal., 2003; Prieto et al., 2006).
Diversas especies de copépodos han sido estudiadas para su aprovechamiento en acuicultura, entre estos se mencionan los calanoides de los géneros Acartia, Centropages y Eurytemora; los harpacticoides de los géneros Tisbe, Tigriopus y Euterpina; y los ciclopoides de los géneros Oithona y Apocyclops. Muchos estudios en copépodos se han enfocado a su nutrición, reproducción y aspectos fisiológicos, y las técnicas de producción han tenido un buen desarrollo primariamente a escala de laboratorio; sin embargo, el desarrollo en este campo ha sido fragmentado y los progresos hacia las técnicas de cultivos en masa a gran escala aún son incipientes (Støttrup, 2006).
En Colombia, principalmente en la región Caribe, se vienen realizando, esfuerzos conjuntos entre entidades como Ceniacua, Ceiner y La Estación Acuícola Bahía Málaga, con el fin de implementar tecnologías para el aprovechamiento y desarrollo de la piscicultura marina; siendo las etapas de reproducción y larvicultura las que han merecido inicialmente la atención de los investigadores; dado que los nauplios de copépodos desempeñan un papel fundamental como alimento vivo excelente con efectos directos en la sobrevivencia de las larvas.
Surge entonces la necesidad de establecer la potencialidad de especies de copépodos presentes en las costas colombianas y con este objetivo se realizaron ensayos de crecimiento poblacional en cultivos experimentales del copépodo marino Cyclopina sp, con el objetivo de determinar su bilidad en la producción de alimentos vivos alternativosenacuiculturamarina.
Materiales y métodos
Sitio de estudio
El estudio se realizó en el Laboratorio de Alimento Vivo de la Universidad de Córdoba sede Lorica, ubicado en el Municipio de Santa Cruz de Lorica (Córdoba), entre los 9° 13’ latitud norte y 75° 49’ longitud oeste. Con una altitud de 7 msnm.
Cultivo experimental
Los cultivos experimentales se realizaron en acuarios de vidrio con volumen útil de 10 litros, agua de mar filtrada (0.2 µm), aireación, luz constante y densidad de siembra de 2 copépodos/ ml. Se emplearon diferentes combinaciones de microalgas en proporción 70:30, en concentración 4x105 cel/ml, siendo: 1) Tratamiento 1 (T1) = Tetraselmis suecica + Isochrysis galbana, 70:30; 2) Tratamiento 2 (T2) = Isochrysis galbana + Nannochloropsis oculata, 70:30; 3) Tratamiento 3 (T3) = Nannochloropsis oculata + Tetraselmissuecica, 70:30; 4) Tratamiento 4 (T4 = Control) = Levadura (Saccharomicesserevisiae) 100%.
Las microalgas se cultivaron en agua de mar filtrada (0.2 μm), clorinada y esterilizada con luz UV, nutrida con el medio de cultivo f/2 de Guillard y Ryther (1962), con temperatura media de 26 °C, aireación y luz constante; bajo condiciones de laboratorio. Se registró diariamente la temperatura (ºC), salinidad (‰), oxígeno disuelto (mg/L) (YSI 85 modelo # 85/10 ft. YSI Incorporate, Ohio. USA) y pH (pHmeter Acument® Basic, modelo AB15 Fisher Scientific).
Crecimiento y composición poblacional en cultivo
Se determinó la densidad de las poblaciones de copépodos en cultivo/día mediante el conteo en placas Sedgwick-rafter de cinco alícuotas de 2 ml en cada unidad experimental, previa homogenización de los cultivos y discriminando los estadios nauplio, copepodito y adulto. Acorde a las ecuaciones propuestas por González de Infante (1988), se determinó la tasa instantánea de crecimiento (R) y tiempo de duplicación (Td) (R=(LnNt1–LnNt0) / (t1 – t0 ), Td = Ln2 / R; Ln = logaritmo neperiano; Nt1 / Nt0 = número final / inicial de copépodos/ ml;t1 /t0 = tiempo final / inicial). La producción diaria (Pd) se determinó como el cociente entre el número de organismos y el tiempo de cultivo así: Pd = (Nt1 – Nt0) / (t1 – t0). Para mantener las concentraciones descritas por tratamiento, diariamente se determinó en cada unidad experimental la concentración de microalgas (D), mediante recuento en placa Neubauer empleando la ecuación propuesta por Paniagua et al. (1986): D = C*10 *1.000 (C= promedio de organismos contados; 10= factor de multiplicación debido a la profundidad cámara (0.1 mm) y 1.000= valor para convertir a mililitro).
Se determinó una ecuación de ajuste (y = atb℮(ct)) para el crecimiento de las poblaciones de copépodos totales y nauplios, basada en los registros de crecimiento durante el tiempo de cultivo, con la cual se proyectó el crecimiento y estimó el día de máxima densidad de organismos en ambos casos para cada tratamiento; siendo “y” la respuesta, “t” el tiempo de cultivo en días, “a, b” y “c” los coeficientes de la ecuación.
Diseño y análisis estadísticos de los resultados
Los cultivos se realizaron bajo un diseño completamente al azar (DCA) y modelo estadístico Yij =μ+Tj+eij, con cuatro tratamientos y tres repeticiones, para un total de doce unidades experimentales. Los datos se analizaron en el programa estadístico SAS (8.2 de 1999 - 2001); se aplicó análisis de varianza de una vía y el test de Duncan de comparación de medias para establecer la incidencia (p<0.05) de las diferentes dietas en el crecimiento poblacional de los copépodos en cultivo. Los resultados se expresaron como promedios ± desviación estándar.
Resultados
El mayor crecimiento poblacional de Cyclopina sp en cultivo, la mayor densidad de copépodos totales registrada el día 15 (10 ± 3 copépodos/ml), así como la mayor densidad de nauplios registrada el día 15 (6 ± 2 nauplios/ml) se presentó igualmente en las poblaciones alimentadas con las microalgas T. suecica + I. galbana (T1) con diferencia estadística significativa (p<0.05) respecto a los demás tratamientos (Figuras 1 y 2). La mayor densidad de copepoditos y adultos se registró en T3 el día 11 y 21, respectivamente, oscilando en ambos casos entre 3 y 1 organismos/ml, sin registrar diferencias significativas (p<0.05) entre tratamientos (Figura 2).
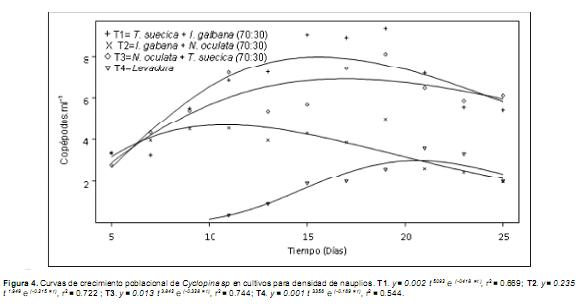
La temperatura promedio y condiciones ambientales fueron similares entre los tratamientos (Tabla 1), excepto en T4, tratamiento que presentó menores valores de salinidad, pH y oxígeno disuelto (p<0.05). El ajuste de las curvas de crecimiento para copépodos totales (r2=0.811) y nauplios (r2=0.669), mostró que en ambos casos, la máxima densidad de organismos corresponde a las poblaciones alimentadas con T. suecica + I. galbana (T1) (Figuras 3 y 4), observando los intervalos de confianza para las densidades máximas en cada caso (Tabla 2).
En cuanto a los parámetros de productividad de los cultivos, las mayores velocidades de crecimiento (R y Td) y mejores producciones de organismos (Pd) para copépodos totales y número de nauplios, se registraron en las poblaciones alimentadas conT. suecica + I. galbana (T1), con diferencias significativas (p<0.05) respecto a los demás tratamientos (Tabla 3). Basados en la ecuación de ajuste, parámetros para copépodos totales (r2=0.811) y nauplios (r2=0.669) estimados para el día de máxima densidad en cada tratamiento, muestran de igual manera que las poblaciones alimentadas con (T1), presentan la mejor tasa de crecimiento, menor tiempo de duplicación y mayor producción diaria de organismos en ambos casos (Tabla 3).
Discusión
Los mejores crecimientos y composición poblacional se registraron cuando se alimentó con T. suecica + I. galbana, seguidos por las poblaciones alimentadas con N. oculata + T. suecica, lo que refleja una preferencia en la alimentación de Cyclopina sp por las microalgas flageladas (móviles) grandes, en este caso T. suecica que fue
la de mayor tamaño (12 ± 1 µm de largo y 9 ± 1 µm de ancho) respecto a I.galbana(7 ± 0.3 µm de largo y 5 ± 0.4 µm de ancho) y N.oculata(4 ± 1 µm de diámetro), y estuvo presente en ambos tratamientos. Al respecto, muchas investigaciones sobre las estrategias de alimentación de los copépodos, muestran que en general hay una mayor preferencia por las microalgas móviles y otros organismos zooplanctónicos, puesto que el movimiento incrementa la probabilidad de encuentro entre el depredador y la presa, y también estimula los mecanismos de detección de alimentos de los copépodos (Williamson y Reid, 2001; Yang et al., 2010).
Resultados similares indican que el copépodo Paracyclopina nana al igual que muchos otros ciclopoides se desarrollan bien al ser alimentados con microalgas, teniendo una preferencia por las flageladas T. suecica (13 ± 1.4 µm de largo y 7 ± 1.4 µm de ancho) e I. galbana, (5 ± 0.8 µm de diámetro), logrando mayor densidad poblacional (96.3 ± 13.6 - 119.0 ± 13.6 copépodos/ml) y tasa de crecimiento especifico (0.14 ± 0.015 – 0.16 ± 0.016) con estas microalgas solas o en combinación con otras microalgas (Lee et al., 2006).
De igual manera Torres (2008) registró para Oithona sp un ciclopide de tamaño similar (938.5 ± 14.6 µm de largo y 288.5 ± 9.9 µm de ancho) a Cyclopina sp (736.0 ± 39.1 µm de largo y 223.1 ± 9.1 µm de ancho), los mejores resultados en cuanto a producción de nauplios (2.2 nauplios/ml), crecimiento poblacional (3 copépodos/ml), tasa de crecimiento específico (0.64 ± 0.03), tiempo de duplicación (1.09 ± 0.06 días) y producción diaria (0.36 ± 0.08 nauplios), cuando se alimentó con T. sueca (12.5 µm), respecto a las poblaciones alimentadas con N. oculata (2.5 µm) las cuales se desarrollaron hasta su estadio adulto sin lograr reproducirse. Estos resultados concuerdan con los obtenidos en la presente investigación con Cyclopina sp, donde se registraron los mejores resultados para estos mismos parámetros cuando se alimentó con T. suecica + I. galbana (Figura 2, Tabla 3).
Algunos autores señalan que el umbral de alimentación en los copépodos disminuye con el tamaño de la presa, porque es energéticamente más eficiente la captura de presas grandes respecto a las de menor tamaño, igualmente a mayores concentraciones, al ser más disponibles (Almeda et al., 2010). En este sentido se puede explicar el menor crecimiento poblacional registrado cuando se alimentó con las microalgas de menor tamaño I. galbana (7 ± 0.3 µm de largo y 5 ± 0.4 µm de ancho) + N. oculata (4 ± 1 µm de diámetro) (T2), considerando que el balance energético entre lo invertido en la captura y la cantidad de alimento ingerido, es menor respecto a las poblaciones donde se alimentó con T. suecica que fue la microalga de mayor tamaño (12 ± 1 µm de largo y 9 ± 1 µm de ancho) entre la usadas (T1 y T3).
De otro lado, investigaciones señalan que los copépodos ciclopoides Apocyclops royi (Su et al., 2005) y Oithonasp(Torres, 2008), se desarrollaron hasta su estadio adulto pero no lograron producir huevos cuando se alimentaron con la microalga N. oculata como única dieta. De manera similar Lee et al. (2006), reportó que los nauplios de P. nana alimentados con las microalgas Chorella elliopsidae y alimento balanceado comercial a base de Chorella vulgaris, no se desarrollan hasta adultos y sufren mortalidades en masa. Al respecto se ha señalado que estas microalgas cocales (N. oculata, C. elliopsodae y C. vulgaris) tienen una pared celular relativamente dura y poco digerible respecto a las flageladas (Payne y Rippingale, 2001; Lee etal., 2006). Los resultados de esta investigación concuerdan con lo expuesto anteriormente, sustentando que N. oculata no se muestra como una microalga recomendable para la alimentación de copépodos ciclopoides en cultivo.
En contraste, otro estudio reporta el mejor crecimiento poblacional (132.66 ± 34.0 copépodos/5ml) y la mayor producción de nauplios (105.33 ± 48.52 nauplios/5ml) del copépodo ciclopoide A. distans cuando fue alimentado con la microalga T. chuii, siendo la de mayor tamaño (9-10 µm de ancho y 12-14 µm de largo) entre las demás usadas tales como N. oculata (1.5-2.5 µm de diámetro) y Dunaliella salina (5-8 µm de ancho y 7-12 µm de largo) (Velásquez et al., 2001). Los resultados de la presente investigación, reflejan una tendencia en la alimentación de Cyclopina sp, por la microalga flagelada de mayor tamaño T. suecica (12 ± 1 µm de largo y 9 ± 1 µm de ancho); reafirman lo expuesto por varios autores como se indicó anteriormente, respecto a la preferencia de los copépodos ciclopoides por la alimentación con microalgas flageladas grandes.
La levadura (5 ± 1 µm) suministrada como dieta única (T4) no fue un alimento adecuado, limitando el crecimiento de las poblaciones en cultivo, las cuales estuvieron durante la mayor parte del tiempo, con densidad inferior o igual a la inicial (2 copépodos/ml) (Figura 1). Esto indica que la reproducción estuvo restringida hasta los últimos días de cultivo, donde se registró un leve incremento poblacional (3 ± 1.4 copépodos/ml) (Figura 1); paralelamente, no se observó durante los conteos, estadios naupliares entre los días 3 y 15, ni copepoditos entre los días 5 y 19, mientras que en las demás poblaciones alimentadas con las diferentes combinaciones de microalgas, se registraron todos los estadios (nauplios, copepoditos y adultos) durante todo el tiempo de cultivo. Resultados similares han sido reportados para el calanoide Gladioferens imparipes, con mortalidades antes de alcanzar la maduración, cuando fueron alimentados con levadura (Payne y Rippingale, 2000). Al respecto se ha señalado que la levadura no tiene contenidos de ácidos grasos comparables a los de diversas microalgas, especialmente la proporción DHA:EPA, que ha sido descrita como esencial en la sobrevivencia y producción de huevos en copépodos, y un criterio de mayor importancia que los contenidos individuales de estos ácidos grasos esenciales (Payne y Rippingale, 2000; Lee et al., 2006). En contraste, la levadura en combinación con microalgas ha sido usada por varios autores en el cultivo de copépodos con buenos resultados (Payne et al., 2001; Hernández y Álvarez-Lajonchére, 2003).
La salinidad más baja y el menor valor de oxígeno disuelto del agua se registró en los acuarios donde se alimentó con levadura (T4), con relación a los acuarios donde se alimentó con microalgas (T1, T2 y T3) (Tabla 1). Lo anterior es debido al incremento de salinidad como resultado de la evaporación normal durante el tiempo de cultivo y debido a la carencia de fotosíntesis como una fuente de oxígeno. El pH mantuvo valores dentro de un rango normal para el agua marina en todos los tratamientos (Tabla 1).
Se debe señalar que en el ajuste de las curvas de crecimiento a la ecuación descrita, no se usaron los datos del primer conteo (día 3 del cultivo), que corresponden a la fase de adaptación de la población y no describen la fase de crecimiento poblacional, de mayor importancia para proyectar el manejo de la población en cultivo. De este modo, la ecuación de ajuste para las curvas de crecimiento a partir del segundo conteo (día 5 de cultivo), describe un comportamiento similar al registrado durante el tiempo de cultivo para las poblaciones totales de copépodos y la proporción de nauplios dentro de esta (Figura 3 y 4). Los mejores valores de r2en el ajuste de las curvas de crecimiento para copépodos totales, respecto a la proporción de nauplios, se pueden explicar considerando que al contar número total de copépodos (sumatoria de los estadios nauplio, copepodito y adulto), se obtienen valores más homogéneos y que denotan una tendencia de crecimiento más definida, respecto al conteo de un estadio en particular dentro de la población (en este caso los nauplios).
En conclusión, los mejores resultados tanto en crecimiento y composición poblacional (entendida como la mayor proporción de nauplios dentro de la misma), se registraron en las poblaciones alimentadas con T. suecica + I. galbana (T1), con diferencias significativas (p<0.05) respecto a los demás tratamientos, y se reflejó una tendencia en la alimentación de Cyclopina sp, por T. suecica, la microalga flagelada de mayor tamaño (12 ± 1 µm de largo y 9 ± 1 µm de ancho) entre las usadas.
Agradecimientos
Al laboratorio de Alimentos Vivos de la Universidad de Córdoba, por facilitar sus instalaciones para el desarrollo del presente estudio. Al profesor Mario Morales del departamento de Ciencias Básicas e Ingeniería de la Universidad Córdoba, por su colaboración y asesoría en la parte estadística.
Referencias
1. Almeda R, Augustín CH, Alcaraz M, Calbet A, Saiz E. Feeding rates and gross growth efficiencies of larval developmental stages of Oithona davisae (Copepoda, Cyclopoida). J Exp Mar Bio Ecol 2010; 387:24-35. [ Links ]
2. Evjemo J, Reitan K and Olsen Y. Copepods as live food organisms in the larval rearing of halibut larvae (Hippoglossus hippoglossus L.) with special emphasis on the nutritional value. Aquaculture 2003; 227:191-210. [ Links ]
3. García A editores. Avances en Nutrición Acuícola VIII. VIII Symposium internacional de Nutrición Acuícola; Nuevo León 15-17 de Noviembre de 2006. Monterrey: Universidad autónoma de Nuevo León; 2006. p.62-83. [ Links ]
4. González de Infante A. El Plancton de las aguas continentales. Washington D.C.: Secretaria general de la O.E.A. Serie de biología: Monografía N° 33; 1988. [ Links ]
5. Guillard R, Ryther J. Studies of marine planktonic diatoms. I Cyclotella nana Hustedt and Detonula confervacea (Cleve) Gran. Com J Microbiol 1962; 229-398. [ Links ]
6. Hernández O, Álvarez-Lajonchére L. Culture experiments with OithonaoculataFarran, 1913 (Copepoda: Cyclopoida), and its advantages as food for marine fish larvae. Aquaculture 2003; 219:471-483. [ Links ]
7. Lee K, Park H, Lee S, Kang H. Effects of diets on the growth of the brackish water cyclopoid copepod Paracyclopina nana Smirnov. Aquaculture 2006; 256:1-4. [ Links ]
8. Mckinnon A, Duggan S, Nichols P, Rimmer M, Semmens G, Robino B. The potential of tropical paracalanid copepods as live feeds in aquaculture. Aquaculture 2003; 223:89-106. [ Links ]
9. Paniagua J, Buckles F, Granados C, Loya D. Manual de metodologías y alternativas para el cultivo de microalgas. México: CICESE; 1986. p.93. [ Links ]
10. Payne M, Rippingale R, Cleary J. Cultured copepods as food for West Australian fish Glaucosoma hebraicum and pink snapper Pagrus auratus larvae. Aquaculture 2001; 194:137-150. [ Links ]
11. Payne M, Rippingale R. Evaluation of diets for culture of calanoid copepod Gladioferens imparipes. Aquaculture 2000; 187:85-96. [ Links ]
12. Payne M, Rippingale R. Intensive cultivation of the calanoid copepod Gladioferens imparipes. Aquaculture 2001; 201:329- 342. [ Links ]
13. Prieto M, Castaño F, Sierra J, Logato P, Botero J. Alimento vivo en la larvicultura de peces marinos: copépodos y mesocosmos. Rev MVZ Córdoba 2006; 11:30-36. [ Links ]
14. Støttrup J. Review on the Status and Progress in Rearing Copepods for Marine Larviculture. Anvantages and Disadvantages Among Calanoid, Harpacticoid and Cyclopoid Copepods. En: Cruz L, Ricque D, Tapia M, Nieto M, Villarreal D, Puello [ Links ]
15. Su H, Cheng S, Chen T, Su M. Culture of copepods and applications to marine finfish larval rearing in Taiwan. In: Lee C, O´Bryen P, Marcus N. Copepods in Aquaculture editors. Oxford UK: Blackwell Publishing; 2005. p.183-194,354. [ Links ]
16. Torres GA. Cultivo experimental de los copépodos marinos Oithona sp y Cyclopina sp. [Trabajo de grado]. Montería: Universidad de Córdoba; 2008. [ Links ]
17. Velásquez A, Rosas J, Cabrera T, Millan J, Hernández M. Efecto de Tetraselmis chuii, Nannochloropsis oculata y Dunaliella salina sobre el crecimiento poblacional de Apocyclops distans (Copépoda, Cyclopidae) en diferentes condiciones de temperatura e iluminación. Rev Biol Mar Oceanogr 2001; 36:189-197. [ Links ]
18. Williamson CE, Reid JW. Copepoda. En: Thor J, Covich A editors. Ecology and classification of North American freshwater invertebrates. 2nd ed. USA: Academic Press; 2001. p.915-954. [ Links ]
19. Yang E, Ju S, Choi J. Feeding activity of the copepod Acartia hongi on phytoplankton and micro-zooplankton in Gyeonggi Bay, Yellow Sea. Estuar Coast Shelf Sci 2010; 88:292-301
[ Links ]