Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
DYNA
Print version ISSN 0012-7353
Dyna rev.fac.nac.minas vol.80 no.177 Medellín Jan./Feb. 2013
CARACTERIZACIÓN AMBIENTAL DE LAS VINAZAS DE RESIDUOS DE CAÑA DE AZÚCAR RESULTANTES DE LA PRODUCCIÓN DE ETANOL
ENVIRONMENTAL CHARACTERIZATION OF STILLAGE FROM SUGAR CANE WASTE FROM THE PRODUCTION OF ETHANOL
VANESSA ZÚÑIGA CERÓN
Administradora ambiental, Universidad Autónoma de Occidente, Cali, Colombia. vanzuce098@hotmail.com
MARIO ANDRÉS GANDINI AYERBE
Dr. Ing. Universidad Autónoma de Occidente, Cali, Colombia. magandini@uao.edu.co
Recibido para revisar Enero 20 de 2012, aceptado Diciembre 7 de 2012, versión final Enero 8 de 2013
RESUMEN: El siguiente artículo presenta los resultados de la caracterización ambiental de las vinazas resultantes de la producción de etanol de segunda generación a partir de dos fuentes: la primera, de substratos sintéticos producidos en el laboratorio que simulan las condiciones de los residuos de caña, y la segunda, a partir de los hidrolizados de residuos de caña de azúcar. Esto con el fin de identificar alternativas de tratamiento que disminuyan su impacto y potencial de contaminación. Se determinaron parámetros de importancia para la calidad de las mismas, como son Demanda Biológica de Oxígeno (DBO5), Demanda Química de Oxígeno (DQO), sólidos en suspensión, nitratos, fosfatos, etc. los cuales arrojaron una menor carga contaminante al compararse con las resultantes de otros procesos cuya materia prima es diferente. Sin embargo, contienen altos valores de DBO5 y DQO, así como de nitratos, fosfatos y sólidos totales, que exceden la legislación colombiana para vertimientos de efluentes.
PALABRAS CLAVE: Vinazas, DQO, DBO5, hojas, cogollos, residuos agroindustriales, etanol, biocombustible.
ABSTRACT: This paper presents the results of the environmental characterization of the stillage from the production of second generation ethanol from two sources: the first is the synthetic substrate produced in the laboratory to simulate the conditions of cane waste, and the second comes hydrolyzed of sugar cane waste. This is to identify treatment alternatives to reduce their impact and its contamination potential. In the characterization of stillage were determined important parameters for the quality of them, such as Biochemical Oxygen Demand (BOD5), Chemical Oxygen Demand (COD), suspended solids, nitrates, ammonia, phosphates, etc. It was found that the stillage have a lower pollutant load when it is compared to other stillage from a process with a different raw material. However, they have high BOD5 and COD values, as well as, nitrates, phosphates and total solids which exceed the Colombian law for effluent discharges.
KEYWORDS: Stillage, COD, BOD5, leaves, top cane, agro-industrial waste, ethanol, biofuel.
1. INTRODUCCIÓN
Los residuos de la cosecha de caña de azúcar (hojas y cogollos) representan una dificultad para los ingenios azucareros ya que su disposición final da origen a problemas de contaminación y salubridad, como son la presencia de plagas, malos olores, y generación de gases de efecto invernadero, estos últimos producidos por la quema de la caña. Es por ello que la industria busca soluciones que apuntan hacia la conversión de sus residuos a subproductos de los cuales se puede obtener un beneficio económico, al tiempo que disminuye los impactos al ambiente. Este es el caso, no solo de los residuos de caña sino también de las vinazas, residuo generado en la obtención de este combustible de segunda generación.
La vinaza, que puede definirse como el efluente resultante de la producción de alcohol a partir de la fermentación y la destilación de una materia prima [1], en este caso, residuos de caña de azúcar, se caracteriza por ser un líquido de color marrón, con un gran contenido de sólidos suspendidos, olor a miel final y sabor a malta [2].
Este residuo presenta pH bajo, altos valores de DQO y DBO5, gran contenido de sólidos en suspensión, entre otros [1; 2, 3; 4]. Por ello, se considera como un residuo líquido que impacta negativamente el ambiente, especialmente, al recurso hídrico, ya que disminuye la luminosidad de las aguas, la actividad fotosintética, y el oxígeno disuelto [5] producen además eutrofización del agua, contribuye al aumento de poblaciones de insectos y vectores, y como resultado al desarrollo de enfermedades [3]. Por ésta razón se han propuesto diversas alternativas de tratamiento, de uso y reutilización de modo que el impacto pueda ser reducido e incluso eliminado [1, 4, 5, 6, 7, 8].
En la presente investigación se evaluaron las características fisicoquímicas de las vinazas generadas del proceso de obtención de etanol a partir de residuos de caña de azúcar, con el fin de buscar alternativas de tratamiento que permitan disminuir el impacto ambiental de las mismas en el ecosistema.
2. MÉTODOS
La caracterización ambiental de las vinazas se realizó a partir de dos substratos de fermentación. Los primeros fueron los sintéticos, cuya fuente de carbono fue la glucosa, xilosa y sacarosa en dos concentraciones diferentes (18g/L y 40g/L) y una fuente de nitrógeno (urea y extracto de levadura). Además se utilizaron 3 cepas diferentes (AM44, AM45 y AM89). Los segundos, se realizaron a partir de los hidrolizados directos (enzimáticos) de los residuos de caña de azúcar, más un cuarto microorganismo (P. stipitis) usado como control [9].
2.1. Proceso de obtención de etanol a partir de residuos de caña de azúcar
A continuación se presentan las etapas llevadas a cabo para la obtención de etanol a partir de hojas y cogollos de la caña de azúcar.
2.1.1. Adecuación de la materia prima: Se realizó la molienda de las hojas y cogollos, para después tamizarlos. Para la siguiente etapa y de acuerdo con estudios previos [10], se escogieron los residuos tamizados con mallas serie Tyler Mesh 40, 20 y fondos (0.331 y 0.165 pulgadas, respectivamente).
2.1.2. Deslignificación: De acuerdo con estudios previos se realizó una mezcla de hojas de caña (60%) y de cogollos (40%). Para este proceso se siguió la metodología por organosolvente [10, 11]. Finalizado esto, el material se lavó y se llevó a refrigeración.
2.1.3. Hidrólisis: Para realizar la hidrólisis, se siguió el procedimiento descrito en [11]. El material se descongeló y se llevó a secar a estufa a 50°C hasta que el peso fue constante. Realizado esto, la relación sólido - liquido fue de 10% (p/v). Posteriormente, se agregó un coctel de enzimas y se dejó en baño maría a 50°C, durante 48 horas.
2.1.4. Fermentación: Para llevar a cabo este proceso se filtró el material hidrolizado y se llevó al shaker en erlenmenyers con 200 ml de muestra, donde se le agregaron por separado las cepas AM44, AM45, AM89 y P. stipitis. Y se dejó actuar durante tres días. Además se agregaron diferentes sales como ZnSO4, MgSO4, NH4SO4, KH2PO4, Na2HPO4 y FeSO4.
2.1.5. Destilación: Para realizar la separación de componentes y obtener la vinaza, se empleó una columna de destilación fraccionada. El rango de temperaturas que se manejó para la destilación fue de 65°C hasta 75°C. Ésta se realizó en promedio durante 2 horas. La temperatura de ebullición para el mosto fermentado fue de 96°C.
2.2. Caracterización de las vinazas
Para determinar la carga contaminante presente en las vinazas de residuos de caña, se midieron los siguientes parámetros fisicoquímicos, los cuales son los principales a medir al tratarse de los usos del agua y vertimientos de residuos líquidos a fuentes hídricas, lo cual está reglamentado por los decretos 3930 de 2010, 1594 de 1984 y la resolución 3957 de 2009, y para potabilización del agua se consideraron algunos parámetros de las resoluciones 12186 de 1991 y 2115 de 2007, ya que en las anteriores normas no se especifica el valor (concentración) del parámetro analizado [12, 13, 14, 15, 16].
2.2.1. Demanda Bioquímica de Oxígeno (DBO5): Para realizar la medición de DBO5 se siguió el método respirométrico en el equipo Lovibond Oxidirect. Se verificó el funcionamiento hasta el término de 5 días.
2.2.2. Demanda Química de Oxígeno (DQO): El método usado fue el de Dicromato de potasio que se llevo a cabo a través de un Digestor DQO Hach [17].
2.2.3. Nitratos: El método que se utilizó es el de reducción de cadmio, número 8039, según el manual de procedimientos del espectrofotómetro 2010 de Hach [17].
2.2.4. Fosfatos: El método que se utilizó es el del Phos Ver 3 (Ácido Ascórbico) identificado en el manual de procedimientos del espectrofotómetro 2010 de Hach como el método 8048, adaptado de Standard methods for the Examination of Water and Wastewater [17].
2.2.5. Sólidos Suspendidos Totales (SST): La medición de este parámetro se realizó en el espectrofotómetro Hach 2010, por el método fotométrico (8006) [17].
2.2.6. Sólidos Disueltos (SD): Para medir estos sólidos se utilizó el conductivimetro Hach Sension 5 el cual arroja el dato de la cantidad de SD presentes en la muestra.
2.2.7. Sólidos Totales (ST): Es la sumatoria de los sólidos disueltos y los sólidos suspendidos totales.
2.2.8. Turbiedad: Para medir la turbiedad se utilizó el Turbidímetro Hach 2100 P.
2.2.9. Conductividad, salinidad, temperatura, pH: La medición de estos parámetros se realizó en el conductivimetro Hach Sension 5.
2.2.1. Amoniaco: La medición de este parámetro se realizó siguiendo el método de Salicilato número 10031 con el espectrofotómetro Hach 2010 [17].
2.2.11. Sulfatos: El método que se utilizó es el número 8051 descrito en el manual de procedimientos del espectrofotómetro 2010 de Hach [17].
3. RESULTADOS
3.1. Substratos sintéticos
Se destilaron 6 substratos de fermentación en Erlenmeyer y 8 substratos de fermentación en Bioreactor. Los ensayos de Erlenmeyer (cada uno de 200 ml) corresponden a los ensayos D, G, I, J, L y F (3 muestras c/u, equivalente a cada cepa) (Tabla 1).
De los primeros tres ensayos, no se obtuvo etanol, contrario a los tres últimos donde se obtuvo pero en bajas concentraciones, esto puede explicarse debido a el proceso mismo de destilación (en laboratorio) y tipo, debido a que es un proceso de uso industrial donde se manejan cuantiosos volúmenes [18, 19]. Los ensayos en Bioreactor (Tabla 2) se realizaron con las tres cepas igualmente, con diferentes concentraciones de fuente de carbono y con una única fuente de nitrógeno (extracto de levadura) y con un volumen de trabajo de 1 L y 1.5 L cuando era alimentado.
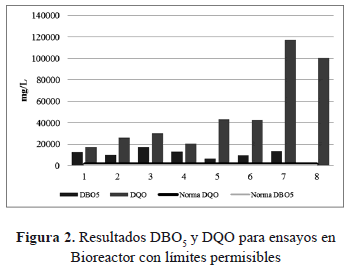
3.1.1. Caracterización de vinazas: Una vez el mosto fermentado fue destilado y se generaron las vinazas, se realizaron las mediciones de los parámetros de calidad de agua descritos en la metodología. De acuerdo con los resultados se puede afirmar que las vinazas de substratos sintéticos (Erlenmeyer y Bioreactor) en general tienen una tendencia en su pH a ácido - neutro, presentan un alto contenido de sólidos en suspensión que van desde 700 hasta 4.500 mg/L. En cuanto a la DQO, los resultados van desde 10.200 hasta 22.000 mg/L para los ensayos en Erlenmeyer y para los ensayos en Bioreactor de 17.300 a 43.000 mg/L excepto por un par de muestras cuyos valores están entre 100.000 y 117.000 mg/L (esto podría explicarse ya que los microorganismos no asimilaron correctamente el contenido de sales en el medio durante la fermentación [20, 21, 22]), lo que de cualquier forma excede las normas de calidad de agua y de vertimientos de aguas residuales.
En el caso de la DBO5 y para los ensayos en Erlenmeyer los valores estuvieron entre 6.200 y 12.400 mg/L, el rango de los nitratos fue de 122 hasta 600 mg/L y las concentraciones de fosfatos de 10 hasta 62 mg/L. Por otro lado, para los ensayos en Bioreactor la concentración de BDO5 estuvo en el rango de 6.700 hasta 17.100 mg/L, los nitratos de 60 a 182 mg/L y fosfatos de 17 a156 mg/L.
Según la caracterización ambiental, los parámetros de calidad de las vinazas están por debajo de los reportados para caña de azúcar, yuca y sorgo [2, 23, 24]. Sin embargo, siguen estando por encima de los límites permisibles.
De acuerdo con las figuras 1 y 2, las concentraciones registradas de DQO para los ensayos en Erlenmeyer y Bioreactor presentaron valores fluctuantes. No obstante, los valores de Bioreactor tuvieron variaciones más pronunciadas. Mientras que el rango en Erlenmeyer iba de 10.000 a 22.000 mg/L, en el otro fue de 17.000 mg/L hasta 43.000 sin contar las ya mencionadas ocasiones en las que el número de la concentración ascendió a 100.000 y 117.000 mg/L. La diferencia en dichas fluctuaciones podría ser atribuida a las condiciones de operación en el proceso de fermentación, ya que para ambos ensayos fueron distintas y es por esto que no pueden ser comparables.
Para el caso de la DBO5, el ensayo en Erlenmeyer mostró valores consistentes con la DQO. Por otro lado, los valores de DQO en los ensayos de Bioreactor no se aproximan a los de DBO5. Esto puede ser debido a las sales que son agregadas al medio durante el proceso de fermentación y a los ácidos y bases para ajustar el pH en este ensayo [22], que pueden causar interferencias en el análisis [17].
En consecuencia, los resultados de la relación DBO5/DQO, indican la biodegradabilidad de las vinazas sintéticas en Erlenmeyer y su capacidad de ser tratadas mediante un sistema biológico. En el caso de las vinazas de Bioreactor, la relación DBO5/DQO presentó diferencias dependiendo de la muestra. En términos generales, el método para el tratamiento de estas últimas sería químico ya que la relación fue menor a 0.5 indicando la dificultad para biodegradar dichas vinazas.
Por otro lado, para el caso de los SST, el ensayo con Erlenmeyer mostró valores elevados de sólidos mientras que el ensayo con Bioreactor presentó valores bajos, situación que se atribuye a una filtración previa que se hace para los ensayos en Bioreactor (Figura 3).
En el caso de los nitratos, aunque todos los ensayos sobrepasan los límites permisibles, se obtuvo que para los ensayos en Bioreactor las muestras que más se acercan a la norma, es decir, aquellas que presentaron los menores valores de NO3 - N y NO3 - fueron las de la cepa AM45. Esto significa que en estos ensayos, este microorganismo asimila correctamente el nitrógeno contenido en las sales [9]. A pesar de esto, ambos ensayos requieren tratamiento para disminuir su nivel de contaminación.
Los fosfatos para los dos ensayos resultaron ser altos, debido al contenido de las sales KH2PO4 y Na2HPO4 en el medio de fermentación y sin diferencia entre la fuente de carbono y la cepa.
3.2. Substrato de hidrolizado de residuos de caña
Las fermentaciones de los hidrolizados de residuos de caña, se realizaron con las cepas AM44, AM45, AM89 y Pichia stipitis. Este último, fue usado como microorganismo de control y como referencia para las demás cepas nativas.
3.2.1. Caracterización ambiental de hidrolizados: Las vinazas de los hidrolizados de residuos de caña de azúcar tienen pH ácido, presentan alto contenido de sólidos disueltos (3.400 - 3.500 mg/L) y suspendidos (3.800 - 5.000 mg/L). Los valores de DQO varían desde 36.000 hasta 42.000 mg/L, mientras que para la DBO5 se encontraron valores que van desde 17.000 hasta 22.000 mg/L (Figura 4).
Se encontraron además elevados valores para parámetros como nitratos, sulfatos, fosfatos y amoniaco, lo que indica el potencial de impacto en el ecosistema que podrían tener las vinazas de residuos de caña (Tabla 3). Sin embargo, las vinazas de residuos de caña de azúcar tienen valores por debajo de los reportados, comparados con las vinazas tradicionales [2, 23, 24]. Aun así, los resultados están por encima de los límites permisibles de las normas de calidad de agua y de vertimientos de aguas residuales industriales. Por otro lado, la relación DBO5/DQO indica la biodegradabilidad de las vinazas de residuos de caña de azúcar, es decir, que el método de tratamiento para las mismas debe ser biológico (Tabla 3).
Las vinazas de residuos de caña de azúcar presentan un alto contenido de sólidos suspendidos y disueltos. Es por ello que para realizar la fermentación fue necesario filtrar el material (hidrolizados), lo que da una idea de la cantidad de sólidos que fue necesario remover antes de comenzar con el proceso de fermentación para que los microorganismos lograran actuar.
Los resultados de fosfatos y nitratos indican un bajo contenido de los mismos en las vinazas de residuos de caña, si se comparan con los arrojados por las vinazas sintéticas de Erlenmeyer y Bioreactor (Tabla 3).
3.2.2. Tratamiento: La vinaza no debe ser tomada como un contaminante en sí misma. El error está en su inadecuada disposición y en no considerar su potencial como subproducto del proceso de producción de etanol, la cual tiene una utilidad económica y social [25]. En este sentido, se han propuesto diferentes métodos, dentro de los existentes para su tratamiento se encuentran los métodos fisicoquímicos, químicos y biológicos; siendo los biológicos los más apropiados por la gran cantidad de compuestos orgánicos biodegradables que presentan en su composición [2]. Es por esto y de acuerdo con el índice de biodegradabilidad, que las vinazas tanto sintéticas (de Erlenmeyer) como los hidrolizados directos de los residuos de caña requieren un tratamiento biológico, el cual busca reducir el contenido de materia orgánica y los nutrientes de las mismas.
Para el tratamiento de las vinazas caracterizadas en este estudio se recomendó utilizar un sistema biológico, el cual se aplica a los efluentes biodegradables, en donde una serie de microorganismos actúan para degradar la materia orgánica y los nutrientes [26]. Además, es una opción viable en términos económicos puesto que es un sistema de bajo costo, a diferencia de los sistemas físico químicos [26]. Este sistema se divide en dos: sistemas aerobios y anaerobios. Para tratar estas vinazas lo mejor es buscar la combinación de estos dos sistemas con el fin de remover la materia orgánica, nutrientes como el nitrógeno amoniacal y nitratos, y los sólidos contenidos en la misma. Es así como estudios muestran que las remociones biológicas para la eliminación de materia orgánica, nitrógeno y fósforo requieren de combinaciones de sistemas anaerobios-anóxicos-aerobios [27]. De esta manera, en condiciones anaerobias las bacterias acumulan fósforo y capturan del medio la materia orgánica al tiempo que la acumulan en su interior, mientras que en condiciones aerobias las bacterias utilizan los compuestos acumulados en el paso anterior y lo utilizan para su crecimiento. Finalmente, en la fase anóxica las bacterias reducen los compuestos de nitrógeno hasta su forma gaseosa [27].
Por ello es necesario un sistema de nitrificación con el cual se lleve a cabo una oxidación biológica del amonio a nitrito por medio del oxigeno, seguido por la oxidación de los nitritos a nitratos. Posteriormente se pasa al proceso de desnitrificación mediante el cual los nitratos son reducidos a compuestos gaseosos de nitrógeno [28].
En definitiva, se debe continuar con el estudio de las alternativas adecuadas para el tratamiento y reutilización de las vinazas de residuos de caña de azúcar y realizar los respectivos ensayos en el laboratorio.
4. CONCLUSIONES
Las vinazas de los substratos de fermentación sintéticos son de naturaleza ácida, presentan un alto contenido de sólidos en suspensión (700 a 4.500 mg/L), altas DQO (10.200 a 43.000 mg/L) y altas DBO5 (6.200 y 17.100). De igual forma para los nitratos y fosfatos. Las vinazas de los hidrolizados de residuos de caña de azúcar tienen pH ácido, presentan alto contenido de sólidos disueltos (3.400 - 3.700 mg/L) y suspendidos (3.800 - 5.300 mg/L). Las concentraciones de DQO varían de 35.000 a 42.300 mg/L, mientras que para la DBO5 se encontraron valores que van desde 17.000 hasta 22.000 mg/L. Según esto, las vinazas de residuos de caña de azúcar en términos generales tienen una mejor calidad en términos de contaminación, que las vinazas generadas a partir de los substratos sintéticos. Sin embargo, los tres tipos de vinaza analizadas exceden las normas de calidad de agua y de vertimientos de aguas residuales aunque presentan valores más bajos que los reportados en la literatura a partir de diferentes materias primas; esto no quiere decir que no exista un potencial de impacto en el ambiente.
Para el tratamiento de las vinazas caracterizadas en este estudio se recomienda utilizar un sistema biológico, que combine tecnologías aerobias y anaerobias, con el fin de remover la materia orgánica, nutrientes tales como el nitrógeno amoniacal, nitratos y los sólidos suspendidos. Para ello, se requiere de un sistema de nitrificación, seguido de un sistema de desnitrificación.
5. AGRADECIMIENTOS
Los autores agradecen a Colciencias y al programa Jóvenes Investigadores e Innovadores "Virginia Gutiérrez de Pineda", a la Universidad Autónoma de Occidente, al Ministerio de Agricultura por el apoyo económico con el proyecto 2008D3210, a la Ing. Luz Marina Flórez, al grupo interinstitucional de Biocombustibles GRUBIOC y a todo el equipo de trabajo que estuvo involucrado en la realización de este proyecto.
REFERENCIAS
[1] Larrahondo, J., La vinaza: Caracterización de la vinaza, usos y aprovechamientos potenciales. Memorias Seminario internacional de Fertilización y Nutrición de la Caña de Azúcar, Tecnicaña. Cali, Colombia, pp. 69 - 90, Noviembre 2009. [ Links ]
[2] Bermúdez, R., Hoyos, J y Rodríguez, S., Evaluación de la disminución de la carga contaminante de la vinaza de destilería por ensayo anaeróbico. Revista internacional de contaminación ambiental., 16, pp. 103 - 107, 2000. [ Links ]
[3] Korndorfer, G., Impacto ambiental del uso de la vinaza en la agricultura y su influencia en las características químicas y físicas del suelo. Memorias Seminario internacional de Fertilización y Nutrición de la Caña de Azúcar, Tecnicaña. Cali, Colombia, pp. 115 - 122, Noviembre 2009. [ Links ]
[4] Dávila, J., Machuca, F. y Marrianga, N., Reducción de demanda química de oxígeno, carbono orgánico total y sólidos totales en vinazas mediante electroflotación/oxidación. Revista Ingeniería e Investigación., 29, pp. 35-38, 2009. [ Links ]
[5] Basanta, R., García, M., Cervantes, J., Mata, H. y Bustos, G., Sostenibilidad del reciclaje de residuos de la agroindustria azucarera: una revisión. Revista Ciencia y tecnología alimentaria., 5, pp. 293-305, 2007. [ Links ]
[6] Páez, G., Legislación ambiental enfocada al uso, almacenamiento y aplicación de vinazas en el Valle del Cauca-Colombia. Memorias Seminario internacional de Fertilización y Nutrición de la Caña de Azúcar, Tecnicaña. Cali, Colombia, pp. 93 - 102, Noviembre 2009. [ Links ]
[7] Muñoz, F., Resultados experimentales del uso de vinaza. Memorias Seminario internacional de Fertilización y Nutrición de la Caña de Azúcar, Tecnicaña. Cali, Colombia, pp. 19 - 20, Noviembre 2009. [ Links ]
[8] Rodríguez, S., Bermúdez, R. y Serrat, M., Selección de cepas de Pleurotus ostreatus para la decoloración de efluentes industriales. Revista Mexicana de Micología., 23, pp. 9-15, 2006. [ Links ]
[9] Mutis, D., Deslignificación de residuos de la caña de azúcar (hojas y cogollos) con procesos químicos [Trabajo de grado-Pregrado] Cali, Colombia: Universidad del Valle, 2009. [ Links ]
[10] Salcedo, J., López, J. y Flórez, L., Evaluación de enzimas para la hidrólisis de residuos (hojas y cogollos) de la cosecha de caña de azúcar. Revista DYNA., 78, pp. 182-190, 2011. [ Links ]
[11] COLOMBIA. Ministerio de ambiente, vivienda y desarrollo territorial. Decreto 3930. (25, Octubre, 2010). Bogotá, D.C.: El Ministerio, 2010. [ Links ]
[12] COLOMBIA. Ministerio de agricultura. Decreto 1594. (26, Junio, 1984). Bogotá, D.C.: El Ministerio, 1984. 55 p. [ Links ]
[13] COLOMBIA. Secretaria distrital de ambiente. Resolución 3957 (19, Junio, 2009). Bogotá, D.C.: La Secretaría, 2009. [ Links ]
[14] COLOMBIA. Ministerio de salud. Resolución 12186 (20, Septiembre, 1991). Bogotá, D.C.: El Ministerio, 1991. [ Links ]
[15] COLOMBIA. Ministerio de la protección social y Ministerio de ambiente, vivienda y desarrollo territorial. Resolución 2115 (22, Junio, 2007). Bogotá, D.C.: Los Ministerios, 2007. [ Links ]
[16] HACH COMPANY. Spectrophotometer DR 2010, Procedures manual, 1996. [ Links ]
[17] Climent, M., et al. Experimentación en química: Química orgánica Ingeniería química, Editorial Universidad Politécnica de Valencia, Valencia, 2005. [ Links ]
[18] Mariller, C., Destilación y rectificación de líquidos industriales, Editorial Hachette S.A, Argentina, 1969. [ Links ]
[19] Blateyron, L. and Sablayrolles, J., Stuck and Slow Fermentations in enology: Statistical study of causes and effectiveness of combined additions of oxygen and diammonium phosphate. Bioscience and bioengineering., 91, pp. 184-189, 2001. [ Links ]
[20] Chiva, R., Mecanismos moleculares y bioquímicos implicados en la adaptación de Saccharomyces cerevisiae a las bajas temperaturas de fermentación [PhD Tesis]. Tarragona, España: Universitat Rovira i Virgili, 2010. [ Links ]
[21] Chaves, M., La caña de azúcar como materia prima para la producción de alcohol carburante. Memorias Seminario "Antecedentes y Capacidad Potencial de Cogenerar Energía y Producir Etanol por Parte del Sector Azucarero Costarricense". Irazú, Costa Rica, pp. 1 - 23, Septiembre 2004. [ Links ]
[22] Becerra, C., Estudio preliminar del transporte de la vinaza en un suelo representativo del valle del cauca. [Trabajo de grado- Magíster] Palmira, Colombia: Universidad Nacional de Colombia, 2009. [ Links ]
[23] Ocampo, A., Alcohol carburante: actualidad tecnológica. Revista EIA., 1, pp. 39-46, 2004. [ Links ]
[24] Salazar, M., Sistemas integrales de ensayo de aguas residuales, mediante el uso combinado de digestión anaerobia y microalgas. Contactos., 73, pp. 16-22, 2009. [ Links ]
[25] González, M. y Saldarriaga, J., Remoción biológica de materia orgánica, nitrógeno y fósforo en un sistema tipo anaerobio-anóxico-aerobio. Revista EIA., 10, pp. 45-53, 2008. [ Links ]
[26] Lolmede, P., Jácome, A., Vidart, T. y Tejero, I., Ensayo de agua residual con elevado contenido de nitratos utilizando reactores biomembrana aireados. Ingeniería del agua., 7, pp. 244-254, 2000. [ Links ]