Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418On-line version ISSN 1909-6356
Rev. colomb. cienc. quim. farm. vol.35 no.2 Bogotá July/Dec. 2006
Artículo de revisión
Sistemas osmóticos de administración oral
Osmotically controlled oral drug delivery systems
Yolima Baena1, Marcela Aragón, Plinio A. Sandoval, Jaiver E. Rosas2 y Luisa F. Ponce D´León3
1E-mail: ybaenaa@unal.edu.co
2Departamento de Farmacia, Universidad Nacional de Colombia, A.A. 14490, Bogotá D.C., Colombia.
3E-mail: lfponced@unal.edu.co
Recibido para evaluación: octubre 10 de 2006 Aceptado para publicación: diciembre 18 de 2006
RESUMEN
Considerando que en el ámbito mundial el diseño de nuevos fármacos involucra un costo muy alto, tanto en tiempo como en dinero, la preocupación en los años recientes se ha centrado en diseñar y desarrollar medicamentos que controlen la liberación del activo, de manera que se les pueda dar un valor agregado a moléculas ya existentes, lo que significa una menor inversión en términos de costos. En este sentido, para la presente revisión se seleccionó el sistema de liberación osmótica, uno de los medicamentos de liberación controlada con más participación en el mercado en el mundo. En este escrito se muestran los aspectos fisicoquímicos relacionados con su formulación, las clases de sistemas osmóticos de administración oral existentes y sus aplicaciones, así como el estado del arte en este contexto. Hacia el futuro, estos sistemas osmóticos parecen ser muy promisorios, debido a sus ventajas y gran mercado potencial.
Palabras clave: bomba osmótica, sistema osmótico, presión osmótica, sistema de liberación modificada, administración oral.
SUMMARY
In recent years, the worldwide, the attention has been focused on the development of new drug products with controlled delivery. The reason for this new tendency is relatively low cost and time required to development this kind of product as compared to a new drug. In this sense, the osmotic systems, controlled delivery drug products, have been chosen for the present review to illustrate their physicochemical principles that govern their formulation. Different types of oral osmotic systems and their applications are also discussed. Finally, some studies related to this subject were reviewed. Because of their advantages and strong market potential, the future of osmotic systems seems so good.
Key words: osmotic pump, osmotic system, osmotic pressure, modified release system, oral administration.
INTRODUCCIÓN
Desde finales de la década de 1930 se empezó a trabajar en el diseño de sistemas que permitieran modificar la liberación de fármacos. Lipowski obtuvo la primera patente con la elaboración de una forma farmacéutica de administración oral que lograba una liberación lenta y constante del principio activo después de la ingestión. Sin embargo, la primera forma de dosificación de acción sostenida diseñada bajo el principio de Lipowski fue introducida tan solo hacia 1952 (1). Desde esa época a la fecha se continúa investigando en el diseño de diferentes tipos de sistemas que permitan modificar la liberación de fármacos.
En la última década y en parte debido a las nuevas políticas sobre respeto de patentes, la atención se ha centrado en el diseño de formas farmacéuticas de liberación modificada, como una buena posibilidad de darle vida a moléculas cuya patente ya haya expirado. La inversión en este tipo de investigaciones y el tiempo necesario para llevarlas a feliz término, se constituyen en una buena alternativa comparada con el tiempo y dinero requeridos para el desarrollo de medicamentos a partir de la síntesis de nuevas moléculas. Además, este tipo de sistemas de administración oral presenta múltiples ventajas: intervalos de dosificación más amplios, lo que lleva a un menor número de tomas al día; posibilidad de liberación en sitios específicos del tracto gastrointestinal (TGI); sostenimiento de los niveles plasmáticos, sin que se presenten grandes fluctuaciones; entre otros, que le dan un valor agregado a fármacos ya existentes en el mercado (2). De estos sistemas, el mayor porcentaje corresponde a los de administración oral, debido a que sigue siendo la ruta de elección por ser una vía natural. Idealmente estos sistemas deberían liberar el fármaco de manera controlada y reproducible en el sitio blanco por un tiempo prolongado (3, 4).
La mayoría de las formas farmacéuticas de administración peroral y liberación controlada modulan la liberación del fármaco mediante el empleo de diseños del tipo matriz, de reservorio o de presión osmótica. En el primer caso, el fármaco se encuentra embebido en una matriz polimérica y la liberación se da por procesos de disolución, difusión o erosión; en los sistemas de reservorio, se diseña un núcleo en donde el fármaco está rodeado por una membrana que controla la liberación; y en los sistemas osmóticos, se utiliza la presión osmótica como fuerza impulsora para conseguir la liberación del fármaco. En los dos primeros casos actúan factores como el pH, la presencia de alimentos y otros de tipo fisiológico que pueden afectar la liberación, a diferencia de los sistemas osmóticos que presentan una liberación del fármaco independiente de estos factores (2, 5).
El desarrollo del presente trabajo está enfocado en recopilar información relacionada con el diseño de sistemas tipo bomba osmótica para administración oral, con el fin de conocer el mecanismo de funcionamiento de estos dispositivos, los tipos de bombas osmóticas disponibles, los aspectos relacionados con su formulación, los fármacos que pueden ser entregados a través de estos sistemas y los estudios que se han venido realizando en el tema.
DESARROLLO HISTÓRICO
El primer dispositivo que empleó los principios osmóticos para liberar un fármaco fue desarrollado en 1955 por Rose y Nelson mediante un sistema de inyección que proporcionaba una liberación variante de 0.02mL/día (durante 100 días) a 0.5 mL/día (por 4 días). En 1971 se concedió una patente a Stolzenberg, que describe un inyector de pistón accionado por la presión osmótica (6). Por esa misma época, Higuchi y Leeper propusieron una serie de variaciones de la bomba de Rose y Nelson, y Theeuwes y col. modificaron aún más lo existente hasta diseñar la bomba osmótica elemental (BOE) (3). Esto último dio pie a una serie de otras patentes, provenientes la mayor parte de la firma Alza Corporation (aproximadamente un 90% de las patentes existentes son de su propiedad), de diferentes sistemas de liberación y por otras rutas de administración, que recurren a la presión osmótica como fuente impulsora. Sin embargo, muchas de estas patentes han expirado y otras están próximas a hacerlo, lo que ha incrementando el interés en el desarrollo de bombas osmóticas para liberación controlada. Una revisión completa acerca de esta temática fue realizada por Santus y Baker en 1995 (7)
.CONCEPTOS GENERALES
Los comprimidos osmóticos son formas farmacéuticas recubiertas de liberación controlada con unas características de diseño y funcionamiento especiales. En este tipo de sistemas, la presión osmótica controla la liberación de los fármacos, fundamentándose en el aprovechamiento de esta propiedad coligativa de las sustancias no volátiles cuando están en solución. En esencia, todos los sistemas osmóticos se encuentran constituidos por un comprimido (núcleo) que contiene el fármaco, rodeado por una membrana semipermeable. La liberación del principio activo se logra por el empuje de este a través de un orificio en la membrana. De este modo se obtiene una cinética de liberación de orden cero (2, 4, 8). Si se formulan de manera adecuada tanto el núcleo como la membrana, se logra que el proceso de liberación sea independiente del pH del medio y de las condiciones de agitación (5).
Los sistemas osmóticos de administración oral se han clasificado en diferentes tipos, dependiendo de su complejidad, como se muestra a continuación.
Bomba Osmótica Elemental (BOE)
Es el sistema más simple, conocido como OROS® (Osmotic Release Oral System) o GITS® (Gastrointestinal Therapeutic System), pionero de los sistemas para la entrega de fármaco en forma de bomba osmótica oral. Consta de un núcleo osmótico que contiene el fármaco (con o sin agentes osmóticos) cubierto por una membrana semipermeable, provista de un orificio, (en el centro de una de las caras del comprimido) por donde ocurre la liberación (Figura 1) (9).

Este dispositivo utiliza el gradiente osmótico entre el medio gastrointestinal y su interior, como mecanismo de liberación del principio activo. Una vez administrado, el núcleo osmótico al entrar en contacto con los fluidos acuosos, absorbe agua a una velocidad que está determinada por la permeabilidad de la membrana frente al fluido biológico y por la presión osmótica del núcleo, como se presenta en la ecuación 1.
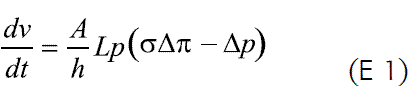
donde dv/dt es la velocidad de entrada del agua, A y h son el área y el espesor de la membrana, respectivamente; Lp es la permeabilidad mecánica de la membrana; σ es el factor de semipermeabilidad y Δπ y Δπ son las diferencias de presión osmótica e hidrostática, respectivamente. La ecuación 1 puede simplificarse, considerando un orificio de liberación suficientemente grande que permita despreciar la presión hidrostática dentro del sistema, Δπ;>>Δπ; una presión osmótica en el núcleo mucho mayor que la externa (pudiéndose despreciar la externa) y remplazando Lpσ por K, que es una constante de la membrana, así (E 2):

La liberación del principio activo de los sistemas osmóticos involucra la entrada del medio disolvente al núcleo (discutida anteriormente) a través de la membrana, y la posterior salida de la solución (fármaco + disolvente) a través del orificio presente en la membrana semipermeable. La expresión general que describe el proceso de liberación del soluto, dM/dt, está dada por:
donde C es la concentración del fármaco en solución.
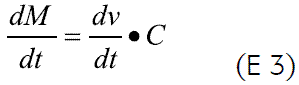
De la ecuación 4 se deduce que el lograr una velocidad de liberación constante depende de la correcta selección de la membrana y de la formación de una solución saturada del fármaco dentro del núcleo, que permita obtener una concentración en solución constante, siempre y cuando se haya hecho una adecuada selección del diámetro del orificio de liberación. Esto lleva a considerar tres aspectos críticos en el diseño de este tipo de sistemas: la solubilidad del fármaco (que se refleja directamente en la presión osmótica de la solución, para algunos casos), el orificio y la naturaleza de la membrana (2, 5, 6, 10-12).

Solubilidad
La cinética de liberación del fármaco en un sistema osmótico está directamente relacionada con su solubilidad en agua para la formación de la solución saturada correspondiente dentro del núcleo. Si se asume que este último está constituido por fármaco puro, es posible calcular la fracción de fármaco liberado con cinética de orden cero (F(z)), así E 5 :
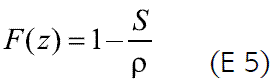
Donde S es la solubilidad del fármaco (g/mL) y r es la densidad del núcleo de la tableta (g/mL). De acuerdo con esta ecuación, fármacos con una solubilidad menor de 0.05 g/mL deberían ser liberados en más de un 95% con cinética de orden cero, pero considerando la ecuación 4, su velocidad de liberación sería muy baja, debido al bajo gradiente osmótico que se generaría. Por el contrario, fármacos altamente solubles en agua serían liberados en baja proporción, siguiendo una cinética de orden cero, y de acuerdo a la ecuación 4, a una mayor velocidad de liberación (2, 3, 12). De ahí la importancia de considerar el valor de la solubilidad intrínseca del fármaco para buscar alternativas de formulación, como incluir ingredientes auxiliares que permitan modular su solubilidad en el núcleo. Como ejemplos se pueden citar los siguientes: formación de la sal de un fármaco como la glipizida, contenida en el núcleo, que por modificación del pH del microentorno lleva a un aumento de su solubilidad y por consiguiente a un incremento en la velocidad de liberación (13); incorporación de un polímero que retarde la velocidad de liberación del diltiazem clorhidrato, controlando eficientemente la liberación del fármaco (orden cero), gracias a la modulación de su alta solubilidad (mayor a 590mg/mL a 37 oC) por este medio (14); evaluación de un caso similar al anterior en un estudio con ciclobenzaprina clorhidrato (15); el empleo de bicarbonato de sodio, que en presencia de los componentes ácidos de una droga de la medicina tradicional china forma una mezcla efervescente que incrementa la velocidad de liberación de los activos pobremente solubles en agua (16); la formación de complejos de inclusión con ciclodextrina permite incrementar la velocidad de liberación de fármacos poco solubles en agua (17, 18).
Para el diseño de bombas osmóticas elementales se recomiendan solubilidades intermedias (50-300 mg/mL), ya sean intrínsecas u obtenidas por adición de otros componentes (3). Siendo la solubilidad una de las limitantes para este tipo de diseño, se han realizado múltiples modificaciones para lograr sistemas que liberen fármacos de baja y muy alta hidrosolubilidad, como se muestra más adelante.
Presión osmótica
La liberación de un fármaco de un sistema osmótico es directamente proporcional a la presión osmótica del núcleo, de acuerdo a lo planteado en la ecuación 4. Para garantizar una liberación adecuada, es necesario optimizar el gradiente de presión osmótica entre el núcleo y el exterior, lo que se logra con una solución saturada del fármaco. En el caso de que su solubilidad sea muy baja se debe adicionar un compuesto osmóticamente activo, pero farmacológicamente inerte, hasta alcanzar la concentración de saturación adecuada, consiguiendo de esta manera tener una presión osmótica mayor y constante. Algunos de los compuestos osmóticamente activos más empleados son las sales de ácidos inorgánicos solubles en agua (cloruro o sulfato de magnesio; cloruro de litio, potasio o sodio; entre otros), las sales de ácidos orgánicos solubles en agua (acetato de sodio o potasio, succinato de magnesio, benzoato de sodio, entre otros), los carbohidratos (arabinosa, ribosa, glucosa, fructosa, sacarosa, lactosa, etc), los aminoácidos solubles en agua (glicina, leucina, alanina, metionina, etc), y los polímeros orgánicos (carboximetilcelulosa sódica, HPMC, carbómeros, etc) (2, 3, 12).
Siendo la presión osmótica la fuerza impulsora de la liberación, es necesario tener en cuenta que la osmolaridad a lo largo del tracto digestivo se considera, para efectos prácticos, constante, con un valor de aproximadamente 300 mOsmol/kg (lo que corresponde a casi 8 atm), que en comparación con una solución saturada de un compuesto dentro del núcleo (por ejemplo 245 atm para el KCl), conlleva a una diferencia neta de presión osmótica de 237 atm, suficiente para dar lugar a la liberación de un fármaco a una velocidad constante, siempre y cuando exista en su interior una solución saturada del mismo (19).
Orificio de liberación
Los sistemas de liberación osmótica contienen por lo menos un orificio en su membrana semipermeable para que se de la liberación del fármaco. El diámetro del orificio debe ser optimizado para garantizar una liberación con cinética de orden cero. Un tamaño menor a 200 µ incrementa la presión hidrostática en el núcleo variando la cinética de liberación y un tamaño mayor a 1000 µ puede permitir la difusión del fármaco a través de él modificando también la cinética (2, 6). Existen cálculos matemáticos que permiten establecer el tamaño óptimo del orificio de liberación, sin embargo el rango adecuado es particular para cada sistema (6). Se ha demostrado, que dentro de ciertos límites, el diámetro del orificio no incide en la cinética de liberación del fármaco. Esto se puso en evidencia en el estudio realizado por Liu y col. para el diseño de una bomba osmótica de nifedipina, en el que no se encontraron diferencias significativas entre los perfiles de liberación del fármaco para diámetros comprendidos entre 0.25-1.41 mm (20). De la misma manera, Ramadan y Tawashi evaluaron la incidencia del tamaño del orificio en la cinética de liberación de una BOE de KCl, encontrando que este factor no tenía incidencia a velocidades de agitación bajas, mientras se tornaba significativo cuando se incrementaba la agitación (21).
Algunos de los métodos empleados para crear el orificio de liberación son el rayo láser, el taladro mecánico, los punzones modificados, el uso de sustancias solubles que permiten la formación del orificio in situ y el de indentación (2, 9, 22). En el diseño de una bomba osmótica monolítica con atenolol, se empleó el método de indentación para crear el orificio de liberación y se encontró que el diámetro adecuado del orificio estaba comprendido entre 1.00 y 1.14 mm para conseguir una liberación del fármaco con cinética de orden cero (23).
Membrana de recubrimiento
Este es uno de los parámetros más críticos en el diseño de sistemas osmóticos. Debe ser semipermeable, es decir, permeable al agua e impermeable al principio activo y los agentes osmóticos contenidos en el núcleo y debe ser capaz de mantener estables la forma y las dimensiones del dispositivo para garantizar que su volumen sea constante; además, tiene que resistir las agresiones mecánicas y enzimáticas del TGI, así como las relacionadas con el pH (6, 9). Para asegurar la resistencia mecánica, el grosor de la membrana debe estar entre 200 y 300 μm (2). Entre los principales polímeros utilizados para este fin están ésteres de celulosa (acetato, triacetato, propionato y butirato de celulosa, entre otros), etilcelulosa y copolímeros derivados del ácido metacrílico. En cuanto a los derivados de celulosa, pueden incrementar su permeabilidad al agua con la adición de agentes plastificantes o de agentes hidrofílicos como los PEG. La etilcelulosa pura tiene un uso limitado como membrana de recubrimiento de sistemas osmóticos, debido a su baja permeabilidad al agua, pero combinada con HPMC mejora esta propiedad (3). Con los copolímeros derivados del ácido metacrílico se han realizado estudios empleándolos como película de recubrimiento, en combinación con diferentes tipos y varias composiciones de polímero, comprobando su aplicabilidad en el diseño de este tipo de sistemas y estableciendo la posibilidad de utilización de dispersiones acuosas en vez de las orgánicas, comúnmente empleadas (24, 25).
En otro estudio se evaluó un pseudolátex de acetato de celulosa para el recubrimiento de un GITS® a base de atenolol, demostrando la aplicabilidad de las dispersiones acuosas de polímeros en el recubrimiento de este tipo de sistemas (26). En la literatura se reporta el empleo de un nuevo tipo de membranas, llamadas asimétricas que consisten en un sustrato poroso que tiene como características un flujo elevado y altas velocidades de liberación para fármacos poco solubles en agua. La permeabilidad puede ser ajustada controlando la estructura y porosidad de la membrana (2, 3) y este tipo de membranas puede ser aplicado a tabletas, cápsulas o formulaciones multipartículas (27-29).
Bombas osmóticas multicompartimentales (BOM)
La BOM es un diseño simple y adecuado para fármacos con solubilidades intermedias; sin embargo, existen muchos fármacos con muy bajas y muy altas solubilidades que difícilmente podrían ser incluidos en este tipo de diseños. Esta fue la razón que llevó al desarrollo de bombas osmóticas multicompartimentales (3). Estos dispositivos pueden ser divididos en dos categorías principales, dependiendo si una de las cámaras se expande en la otra (sistema push-pull) o si las cámaras son rígidas y mantienen su volumen constante, aun estando en funcionamiento (7).
Bomba osmótica aspirante-impelente
Este sistema es conocido como push-pull OROS® y fue desarrollado en la década de los años de 1980 para superar los problemas de formular fármacos insolubles que tiene la BOE. Consiste en dos compartimentos separados por un diafragma elástico, recubiertos por una membrana semipermeable. La capa inferior contiene un polímero hidrófilo (agente polimérico osmótico) capaz de formar un hidrogel expandible que empuja el compartimento superior, que contiene el fármaco (Figura 2). Este comprimido osmótico actúa mediante el efecto combinado de la hidratación de sus dos compartimentos de modo que, inicialmente, el compartimento de principio activo absorbe agua suficiente para formar una suspensión o solución que será expulsada a través del orificio de salida tan pronto como se inicie la formación de un fluido en su interior y se de la expansión y empuje por parte del compartimento inferior, previamente hidratado (3, 7-9).

La expresión matemática de la velocidad de liberación del fármaco para estos sistemas está definida por la ecuación 4 (3). Un estudio realizado con salbutamol y teofilina en un sistema push-pull, demostró la factibilidad de diseñar un sistema para la liberación de dos fármacos, con dos solubilidades diferentes, que siguiera una cinética de liberación de orden cero (29).
Bombas osmóticas con una segunda cámara no expandible
Este grupo puede a su vez subdividirse en dos subgrupos, dependiendo de la función que cumpla la segunda cámara. En el primer subgrupo, en la segunda cámara se logra la dilución de la solución saturada antes de salir del dispositivo. Esto es muy útil para el caso en el que la solución saturada del fármaco al entrar en contacto con el TGI causa una irritación que genera algún riesgo. El segundo grupo consta de dos BOE independientes en una misma tableta. El dispositivo es capaz de liberar el fármaco simultáneamente a partir de cada una de las BOE (7).
Bombas osmóticas con liberación dirigida al colon
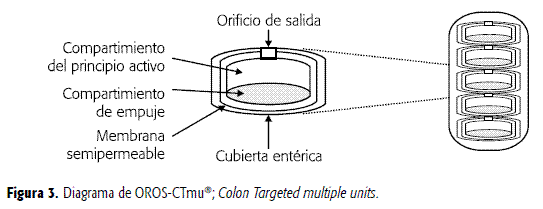
Modificaciones realizadas a la tecnología del comprimido osmótico bicompartimental se han aplicado recientemente al desarrollo de sistemas terapéuticos gastrointestinales para la liberación de fármacos a nivel de colon, ya sea para el tratamiento local de la mucosa colónica o para ser absorbido sistémicamente. Estos dispositivos poseen un recubrimiento gastrorresistente externo que bloquea el paso de agua hacia el interior del sistema en el medio ácido del estómago, retrasando la liberación del principio activo hasta que el sistema haya alcanzado el colon. Una vez allí, el recubrimiento gastrorresistente se disuelve completamente, quedando expuesta la membrana semipermeable y a partir de este instante la liberación del principio activo se produce a velocidad constante (OROS-CT®, Colon Targeted (ALZA Corp.)) (9, 22).
Con el fin de mejorar la distribución del principio activo en el colon, pueden fabricarse sistemas con múltiples unidades individuales contenidas en una cápsula de gelatina dura que se disuelve rápidamente en el estómago. De este modo, pueden quedar repartidos varios dispositivos a lo largo del colon al salir del estómago en forma espaciada de acuerdo con el vaciado gástrico, como se ilustra en la Figura 3 (OROS-CTmu®; Colon Targeted multiple units) (2, 9).
Bombas osmóticas que contienen formulaciones autoemulsificables
Se ha diseñado el sistema L-OROSTM (ALZA Corp.) para la entrega de fármacos en formulaciones líquidas lipofílicas, mediante el cual se incrementa la biodisponibilidad de compuestos activos insolubles en agua y se proporciona una liberación controlada desde 2 hasta 24 horas. En este sistema se encuentra la tecnología L-OROSTM SOFTCAPTM, adecuada para la liberación controlada de formulaciones líquidas lipofílicas autoemulsificables, de forma que cuando el fármaco en solución es liberado en el TGI, forma gotas muy pequeñas (<100 nm - microemulsión), incrementando la solubilidad del fármaco y por tanto su biodisponibilidad. La formulación líquida del principio activo está contenida dentro de una cápsula blanda de gelatina, rodeada en su orden por una película de barrera, una cámara osmótica y una membrana semipermeable que controla la velocidad de liberación. El orificio de entrega es formado a través de las tres capas. Cuando el sistema está en contacto con el ambiente acuoso, el agua permea a través de la membrana externa y activa la película osmótica produciendo su expansión y la compresión de la cápsula de gelatina blanda, generando una presión hidrostática dentro del sistema, que induce a la formulación líquida a salir a través del orificio, como se aprecia en la Figura 4 (2, 30).

El sistema L-OROSTM HARDCAPTM, similar al anterior, consta de un compartimento líquido de fármaco, una película de barrera y una cámara osmótica, contenidas en una cápsula dura de gelatina, cubierta finalmente con una membrana semipermeable. El orificio para la entrega del compuesto activo va desde la membrana hasta la película que contiene el fármaco en solución o suspensión. Cuando el sistema entra en contacto con el medio acuoso, el agua es embebida a través de la membrana semipermeable, expandiendo la cámara osmótica, la cual ejerce una presión contra la película de barrera, liberando el fármaco a través del orificio de entrega (Figura 5) (2, 22).

Mientras que los sistemas L-OROSTM SOFTCAPTM y L-OROSTM HARDCAPTM son diseñados para producir una liberación continua de fármaco, el sistema L-OROSTM de liberación retardada permite entregar el fármaco, a partir de formulaciones líquidas, después de transcurrido un determinado tiempo. Este sistema está compuesto de tres compartimentos: uno formado por placebo (ejerce la acción retardante), otro que contiene el compuesto activo y el tercero que corresponde a una cámara osmótica, los cuales están rodeados por una membrana semipermeable que controla la velocidad de liberación, como se aprecia en la Figura 6. El orificio se forma a través de la membrana hasta la película de placebo. Cuando la cámara osmótica se expande, el placebo se libera primero, demorando la salida del fármaco. La liberación del principio activo puede ser retardada desde 1 hasta 10 horas, dependiendo de la permeabilidad de la membrana y el tamaño del compartimento de placebo. Esto permite que el sistema se dirija hacia áreas específicas del tracto GI para la entrega del fármaco, así por ejemplo, existen péptidos que se absorben mejor en el colon que en la parte superior del tracto GI (Figura 6) (22).

Bombas osmóticas de porosidad controlada
Este tipo de sistemas contienen aditivos solubles en agua en la membrana de cubrimiento, los que se disuelven en contacto con el agua, formando microporos (Figura 7). Como resultado se obtiene que la membrana se hace permeable al agua y a los solutos disueltos. El mecanismo para la liberación del fármaco a partir de este sistema es principalmente osmótico con una pequeña proporción de liberación por difusión simple (2, 9). De esta manera, al no ser la presión osmótica el único mecanismo para liberar el fármaco, la ecuación 4 puede modificarse, incluyendo un término referente al proceso de difusión pasiva (asumiendo condiciones sink), así E 6:


donde P es el coeficiente de permeabilidad del fármaco para atravesar la membrana, A es el área de la membrana, S es la solubilidad del fármaco y h el espesor de la membrana (31). En un estudio realizado con clorpromazina, formulada como una bomba osmótica de porosidad controlada, se demostró que la cantidad y el tamaño de partícula de la lactosa presente en la membrana de acetato de celulosa influía en la liberación, incrementándola al aumentar la concentración de lactosa y disminuir su tamaño de partícula (32). Así mismo se evaluó la influencia de diferentes formadores de canales en la membrana de celulosa, sobre la cinética de liberación de orden cero para bombas osmóticas de porosidad controlada de pseudoefedrina (33).
Existen bombas osmóticas modificadas para fármacos insolubles, que constan de partículas de agentes osmóticos recubiertas con una película elástica semipermeable mezcladas con el fármaco insoluble, y comprimidas posteriormente en forma de tableta. Esta tableta se recubre finalmente con una membrana semipermeable en la que se crea el orificio de liberación. Al entrar en contacto con el fluido biológico, el agua penetra a través de las dos membranas hasta llegar a las partículas del agente osmótico, que se hinchan y empujan el fármaco insoluble hacia el orificio de liberación (3, 9).
Comprimido osmótico monolítico
Es un sistema que favorece la liberación de fármacos insolubles en agua hasta por 24 horas. Consiste en la dispersión de un agente soluble en agua (agente osmótico) en una matriz polimérica. El fármaco insoluble es suspendido en la matriz y la cinética de liberación de orden cero está dada tanto por el efecto osmótico como por la capacidad del polímero de mantener el fármaco suspendido. La tableta formada es recubierta por una membrana semipermeable, sobre la que se genera el orificio de liberación. La limitante de este sistema radica en que se puede tener hasta un máximo de 30% de fármaco (3, 20). Se han realizado estudios con nifedipina, fármaco muy insoluble en agua, demostrándose perfiles de liberación que siguen una cinética de orden cero, tanto in vitro como in vivo (20, 34). Estudios realizados con sistemas monolíticos de naproxeno presentan un comportamiento similar al utilizar como polímero la goma arábiga (35).
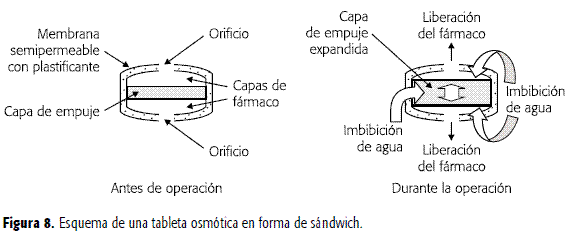
Tableta osmótica tipo sandwich (SOTS)
Consta de una cámara osmótica ubicada en medio de dos compartimentos de fármaco, los que a su vez están cubiertos con una membrana semipermeable. Como se indica en la Figura 8, los dos compartimentos interactúan con el medio externo a través de dos orificios de entrega (uno en cada lado de la tableta). Después de que el sistema entra en contacto con el medio acuoso, la cámara de presión osmótica que contiene agentes poliméricos, se hidrata y el fármaco es liberado a través de los orificios de entrega. Este sistema ha sido empleado para nifedipina en el tratamiento de la hipertensión arterial y la angina de pecho (36).
Sistemas multiparticulados de liberación retardada
Están compuestos por pellets que contienen el fármaco, con o sin agente osmótico, recubiertas con una membrana semipermeable como el acetato de celulosa. Al entrar en contacto con un entorno acuoso, el agua penetra en el núcleo y forma una solución saturada de los componentes solubles. El gradiente de presión osmótico favorece la entrada del agua, originando una rápida expansión de la membrana y dando lugar a la formación de poros en la superficie. El fármaco y el ingrediente osmótico son liberados a través de estos poros, siguiendo una cinética de orden cero (2, 3). Un estudio realizado con acetaminofén en un sistema de este tipo demostró liberación con cinética de orden cero después de un tiempo de latencia determinado (37). En otro estudio realizado con maleato de clorfeniramina, en el que se evaluaron diferentes agentes osmóticos y membranas de recubrimiento, se encontró que el mecanismo de liberación en este tipo de sistemas es complejo, involucrando no sólo la presión osmótica y la difusión pasiva, discutida en la ecuación 6, sino otros fenómenos como la inducción de la presión osmótica, la ruptura de la cubierta y la posible disolución y erosión de la película de HPMC (38).
VENTAJAS DE LOS SISTEMAS OSMÓTICOS Y ESTUDIOS REALIZADOS
Como se puede apreciar, la mayor ventaja de este tipo de sistemas es la posibilidad de conseguir cinés;ticas de orden cero que no se ven afectadas por condiciones f|isiológicas como el pH, la presencia de alimentos, las condiciones hidrodinámicas y enzimáticas del medio, aspectos a los que es indiferente siempre y cuando se haya hecho una correcta elección de la membrana semipermeable. Estos sistemas permiten formular fármacos de una amplia gama de solubilidades debido a su gran versatilidad. Cabe resaltar que las velocidades de liberación para estos sistemas son mayores comparadas con las de aquellos cuyo mecanismo es la difusión convencional, y altamente predecibles y programables, debido a la posibilidad de modulación de los términos en la ecuación 4 lo que lleva a obtener resultados calculados bastante cercanos a los obtenidos experimentalmente (3, 22). En un estudio realizado para la formulación de un sistema osmótico a base de mononitrato de isosorbide, se verificó la independencia del sistema de los factores discutidos anteriormente, así como la utilidad de la predicción de niveles plasmáticos, basados en la información generada in vitro (39). De la misma manera, en diferentes estudios realizados se ha encontrado una alta correlación entre los estudios in vitro e in vivo para este tipo de sistemas (3, 40).
Rani y colaboradores evaluaron, tanto in vitro como in vivo, la liberación de diclofenaco sódico a partir de una BOE, encontrando que este proceso era dependiente del tipo y espesor de la membrana semipermeable e independiente del tamaño del orificio y de las condiciones de agitación del medio. Concluyeron que este sistema presentaba una liberación más controlada y prolongada que el que se encontraba en el mercado (41). En un estudio similar, en que se compara el desempeño in vivo e in vitro de tres sistemas de liberación controlada a base de diclofenaco sódico, de los cuales dos de ellos tienen como mecanismo de liberación la presión osmótica (matriz osmótica y bomba osmótica), se demostró que existía control más efectivo de la liberación, efecto más prolongado y mayor independencia de los efectos fisiológicos para los sistemas osmóticos. Se espera que esto ayude en el mejoramiento en la eficacia terapéutica y la confianza del paciente (42).
Los sistemas de liberación osmótica también han sido utilizados para el diseño de productos de aplicación en medicina veterinaria. Es el caso de la ivermectina, formulada como bomba osmótica, garantizando una cinética de liberación de orden cero y un efecto por 135 días (43).
A pesar de las ventajas que estos sistemas evidencian, en la literatura se han reportado estudios que demuestran diferencias en los perfiles de liberación de sistemas osmóticos de nifedipina, fabricados en las mismas condiciones. Mediante imágenes de resonancia magnética se estableció que no existía uniformidad en el recubrimiento de la tableta, dando lugar a diferentes espesores de membrana, causante del comportamiento observado (44).
Además se han manifestado problemas de obstrucción GI en pacientes con úlcera péptica preexistente, así como serias reacciones GI (hemorragia y perforación) asociadas a la liberación de soluciones concentradas de compuestos irritantes de la mucosa gástrica (3, 6).
CONCLUSIONES
La liberación de fármacos que emplean la presión osmótica como fuerza impulsora, considerando un adecuado diseño del sistema, permite garantizar una liberación del activo con cinética de orden cero, lo que ofrece ventajas frente a otras formas de liberación controlada. La solubilidad, asociada a la presión osmótica del núcleo, la naturaleza de la membrana y el diámetro del orificio, son los factores que inciden y controlan su liberación. Existen diferentes tipos de sistemas osmóticos de administración oral en los que resalta su versatilidad. Debido al vencimiento de múltiples patentes relacionadas con este tipo de sistemas, en los últimos años se han incrementado notablemente los estudios en este campo promisorio para desarrollarse aún más en los próximos años.
BIBLIOGRAFÍA
1. J. Lazarus and J. Cooper , Oral prolonged action medicaments: their pharmaceutical control and therapeutic aspects, J. Pharm. Pharmacol., 11 (5), 257-290 (1959). [ Links ]
2. R. K. Verma, D. M. Krishna, and S. Garg, Formulation aspects in the development of osmotically controlled oral drug delivery systems, J. Control. Release, 79, 7-27(2002). [ Links ]
3. R. K. Verma, B. Mishra and S. Garg, Osmotically Controlled Oral Drug Delivery, Drug Dev. Ind. Pharm., 26, 695 (2000). [ Links ]
4. R. K. Verma and S. Garg, Current status of drug delivery technologies and future directions, Pharm. Technol. On-line, 25, 1 (2001). [ Links ]
5. F. Theeuwes, P.S.L. Wong and S.I. Yum, Drug Delivery and Therapeutic Systems, in: "Encyclopedia of Pharmaceutical Technology", Edited by Swarbrick, J. and Boyland, J.C., Marcel Dekker, U.S.A., 1991, Vol. 4, pp. 303-316. [ Links ]
6. P. Buri, F. Puisieux, E. Doelker et J.P. Benoit, "Formes Pharmaceutiques Nouvelles: aspects technologique biopharmaceutique et medical", Technique et Documentattion, Paris, 1985, pp. 175-196. [ Links ]
7. G. Santus and R.W. Baker, Osmotic Drug Delivery: A review of the patent literature, J. Control. Release, 35, 1 (1995). [ Links ]
8. H. C. Ansel, N. G. Popovich, and L. V. Allen, "Pharmaceutical Dosage Forms and Drug Delivery Systems", 6th edition, Lippincott Williams & Wilkins, Baltimore, U.S.A.,1999, pp. 218-219. [ Links ]
9. J. M. Suñé, "Nuevas Aportaciones Galénicas a las Formas de Administración", Ferrer Grupo, Barcelona, España, 2000, pp. 41-47. [ Links ]
10. A.T. Florence and G.W. Halbert, Drug delivery and targeting, Phys. Technol. 16, 164 (1985). [ Links ]
11. M. George, I.V. Grass and R. Joseph, Sustained and controlled release drug delivery systems, in: "Modern Pharmaceutics", Edited by G.S. Banker and C.T. Rhodes, Marcel Dekker, USA, 1990, pp. 655-657. [ Links ]
12. P.J. Sinko, "Martin´s Physical Pharmacy and Pharmaceutical Sciences", 5th edition, Lippincott Williams & Wilkins, Baltimore, U.S.A., 2006, pp. 333-334. [ Links ]
13. R. K. Verma and S. Garg, Development and evaluation of osmotically controlled oral drug delivery system of glipizide, Eur. J. Pharm. Biopharm, 57, 513 (2004). [ Links ]
14. D. Prabakaran, P. Singh, P. Kanaujia and S. P. Vyas, Effect of hydrophilic polymers on the release of diltiazem hydrochloride from elementary osmotic pumps, Int. J. Pharm., 259, 173 (2003). [ Links ]
15. A.M Razagui. and J.B. Schwartz, Investigation of cyclobenzaprine hydrochloride release from oral osmotic delivery systems containing a water-swellable polymer, Drug Dev. Ind. Pharm., 28, 631 (2002). [ Links ]
16. X. Li, W. Pan, S. Nie, L. Wu, Studies on controlled release effervescent osmotic pump tablets from traditional Chinese medicine compound recipe, J. Control. Release, 96, 359 (2004). [ Links ]
17. K. Okimoto, R. A. Rajewski and V. J. Stella, Release of testosterone from an osmotic pump tablet utilizing SBE)7m beta cyclodextrin as both a solubilizing and an osmotic pump agent, J. Control. Release, 58, 29 (1999). [ Links ]
18. Y. Gan, W. Pan, M. Wei and R. Zhang, Cyclodextrin complex osmotic tablet for glizipide delivery, Drug Dev. Ind. Pharm., 28, 1015 (2002). [ Links ]
19. J. Urquhart, Controlled drug delivery: therapeutic and pharmacological aspects, J. Internal Medicine, 248, 357 (2000). [ Links ]
20. L. Liu, J. Ku, G. Khang, J. M. Rhee, and H. B. Lee, Monolithic osmotic tablet system for nifedipine delivery, J. Control. Release, 67, 309 (2000). [ Links ]
21. M.A. Ramadan and R. Tawashi, The effect of hydrodynamic conditions and delivery orifice size on the rate of drug release from the elementary osmotic pump system (EOP), Drug Dev. Ind. Pharm., 13, 235 (1987). [ Links ]
22. V. Gupta, S. Verma, A. Nanda and S. Nanda, Osmotically controlled drug delivery, Drug Delivery Technology, 5, 1 (2005). URL: http://www.drugdeliverytech.com [ Links ]
23. L. Liu and B. Che, Preparation of monolithic osmotic pump system by coating the indented core tablet, Eur. J. Pharm. Biopharm., in press (2006). [ Links ]
24. J.L. Jensen, L.E. Appel, J.H. Clair and G. M. Zentner, Variables that affect the mechanism of drug release from osmotic pumps coated with acrylate/methacrylate copolymer latexes, J. Pharm. Sci., 84, 530 (1995). [ Links ]
25. Y. Zhang, Z. Zhang and F. Wu, A novel pulsed-release system based on swelling and osmotic pumping mechanism, J. Control. Release, 89, 47 (2003). [ Links ]
26. S.V. Sastry and M.A. Khan, Aqueous based polymeric dispersion: Plackett-Burman design for screening of formulation variables of atenolol gastrointestinal therapeutic system, Pharm. Acta Helvetiae, 73, 105 (1998). [ Links ]
27 S.M. Herbig, J.R.Cardinal, R.W. Korsmeyer, K.L. Smith, Asymmetric membrane tablet coatings for osmotic drug delivery, J. Control. Release, 35, 127 (1998). [ Links ]
28. G. Thombre, J.R. Cardinal, A.R. DeNoto, D.C. Gibbes, Asymmetric membrane capsules for osmotic drug delivery II. In vitro and in vivo drug release performance, J. Control. Release, 57, 65 (1999). [ Links ]
29. D. Prabakaran, P. Singh, P. Kanaujia, K.S. Jaganathan, A. Rawat, and S. P. Vyas, Modified push pull osmotic system for simultaneous delivery of theophylline and salbutamol: development and in vitro characterization, Int. J. Pharm., 284, 95 (2004). [ Links ]
30. L. Dong, K. Shafi, P. Wong and J. Wan, L-OROS® SOFTCAP™ for Controlled Release of Non-Aqueous Liquid Formulations, Drug Delivery Technology, 2, 1 (2002). URL: http://www.drugdeliverytech.com. [ Links ]
31. N. Özdemir and J. Sahin, Design of a controlled release osmotic pump system of ibuprofen, Int. J. Pharm., 158, 91 (1997). [ Links ]
32. K. Okimoto, A. Ohike, R. Ibuki, O. Aoki, N. Ohnishi, R. A. Rajewski and V. J. Stella, T. Irie, K. Uekama, Factors affecting membrane-controlled drug release for an osmotic pump tablet (OPT) utilizing (SBE)7m beta CD as both a solubilizer and osmotic agent, J. Control. Release, 60, 311 (1999). [ Links ]
33. S. N. Makhija and P. R. Vavia, Controlled porosity osmotic pump-based controlled release systems of pseudoephedrine. I. Cellulose acetate as a semipermeable membrane, J. Control. Release, 89, 5 (2003). [ Links ]
34. X. Liu, D. Chen and R. Zhang, Evaluation of monolithic osmotic tablet system for nifedipine delivery in vitro and in vivo, Drug Dev. Ind. Pharm., 29, 813 (2003). [ Links ]
35. E. Lu, Z. Jiang, Q. Zhang, and X. Jiang, A water-insoluble drug monolithic osmotic tablet system utilizing gum arabic as an osmotic, suspending and expanding agent, J. Control. Release, 92, 375 (2003). [ Links ]
36. L. Liu, J. Ku, G. Khang, B. Lee, J. M. Rhee, and H. B. Lee, Nifedipine controlled delivery by sandwiched osmotic tablet system, J. Control. Release, 68, 145 (2000). [ Links ]
37. P.Schultz and Kleinebudde, A new multiparticulate delayed release system. Part I: Dissolution properties and release mechanism, J. Control. Release, 47, 181 (1997). [ Links ]
38. P.W.S. Heng, J. Hao, L.W. Chan and S.H. Chew, Influences of osmotic agents in diffusion layer on drug release from multilayer coated pellets, Drug Dev. Ind. Pharm., 30, 213 (2004). [ Links ]
39. R. K. Verma, A.M. Kaushal and S. Garg, Development and evaluation of extended release formulations of isosorbide mononitrate based on osmotic technology, Int. J. Pharm., 263, 9 (2003). [ Links ]
40. A. G. Thombre, L. E. Appel, M. B. Chidlaw, P. D. Daugherity, F. Dumont, L.A.F. Evans, and S.C. Sutton, Osmotic drug delivery using swellable-core technology, J. Control. Release, 94, 75 (2004). [ Links ]
41. M. Rani, R. Surana, C. Sankar and B. Mishra, Development and biopharmaceutical evaluation of osmotic pump tablets for controlled delivery of diclofenac sodium, Acta Pharm., 53, 263 (2003). [ Links ]
42. M. Rani and B. Mishra, Comparative in vitro and in vivo evaluation of matrix, osmotic matrix and osmotic pump tablets for controlled delivery of diclofenac sodium, AAPS PharmSci Tech, 5 (4), article 71 (2004). [ Links ]
43. J. R. Zingerman, J.R. Cardinal, R.T. Chern, J. Holste, J.B. Williams, B. Eckenhoff and J. Wright, The in vitro and in vivo performance of an osmotically controlled delivery system - IVOMEC SR® bolus, J. Control. Release, 47, 1 (1997). [ Links ]
44. M. Shapiro, M.A. Jarema and S. Gravina, Magnetic resonance imaging of an oral gastrointestinal-therapeutic-system (GITS) tablet, J. Control. Release, 38, 123 (1996). [ Links ]














