Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.43 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/rcciquifa.v43n1.45472
http://dx.doi.org/10.15446/rcciquifa.v43n1.45472
Artículo de revisión
Dipirona: ¿Beneficios subestimados o riesgos sobredimensionados? Revisión de la literatura
Dipyrone: Benefits underestimated or oversized risks? Review of the literature.
Tatiana Patricia Buitrago-González1, Carlos Alberto Calderón-Ospina2, Alvaro Vallejos-Narváez.3
1,2Escuela de Medicina y Ciencias de la Salud. Universidad del Rosario. Carrera 24 N° 63C - 69. Bogotá D.C. Correos electrónicos: buitrago.tatiana@urosario.edu.co., carlos.calderon@urosario.edu.co
1Facultad de Medicina, Fundación Universitaria de Ciencias de la Salud. Correo electrónico: agvallejos@gmail.com
Recibido para evaluación: Diciembre 12 de 2013
Aceptado para publicación: Mayo 29 de 2014
RESUMEN
Dipirona es un analgésico, antipirético, espasmolítico y antiinflamatorio de amplio uso en Colombia y Latinoamérica, proscrito por agencias regulatorias de referencia, por el riesgo de agranulocitosis y otras discrasias sanguíneas. Estos antecedentes han generado controversia e incluso aprensión dentro de los prescriptores, lo cual justifica esta revisión. Una vez revisada la literatura se encuentra que dipirona es eficaz como antipirético y para manejo del dolor agudo, crónico, postoperatorio, cólico renal y migraña. La prevalencia de agranulocitosis es de 0,03 al 0,5% en pacientes europeos y la incidencia de pacientes hispanos está alrededor de 0,38 casos por un millón de habitantes/año y aun menor en anemia aplásica. El riesgo de lesión gástrica es menor que el de otros AINEs de uso habitual y es un medicamento relativamente seguro en el embarazo. Otros efectos adversos incluyen hipersensibilidad, anafilaxia, pénfigo e hipotensión arterial relacionada con la administración intravenosa rápida del medicamento. Conclusiones: Dipirona conlleva un riesgo muy bajo de generar discrasias sanguíneas en población latinoamericana posiblemente por factores farmacogenéticos aún no identificados. Los principales factores de riesgo incluyen la duración del tratamiento, la dosis empleada y el uso concomitante de otros medicamentos que generen mielotoxicidad.
Palabras clave: Dipirona, Agranulocitosis, Anemia aplásica, Farmacovigilancia, Toxicidad por medicamentos, Resultados del tratamiento.
SUMMARY
Dipyrone is an analgesic, antipyretic, antispasmodic and anti-inflammatory widely used in Colombia and Latin America, outlawed by reference regulatory agencies due to the risk of agranulocytosis and other blood dyscrasias. These facts have generated controversy and even apprehension within prescribers, which justifies this review. After reviewing the literature is that dipyrone is effective as antipyretic and management of acute pain, chronic, postoperative, renal colic and migraine. The prevalence of agranulocytosis is 0.03 to 0.5% in European patients and the incidence in Hispanic patients is about 0.38 cases per million inhabitants / year and even lower for aplastic anemia. Gastric injury risk is lower than that of other commonly used NSAIDs and is a relatively safe drug during pregnancy. Other adverse effects include hypersensitivity, anaphylaxis, pemphigus and hypotension related to rapid intravenous administration of the drug. Conclusions: Dipyrone carries a very low risk of blood dyscrasias in Latin American population, possibly due to pharmacogenetic factors not yet identified. The main risk factors include duration of treatment, the dose used and the concomitant use of other drugs that produce myelotoxicity.
Key words:Dipyrone, Agranulocytosis, Aplastic anemia, Pharmacovigilance, Drug Toxicity, Treatment Outcome.
INTRODUCCIÓN
La dipirona es una pirazolona también llamada metamizol, es un fármaco analgésico, antipirético, espasmolítico y con mínimo efecto antiinflamatorio, ampliamente utilizado [1-3]. Las pirazolonas fueron descubiertas en 1884 por Ludwig Knorr, fueron introducidas en el mercado en el siglo XIX y ampliamente utilizadas hasta 1970, momento en el cual fueron relacionadas con algunas reacciones adversas como la agranulocitosis [4, 5]. Este medicamento fue fabricado por primera vez en Alemania en 1922 y la FDA (Food and Drug Administration), agencia regulatoria de medicamentos estadounidense prohibió su uso en 1977 [4]. Ha sido censurada en algunos países a causa de una posible asociación con agranulocitosis y anemia aplásica; pero aún así, se sigue utilizando en países como Austria, Bélgica, Francia, Alemania, Italia, Países Bajos, Turquía, España, Suiza, Sudáfrica, Rusia, y en América Latina y, debido a que es eficaz, de bajo costo y puede ser administrada por varias vías [6-10].
En Israel la dipirona es de venta libre, se usa para adultos y está aprobada para niños mayores de tres meses de edad [11]. En Brasil es el principal analgésico utilizado, con un 31,8% del mercado de los analgésicos, seguida por paracetamol (29,7%) y ácido acetilsalicílico (27,1%), se utiliza ampliamente y se considera segura [7, 12].
El hecho de que haya sido retirada de varios mercados, ha dificultado la ampliación del perfil de seguridad de este medicamento, especialmente en el embarazo; incluso al momento de su prohibición cuando se disponía de poca información para cuantificar el riesgo asociado a su uso [8, 13].
ASPECTOS FARMACOLÓGICOS DE LA DIPIRONA
La dipirona es un derivado de la aminopirina, también denominada noramidopirina, metamizol, metampirone; cuyo nombre químico es 1-fenil-2,3-dimetil-5-pirazolona-4-metilsulfonato [11]. Es un compuesto hidrofílico que en solución es rápidamente hidrolizado a sus metabolitos [7, 14]. Tiene un bajo peso molecular (351,3 daltons) [14]. La fracción activa 4-metil-amino-antipirina (MAA), tiene 85% de biodisponibilidad después de la administración oral en forma de tableta y alcanza su concentración máxima sérica (tmax) en 1,2 a 2 horas después de su administración [15]. La biodisponibilidad luego de administración intramuscular y rectal es de 87 y 54%, respectivamente [15]. El efecto analgésico alcanza su pico entre 20 a 45 minutos después de la administración intravenosa [7].
La unión a proteínas plasmáticas de los 4 metabolitos principales de la dipirona es menor al 60% [15]. El volumen aparente de distribución de MAA es de aproximadamente 1,15 L por kg de masa corporal. Al ser un compuesto hidrofílico no pasa barreras con facilidad y tiene poca acumulación en tejidos [15].
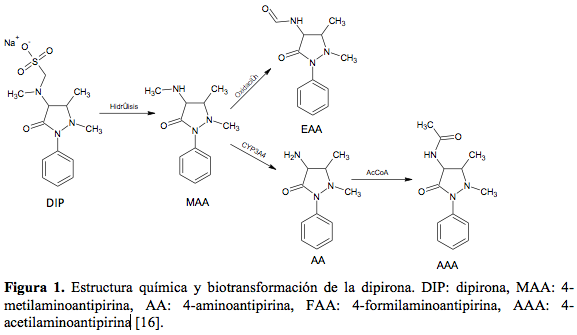
La dipirona en su metabolismo genera cuatro metabolitos, dos activos y dos inactivos (ver tabla 1 y figura 1) [16].
La dipirona es un profármaco que se hidroliza rápidamente por un mecanismo no enzimático para formar 4-metilaminoantipirina (MAA) su principal metabolito activo. El MAA se metaboliza en el hígado por desmetilación y produce 4-aminoantipirina (AA); a su vez el MAA por oxidación genera 4-formolaminoantipirina (FAA); y finalmente la AA es acetilada por la N-acetil-transferasa para formar 4-acetilaminoantipirina (AAA) [6, 16, 17]. El análisis de microsomas hepáticos de los pacientes tratados con dipirona ha mostrado inducción de las enzimas CYP2B6, CYP3A4 y de la bupropión hidroxilasa en comparación con sujetos no tratados con dipirona [1]. Así, la dipirona favorece la hidroxilación hepática y eliminación del bupropión (que además es sustrato del CYP2D6) y de otros sustratos de esta isoenzima (CYP2B6) como ciclofosfamida, selegilina, propofol y efavirenz. Así mismo, se ha demostrado que la co-administración de dipirona y ciclosporina trae como consecuencia una disminución en la concentración plasmática de este último fármaco por un efecto inductor del sistema CYP3A4 [1].
Para la eliminación de los metabolitos de dipirona es necesaria la transformación a glucurónidos, los cuales tienen depuración predominantemente renal, aproximadamente en un 60% [5, 7, 17]. Aproximadamente el 20% de dipirona es eliminado como MAA, en forma de glucurónido [17]. La MAA tiene una semivida de eliminación (t1/2) de 2,6 a 3,5 horas a FAA [15].
El mecanismo de acción de dipirona comprende un efecto a nivel periférico, reduciendo la actividad de nociceptores sensibles a la activación de dolor y centralmente al actuar sobre la sustancia gris periacueductal, activando las vías inhibitorias del dolor [6, 7]. La acción central explicaría su efecto antiemético y de control de la fotofobia [7].
Algunos estudios proponen que su acción periférica es el principal mecanismo analgésico, inhibiendo de manera reversible las dos isoformas de la ciclooxigenasa COX 1 y COX 2. [3,18]. Se propone que la 4-metilaminoantipirina, su principal metabolito activo, inhibe ambas isoformas [6]; aunque también se ha visto que la dipirona puede inhibir la COX-3 [19]. A nivel periférico ocasiona una desensibilización de las terminaciones del nervio trigémino estimuladas por la inflamación neurogénica, lo cual se relaciona con su acción antimigrañosa. A su vez se ha sugerido que el efecto antinociceptivo periférico también se puede asociar con canales sensibles al ATP, canales de potasio y posiblemente estimulación de la vía L-arginina/NO/cGMP en las neuronas sensoriales [7, 20]. Los efectos centrales y periféricos se asocian, ya que el efecto periférico genera reducción aferente excitatoria al tallo cerebral, generando una acción central [21].
Aunque el mecanismo molecular analgésico y antipirético de la dipirona ha estado en debate por mucho tiempo, se cree que inhibe la ciclooxigenasa, bloqueando la síntesis de tromboxano en las plaquetas y de prostaglandinas E1 y E2 [3, 6, 11]. En cuanto a su efecto espasmolítico, se sabe que está relacionado con la formación de las amidas araquidonoles en otros tejidos, que estimulan los receptores canabinoides [6]. Dipirona puede afectar la permeabilidad de la membrana celular y de los canales iónicos; y a su vez podría reducir o inhibir la concentración de los aminoácidos excitatorios o N-metil-D-aspartato, mecanismo importante en la migraña con aura, debido a que en esta patología hay un estado de hiperexcitabilidad neuronal, con mayor concentración de aminoácidos excitatorios en LCR como glutamato y aspartato [7].
En Colombia el INVIMA tiene registro sanitario aprobado para las siguientes formas farmacéuticas: Dipirona sódica solución inyectable de 1 g/2ml y 2 g/5ml, dipirona magnésica solución inyectable de 2,5 g/5ml, dipirona tabletas de 500 y 324 mg, solución oral 50 mg/ml y jarabe 50 mg/ml [22].
Para el manejo de la fiebre, la dosis eficaz por vía oral es de 0,5 a 1 g y se administra una dosis tres veces al día. La dosis máxima diaria recomendada es de 3 a 4 gramos [23]. Las dosis habituales por vía parenteral son de 0,5 a 1 g por vía intravenosa principalmente, pero también puede aplicarse por vía intramuscular o subcutánea [23].
En pacientes con insuficiencia renal, menos del 8% de la dosis se elimina por vía renal, como el metabolito activo MAA (4-metilaminoantipirina); y su eliminación en pacientes con insuficiencia renal crónica no está alterada. En los pacientes con falla renal aguda se ha evidenciado aumento de la vida media del MAA, que van desde 2,5 a más de 40 horas, lo que puede contribuir a reacciones adversas graves debido a la acumulación del fármaco. No hay mucha experiencia sobre cómo realizar el ajuste de dosis respectivo, debido a que no hay estudios formales en estos pacientes. La recomendación general es no usar dosis altas y reducir la duración del tratamiento al mínimo posible [23].
En los niños dipirona gotas orales (500 mg/mL) se usa a una dosis de 20 mg/Kg hasta 4 veces al día, siendo eficaz para el tratamiento de la fiebre [23].
INDICACIONES Y EFICACIA DE LA DIPIRONA
Hay diferentes indicaciones para el uso de dipirona y la eficacia varía de acuerdo a estas. Su baja toxicidad y su eficacia soportan su uso en la práctica clínica [6]. Dipirona se utiliza ampliamente para el tratamiento del dolor agudo y crónico [10]; en Alemania es un fármaco ampliamente prescrito para estos dos tipos de dolor [10].
En el manejo del dolor agudo tiene varias indicaciones, así: En el dolor postoperatorio muchas publicaciones afirman que este medicamento es eficaz [3, 7]; algunas revisiones Cochrane del equipo de McQuay confirman que incluso una sola dosis de dipirona es eficaz para este tipo de dolor [24]. En el manejo del dolor postoperatorio los analgésicos opioides son muy eficaces pero ocasionan efectos adversos como náuseas, vómito, retención urinaria, sedación, íleo paralítico y depresión respiratoria [25]. Diferentes estudios han analizado que otros analgésicos podrían ser eficaces para esta indicación. Se describe que la eficacia de lornoxicam IM 16 mg/día, diclofenaco 150 mg/día, ketoprofeno 200 mg/día y dipirona 3 g/día es muy similar para el dolor postoperatorio agudo; y la eficacia de una dosis única de dipirona es similar a la de los otros analgésicos para esta indicación [25]. Recientemente se ha propuesto que dipirona es más eficaz que parecoxib o paracetamol parenteral en el tratamiento del dolor postoperatorio [25]. Se plantea que dipirona 1 g IM tres veces al día es más eficaz que diclofenaco 75 mg dos veces al día, para esta indicación [26].
Dipirona es ampliamente utilizada para proporcionar alivio del dolor postoperatorio por sí misma y en combinación con opioides en varios países [27]. Se ha demostrado la eficacia que tiene dipirona en el manejo del dolor visceral en pacientes en posoperatorio; siendo la combinación de dipirona con un opioide débil como tramadol más eficaz que el opioide como monoterapia [28]. En el posoperatorio de histerectomía, al comparar dipirona con tramadol se ha visto que la eficacia es similar [25, 29]. Parecoxib 40 mg c./12 horas, alivia el dolor de manera similar a la dipirona 4g c./24 horas durante las primeras 48 horas poshisterectomía [30].
Hay pacientes que no se someten a una septoplastia por el dolor que pueden experimentar al retirar el empaquetamiento nasal; se ha demostrado que la administración de dipirona antes de este procedimiento es eficaz y costo-efectiva, minimizando el riesgo de complicaciones hemorrágicas, gastrointestinales y el daño renal asociados con los AINES clásicos; por este motivo, dipirona es una buena alternativa para estos pacientes [31]. Dipirona 1 g IV tres veces al día ha demostrado ser tan eficaz como diclofenaco administrado por vía rectal 100 mg dos veces al día después de una cirugía menor (32). De esta manera es posible afirmar que en el contexto del dolor posoperatorio, dipirona es uno de los analgésicos no opiodes más eficaces comercializados hasta la fecha [10].
Dipirona es eficaz en el manejo del cólico renal, incluso con una sola dosis por su actividad espasmolítica [3, 24]. Por eso es uno de los analgésicos de primera elección en el tratamiento de los pacientes con esta patología [33]. La eficacia analgésica de una única dosis IM de dexketoprofeno trometamol (25 y 50 mg), en comparación con dipirona (2 g) en dolor moderado a severo como lo es el de cólico renal, es similar para estos dos analgésicos; pero dexketoprofeno trometamol tiene mayor eficacia analgésica porque tiene un inicio más rápido de acción [34]. Se ha reportado que el manejo del dolor tipo cólico renal con una dosis IV única de dexketoprofeno 25 mg, dexketoprofeno 50 mg o dipirona 2 g, no ha mostrado diferencias significativas para el alivio de este tipo de dolor entre los tres medicamentos (35). Para el manejo del cólico biliar, se ha reportado que dipirona es más eficaz que desketoprofeno trometamol [3].
La migraña es una enfermedad muy frecuente que afecta al 6% de los varones y 15% de las mujeres. Dipirona intravenosa es segura y costo-efectiva para el alivio de la migraña asociada a otros síntomas y por esto es una buena alternativa para el tratamiento de la crisis migrañosa con y sin aura; los pacientes que reciben dipirona tienen una baja tasa de recurrencia y una reducción de la necesidad de medicación de rescate [7]. Dipirona también produce alivio de la fonofobia, fotofobia, náuseas y aura [7].
En una revisión Cochrane de cefalea primaria aguda en adultos y niños, que fueron tratados con dipirona, se concluyó que esta alivia la cefalea tensional de tipo "contracción muscular". Se concluyó que una dosis de 1 g VO de dipirona fue más eficaz que una dosis de 1 g de ácido acetil salicílico para la cefalea tensional [36]. No hay información acerca de la efectividad de dipirona en los niños y faltan datos para llegar a conclusiones sobre que dosis es mejor (0,5 o 1 g) y cuándo usar VO vs IV [36]. En las odontalgias, dipirona también ha demostrado ser eficaz [7].
En el manejo del dolor crónico, dipirona también ha demostrado eficacia. En el dolor ocasionado por el cáncer, en el cual el alivio de este es una piedra angular de su tratamiento, muchas veces paliativo, se documenta que dipirona puede ser eficaz para el control de este [3, 7]. En pacientes que recibieron morfina y dipirona, dipirona mostró que mejora la eficacia de la morfina para el control analgésico, generando un efecto analgésico precoz y más duradero, incluso después de la suspensión de la dipirona [37]. Paracetamol comparado con dipirona mostró tener similar efecto analgésico [38].
Otras indicaciones para el uso de dipirona están dadas por su excelente efecto antipirético siendo eficaz incluso para el manejo de la fiebre refractaria [3]. Comparando ibuprofeno, nimesulide y dipirona como antipiréticos, la disminución de la temperatura es mayor con dipirona que con ibuprofeno dos horas después de la administración de estos, aunque los tres antipiréticos fueron eficaces en la reducción de temperatura axilar en niños con estados febriles [39]. Comparando dipirona con otros antipiréticos en varios países latinoamericanos (Brasil, Argentina, México y Chile) en 8 centros asistenciales, se demostró que dipirona 15 mg/kg tuvo mayor eficacia para el control de la fiebre, con un tiempo de mantenimiento de temperatura normal, respecto a acetaminofén 12 mg/kg e ibuprofeno 5 mg/kg [40].
EFECTOS ADVERSOS DE LA DIPIRONA
La dipirona ha generado controversia en cuanto a su seguridad, en especial por no contar con la aprobación de la FDA. Antes de describir las reacciones adversas que puede generar este medicamento, se debe tener en cuenta que en una "reacción adversa probable" debe haber una relación temporal razonable entre la administración del medicamento y la aparición del evento adverso; y la reacción debe desaparecer después de suspender éste [41, 42]. No hay consenso con respecto a si dipirona es un analgésico y antipirético lo suficientemente seguro y si la relación beneficio/riesgo está favor de emplearlo en la mayoría de pacientes. Entre los efectos adversos se describen: reacciones inmunes graves como anafilaxia, asma, enfermedad del suero, vasculitis por hipersensibilidad, alveolitis, neumonitis, hepatitis, o síndrome hemolítico urémico, cuatro veces más frecuentes que la agranulocitosis, el cual curiosamente ha sido uno de los efectos adversos más temidos de este medicamento [24]. Náuseas, vómito, irritación gástrica, xerostomía, astenia, exantemas e hipotensión están descritos entre los principales efectos adversos después de la administración intravenosa de dipirona [11].
Hay otra literatura que ratifica su seguridad, su baja toxicidad, su eficacia y su buen perfil de tolerabilidad aguda, que apoya su uso en la práctica clínica [6, 7]. Muchos autores aseguran que la dipirona es un potente analgésico que produce efectos adversos menores y que las RAM como hepatitis, agranulocitosis, anemia aplásica, anemia hemolítica, anafilaxia grave y el síndrome de Stevens - Johnson son raras, con tasas de incidencia entre 1 y 25 casos por cada millón de pacientes tratados al año con este medicamento [25, 43].
Las discrasias sanguíneas son reacciones adversas descritas para dipirona, por las cuales y principalmente por la anemia aplásica, este medicamento no tiene aprobado su uso por la FDA. La incidencia de discrasias sanguíneas es de uno por cada 3000 usuarios [24]. Un estudio en Suecia describe que el porcentaje de discrasias sanguíneas es "alto" y concluye que dipirona no es segura; estos resultados no son concluyentes debido a que no hay datos sobre la dosis ni el tiempo de tratamiento relacionado con las reacciones adversas [41]. Dipirona no influye de manera significativa en la cascada de la coagulación y es bien tolerada por los pacientes [10]. La leucopenia se reporta también como un efecto adverso de dipirona [3]. La agranulocitosis, el efecto adverso más grave y potencialmente fatal de dipirona, ha llevado a que este medicamento sea retirado en varios países [11, 44]. Aunque su frecuencia sigue siendo controvertida, hay artículos que concluyen que su incidencia es muy baja y que está sujeta a variabilidad geográfica [10, 36, 45]. ésta se explica en parte por los diferentes patrones de uso, en términos de dosis, duración y medicamentos concomitantes; además la agranulocitosis podría tener también una predisposición genética [6, 27, 43], es por eso que la agranulocitosis tiene diferentes causas, tanto farmacológicas como no farmacológicas. El mecanismo de producción de la agranulocitosis por dipirona se ha analizado en varios estudios que han elucidado que este es probablemente de naturaleza inmunológica [4] por lo que clásicamente ha sido clasificada como una RAM de tipo B o idiosincrática de acuerdo a la clasificación mecanística de las RAM propuesta por Rawlins y Thompson [46].
Varios estudios de larga data (1966), orientados a dilucidar la etiología de la agranulocitosis aguda por medicamentos, encontraron un total de 125 medicamentos probablemente relacionados con esta reacción adversa; y más del 50% de los casos son ocasionados por medicamentos comunes en la práctica clínica, tales como: clozapina, dapsona, dipirona, penicilina G, procainamida, rituximab, sulfasalazina, entre otros [47]. Dipirona y fenilbutazona se asocian como causa de agranulocitosis inducida por medicamentos, más frecuentemente [45]. Andersohn and col. recomiendan el recuento de células sanguíneas de rutina, para los siguientes fármacos: carbimazol, clozapina, dapsona, dipirona, penicilina G (a dosis altas), procainamida, rituximab, sulfasalazina, y ticlopidina [47].
En el 2002, Backstrom señaló que la mayoría de los pacientes que desarrollaron agranulocitosis después del tratamiento con dipirona también habían sido tratados con otros medicamentos asociados con agranulocitosis, lo cual dificulta la cuantificación del riesgo asociado a la dipirona [36]. En 1981, Oficina General de Sanidad Alemana calculó el riesgo de agranulocitosis por dipirona en un caso por cada 20.000 usuarios al año; y en 1986 el Estudio Internacional de Anemia Aplásica y Agranulocitosis (IAAAS) informó que la incidencia era de un caso entre 1.100.000 usuarios de dipirona por semana [24]. El riesgo de agranulocitosis se ha estimado cercano a 0,1% y el de la anemia aplásica es cercano a cero [7].
Otros estudios han reportado una incidencia anual de agranulocitosis de 5,02 casos por año, donde 3,36 fueron casos que se presentaron en la comunidad; adicionalmente se sugiere que el riesgo aumenta con la duración del uso y que desaparece 10 días después de la última dosis de metimazol [43]. Es así que la agranulocitosis por dipirona es poco frecuente y los casos que se atribuyen pueden ser en parte debido al empleo de dosis altas durante largos períodos de tiempo [43]. En Texas, un estudio intentó recopilar todas las exposiciones a dipirona entre los años 1998 a 2004; reportando que ningún paciente presentó agranulocitosis [48]. El estudio LATIN en América Latina, realizado entre el 2002 y el 2005 en siete instituciones hospitalarias en Brasil, dos en Argentina y una en México; concluyó que la tasa de incidencia de agranulocitosis es de 0,38 casos por un millón de habitantes/año, y no hay razón para que se tomen medidas de salud pública con respecto a la comercialización de la dipirona [49]. Se plantea que la proporción de casos fatales ha disminuido en las últimas décadas siendo del 0% al 23% [47].
Hay reportes de caso de agranulocitosis en la literatura, de los cuales mencionamos algunos que son particularmente representativos desde el punto de vista clínico: A una paciente de 4 años de edad con neumonía, se prescribió dipirona IV, dosis no clara, tenía tratamiento concomitante con ceftriaxona y dicloxacilina; y posterior a esto presentó leucopenia y neutropenia; por lo cual se descontinuó la dipirona, normalizándose el recuento leucocitario. Otra paciente de 51 años con fiebre y cefalea de larga data, presentó hipocelularidad en la médula ósea después de recibir dipirona; fue manejada inicialmente con ácido acetil salicílico y posteriormente con dipirona, teniendo un antecedente de alergia a este último medicamento el cual no fue reconocido oportunamente. Se reporta un caso de leucopenia en una mujer de 68 años en España (2010), la cual resolvió sin complicaciones.
En Alemania se reportó un caso, en el cual no se pudo establecer si la agranulocitosis había sido generada por la dipirona, el diclofenaco o la combinación de los dos medicamentos: en Brasil (2011), una paciente de 34 años presentó agranulocitosis fatal cuando recibía ceftriaxona y dipirona concomitantemente [50, 51]. En general se puede afirmar que no existe un consenso sobre el riesgo de agranulocitosis relacionada con dipirona [36].
Las revisiones Cochrane del equipo McQuay confirman que una dosis de dipirona para el dolor posoperatorio y para el dolor del cólico renal, provoca pocas reacciones adversas [24]. Haciendo un paralelo entre dipirona y antinflamatorios no esteroideos, el riesgo de agranulocitosis asociado con el uso de dipirona debe ser comparado con reacciones adversas potencialmente mortales de estos últimos como son: sangrado gastrointestinal, hepatitis, discrasias sanguíneas, hipersensibilidad aguda o reacciones dermatológicas severas [43]. En cuanto al tratamiento de la agranulocitosis inducida por fármacos, los factores de crecimiento hematopoyéticos parecen lograr que la duración de esta reacción adversa sea más corta, reduciendo las infecciones y complicaciones fatales [47]. La enterocolitis neutropénica es una complicación seria de la agranulocitosis. Hay un reporte de caso (1999) de una paciente de 50 años, quien presentó un cuadro de 3 semanas de dolor abdominal, diarrea, úlceras en cavidad oral y lesión perianal dolorosa; la paciente había tomado dipirona 5 días previos al inicio del cuadro; el desenlace fue una hemicolectomía derecha con ileostomía y se planteó que la etiología fue la dipirona [52]. La anemia aplásica (AA) es una patología hematológica grave, caracterizada por una médula ósea hipoplásica o aplásica que genera una pancitopenia [53]. Se ha reportado una incidencia en países de América Latina de 1,6 casos por millón de habitantes al año, la cual es baja; a su vez la incidencia más alta se reporta en los países asiáticos [53]. Un estudio realizado en Brasil, de 1999 al 2000, informó una incidencia de 2,4 casos por millón de habitantes al año [53]. En cuanto a la etiología y factores de riesgo para desarrollar AA, se ha visto que la exposición frecuente a productos a base de benceno aumenta el riesgo; algunos medicamentos como dipirona y azitromicina, productos químicos y también factores ambientales pueden influir en su desarrollo [53]. Hay pocas asociaciones de AA con fármacos específicos y es probable que algunos de ellos fueran debidos al azar [53]. Una reciente revisión muestra que la mayoría de los casos de anemia aplásica parece ser secundaria a la destrucción inmunológica de células hematopoyéticas y que la alta exposición a disolventes, pesticidas y benceno, puede influir en su aparición [53].
En 2004, en Turquía se reportó un caso de una niña de 13 años que desarrolló anemia aplásica severa después del tratamiento con dipirona (dosis no especificada); fue hospitalizada por infección urinaria que recibió manejo con amikacina y ciprofloxacina; y una semana después presentó fiebre y pancitopenia; el cuadro resolvió en 15 días y se cree que fue causado por una alta dosis de dipirona sódica [54].
Las Reacciones de Hipersensibilidad por dipirona pueden variar con un cuadro clínico desde eritema hasta broncoespasmo y angioedema [10]. Se plantean como factores de riesgo de reacciones de hipersensibilidad severa a dipirona, antecedentes de alergias previas, intolerancia a ésta y a otros analgésicos no opioides, así mismo pacientes que presentan asma bronquial [10]. Tras la administración intradérmica de dipirona en pruebas de hipersensibilidad se ha documentado la aparición de lesiones en parches eritematosos en palmas, cara y pabellones auriculares, después de 20 minutos de su aplicación [55]. La urticaria es otro efecto adverso reportado [3].
En cuanto a la anafilaxia, para la mayoría de los analgésicos no opioides, la incidencia está entre 5 a 15 casos/100.000 pacientes expuestos [56]; amenazando la vida por compromiso circulatorio [57]. Se ha reportado una reacción anafiláctica grave sin síntomas cutáneos después de la infusión intravenosa de 1 g de dipirona [3, 10]. Las reacciones anafilácticas son producidas por medicamentos diferentes a dipirona como medios de contraste (71/100.000), antibióticos (penicilina parenteral 32/1.000.000), dextrano (36/100.000), estreptoquinasa (284/100.000) [10]. Algunos medicamentos principalmente involucrados en la anafilaxia perioperatoria son los relajantes musculares (69,2% de los casos), látex (21,1%), antibióticos (8,0%) e hipnóticos (3,7%) [58]; siendo la incidencia de esta reacción adversa relativamente baja para dipirona (5/100.000) [57].
El pénfigo es otra reacción adversa, aunque su rol causal no ha sido concluyente [59]. La pustulosis exantematosa generalizada aguda, que se manifiesta como una erupción difusa pruriginosa, con pústulas y eritema en el tronco, se ha asociado también con el uso de dipirona [60, 61]. Así mismo está descrita la erupción por medicamentos, manifestada por máculas violáceas eritematosas pruriginosas en la espalda y la prueba de parche posterior [62].
El uso de dipirona se ha asociado también con la presentación de necrólisis epidérmica tóxica en adultos mayores, con resolución favorable la mayoría de veces [63]. La fascitis necrotizante también ha sido reportada como posible reacción adversa de dipirona, ésta puede ser potencialmente mortal, requiere un diagnóstico precoz y el desbridamiento quirúrgico; se plantea que la neutropenia aumenta la susceptibilidad a la infección bacteriana y luego conduce a la fascitis necrotizante [47].
Existe un reporte de caso de una paciente de 37 años que presentó una úlcera en la mucosa del labio inferior asociada a la automedicación con dipirona para la fiebre y tos, la cual apareció 3 semanas después de la administración del medicamento; un año atrás había presentado leucopenia después del uso de dipirona [3].
También están asociadas al uso de dipirona reacciones adversas de tipo cardiovascular. De estas reacciones, la hipotensión arterial que puede ser grave, se ha informado en uno de cada 3.000 pacientes [24]. Los pacientes pueden presentar colapso cardiovascular por edema generalizado y la hipotensión consecutiva luego de la administración IV de dipirona durante la anestesia. La presión arterial sistólica puede disminuir hasta en 20 mmHg, esto puede ocurrir en minutos o hasta 6 horas después de la administración de dipirona [10]. Son factores de riesgo para hipotensión por dipirona, una infusión intravenosa rápida y la administración en bolos, por lo cual deben evitarse [10].
En un estudio colombiano realizado en pacientes hospitalizados dirigido a indagar la presentación de reacciones adversas y sus factores predisponentes no se documentaron casos de hipotensión relacionados con administración rápida de dipirona por vía intravenosa [45].
A diferencia del ácido acetil salicílico y otros fármacos antiinflamatorios no esteroideos, dipirona no presenta efectos adversos gastrointestinales significativos [7, 10]. Dipirona está asociada con un bajo riesgo de hemorragia gastrointestinal y este riesgo es mucho más bajo del que se reporta por el uso de AINE [43]. La toxicidad gastrointestinal de dipirona se ha visto que es baja incluso en pacientes suicidas que han ingerido cantidades mayores de 8 g de dipirona [11]. El tratamiento recomendado en caso de intoxicación con dipirona es la descontaminación gastrointestinal (si ha pasado menos de una hora desde la ingestión) y medidas de apoyo [11].
Respecto a la sobredosificación con dipirona, la información sobre sus efectos es escasa, pero al parecer ésta se produce principalmente en casa al ser administrada por vía oral, más frecuentemente en mujeres y en un número considerable de intentos de suicidio, donde el principal síntoma es la toxicidad gastrointestinal leve [11]. Es importante resaltar que las manifestaciones clínicas tóxicas no son inmediatamente evidentes, por lo cual se justifica una observación por un período de 8 horas. Aunque el tratamiento debe incluir básicamente medidas para el control de los síntomas [11]; el uso de carbón activado se puede considerar si el paciente ingirió 5 g o más y si se presenta dentro de 1 hora después de la exposición [11]. Las pruebas hematológicas de rutina no parecen estar justificadas, pero se necesitan más estudios para corroborar esta recomendación [11]. Al comparar dipirona con otros analgésicos y antipiréticos, el incremento en la mortalidad atribuida al ácido acetil salicílico y al diclofenaco está principalmente asociado a la hemorragia gastrointestinal [7].
La incidencia de hemorragia gastrointestinal es alrededor de 400 casos por millón de habitantes al año y que el 38% de estos casos son atribuibles a los AINE [43, 64]. Comparando la seguridad de dipirona con medicamentos con efecto antipirético como acetaminofén e ibuprofeno, se documenta que los tres son seguros sin diferencias estadísticamente significativas [40].
Un estudio colombiano dirigido a establecer el perfil de seguridad de dipirona y tramadol en pacientes hospitalizados de un hospital de referencia en Bogotá encontró que aproximadamente el 4% de un total de 2.547 pacientes presentó algún tipo de efecto adverso a este medicamento durante un periodo de seguimiento de 6 meses. En este estudio la frecuencia de presentación de efectos adversos estuvo claramente relacionada con la dosis empleada siendo más numerosos cuando la dosis empleada fue de 10 g/día (69% de los casos).
Por otra parte las reacciones adversas más frecuentes fueron las náuseas y el vómito, seguidas por las reacciones adversas dermatológicas. No se encontraron casos de agranulocitosis ni de otras discrasias sanguíneas en dicho estudio, siendo la leucopenia y la anemia los únicos efectos adversos hematológicos encontrados con una frecuencia del 6,8 y del 5,7% respectivamente [65]).
INTERACCIONES FARMACOLÓGICAS
La tabla 3 presenta la información general sobre el riesgo potencial de reacciones adversas debidas a las posibles interacciones farmacológicas de dipirona.
Para otros medicamentos se describen interacciones farmacológicas catalogadas como moderadas en MICROMEDEX, las cuales tienen una baja significancia clínica, tales como: Acenocumarol, Alprenolol, Amilorida, Amlodipino, Atenolol, Bisoprolol, Bumetanida, Candesartán, Captopril, Carvedilol, Clorpropamida, Chlortalidona, Desvenlafaxina, Diltiazem, Enalapril, Eprosartán, Esmolol, Flunarizina, Furosemida, Glimepiride, Glibenclamida, Hidroclorotiazida, Indapamida, Irbesartán, Labetalol, Levofloxacina, Carbonato de Litio, Losartán, Metoprolol, Nadolol, Nebivolol, Nicardipina, Nifedipina, Norfloxacina, Ofloxacina, Olmesartán, Pindolol, Propranolol, Quinapril, Ramipril, Sotalol, Espironolactona, Telmisartán, Timolol, Tolbutamida, Torasemida, Triamtereno, Valsartán, Verapamilo y Warfarina [23].
USO EN EMBARAZO Y LACTANCIA
El uso de dipirona durante el embarazo no ha demostrado que la exposición del feto aumente el riesgo de anomalías congénitas y otros eventos adversos durante el embarazo [63]. Se han reportado algunos casos de oligohidramnios asociado a dipirona en embarazadas, pero por altas dosis durante el tercer trimestre [64]; el ultrasonido obstétrico en estos casos muestra que el líquido amniótico se normaliza gradualmente dentro de una semana sin ocasionar daños al feto [65]. Hay algunos reportes de asociación positiva de uso de dipirona y defectos diafragmáticos (OR 2,7), anomalías cardiovasculares (OR 1,3) y otras anomalías (OR 1,8), en comparación con la población control [66]. Al comparar el uso de dipirona con acetaminofén durante el embarazo, se encontró que no hay diferencias significativas entre estos medicamentos en cuanto a la tasa de nacidos vivos, abortos espontáneos, edad gestacional al nacer, prematuridad, malformaciones, peso al nacer y sufrimiento fetal. Se ha descrito una tasa mayor de cesárea entre las mujeres expuestas al dipirona [67].
El uso de dipirona durante la lactancia, es una ventaja para las mujeres que necesitan estar alerta mientras amamantan, ya que los opiáceos pueden producir somnolencia; y por esto es más aceptable la dipirona que los opiáceos para el alivio del dolor; aunque todos los metabolitos de dipirona se excretan en la leche materna [15, 68].
CONCLUSIONES
El uso actual de dipirona en el mundo y fundamentado en su perfil de seguridad es muy diverso; ya que hay países como Estados Unidos donde prohíben su uso; y otros como Brasil donde su uso es amplio. La etiología de la agranulocitosis farmacológica está asociada en más del 50% a medicamentos comúnmente utilizados en la práctica clínica como: clozapina, dapsona, dipirona, penicilina G, entre otros. La incidencia de agranulocitosis sigue siendo controvertida; reportes recientes informan que su incidencia es muy baja y que está sujeta a variabilidad geográfica, patrones de uso, dosis, duración del tratamiento, medicamentos concomitantes y predisposición genética. El estudio LATIN informó que en América Latina la tasa de incidencia de agranulocitosis es extremadamente baja, lo cual sugiere una baja susceptibilidad para este efecto adverso para la población hispana, que no justifica la toma de medidas de salud pública con este medicamento por parte de las autoridades sanitarias.
De esta forma la incidencia de anemia aplásica en América Latina es baja siendo de 1,6 casos por millón de habitantes al año; estando además poco asociada a fármacos específicos siendo probable que algunos casos fueran debidos al azar. Una revisión reciente muestra que la mayoría de los casos de anemia aplásica parecen ser secundarios a la destrucción inmunológica de células hematopoyéticas y su etiología está dada principalmente por la exposición a sustancias diferentes a la dipirona como disolventes, pesticidas y benceno, que pueden favorecer su aparición.
Comparando dipirona con los antinflamatorios no esteroideos (AINE), la evidencia disponible sugiere que estos últimos pueden tener un riesgo más elevado de producir hemorragia gastrointestinal, una complicación de alta incidencia y morbimortalidad en la práctica clínica, en comparación con la baja incidencia de agranulocitosis de la dipirona. Aunque las interacciones farmacológicas de dipirona son varias, muchas están reportadas por el simple hecho que dipirona es un AINE de baja potencia, principalmente las relacionadas con el riesgo de hemorragia, que como ya se mencionó previamente es muy bajo comparado con los otros AINE. La literatura ha mostrado que la exposición del feto a la dipirona no aumenta el riesgo de anomalías congénitas y otros eventos adversos durante el embarazo, aunque se ha reportado oligohidramnios en el tercer trimestre, relacionado solamente con altas dosis de dipirona, siendo el desenlace la recuperación completa sin complicaciones en todos los casos reportados.
AGRADECIMIENTOS
A Diana Carolina Maldonado Viasús por su apoyo en la búsqueda y análisis de información y a Daniel Ricardo Delgado por su apoyo para la elaboración de la Figura 1
FINANCIACIÓN
No se requirió financiación para la realización del presente trabajo. El texto completo de los artículos que fueron consultados se obtuvo a través de las bases de datos a las que la Universidad del Rosario se encuentra suscrita.
CONFLICTOS DE INTERESES
Durante la elaboración del artículo uno de los autores trabajó como asesor de la Sala Especializada de Medicamentos del INVIMA y posteriormente como Asociado de Seguridad Clínica de Novartis de Colombia.
REFERENCIAS
1. T. Saussele, O. Burk, J.K. Blievernicht, K. Klein, A. Nussler, N. Nussler, J.G. Hengstler, M. Eichelbaum, M. Schwab, U.M. Zanger, Selective Induction of Human Hepatic Cytochromes P450 2B6 and 3A4 by Metamizole, Clin. Pharmacol. Ther., 82, 3 (2007). [ Links ]
2. E. Zylber-Katz, Y. Caraco, L. Granit, M. Levy, Dipyrone metabolism in liver disease, Clin. Pharmacol. Ther., 58, 2 (1995). [ Links ]
3. S.T. Becker, J. Wiltfang, I.N. Springer, M.S. Bartsch, R. Guenther, E. Sherry, P.H. Warnke, Life-threatening bite injury of the lower lip after use of metamizole, Oral Maxillofac. Surg., 12, 1 (2008). [ Links ]
4. V.J. Dorr, J. Cook, Agranulocytosis and near fatal sepsis due to 'Mexican aspirin' (dipyrone), South Med. J., 89, 6 (1996). [ Links ]
5. Maier C, Dipyrone (metamizol) - A never ending story, Acute Pain, 2, 4 (1999). [ Links ]
6. T. Rogosch, C. Sinning, A. Podlewski, B. Watzer, J. Schlosburg, A.H. Lichtman, M.G. Cascio, T. Bisogno, V. Di Marzo, R. Nüsing, P. Imming, Novel bioactive metabolites of dipyrone (metamizol), Bioorg. Med. Chem., 1, 20 (2012). [ Links ]
7. M.E. Bigal, C.A. Bordini, S.J. Tepper, J.G. Speciali, Intravenous dipyrone in the acute treatment of migraine without aura and migraine with aura: A randomized, double blind, placebo controlled study, Headache, 42, 9 (2002). [ Links ]
8. T. da Silva Dal Pizzol, L. Schüler-Faccini, S.S. Mengue, M.I. Fischer, Dipyrone use during pregnancy and adverse perinatal events, Arch. Gynecol. Obstet., 279, 3 (2009). [ Links ]
9. C. Berlin C, Are we loosing good drugs?, Clin. Pediatr. (Phil.)., 40, 6 (2001). [ Links ]
10. U.M. Stamera, M. Soehle, T-W. Park, M. Fischer, F. Stubera, Anaphylactic reaction after intravenous dipyrone, Acute Pain, 9, 4 (2007). [ Links ]
11. Y. Bentur, O. Cohen, Dipyrone overdose, J. Toxicol., 42, 3 (2004). [ Links ]
12. Painel Internacional de Avaliação da Segurança da Dipirona, Brasília, Brasil, Agência Nacional de Vigilância Sanitária (ANVISA), 2001, URL: http://www.anvisa.gov.br/divulga/informes/relatoriodipirona2.pdf. [ Links ]
13. S.E. Andrade, C. Martinez, A.M. Walker, Comparative safety evaluation of non-narcotic analgesics, J. Clin. Epidemiol., 51, 12 (1998). [ Links ]
14. S. Mao, S. Yang S, D. Bi, Pharmacodynamics and potential toxicity of intranasally administered dipyrone, Biol. Pharm. Bull., 29, 7 (2006). [ Links ]
15. M. Levy, E. Zylber-Katz, B. Rosenkranz, Clinical pharmacokinetics of dipyrone and its metabolites, Clin. Pharmacokinet., 28, 3 (1995). [ Links ]
16. A.M. Domínguez-Ramírez, P.C. Calzadilla, A.R. Cortés-Arroyo, M. Hurtado y de la Peña, J.R. López, M. Gómez-Hernández, J.F. López-Muñoz, High-performance liquid chromatographic assay for methamizol metabolites in rat plasma: Application to pharmacokinetic studies, J. Pharm. Biomed. Anal., 71, 173-8 (2012). [ Links ]
17. A.M. Domínguez-Ramírez, A.R. Cortés-Arroyo, M. Hurtado y de la Peña, J.R. López, J.F. López-Muñoz, Effect of methamizol on morphine pharmacokinetics and pharmacodynamics after acute and subchronic administration in arthritic rats, Eur. J. Pharmacol., 645, 1-3 (2010). [ Links ]
18. C. Campos, R. de Gregorio, R. García-Nieto, F. Gago, P. Ortiz, S Alemany, Regulation of cyclooxygenase activity by metamizol, Eur. J. Pharmacol., 378¸ 3 (1999). [ Links ]
19. N.V. Chandrasekharan, H. Dai, K.L. Roos, N.K. Evanson, J. Tomsik, T.S. Elton, D.L. Simmons, COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: Cloning, structure, and expression, Proc. Natl. Acad. Sci. U.S.A., 99, 21 (2002). [ Links ]
20. D. Alves, I. Duarte, Involvement of ATP-sensitive K+ channels in the peripheral antinociceptive effect induced by dipyrone, Eur. J. Pharmacol., 444, 1-2 (2002). [ Links ]
21. Woodhouse, P.D. Drummond, Mechanisms of increased sensitivity to noise and light in migraine headache, Cephalalgia, 13, 6 (1993). [ Links ]
22. Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA (Colombia). Sistema de Trámites en Línea Consultas Públicas. Bogotá: INVIMA, [fecha de consulta: 18 de octubre de 2013]. Disponible desde: URL: http://web.sivicos.gov.co:8080/consultas/consultas/consreg_encabcum.jsp [ Links ]
23. Micromedex Healthcare Series. DRUGDEX System. "Dipyrone" Greenwood Village, CO: Truven Health Analytics, 2013. Recuperado 15 Abril de 2012. URL: http://www.thomsonhc.com/. [ Links ]
24. P. Schönhöfer, L. Offerhaus, A. Herxheimer, Dipyrone and agranulocytosis: What is the risk? Lancet, 361, 9361 (2002). [ Links ]
25. M. Sener, C. Yilmazer, I. Yilmaz I, N. Bozdogan, C. Ozer, A. Donmez, G. Arslan, Efficacy of lornoxicam for acute postoperative pain relief after septoplasty: A comparison with diclofenac, ketoprofen, and dipyrone, J. Clin. Anesth., 20, 2 (2008). [ Links ]
26. A. Saray, U. Büyükkocak, I. Cinel, A.T. Tellioglu, U. Oral, Diclofenac and metamizol in postoperative analgesia in plastic surgery, Acta Chir. Plast., 43, 3 (2001). [ Links ]
27. S.A. Schug, A. Manopas, Update on the role of non-opioids for postoperative pain treatment, Best Pract. Res. Clin. Anaesthesiol., 21, 1 (2007). [ Links ]
28. A. Spacek, E. Goraj, F.X. Neiger, J. Jarosz, Kress H.G, Superior postoperative analgesic efficacy of a continuous infusion of tramadol and dipyrone (metamizol) versus tramadol alone, Acute Pain, 5, 1 (2003). [ Links ]
29. L.M. Torres, M.J. Rodríguez, A. Montero, J. Herrera, E. Calderón, J. Cabrera, R. Porres, M.R. de la Torre, T. Martínez, J.L. Gómez, J. Ruiz, I. García-Magaz, J. Cámara, P. Ortiz, Efficacy and safety of dipyrone versus tramadol in the management of pain after hysterectomy, Reg. Anesth. Pain Med., 26, 2 (2001). [ Links ]
30. S. Soltesz, M.U. Gerbershagen, B. Pantke, F. Eichler, G. Molter, Parecoxib versus dipyrone (metamizole) for postoperative pain relief after hysterectomy, Clin. Drug Investig., 28, 7 (2008). [ Links ]
31. E.O. Tulunay, F.C. Tulunay F, S.E. Gulmez, H. Ergun, A. Demireller, The analgesic efficacy of dipyrone during removal of nasal packings after septal surgery, J. Headache Pain, 5, 4 (2004). [ Links ]
32. Steffen, E. Krinn, A. Möller, W. Seeling, M.G. Rockemann, Metamizol and Diclofenac profoundly reduce opioid consumption after minor trauma surgery, Acute Pain, 4, 2 (2002). [ Links ]
33. H. Ergün, M.G. Clingir, I. Apaydin, A.R. Ercöcen, F.C. Tulunay, The effect of dipyrone on survival of skin flaps, Scand. J. Plast. Reconstr. Hand Surg., 35, 1 (2001). [ Links ]
34. J. Sánchez-Carpena, J. Sesma-Sánchez, C. Sánchez-Juan C, S. Tomás-Vecina, D. García-Alonso, J. Rico-Salvadó, M. Forns, M. Mas, I. Paredes, R. Artigas, Dexketoprofen renal colic study group. Comparison of dexketoprofen trometamol and dipyrone in the treatment of renal colic, Clin. Drug Investig., 23, 3 (2003). [ Links ]
35. J. Sánchez-Carpena, F. Domínguez-Hervella, F. García, E. Gene, R. Bugarín, A. Martín, S. Tomás-Vecina, D. García, J.A. Serrano, A. Román, M. Mariné, M.L. Mosteiro, Dexketoprofen renal colic study group, Comparison of intravenous dexketoprofen and dipyrone in acute renal colic, Eur. J. Clin. Pharmacol., 63, 8 (2007). [ Links ]
36. A.S. Ramaciotti, B.G.O. Soares, A.N. Atallah, Dipyrone for acute primary headaches (Review), The Cochrane Library, 4, (2012). [ Links ]
37. J.F. Duarte Souza, P.P. Lajolo, H. Pinczowski, A. del Giglio, Adjunct dipyrone in association with oral morphine for cancer-related pain: the sooner the better, Support Care Cancer, 15, 11 (2007). [ Links ]
38. S. Kampe, M. Warm, S. Landwehr, D Oguzhan, S. Haussmann, M. Paul, B. Pilgram, P. Kiencke, Clinical equivalence of IV paracetamol compared to IV dipyrone of postoperative analgesia after surgery for breast cancer, Curr. Med. Res. Opin., 22, 10 (2006) [ Links ]
39. H.L. Yilmaz, N. Alparslan D. Yildizdas, I. Bayram, E. Alhan, Intramuscular dipyrone versus oral ibuprofen or nimesulide for reduction of fever in the outpatient setting, Clin. Drug Investig., 23, 8 (2003). [ Links ]
40. A. Wong, A. Sibbald, F. Ferrero, M. Plager M, M.E. Santolaya, A.M. Escobar, S. Campos, S. Barragán, M. De León González, G.L. Kesselring, Fever pediatric study group, Antipyretic effects of dipyrone versus ibuprofen versus acetaminophen in children, Clin. Pediatr. (Phil.), 40, 6 (2001). [ Links ]
41. K. Hedenmalm, O. Spigset, Agranulocytosis and other blood dyscrasias associated with dipyrone (metamizole), Eur. J. Clin. Pharmacol., 58, 4 (2002). [ Links ]
42. C.A. Calderón-Ospina, A. Urbina-Bonilla, La Farmacovigilancia en los últimos 10 años: actualización de conceptos y clasificaciones, Logros y retos para el futuro en Colombia, Méd. UIS, 24, 1 (2011). [ Links ]
43. L. Ibañez, X. Vidal, E. Ballarín, J.R. Laporte, Agranulocytosis associated with dipyrone (metamizol), Eur. J. Clin. Pharmacol., 60, 11 (2005). [ Links ]
44. R. Braun, I. Biiche, P. Maier, H. Thiele, Perioperative analgesia with intraoperatively started infusion of high- dose dipyrone in orthopaedic and trauma surgery, Acute Pain, 2, 4 (1999). [ Links ]
45. H.K. Doshi, J. Thambiah, C.L. Chan, M.E. P.A. Tambyah, Necrotising fasciitis caused by adulterated traditional Asian medicine: A case report, J. Orthop. Sur. (Hong Kong), 17, 2 (2009). [ Links ]
46. C. Calderón-Ospina, C. Bustamante-Rojas, The DoTS classification is a useful way to classify adverse drug reactions: a preliminary study in hospitalized patients, Int. J. Pharm. Prac., 18, 4, (2010). [ Links ]
47. F. Andersohn, C. Konzen, E. Garbe, Systematic review: Agranulocytosis induced by nonchemotherapy drugs, Ann. Internal Med., 146, 9, (2007). [ Links ]
48. M.B. Forrester, Pattern of dipyrone exposure in Texas, 1998 to 2004, J. Med. Toxicol., 2, 3 (2006). [ Links ]
49. Maluf, N. Hamerschlak, A.B. Cavalcanti, A.A. Júnior, J. Eluf-Neto, R.P. Falcão, I.G. Lorand-Metze, D. Goldenberg, C.L. Santana, Dde O Rodrigues, L.N. Passos, L.G. Rosenfeld, M. Pitta, S. Loggetto, A.A. Ribeiro, E.D. Velloso, A.T. Kondo, E.O. Coelho, M.C. Pintão, H.M. de Souza, J.R. Borbolla, R. Pasquini, Incidence and risk factors for agranulocytosis in Latin American countries-the Latin Study, Haematologica, 94, 9 (2009). [ Links ]
50. M Pfersdorff, Diclofenac/dipyrone agranulocytosis: Case report, Reactions weekly, 1347, 1 (2011). [ Links ]
51. A. Luengo, Neutropenia in an elderly patient: Case report, Reactions Weekly, 1316, 1 (2010). [ Links ]
52. H.M. Candido, M.R. Bortolotto, T.M. Strabelli, L.A. Benvenuti, Case 4/2011 - Agranulocytosis and puerperal sepsis in woman after the use of ceftriaxone, Arq. Bras. Cardiol., 97, 2 (2011). [ Links ]
53. C.E. Daphan, O. Abbasoglu, F. Agalar, M.C. Yagmurdur, Neutropenic enterocolitis due to dipyrone use, Aust. N. Z. J. Surg., 69, 9 (1999). [ Links ]
54. S. Yetgin, E. Ozyiirek, D. Aslan, M. Cetin, Metamizole sodium-induced severe aplastic anemia and its recovery with a short-course steroid therapy, Pediatr. Hematol. Oncol., 21, 4 (2004). [ Links ]
55. M.A. Gonzalo-Garijo, D. de Argila, I. Rodriguez-Nevado, Generalized reaction after patch testing with methamizol, Contact Dermatitis, 45, 3 (2001). [ Links ]
56. International Collaborative Study of Severe Anaphylaxis, Pharmacoepidemiol. Drug Saf., 12(3): 195-202 (2003). [ Links ]
57. Risk of anaphylaxis in a hospital population in relation to the use of various drugs: an international study, The International Collaborative Study of severe anaphylaxis risk of anaphylaxis in a hospital population in relation to the use of various drugs: an international study. Pharmacoepidemiol Drug Saf., 12, 3 (2003). [ Links ]
58. A. Helbling, T. Hurni, U.R. Mueller, W.J. Pichler, Incidence of anaphylaxis with circulatory symptoms: a study over a 3- year period comprising 940,000 inhabitants of the Swiss Canton Bern, Clin. Exp. Allergy, 34, 2 (2004). [ Links ]
59. M.C. Laxenaire, P.M. Mertes, Groupe detudes des reactions anaphylactoides peranesthesiques anaphylaxis during anaesthesia, Results of a two-year survey in France, Br. J. Anaesth., 87, 4 (2001). [ Links ]
60. S. Brenner, A. Bialy-Golan, N. Crost, Dipyrone in the induction of pemphigus, J. Am. Acad. Dermatol., 36, 3 Pt 1 (1997). [ Links ]
61. M.A. Gonzalo-Garijo, R. Pérez-Calderón, D. De Argila, L. Rodríguez-Nevado, Metamizole-induced acute generalized exanthematous pustulosis, Contact Dermatitis, 49, 1 (2003). [ Links ]
62. K. Eyerich, C. Traidl-Hoffmann, A. Albert, R. Kerzl, S. Rombold, U. Darsow, B. Eberlein,T. Jakob, J. Ring, R. Hein, Lipomatous metaplasia after severe and chronic cutaneous inflammation, Dermatology, 217, 1 (2008). [ Links ]
63. J. Dalmau, E. Serra-Baldrich, E. Roé, L. Peramiquel, A. Alomar, Use of patch test in fixed drug eruption due to metamizole (Nolotil), Contact Dermatitis, 54, 2 (2006). [ Links ]
64. L. Feldmeyer, Dipyrone, Reactions Weekly, 1330, 1 (2010). [ Links ]
65. B. Bar-Oz, M. Clementi, E. Giantonio, Metamizol (dipyrone, optalgin) in pregnancy, is it safe? A prospective comparative study, Eur. J. Obstet. Gynecol. Reprod. Biol., 119, 2 (2005). [ Links ]
66. A. Weintraub, D. Mankuta, Dipyrone-induced oligohydramnios and ductus arteriosus restriction, Isr. Med. Assoc. J., 8, 10 (2006). [ Links ]
67. F. Bánhidy, N. ács, E. Puhó, AE. Czeizel, A population based case-control teratologic study of oral dipyrone treatment during pregnancy, Drug Saf., 30, 1 (2007). [ Links ]
68. G.A. Montoya, C. Vaca, M.F. Parra, Detección de efectos secundarios asociados a la administración de tramadol y dipirona en un hospital de alta complejidad, Biomédica, 29, 3 (2009). [ Links ]