INTRODUCCIÓN
El creciente interés por la medicina alternativa ha promovido el uso de productos de origen vegetal para diversas terapias. El uso de hierbas medicinales es común a todas las culturas. Para millones de personas estas constituyen una de las principales fuentes para el mantenimiento de la salud, la prevención y el tratamiento de enfermedades, particularmente las enfermedades crónicas [1, 2].
Las hierbas medicinales se encuentran integradas significativamente dentro de las prácticas médicas aceptadas en países como China y Japón. En otras naciones, las plantas se utilizan para prevenir el desarrollo de enfermedades, mejorar la salud y bienestar o, en raras ocasiones, como alternativa a la medicina convencional [2].
Diversas especies de Kalanchoe han sido ampliamente utilizadas en la medicina tradicional como antiinflamatoria y analgésica. Recientemente, se ha publicado que tienen propiedades citotóxicas; sin embargo, los datos sobre el uso tradicional de estas plantas en el tratamiento de tumores son extremadamente limitados [3].
El género Kalanchoe cuenta con 150 especies aproximadamente, algunas muy reconocidas como Kalanchoe pinnata (Lam.) Pers. (K. pinnata) [4-6], Kalanchoe brasiliensis Cambess (K. brasiliensis) [4, 5, 6], Kalanchoe gracilis (L.) DC (K. gracilis) [7], Kalanchoe daigremontiana Raym. -Hamet. & H. Perrier (K. daigremontiana) [8-11], Kalanchoemillotii Raym.-Hamet & H. Perrier (K. millotii) [9], Kalanchoenyikae Engl. (K. nyikae) [9] son fuertemente estudiadas, se les atribuyen propiedades medicinales debido a la presencia de bufadienólidos, un grupo de polihidroxi esteroides C-24 y sus glucósidos, de gran interés por sus actividades cardiotónicas y anticancerígenas [3, 12].
La especie K. daigremontiana es una planta suculenta, originaria de Madagascar, perteneciente a la familia Crassulaceae, que se ha adaptado a diferentes ecosistemas, por su resistencia a condiciones adversas, lo que le ha permitido diseminarse en zonas tropicales y templadas [10]. Su característica principal es producir pequeñas plántulas o hijuelos, que nacen entre los dientes del margen aserrado del foliolo. Alcanza hasta 120 cm de longitud, posee hojas opuestas decusadas, lanceoladas, aserradas, de color verde en su haz y marcas púrpuras en el envés, sus flores son tubulares de color rojo-anaranjado que se agrupan en una inflorescencia tipo umbela. Presenta reproducción sexual y por su capacidad de generar plántulas en el margen de sus hojas, muchas de las especies son conocidas como madre de miles [10, 11]. Se encuentran principalmente en áreas tropicales y subtropicales de África, Asia y América [3]. También tiene los sinónimos Kalanchoe madagascar, Bryophyllum daigremontianum y, nombres comunes como aranto o espinazo del diablo, mala madre, madre de miles, entre otros [3, 11, 13].
Las especies de Kalanchoe se han utilizado en diversos tratamientos como lesiones periodontales y de la piel, infecciones del oído, tos, úlceras gástricas y artritis. Los extractos crudos o el jugo de las especies de estas plantas también exhiben propiedades anticancerígenas; sin embargo, en el campo de la etnomedicina, solo K. brasiliensis se ha descrito en la literatura como un remedio para tratar el cáncer de próstata humano [3]. En cuanto a K. daigremontiana, esta planta tiene actividades antiinflamatorias, antimicrobianas, antioxidantes y citotóxicas [3, 13, 14]. Sin embargo, el efecto de sus extractos en las células cancerosas solo se probó en las células T de leucemia linfoblástica humana [3]. En China, K. daigremontiana se ha utilizado durante cientos de años tanto por vía oral como tópica para tratar afecciones como el vómito sanguíneo, quemaduras y cuadros gripales [15]. Tradicionalmente, las infusiones o decocciones de sus hojas son utilizadas como tratamiento alternativo para distintas dolencias como fiebre, hipertensión, relajante muscular, sedante, antihistamínico, entre otros [10].
Recientemente, K. daigremontiana se ha convertido en una fuente de nuevos compuestos para el tratamiento de tumores y enfermedades inflamatorias y alérgicas [15]. Se aislaron esteroides cardiotónicos bufadienólidos de K. daigremontiana, los cuales presentaron efectos inhibitorios sobre un tipo de virus (Epstein-Barr) que ataca los linfocitos B y se asocia con el desarrollo de muchas clases de neoplasia. Además de su capacidad anticancerígena, estos compuestos esteroidales presentaron actividad insecticida [16]. Los compuestos antioxidantes presentes en diferentes plantas juegan un papel importante como factores promotores de la salud. Estas moléculas reducen el riesgo de enfermedades crónicas, como las enfermedades cardíacas. Las propiedades farmacológicas de la planta no se deben a un solo mecanismo, sino que exhiben su efecto protector a través de una combinación de los mismos [13].
El objetivo de este trabajo fue determinar la capacidad antioxidante y antiinflamatoria en extractos hidroalcohólicos de las partes aéreas de K. daigremontiana.
MATERIALES Y MÉTODOS
Recolección y preparación de la muestra
Los ejemplares de K. daigremontiana (figura 1) se recolectaron en la zona urbana del departamento Comandante Fernández, provincia del Chaco, Argentina, entre los meses de enero a marzo de 2019. La localización para la especie estudiada según coordenadas fue 26°47'03.3''S 60°26'47.5''O. Las partes aéreas de las plantas fueron lavadas con agua potable, las porciones decoloradas y dañadas por insectos fueron descartadas. Luego se procedió al secado a temperatura ambiente y a la sombra, se sometió a molienda con un molino de cuchillas (TecnoDalvo®) hasta polvo grueso y, finalmente, se almacenó a temperatura ambiente en recipientes de vidrio al abrigo de la luz y se utilizó dentro de las tres semanas posteriores.
Preparación de extractos
Se prepararon extractos hidroalcohólicos. Se pesaron 5 g de muestra en polvo, se colocaron en matraces cónicos y se añadió 100 mL de EtOH (etanol) al 50%, 70% y 80% (v/v) y de MeOH (metanol) al 80% (v/v) respectivamente. La muestra se dejó durante 2 h en un baño de agua con agitación a 100 rpm a una temperatura de 40 ± 1 °C. El filtrado se realizó a través de papel de filtro (Whatman número 1) y el residuo se volvió a extraer nuevamente con el solvente utilizado de acuerdo con el procedimiento mencionado anteriormente. Los filtrados se agruparon y el exceso del solvente utilizado se evaporó a presión reducida utilizando un evaporador rotatorio, (Büchi Rotavapor R-114, Suiza). En ambos casos, los extractos concentrados se almacenaron a -20 ± 1 °C hasta su utilización. Los extractos se prepararon siguiendo el método descrito por Alam et al. [17], con ligeras modificaciones.
Tamizaje fitoquímico
Los compuestos fueron identificados preliminarmente mediante los procedimientos establecidos para cada metabolito [18].
Cuantificación de fenoles totales
El contenido de fenoles totales se determinó usando la técnica de Singleton et al. [19]. Este método se fundamenta en que los compuestos fenólicos reducen el reactivo de Folin-Ciocalteu para formar un complejo azulado que absorbe a 765 nm. A 90 μL de extracto de la muestra se agregaron 1,91 mL de agua desionizada y 0,2 mL del reactivo de Folin-Ciocalteu; después de 2 min se agregó 0,8 mL de carbonato de sodio 15,9%, se incubó a 50 °C durante 5 min y se midió la absorbancia a 765 nm en un espectrofotómetro UV-visible (UV-1800, Shimadzu®). Se realizó la curva de calibración con una solución alcohólica de ácido gálico (AG) (figura 2). Los resultados fueron expresados en mg equivalentes de ácido gálico por g de peso seco de la muestra (mg EAG/g ps muestra). Este procedimiento se efectuó con cada uno de los extractos por triplicado.
Cuantificación de flavonoides
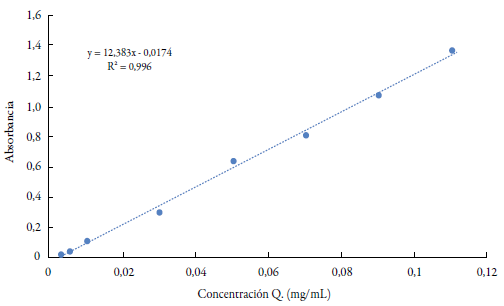
El contenido de flavonoides en los diferentes extractos fue determinado por el método de Popova et al. [20] con modificaciones. A una alícuota de 90 μL de extracto se le adicionaron 1,91 mL de MeOH; 0,1 mL de solución etanólica de AlCl3 5% y finalmente 2,9 mL de MeOH. Se dejó durante 10 min a temperatura ambiente y la absorbancia fue medida a 425 nm en un espectrofotómetro UV-visible (UV-1800, Shimadzu®). Se realizó la curva de calibración con una solución alcohólica de quercetina (Q) (figura 3). El contenido de flavonoides fue calculado como mg equivalentes de quercetina por g de peso seco de la muestra (mg EQ/g ps muestra). Este procedimiento se efectuó con cada uno de los extractos por triplicado.
Determinación de la actividad antioxidante
Se usó el método descrito por Brand-Williams, con algunas modificaciones [21]. Este método está basado en la reducción de una solución alcohólica de DPPH• en presencia de un antioxidante donador de hidrógeno. Se calculó la cantidad de antioxidantes necesarios en la muestra para reducir la concentración inicial de radical DPPH• en un 50%. Este radical fue disuelto en EtOH a diferentes porcentajes y MeOH según el extracto a ensayar; se tomaron 1 mL de solución de DPPH• ajustada hasta tener una absorbancia de 0,9 y se agregaron alícuotas del extracto a diferentes concentraciones. Se agitó el contenido de los tubos y se dejó a temperatura ambiente durante 30 min en la oscuridad. Se midió la absorbancia a 515 nm y la disminución de estas fue registrada a intervalos de 0,5 min durante 7 min. La actividad se midió en un espectrofotómetro UV-visible (UV-1800, Shimadzu®). Los resultados se expresaron como porcentajes de actividad de captación de radicales.
Porcentajes de actividad de captación de radicales (% AAR) = (1- A muestra/A control) x100.
El valor de IC50 que representa la cantidad de extracto que redujo el 50% del radical DPPH» se calculó a partir del porcentaje de captación versus la curva de concentración.
Determinación de la actividad antiinflamatoria
El efecto inhibitorio sobre la actividad de la lipoxigenasa (LOX) se evaluó siguiendo la metodología de Taraporewala y Kauffman [22]; que mide la cantidad de hidroxiperóxidos lipídicos producidos a partir del ácido linoleico a 234 nm. La mezcla de reacción contenía 50 μM de ácido linoleico en buffer borato 0,2 M; pH 9; 0,9 nM de 1-Lipoxigenasa de soja en buffer y diferentes concentraciones del extracto preparados en DMSO. Los reactivos utilizados fueron: buffer borato 0,2 M pH 9, solución de ácido linoleico en metanol, 5 mM, enzima 1-Lipoxigenasa de soja en buffer borato (1 mg/mL), dimetilsulfóxido y muestras en DMSO.
Para iniciar la reacción, se colocó en una celda de cuarzo 2410 μL de buffer borato 0,2 M pH 9, se agregó 30 μL de ácido linoleico, 20 μL de DMSO, y 40 μL de lipooxigenasa. Se procedió a la lectura de la absorbancia a 234 nm durante 4 min cada 30 segundos usando un espectrofotómetro UV-visible (UV-1800, Shimadzu®). Se realizaron controles de sustrato, enzima, de solvente y extracto. Los ensayos inhibitorios se realizaron en presencia de extractos a diferentes concentraciones (25-125 μg/mL).
Se calcularon los porcentajes de inhibición de la enzima a diferentes concentraciones de extracto por comparación con el control de 100% de actividad realizado con DMSO.
Para todos los extractos se determinó la IC50 a partir de las curvas de porcentaje de inhibición vs. diferentes concentraciones de extracto.
Análisis de datos
Se utilizó el procedimiento de análisis de varianza (Anova) mediante el programa estadístico Statgraphics Plus. Los resultados se expresaron como media/desviación estándar.
RESULTADOS Y DISCUSION
En las pruebas fitoquímicas preliminares, los metabolitos secundarios fueron detectados de manera cualitativa mediante ensayos de coloración y precipitación de los reactivos; mostrando la presencia de flavonoides, fenoles, lípidos, hidratos de carbono, esteroides y triterpenoides, antraquinonas, alcaloides y saponinas lo cual permitió conocer que la planta tiene compuestos de alto valor farmacológico. Los metabolitos detectados coinciden con otros estudios realizados por Pinzón et al. [10], Puertas Mejía et al. [11], y Quintero Barba [23].
Los metabolitos secundarios que se encuentran comúnmente presentes en diferentes extractos de plantas son los flavonoides y los ácidos fenólicos. Los ácidos fenólicos al igual que el ácido cafeico, el ácido ferúlico y el ácido gálico se encuentran ampliamente distribuidos en las plantas y han sido reconocidos como antioxidantes naturales [13]. Se ha informado que los contenidos de fenoles y flavonoides están asociados con la actividad antioxidante en varias plantas [17]. Los compuestos fenólicos tienen una importante acción en la estabilización de la oxidación lipídica, han sido asociados con la capacidad atrapadora de radicales libres y se ha sugerido que tienen efecto inhibitorio sobre la mutagénesis y la carcinogénesis [24].
Estudios realizados por Puertas et al. [11] observaron un elevado efecto antioxidante tanto en las hojas como en las flores de K. daigremontiana. Este resultado lo atribuyen a los compuestos polifenólicos detectados en el análisis fitoquímico. Además, sugieren que la presencia de taninos, flavonoides, triterpenoides y antocianinas, puede estar relacionada a un efecto sinérgico entre las diferentes familias de compuestos previamente detectados, incrementando así la capacidad antioxidante.
Los valores obtenidos de fenoles totales y flavonoides en los extractos hidroalcohólicos estudiados de K. daigremontiana se presentan en la tabla 1.
Tabla 1 Fenoles totales y flavonoides.
| Fenoles totales (mg EAG/g peso seco) | Flavonoides (mg EQ/g peso seco) | |
|---|---|---|
| EtOH 50% | 11,04 ± 0,10 | 2,25 ± 0,04 |
| EtOH 70% | 14,17 ± 0,24 | 5,07 ± 0,05 |
| EtOH 80% | 12,10 ± 0,10 | 4,80 ± 0,40 |
| MeOH 80% | 3,04± 0,10 | 4,48 ± 0,37 |
El valor más alto de fenoles totales se determinó para el extracto etanólico al 70% (14,17 ± 0,24 mg de EAG/g peso seco), seguido por el de 80% (12,10 ± 0,10 mg de EAG/g peso seco), el de 50% (11,04 ± 0,10 mg de EAG/g peso seco) y por último el extracto metanólico 80% (3,04 ± 0,10 mg de EAG/g peso seco). Shujaat et al. [13] trabajaron con varios extractos y reportaron para el etanólico al 70%, un valor considerablemente menor al hallado en nuestro estudio (0,27 ± 0,05 mg de EAG/g peso seco). Bogucka-Kocka et al. [9] evaluaron la composición de ácido fenólico en hojas de cuatro especies de Kalanchoe y los resultados mostraron que para K. daigremontiana; utilizando el método de extracción acelerada de solvente (ASE), contenía las mayores cantidades de ácidos fenólicos (124 μg/g de peso seco), mientras que K. nyikae los más bajos (9,61 μg/g de peso seco).
El contenido de flavonoides para los extractos etanólicos fue de 5,07 ± 0,05; 4,80 ± 0,40 y 2,25 ± 0,04 mg EQ/g peso seco, para las concentraciones de 70%, 80% y 50% respectivamente; respecto al extracto metanólico al 80% el contenido de flavonoides hallado fue de 4,48 ± 0,37 mg EQ/g peso seco. Shujaat et al. [13] hallaron para flavonoides valores mayores en el extracto etanólico al 70%. Asiedu-Gyekye et al. [25] encontraron en extracto metanólico de otras especies de Kalanchoe (pinnata e inte-valores muy superiores en fenoles totales y flavonoides. Los resultados obtenidos en nuestro estudio sugieren que el EtOH al 70% es el solvente más adecuado para la extracción de compuestos fenólicos y flavonoides en esta especie.
La actividad antioxidante se analizó utilizando la capacidad de captación de radicales libres DPPH• cuyos valores de (IC50 / % AAR) se muestran en la tabla 2.
La capacidad de captación de radicales libres de DPPH• del extracto etanólico al 70% fue mayor respecto del extracto metanólico. Los valores de IC50 para los extractos etanólicos al 70%, 80% y 50% estudiados fueron de 3,01 ± 0,16; 3,80 ± 0,04 y 4,41± 0,18 mg/mL respectivamente, y el metanólico 80% fue de 3,51 ± 0,10 mg/mL. En el estudio de Bogucka-Kocka et al. [9] con extractos etanólicos al 70% de K. diagremontiana, mostraron una gran variación en la actividad de la capacidad de captación de radicales libres DPPH» entre el extracto obtenido por maceración respecto del preparado por el método de extracción acelerada de solventes. Los valores de IC50 para los dos extractos fueron de 0,18 ± 1 mg/mL y 1,45 ± 8 mg/mL indicando una actividad antioxidante más alta para el obtenido por maceración. Estos valores revelaron una mayor actividad antioxidante comparado con los hallados en nuestro estudio respecto del radical DPPH•, al igual que los resultados hallados por Shujaat et al. [13], en extractos etanólicos de hojas K. daigremontiana, cuyo valor de IC50 fue de 0,0619 mg/mL. En una investigación realizada por Zhen-Rung Lai et al. [26] en extracto metanólico de K. gracilis, obtuvieron valores de IC50 de 4,90 ± 0,22 mg/mL, mostrando una actividad antioxidante más baja en esta especie, respecto a lo encontrado en nuestro trabajo. En la determinación de la actividad antirradicalaria se observó el porcentaje más alto de inhibición del radical libre de 56,87% en el extracto etanólico 70% (5 mg/mL), y el valor más bajo se dio en el extracto etanólico 50% de 53,74% (5 mg/mL).
En cuanto a la actividad antiinflamatoria, el valor de IC50 determinado para distintas concentraciones del extracto etanólico, de partes aéreas de K. daigremontiana expresada como concentración inhibitoria media fue de 21,96 ± 0,70 μg/mL, que representa la concentración que inhibe el 50% de la actividad de la enzima mostrando una fuerte actividad. Si bien existen trabajos que destacan la actividad antiinflamatoria del género Kalanchoe estos fueron realizados in vivo, no se encontró literatura respecto de la actividad de la enzima lipoxigenasa in vitro frente a este extracto de K. daigremontiana. Torres Carro et al. [27] estudiaron extractos hidroalcohólicos de trece plantas de la Puna Argentina y encontraron variaciones de IC50 entre 132,6 ± 2,0 μg/mL y 389,2 ± 12,3 μg/mL. El extracto estudiado de K. daigremontiana mostró una elevada capacidad inhibitoria frente a la LOX.
Los resultados demostraron que los extractos de las partes aéreas de K. daigremontiana contienen metabolitos de interés terapéutico y el extracto etanólico al 70% presentó una mayor capacidad antioxidante frente al radical DPPH•, respecto a los demás extractos estudiados; lo cual podría estar directamente relacionado con su mayor contenido de fenoles totales y flavonoides. Además, presentó una elevada capacidad inhibitoria frente a la LOX.
Estos hallazgos sugieren que el K. daigremontiana posee propiedades antioxidantes y antiinflamatorias que la convierten en una fuente promisoria para ser utilizada con propósitos medicinales.