INTRODUCCIÓN
La familia Euphorbiaceae es una gran familia de distribución cosmopolita. Se trata de una amplia familia con más de 7000 especies reunidas en 240 géneros, que son más abundante en regiones tropicales de Sudamérica y África. Para Argentina se han citado 29 géneros y 216 especies; de las cuales, unos 20 géneros son indígenas de Salta y 12 se localizaron en el valle de Lerma [1]. Entre las especies nativas de esta familia en el nordeste argentino están Acalypha communis, Cnidoscolus loasoides, Croton bonplandianus, Euphorbia serpens, Jatropha isabelli, Sapium haematospermum y Sebastiania schottiana [2]. Actualmente, sus usos más frecuentes son en alimentación (con la mandioca) y en la producción de medicinas, venenos, aceites y grasas, ceras, gomas, caucho y componentes para pinturas, barnices y otros productos industriales. Algunas de ellas se cultivan como ornamentales [3]. Muchos compuestos extraídos de las euforbiáceas tienen propiedades farmacológicas de gran potencial. Se reconocen sustancias con actividades anticancerígena, antimicrobiana, antimicótica, antiulcerosa, tripanocida, vasorrelajante, antiinflamatoria, analgésica, antimalárica, citotóxica, antiséptica, antiviral, antimutagénica, lipolítica y antioxidante [4, 5].
Sapium haematospermum Müll. Arg., en medicina popular, su látex es utilizado para calmar el dolor de muelas; la decocción de las hojas es febrífuga y combate los dolores reumáticos, mientras que su corteza es empleada en cataplasmas para cicatrizar heridas [6]. Euphorbia serpens (yerba meona, golondrina) es una planta tradicionalmente empleada como diurética, el látex como antitumoral, purgante drástico y en uso externo contra enfermedades o problemas de la piel (callo, verrugas, herpes, tatuajes) [7-9].
En APG II Angiosperm Phylogenetic Group [10], la familia Euphorbiaceae fue dividida en 4 familias : Euphorbiaceae s. str., Phyllantaceae, Picodendraceae y Putranjivaceae.
De acuerdo con esta clasificación, en la familia Euphorbiaceae están incluidos los géneros que se caracterizan por ser uniovulados, mientras que en la familia Phyllanthaceae se incluyen los géneros biovulados [2, 11].
Otra familia Phyllanthaceae se encuentran ampliamente distribuidas en regiones tropicales y subtropicales del mundo [12] son muy utilizadas en la medicina popular para trastornos urinarios, infecciones intestinales, diabetes y hepatitis B. Phyllanthus niruri es una especie conocida como "quebra-pedra" (Brasil), "helechito", "sarandicito" (Argentina), entre otros. La planta es nativa de América; sudeste de Brasil, noroeste argentino (Misiones, Formosa y Chaco), sur de Paraguay y este de Uruguay. Empleada popularmente en todo el continente para eliminar pequeños cálculos renales y vesiculares, con propiedades diurética, antidiabética, antirreumática, uricosúrica, sudorífica, sedante, tónica, eupéptica y protectora hepática [13, 14].
Phyllanthus tenellus Roxb., conocida popularmente en Brasil como "quebra-pedra" y "erva-pombinha". Las propiedades medicinales de esta especie están relacionadas con la eliminación de cálculos renales, actividad diurética, hipoglucemiante y en el tratamiento de las infecciones del hígado [15].
El estudio de componentes bioactivos como los polifenoles totales presentes en los extractos hidroalcohólicos nos aportarán información para explicar su potencial acción antioxidante. Esta actividad está relacionada con la prevención de enfermedades crónicas. El desarrollo de la enfermedad y sus complicaciones ocurre por el daño inducido por los radicales libres, los cuales causan la oxidación de las macromoléculas biológicas que no siempre pueden contrarrestarse por los sistemas de defensa antioxidante del organismo. Las sustancias antioxidantes extraídas de plantas serían beneficiosas ante patologías como infecciones, enfermedades inflamatorias, diabetes, etc. [16].
Los objetivos de este trabajo fueron determinar la composición fitoquímica y evaluar la actividad antioxidante de los extractos hidroalcohólicos de Sapium haematospermum, Phyllanthus niruri, P. tenellus y Euphorbia serpens.
METODOLOGÍA
Recolección y acondicionamiento del material vegetal
Las especies en estudio se recolectaron durante los meses de febrero, marzo y abril del 2018, en la ciudad de Presidencia Roque Sáenz Peña, provincia del Chaco. La localización por coordenadas fue para Sapium haematospermum (s) 26°46'22,6'' (w) 60°25'46,6'', Phyllanthus niruri (s) 26°46'36,9'' (w) 60°25'79,8'', Phyllanthus tenellus (s) 26°46'37,2'' (w) 60°25'78,5'', y Euphorbia serpens (s) 26°46'38,2'' (w) 60°25'77,9''. Un ejemplar de cada especie fue herborizado y depositado con el código: CTES0060491, CTES0061228, CTES0061227, CTES0061229, respectivamente; en el Herbario del Instituto de Botánica del Nordeste, Universidad Nacional del Nordeste, Corrientes, Argentina.
El material vegetal para el trabajo se secó a la sombra y a temperatura ambiente durante 7 días. Luego se procedió con molinillo de cuchilla a la pulverización de la droga y posterior tamización para definir la granulometría de polvo. Dicho polvo se conservó en frasco de vidrio color caramelo y de cierre hermético hasta su empleo en el proceso de extracción.
Preparación de los extractos
Los extractos de las cuatro especies vegetales se prepararon siguiendo el método de maceración descripto por Farmacopea argentina [17], obteniendo tinturas. Para eso se pesaron 20 g de cada material vegetal en polvo y se colocaron en frasco color caramelo, añadiendo 100 ml de EtOH al 70% (v/v). El mismo se dejó en contacto durante 7 días a temperatura ambiente y con agitación periódica. Finalmente, el líquido extractivo se separó por filtración a presión reducida y se dispuso en botellas color caramelo de buen cierre y se almacenó en refrigeración hasta su uso.
Caracterización fitoquímica cualitativa de los extractos
La detección de metabolitos secundarios se efectuó por cromatografía en capa fina (CCF) de los extractos hidroalcohólicos (correspondientes a las cuatro especies vegetales). Se usaron placas con sílica gel 60 (Merck, 10 x 10) y como eluyente se utilizó la mezcla de tolueno: acetato de etilo: ácido acético (36:12:5). La placa cromatográfica se reveló por aspersión del reactivo NP (ácido 2-amino-etil éster difenilbórico al 1% en metanol (p/v) y se visualizó a la luz visible y a la luz UV a una longitud de onda de 365 nm [18].
Ensayo cualitativo de actividad antioxidante
Se realizó la siembra de una alícuota 10 μl de extracto de cada especie medicinal y de los patrones de referencia quercetina y catequina (0,1mg/ml) sobre 2 placas TLC de silicagel 60 Merck (10 x 10 cm); utilizando como fase móvil cloroformo: metanol (9,5: 0,5 v/v) como eluyente. Una placa se asperjó con una solución de ABTS•+ de color verde y la otra placa con una solución de DPPH• de color violeta (ambas soluciones preparadas 1 mg/ ml en EtOH 70 %); se dejaron secar a temperatura ambiente 15 min. Los componentes activos de cada extracto con capacidad antioxidante se visualizaron por decoloración del radical ABTS•+ y DPPH•, sobre la banda activa (autografía en bandas).
Cuantificación de fenoles totales
El contenido de fenoles totales se determinó por el método de Singleton et al. [19], que se fundamenta en que los compuestos fenólicos reducen el reactivo de Folin-Ciocalteu (reactivo de tungsteno y molibdato) formando un complejo azulado que absorbe a 765 nm. En un tubo de ensayo se colocó 50 μl de extracto, se agregaron 1650 μl de agua deionizada y 100 μl del reactivo de Folin-Ciocalteu; después de 2 min se agregó 200 μl de carbonato de sodio (20 %). Cada tubo de reacción se incubó a 50 °C durante 5 min y luego se midió la absorbancia a 765 nm en un espectrofotómetro UV-visible (UV-1800, Shimadzu). Se realizó la curva de calibración con una solución alcohólica de ácido gálico (1 mg/ml) (figura 1). Los resultados de la reacción de los extractos fueron expresados en mg equivalente de ácido gálico por gramo de muestra seca (mg EAG/g MS). Este ensayo se efectuó por triplicado para cada extracto.
Cuantificación de flavonoides totales
El contenido de flavonoides totales se determinó por el método modificado de complejación con nitrato de aluminio de Look et al. [20]. En la reacción se coloca 30 μl del extracto hidroalcohólico con 120 μl de la solución de acetato de potasio (1 M) y 120 μl de nitrato de aluminio al 10% y se llevó a 2730 μl de volumen con EtOH 70%. Se dejó reposar por 40 min y se procedió a leer la absorbancia a 415 nm en espectrofotómetro UV-visible (UV-1800, Shimadzu). Se realizó la curva de calibración con una solución alcohólica de quercetina (Q) (2,7 mg/ml EtOH 70 %) (figura 2). Los resultados del contenido de flavonoides en los extractos se expresaron como miligramos equivalentes de quercetina por gramo de muestra seca (mg Q/g MS).
Método con radical DPPH•
Los ensayos de inhibición de radicales DPPH• se hicieron utilizando el método descripto por Brand-Williams et al. [21] con algunas modificaciones. Este método está basado en la reducción de una solución alcohólica de DPPH• en presencia de un antioxidante donador de hidrogeno como los extractos vegetales. Este radical fue disuelto en EtOH 70° (0,004% p/v); se tomaron 1000 μl de solución de DPPH• y se midió la absorbancia a 515 nm hasta tener una absorbancia de 0,9, luego se agregaron alícuotas de cada uno de los extractos a diferentes concentraciones. Se agitó el contenido de los tubos, se dejó a temperatura ambiente durante 30 min en la oscuridad y se midió la absorbancia a 515 nm en espectrofotómetro UV-visible (1800 Shimadzu) y la disminución de las mismas fue registrada a intervalos de 0,5 min durante 7 min. Los resultados se expresaron como porcentajes de actividad de captación de radicales (% AAR), calculados como:
El reactivo Trolox se usa como antioxidante de referencia y la actividad se expresa como el valor de IC50 que representa la cantidad de extracto que inhibe el 50% del radical libre DPPH•.
Método con radical catión ABTS •+
Otro método probado para evaluar la actividad antioxidante fue el ensayo de decoloración del catión radical ABTS•+. En este caso se usó la metodología desarrollada por Re et al. [22] y descrita por Kuskoski et al. [23]. El radical ABTS•+ se obtiene tras la reacción del reactivo ABTS•+ (7 mM) con persulfato potásico (2,45 mM) incubado a temperatura ambiente (25 °C) y en la oscuridad durante 16 h. Una vez formado el radical catión ABTS•+ se diluye con EtOH hasta obtener un valor de absorbancia de 0,70 (± 0,1) a 754 nm (longitud de onda de máxima absorción). Luego a 1000 μl de la solución de ABTS•+ se adicionaron alícuotas de extracto (distintas concentraciones) y se midió a 754 nm la absorbancia de la misma a los 6 min en espectrofotómetro UV-visible (UV-1800, Shimadzu). El reactivo Trolox se usa como antioxidante de referencia y la actividad se expresa como el valor de IC50 que representa la cantidad de extracto que inhibe el 50% del radical ABTS•+. Las determinaciones se realizaron por triplicado.
Poder reductor
La capacidad de las especies vegetales para reducir el Fe (III) a Fe (II) se determinó por espectrofotometría UV-visible de acuerdo con la técnica descrita por Oyaizu et al. [24] con modificaciones. Esta técnica se basa en la formación de ferrocianuro de potasio, este compuesto reacciona con el FeCl3 produciéndose una intensa coloración verde esmeralda que absorbe a 700 nm, cuya intensidad es dependiente de la concentración de los antioxidantes que se encuentran en la muestra. Cuanto mayor sea la absorbancia en el medio de reacción, mayor será el poder reductor de las sustancias antioxidantes que se evalúan [25].
Para este ensayo se mezcló 200 μl de extracto (distintas concentraciones) con 500 μl de tampón fosfato (0,5 mol/L, pH7) y 500 μl de una disolución de ferricianuro de potasio (1 %). La mezcla se incubó a 50 °C durante 20 min. Posteriormente, se adicionaron 500 μl de ácido tricloroacético (TCA 10 %) y se agitó con vortex por 5 min. Parte de la solución sobrenadante (1000 μl) fue mezclada con 2000 μl de agua destilada y 500 μl FeCl3 (0,1 %), y se repite la agitación con vortex. Finalmente, se determinó la absorbancia a 700 nm. Se consideró el aumento de la absorbancia como indicador del poder reductor de los extractos.
RESULTADOS Y DISCUSIÓN
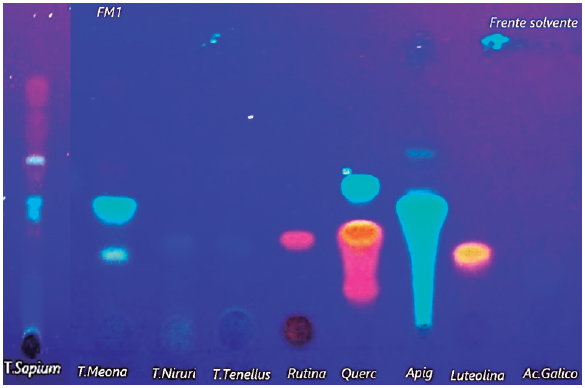
En la caracterización fitoquímica por cromatografía CCF (figura 3), la especie S. haematospermum mostró una banda azul que coincide con el testigo ácido gálico (Rf 0,17); banda amarilla (Rf 0,33) que coincide con el testigo rutina y una banda celeste (Rf 0,41) que concuerda con el testigo apigenina. E. serpens presentó una banda amarilla (Rf 0,3) coincidente con el patrón luteolina, y una banda verde (Rf 0,33) que coincide con el patrón de apigenina. Respecto a P. niruri mostró bandas azul (Rf 0,33) coincidente con el ácido gálico. P. tenellus presentó una banda azul que coincide con el patrón de ácido gálico. Este ensayo fitoquímico evidenció en todas las especies la presencia de flavonas (luteolina, apigenina), flavonol (rutina) y ácidos fenólicos (ácido gálico) los cuales coinciden con los reportados por da Silva et al. [26], Gratti et al. [27], Nascimento et al. [28], Sandini et al. [15], Sobreira et al. [29], Bagalkotkar et al. [30] y Calixto et al. [12].
Los resultados obtenidos del ensayo cualitativo de actividad antioxidante (figura 4) mostraron que los extractos de S. haematospermum, P. niruri, P. tenellus y E. serpens presentaron actividad al exhibir bandas de color blancas-amarillentas sugiriendo la presencia de componentes bioactivos con actividad antioxidante. Todos los extractos presentaron una banda que coincide con el testigo de quercetina (Rf 0,4) al asperjarlo con ABTS•+ y S. haematospermum se destacan porque presentan una banda que coincide con el patrón catequina (Rf 0,5) al asperjarlo con el radical DPPH•. Teniendo en cuenta que el radical DPPH• permite determinar compuestos con características polares y el radical ABTS•+ compuestos con características más apolares; este ensayo cualitativo es un medio rápido; simple porque es colorimétrico (no requiere equipo analítico); sensible ya que no necesita grandes cantidades de antioxidante y muestra, lo cual permitió detectar rápidamente los compuestos bioactivos con potencial capacidad antioxidante presentes en estas especies vegetales.

Figura 4 Autografía en bandas de los extractos hidroalcohólicos revelados con radical ABTS•+ (A) y con radical DPPH• (B).
Recientemente, no se encontraron reportes sobre el contenido de fenoles totales (TPC) de la especie S. haematospermum; sin embargo, este valor se ha determinado para la especie S. glandulosum perteneciente a la misma familia, cuyos valores de TPC son 280,68 ± 6,36 (mg TAE/g PS) y TFC 312,56 ± 7,34 (mg RE/g PS). Además, se observó que S. haematospermum presentó un valor superior de TPC y un valor inferior de contenido de flavonoides totales (TFC) a los informados por Silva et al. [31] (tabla 1). Respecto a P. tenellus presento valores mayores de TPC a los reportados por Sobreira et al. [29] cuyo valor fue de 271,97±5,45 (mg EAG/g PS). Sin embargo, P. niruri presenta valores superiores de contenidos fenólicos a los reportados por Amin et al. [32], Gularte et al. [33-34] y Mahdi et al. [35], los cuales varían entre 90,53 ± 2,50 y 270 ± 3,0 (mg EAG/g) y valores inferiores de flavonoides totales (123,9 ± 2,0 mg EQ/g) a los informados por Amin et al. [32]. Por último, E. serpens obtuvo un valor de 369,8 ± 52,6 (mg EAG/g) TPC, mayor a lo informado por Gratti et al. [27]. También es posible observar que existe una correlación entre los resultados del contenido de flavonoides totales presentados y los de fenoles totales puesto que los flavonoides son un subgrupo de los compuestos fenólicos. La importancia de la presencia de fenoles y flavonoides radica en su actividad como antioxidantes. Estudios recientes han demostrado que muchos constituyentes polifenólicos derivados de plantas son antioxidantes más eficaces in vitro que las vitaminas E o C, y, por tanto, podrían contribuir significativamente a los efectos de protección in vivo [36].
Tabla 1 Fenoles totales, flavonoides y actividad antioxidante.

Valores obtenidos de CFT; CFT; DPPH• y ABTS•+.
La evaluación de la actividad antioxidante se realizó utilizando dos radicales libres: DPPH• y ABTS•+. Los resultados obtenidos con el radical DPPH•: los extractos que presentaron mejor actividad fueron E. serpens seguido de P. tenellus, P. niruri; y, por último, S. haematospermum (tabla 1). El valor obtenido de IC 50 3,42 mg/ml para P. niruri fue mayor a los hallados por Amin et al. [32] y Rusmana et al. [34]; al igual que P. tenellus, cuyo valor obtenido de IC50 3,4 mg/ml fue superior al reportado por Sobreira et al. [29]; S. haematospermum presentó un IC 50 5,12 mg/ml también superiores a los obtenidos para la especie S. glandulosum por Ocampos et al. [37]; finalmente, E. serpens presentó un IC 50 1,46 mg/ml, mayor que la especie E. prostrata informado por Soto-Valenzuela et al. [38]. Los resultados obtenidos muestran una inhibición significativa del radical DPPH•, lo que indica la potencial acción reductora de radicales libres de estos extractos. Respecto de la actividad antioxidante por el método ABTS•+, las especies P. niruri y P. tenellus presentaron un IC 50 de 0,72 y 0,71 mg/ml respectivamente, superior a lo informado por Amin et al. [32] y Rusmana et al. [34], mientras que la especie E. serpens mostró un IC 50 0,52 mg/ml, que es menor a lo reportado por Payne et al. [39], cuyo valor fue de IC 50 3,92 mg/ml. Por otro lado, el poder reductor es definido como la habilidad de un compuesto para reducir el Fe3+ a Fe2+, lo cual indica su capacidad de actuar como antioxidante al donar electrones.
Con esta técnica se logró determinar que los extractos con mayor capacidad reductora fueron en orden decreciente: S. haemastorpermum > P. niruri > P. tenellus > E. serpens (figura 5). S. haemastorpermum presentó un valor superior al reportado por Valdés-Izaguirre et al. [40], comparado con otras especies de la misma familia. Analizando los resultados obtenidos es posible afirmar que el poder reductor de los extractos aumenta con el aumento de la concentración fenólica descrito por Yen y Yen [41], Benzie y Szeto [42] y Yildirim et al. [43]. A partir de los resultados y datos de la literatura se puede relacionar que los compuestos presentes en los extractos pueden interactuar con la química redox del hierro interfiriendo con el ciclo redox de este metal. Los ensayos realizados sugieren un vínculo entre la acción de los radicales libres y ciertas enfermedades. Uno de los factores etiológicos implicados en el desarrollo de la enfermedad y sus complicaciones es el daño inducido por los radicales libres, quienes provocan la oxidación de las macromoléculas biológicas que no pueden ser contrarrestados por los sistemas de defensa antioxidante del organismo, por lo que sustancias antioxidantes serían beneficiosas ante patologías como infecciones, enfermedades inflamatorias, diabetes, etc. [16].
La formación de los metabolitos secundarios en las especies vegetales está determinada por diferentes factores como suelo, clima, edad de la planta, época de recolección, acondicionamiento y almacenamiento de la misma como también el método de extracción, entre otros; lo que podría explicar la variación de los datos alcanzados en comparación con otros autores. Los resultados obtenidos demuestran que las especies estudiadas contienen metabolitos de interés terapéuticos (compuestos fenólicos, flavonoides) con propiedades antioxidantes, los cuales son beneficiosos para la salud, y son fuentes promisorias con potencial aplicación con fines medicinales.