INTRODUCCIÓN
Los productos naturales han sido ampliamente utilizados en el descubrimiento y desarrollo de fármacos, sin embargo, aún hay muchos recursos sin explorar en esta área, aproximadamente el 15% de las intervenciones de drogas están relacionadas con las plantas y cerca del 60% de estas fuentes de drogas se concentran solo en diez familias taxonómicas, la mayoría de medicamentos tradicionales a base de plantas, que son utilizados por diferentes comunidades, no han sido explorados para obtener medicamentos [1]. Diversos fármacos que producen inhibición enzimática específica son una de las soluciones más efectivas al tratamiento de enfermedades. De 2006 a 2011 ingresaron en el mercado mundial 149 fármacos biológicos, 51 de ellos fueron inhibidores enzimáticos [2].
Entre los diferentes estudios de la familia Myristicaceae que abarcan las actividades y usos de las especies se destacan los de farmacología (evaluada científicamente y en medicina popular); microbiológicos y de utilidad en las industrias [3], evidenciando el potencial de activos farmacológicos de la familia. Sus árboles son característicos de las selvas húmedas, como la selva del Amazonas, el 80% de las especies de allí pertenecen al género Virola e Iryanthera, los cuales inspiraron las primeras investigaciones en el área de la fitoquímica, a causa del uso medicinal que se daba de estas por las comunidades indígenas [4]. A partir de la importancia descrita, el presente artículo de revisión recopila información de la herboristería de la familia Myristicaceae e identifica los posibles metabolitos secundarios que producen inhibición enzimática y actividad biológica.
METODOLOGÍA
Se realizó un análisis cienciométrico de los artículos de la base de datos Scopus relacionados con la familia Myristicaceae para determinar tendencias en torno a esta. Se observó que hay un número significativo de estudios de la familia Myristicaceae en diferentes áreas del conocimiento, sin embargo, el número de reportes de estudios de inhibición enzimática es reducido. Por lo cual surgió la necesidad de realizar una búsqueda bibliográica que compile información de la herboristería de la familia Myristicaceae, los estudios reportados de la familia Myristicaceae se enfocaron en la inhibición enzimática producida por metabolitos secundarios y que generan alguna actividad biológica.
La búsqueda de bibliografía se hizo con libros especializados, tesis de grado desarrolladas en el grupo de investigación y bases de datos como: Scopus, ScienceDirect, SciELO, Journal of American Chemical Society (ACS), SciFinder y Scival.
En las plataformas se utilizó en el motor de búsqueda los comandos: MYRISTICACEAE + INHIBITOR/INHIBITION + ENZYME/ENZYMATIC, también en español MYRISTICACEAE + INHIBIDOR/INHIBICIÓN + ENZIMA/ENZIMÁTICA. La consulta no se restringió a un tiempo determinado, teniendo en cuenta que en el análisis cienciométrico se observaron pocos estudios sobre inhibidores enzimáticos presentes en la familia Myristicaceae. Sin embargo, los resultados de la misma se limitaron a 2017, año donde se procesó y analizó la información.
La información se clasiicó de acuerdo con los estudios enzimáticos correspondieran a actividad de inhibición en especies y extractos de la familia Myristicaceae. La depuración de la información se elaboró manualmente.
RESULTADOS Y DISCUSIÓN
Análisis cienciométrico
En la figura 1 se evidencia que en el año 1937 hay un documento reportado; a partir de los años 70 hay una tendencia de aumento, llegando al máximo en 2013 con 37 documentos reportados y para 2017 se reportaron 13 trabajos de investigación.

Fuente: https://www.sco-pus.com/Scopus Copyright© 2017.
Figura 1 Documentos publicados de la familia Myristicaceae por año.
La figura 2 muestra los reportes de los trabajos realizados sobre inhibición enzimática en la familia Myristicaceae. El primer reporte es de 1988, el segundo de 1996, se evidencia un aumento en 2005 alcanzando el punto máximo en el 2011 con 4 documentos, es destacable que en 2014 y 2017 no se reportaron documentos.

Fuente: https://www.scopus.comIScopus Copyright© 2017.
Figura 2 Documentos publicados de estudios de inhibición enzimática en la familia Myristicaceae por año.
Herboristería familia Myristicaceae
La herboristería nace de las tradiciones y prácticas médicas con plantas, que realizaban las sociedades para prevenir y tratar enfermedades y mejorar la calidad de vida [5]. Abarca el estudio de las plantas y las siguientes disciplinas: morfología, taxonomía, etnobotánica, fitoquímica, farmacología, farmacognosia y actividad biológica.
Generalidades
La familia Myristicaceae pertenece al grupo de angiospermas, plantas con flores. Comprende 21 géneros [6], distribuidos en zonas tropicales y característicos de las selvas húmedas de tierras bajas. Comprende árboles de gran porte. La mayoría tienen follaje aromático, con puntos glandulares pequeños y transparentes, al ser cortados sus troncos exudan una resina de color rojo o amarillento. Poseen flores pequeñas de color verde o blanco, carecen de pétalo, unisexuales en plantas dioicas, frutos de carnosos a coriáceos, con una semilla encerrada en un arilo carnoso [7]. Tienen hojas simples, alternas, dísticas o espiraladas, enteras sin estípulas; especies diferenciadas por la diversidad de tricomas (ramificados, lepidotos, estrellados o dendríticos) [8].
Fitoquímica
Se han identificado metabolitos secundarios de especies de Myristicaceae, los más representativos de tipo son: lignanos, neolignanos, flavonoides, terpenos, alcaloides y compuestos aromáticos.
Lignanos
Se forman por acoplamiento de dos unidades de fenilpropano enlazadas por el átomo central de sus cadenas laterales. Se dividen en lignanos simples y ciclolignanos, los primeros presentan una unión C-C a través de las posiciones 8 y 8' de sus cadenas laterales y los ciclolignanos resultan de la formación de otro enlace adicional C-C, creando un nuevo anillo [9].
De la especie Virola sebifera se identificaron: diacetato de rac-(8a,8'β)-4, 4'-dihi-droxi-3,3'-dimetoxilignan-9,9'-diil 1, diacetato de rac-(8a,8'(3)-4-hidroxi-3-metoxi-3', 4'-metilenodioxilignan-9,9'-diil 2, (8R,8' β)-4'-hidroxi-3'-metoxi-3,4-metilenodioxi-lignan-9,9'-olida (haplomyrfolina) 3 [10]. Y los lignanos furofuranicos (+)-sesamina 4, (+)-kobusina 5, (+)-eudesmina 6 [11, 12]. Del extracto etanólico de Virola calophylla se elucidó otobaeno 7 e hidroxiotoboina 8 [3]; el compuesto último se identificó en la especie Osteophloeum sulcatum, de la cual también se aislaron los lignanos: otobafenol 9, ácido (-) dihidroguayarético 10, verrucosina 11, rel (7S, 8S, 8'R) -7-hidroxi-3,4-3',4'-dimetilenodioxi- 8,8'-lignano (saururinol) 12 [13]. De las especies Virola calophylla y calophylloidea se identificaron los lignanos: calofina 13, calofilina 14, ácido meso-dihidroguayarético 15, y austrobailignano 16 [14].
Neolignanos
Metabolitos secundarios que comprenden unidades C6-C3 unidos por posiciones diferentes a las 8-8' [9]. De la especie Iryanthera ulei se aislaron los neolignanos de tipo 8-O-4-: irianteral 17 y machilina C 18 [15]. De la especie Virolapavonis se identificaron los compuestos 8,4'- oxyneolignano 19, eusiderina E 20 y 4',7-epoxi-8,3'-neolig-nano, fragransol A 21 [16].
Flavonoides
Metabolitos secundarios formados por dos núcleos fenólicos conectados por tres unidades de carbono C6-C3-C6. En las especies de la familia Myristicaceae se han encontrado flavonoides de tipo: chalconas, flavanonas, flavonas, dihidroflavonoles, fla-vonoles, flavanas, flavan-3-ols, 1,3- diarilpropanos (virolanos), 1,3-diaril-2-propanoles (virolanoles), dihidrochalconas, isoflavonas y pterocarpanos [17].
Dos chalconas se han sido aisladas de la especie Iryanthera polyneura, diferenciadas por el grupo metil e hidroxil en el C4, 4,2',4'- trihidroxi-3-metoxidihidrochalcona 22, 2',4'-dihidroxi- 3,4-dimetoxidihidrochalcona 21. La flavanona pinocembrina, 1-(2',4'-dihidroxifenil)-3-(3",4"-metilendioxifenil)-propano 24 fue aislada de hojas y raíces de Iryantherapolyneura [18] y 7,4'-dimetoxiflavanona 25 se identificó en la especie Virola carinata [19].
Flavonas se aislaron de la especie de Virola venosa: 7,4'-dimetoxiflavona 26, 7,4'-dimetoxi-3'-hidroxiflavona 27, 7,3',4'-trimetoxiflavona 28, 7-metoxi-3'4'-metilendioxiflavona 29 [20].
En la especie Iryanthera sagotiana, se identificaron dihidroflavonoles de tipo 3-O-α-L-ramnosildihidroflavonoles, engeletina 3O, astilbina 31, isoengeletina 32, isoastilbina 33 y flavonoles3-O-α-L-ramnosilflavonoles, afzelina 34, quercitrina 35 [21].
Flavanas han sido identificadas de las especies Knema autrosiamensis 7-4’-dihidroxi-3’-metoxiflavana 36 de Virola calophylloidea [22], (±)-4’-hidroxi-3’,7-dimetoxiflavana 37 [23], de Iryanthera coriacea (±)-3’,4’-dihidroxi-5,7-dimetoxiflavana 38 [24], de Iryanthera grandis 36 y (±)-5,7-dimetoxi-4’-hidroxiflavana 39 [25], de Iryanthera juruensis 2’-hidroxi-7-metoxi-4’,5’ metilendioxiflavana 40 [24], de Iryanthera laevis 7,2’-dihidroxi-6,8-dimetil-4’,5-metilendioxiflavana 41, 7,2’-dihidroxi-5,8-dimetil-4’,5-metilendioxiflavana 42, 5,2’-dihidroxi-7-metoxi-6,8-dimetil-4’,5’-metilendioxiflavana 43 [26].
Flavan-3-oles se han aislado de Virola elongata (-) fisetinidol 44 [27] y (-) epicatequina 45 de las semillas de Myristica fragrans [28].
Los compuestos de tipo 1-3-diarilpropanos y 1,3 diaril-2-propanoles fueron encontrados principalmente en el género Virola por lo cual se conocen como virolanos y virolanoles respectivamente [29]. 15 virolanos 46-60 y 3 virolanoles 61, 62, 63 [27].
Las dihidrochalconas 64-67 han sido reportadas en Iryantera sagotiana [21], 68 en I. polyneura [18], en I. laevis 69, 70 [30]. En el género Virola, se identificó (±)-α-hidroxidihidrochalcona 71 en las especies V. calophylloidea [24] y V. surinamensis [31]. El primer biflavonoide 3',3'"-bis-2',4',6'-Trihidroxi-4-metoxidihidrochalcona 72, de la familia Myristicaceae se aisló de las hojas de Iryanthera sagotiana [21].
En este grupo se destacan, unos tipos de compuestos complejos de hidrochalconas, conocido como Iryanterinas identificadas exclusivamente en especies del género Iryanthera, diferenciadas por una letra de la A a la J. De la especie I. laevis se identificaron 73-A, 74-B, 75-C, 76-D, 77-E [30], [32] de I. paraensis 78-F [33] en I. grandis se identificaron 79-G, 80-H, 81-1,82-J [34].
Los flavonoides de tipo isoflavonas son también característicos de la familia Myristicaceae, se han identificado en diferentes especies del género Virola, Knema, Otoba, Pycnantus [17]. De la especie V. caducifolia se aislaron: 5,7-dihidroxi-4'-metoxiisoflavona (biochanina) 83, 5, 7,2'-trihidroxi-4'metoxiisoflavona 84, 5,7-dihidroxi-2',4'-dime-toxiisoflavona 85 [35]; en la especie V. surinamensis se elucido 83, 7-hidroxi-4'-metoxi isoflavona 86, 2'-hidroxi-7,4-dimetoxiisoflavona 89 [31]; en V. carinata 7,2'-dihidroxi-4'metoxi isoflavona 87, 5,7,4'-trihidroxi isoflavona 88, 5,4'-dihidroxi-7-metoxiisofla-vona 90 [36]; de la especie V. surinamensis se identificó 5,7-dihidroxi-4',6-dimetoxi isoflavona 91 [37]; en Knemaglomerata se aisló el compuesto 92 [38].
De las hojas de Osteophloeumplatyspermum se aislaron dos pterocarpanos, (±)-3-dime-tilhomopterocarpina conocida también como medicarpina 93 y (±)-maackiaina 94 [39].
Aceites esenciales
Los aceites esenciales están constituidos por una variedad de compuestos químicos volátiles, principalmente terpenos, así como compuestos aromáticos y alifáticos. En el aceite esencial de los frutos de Iryanthera ulei se determinaron compuestos de tipo sesquiterpeno, se destacaron: α -muurolol 95, espatulenol 96 α-cadinol 97, guaiol 98, oplopanone 99, 1,10-diepicubenol 100 y limoneno 101 [40]. De las hojas de Osteophloeum platyspermum se identificaron cincuenta terpenos de los cuales 44% correspondieron a monoterpenos y 56% a sesquiterpenos, los principales compuestos aislados de este estudio fueron 101, β-pineno 102 y α -pineno 103 [41]. De la especie Virola calophylla se determinaron los compuestos Vainillina 104, Safrol 105 y Metil-parabeno 106 [3].
De la especie Virola theidora, se identificaron los alcaloides: 2-metil-tetrahidroharmina 107, N-metiltriptamina 108, N,N-Dimetiltriptamina 109, 5-metoxi-N-metiltriptamina 110, 5-metoxi-N,N-dimetiltriptamina 111, 2-metil-1,2,3,4-tetrahidro-β-carbolina 112, 2-metil-6-metoxi-1,2,3,4-tetrahidro-β-carbolina 113; en Virola calophylla 108, 109, 111; en Virola rufula 108, 109, 110, 113; en Virola multinervia y Virola venosa 109, 111 [42].
Etnobotánica
Especies de la familia Myristicaceae son utilizadas en medicina popular, generalmente, en forma de infusiones, decocciones y cataplasmas, para el tratamiento de enfermedades gastrointestinales, infecciones y enfermedades de la piel entre otros usos. En la tabla 1 se presenta información etnobotánica de algunas especies de la familia Myristicaceae.
Actividad biológica
La tabla 2 muestra información respecto a algunos estudios reportados de diferentes actividades biológicas de algunas de las especies de la familia Myristicaceae.
Usos industriales
El uso primario de las Miristicáceas es maderable. Las especies llamadas cuángares o castaños son explotadas para madera de aserrío, extracción de pulpa de papel, en industrias locales para la elaboración de palos y cajas. Como fuente de alimento para comunidades rurales o para comunidades indígenas. El árbol de Myristica fragrans se cultiva principalmente por su semilla, conocida como "nuez moscada", la cual es utilizada como condimento. La pulpa del fruto es usada en la elaboración de jugos, jaleas, etc. [56]. Con la especie Virola sebifera se fabrican jabones de tocador y manteca para el cabello por su alto contenido de grasas como los compuestos trimiristina y laurodimiristina [10].
Estudios reportados de inhibición enzimática de especies de la familia Myristicaceae
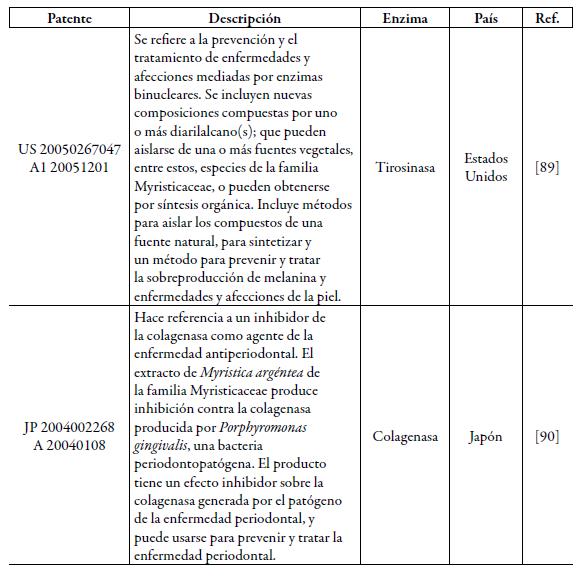
Se obtuvo un total de 33 estudios reportados y dos patentes sobre inhibición enzimática de especies de la familia Myristicaceae. En la tabla 3 se muestra los reportes encontrados por especie, indicando la enzima potencialmente inhibida, estudios de actividad biológica, el país donde se desarrolló, el órgano que fue estudiado, compuestos aislados o extractos evaluados, las referencias bibliográficas. Posteriormente, en la tabla 4 se muestra las descripciones de las patentes encontradas.
Tabla 3 Estudios reportados de inhibición enzimática de metabolitos o extractos de especies de la familia Myristicaceae.

CONCLUSIONES
Los compuestos fenólicos son una fuente promisoria de metabolitos que producen inhibición enzimática de tipo: acilfenol, lignano, neolignano, flavonoide, alquenilfenol, tocotrienol y ácido fenólico. Los que presentaron mayor número de estudios de inhibición enzimática fueron metabolitos lignano. Los reportes encontrados mostraron el mayor resultado para la actividad antioxidante, estableciendo relación con los compuestos fenólicos que actúan como coadyuvante en dicha actividad. Se encontró reportes de inhibición enzimática para 24 enzimas de tipos transferasa, hidrolasa y oxidorreductasa. Los órganelos que presentaron mayor número de estudios reportados fueron las semillas, que corresponde de igual manera a la especie Myristica fragrans. Y los países donde se llevaron a cabo los estudios reportados corresponden a Malasia, Estados Unidos y Corea.