INTRODUÇÃO
Possuindo cerca de 23 000 espécies distribuídas em 1535 gêneros, a família Asteraceae é considerada um dos maiores grupos de angiospermas do mundo [1]. Esta não é endêmica, tendo distribuição cosmopolita, e está mais presente em áreas temperadas e semiáridas dos trópicos e subtrópicos [2].
Espécies da família Asteraceae são conhecidas por apresentarem propriedades aromática, cosmética, assim como terapêutica; tendo diversas pesquisas já evidenciado o potencial medicinal dessa família, verificando as atividades: antifúngica, antioxidante, anti-leishimania, anti-inflamatória e analgésica [3-8].
Dentre as espécies de Asteraceae, está Praxelis clematidea (Griseb.) R. M. King & H. Robinson, que possui os seguintes sinônimos: Eupatorium clematideum Griseb. e Eupatorium urtifolium var. clematideum (Griseb.) Hieron ex. Kuntze, e é uma erva perene de vida anual curta, nativa da América do Sul [9, 10]. Por ser uma espécie muito adaptável, podendo sobreviver em áreas com diferentes climas, tornou-se invasiva em diversas regiões no mundo, sendo uma ameaça à agricultura, biodiversidade e meio ambiente [11-12].
No entanto, apesar de ter tal impacto negativo à indústria e natureza, P. clematidea é rica em substâncias químicas como flavonoides, terpenóides e esteroides, os quais podem desempenhar uma série de atividades biológicas [13]. Metabólitos secundários dessa espécie são alvos de diversas pesquisas, tendo sido constatado que os mesmos possuem propriedades antiviral, antifúngica e antibacteriana, por exemplo [9].
Uma das etapas essenciais para a produção e normatização de um fitoterápico, é que os compostos químicos vegetais ativos em sua composição sejam testados quanto à sua toxicidade [14]. Isso porque a ciência mostra que medicamentos fitoterápicos e plantas medicinais podem sim ter efeitos danosos ao organismo, acabando com a ideia de porque os mesmos advêm de fontes naturais, não possuem efeitos danosos [15, 16]. Tendo em vista o grande potencial terapêutico e a importância de estudos toxicológicos de compostos advindos de fontes naturais, esse trabalho tem como finalidade testar a atividade citotóxica, in vitro, do extrato etanólico das folhas de P. clematidea
METODOLOGIA
Princípios éticos e boas práticas na experimentação
Essa pesquisa foi submetida ao Comitê de Ética do Centro Universitário de Patos (UNIFIP), sob o número de Protocolo 2.373.249, e foi aprovada dentro dos princípios éticos e da legislação vigente. Os eritrócitos humanos referentes aos tipos sanguíneos A, B e O foram oriundos de doadores saudáveis [17]. Estes foram obtidos na Universidade Federal de Campina Grande/UFCG. A manipulação assim como o descarte dos eritrócitos foram feitos de acordo com as Normas de Segurança seguidas pela referida unidade.
Substância teste
As partes aéreas de Praxelis clematidea R.M. King & Robinson foram coletados na Lagoa do Paturi, município de Santa Rita, no estado da Paraíba (Brasil), em maio de 2008. A identificação do material botânico foi realizada e suas exsicatas estão depositadas no Herbário Prof. Lauro Pires Xavier (JPB), da Universidade Federal da Paraíba, sob o código M. F. Agra et al. 6894 (JPB) [9].
Foi utilizado o extrato Etanólico das folhas de Praxelis clematidea, gentilmente atribuídos pela equipe dos Professores Dr. José Maria Barbosa Filho e Dra. Gabriela Lemos de Azevedo Maia, das Universidade Federal da Paraíba (UFPB) e Universidade Federal do Vale do São Francisco (Univasf ), respectivamente.
O extrato foi armazenado em frasco de vidro âmbar e preservado sob refrigeração. Emulsões dos extratos nas diferentes concentrações foram preparadas no momento do teste (utilizando 0,5% de DMSO) por meio de diluições em água destilada, para a obtenção da concentração desejada do extrato.
Avaliação da citotoxicidade em eritrócitos humanos
As amostras dos tipos sanguíneos A, B e O foram misturadas em NaCl 0,9 % na proporção de 1:30 e centrifugadas a 2500 rpm durante 5 minutos para obtenção dos eritró-citos. Tal procedimento foi repetido três vezes, e o sedimento da última centrifugação ressuspenso em NaCl 0,9 % para obtenção de uma suspensão a 0,5 %. As amostras do extrato em concentrações distintas (50, 100, 500 e 1000 µg/mL) foram adicionadas à 2 mL da suspensão de eritrócitos para um volume final de 2,5 mL. Uma suspensão de eritrócitos foi utilizada como controle negativo (0 % de hemólise) e outra suspensão de eritrócitos contendo Triton X-100 a 1 % como controle positivo (100 % de hemó-lise). Em seguida, as amostras foram incubadas durante 60 minutos à 22 (±2) °C sob agitação lenta e constante. Após isso, as amostras foram centrifugadas a 2500 rpm por 5 minutos e a hemólise quantificada por espectrofotometria em comprimento de onda de 540 nm [18].
Análise estatística
Todas os testes foram realizados em triplicata e os dados foram expressos em porcentagens de hemólise que representam a média aritmética de três medidas, os resultados comparados ao controle positivo (100 % hemólise). A estatítica realizada pelo método one-way ANOVA, com pós-teste Bonferroni. Os números foram considerados estatisticamente significativos quando apresentaram p<0,05. A análise estatística foi realizada utilizando o software GraphPad Prism 5.0®.
RESULTADOS E DISCUSSÃO
O consumo de plantas medicinais e medicamentos fitoterápicos na automedicação é muito comum, o que pode aumentar os potenciais danos que estes podem causar ao organismo humano quando usados de maneira errônea, uma vez que, na maioria das vezes, a segurança e eficácia dos mesmos podem ser baseadas em avaliações pouco confiáveis [15].
A hemólise se caracteriza pelo rompimento da membrana da célula sanguínea, ocasionando a liberação de hemoglobina, o que pode gerar uma série de danos a órgão vitais como coração, rins e fígado [19, 20].
Com isso, a verificação do potencial hemolítico de extratos vegetais se faz de extrema importância na triagem de atividades toxicológicas, visando aumentar a segurança no consumo de fitoterápicos e plantas medicinais [20].
Para a avaliação do potencial hemolítico do extrato etanólico de P. clematidea foi utilizado o ensaio in vitro de citotoxicidade em células sanguíneas. Os resultados obtidos são apresentados nas figuras 1, 2 e 3.
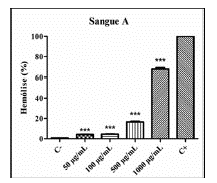
Figura 1 Avaliação hemolítica de P. clematidea em eritrócitos do tipo A. (C-) Controle negativo (suspensão a 0,5%), (C+) Controle positivo (1% Triton X-100). P < 0,05 (*), P < 0,01 (**) e P < 0,001 (***) versus controle positivo.

Figura 2 Avaliação hemolítica de P. clematidea em eritrócitos do tipo B. (C-) Controle negativo (suspensão a 0,5%), (C+) Controle positivo (1% Triton X-100). P < 0,05 (*), P < 0,01 (**) e P < 0,01 (***) versus controle positivo.
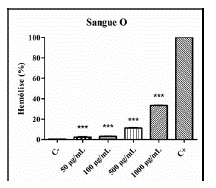
Figura 3 Avaliação hemolítica de P. clematidea em eritrócitos do tipo O. (C-) Controle negativo (suspensão a 0,5%), (C+) Controle positivo (1% Triton X-100). P < 0,05 (*), P < 0,01 (**) e P < 0,001 (***) versus controle positivo.
De acordo com as informações contidas nas figuras 1, 2 e 3 pode-se dizer que o extrato etanólico das folhas de P. clematidea apresentou baixa toxicidade às células sanguíneas humanas. Houve hemólise somente na concentração mais alta (1000 µg/ mL), no tipo sanguíneo A.
Estudos químicos de Praxelis clematidea realizados por Maia et al. (2011) [9] foram isolados seis flavonas: apigenina, genkwanina, 7,4'-dimetilapigenina, trimetilapige-nina, cirsimaritina e tetrametilescutelareína, presentes em extratos: hexânico, metanó-lico e etanólico.
A estrutura química dos flavonoides possui número variável de grupos hidroxilas que desempenham o papel no sequestro de íons, conferindo potencial antioxidante. Dessa forma, justifica-se a função essencial destas moléculas na proteção contra efeitos oxida-tivos e menor desempenho de efeito citotóxico, contribuindo para o uso dessas moléculas na ação terapêutica de muitas patologias [21].
A variação hemolítica mesmo que de forma discreta demostra uma tendência de melhor interação entre o extrato etanólico nas hemácias do tipo O e B; essa ação sugere menor relação citotóxica das moléculas desse composto frente a porção antigênica nestas hemácias. Os monossacarídeos específicos na superfície de membrana eritrocitária: tipo A (N-acetilgalactosamina), tipo B (D-galactose), tipo O que não possuí nenhum antígeno de superfície [22].
Em estudo recente realizado por Sousa et al. (2021) [23] utilizando o flavonoide 5,7-dihydroxy-3,8,4'-trimethoxy isolado da espécie Pavonia glazioviana pertencente a família Malvaceae evidenciou baixo efeito citotóxico em hemácias de humanos corroborando os resultados encontrados no presente trabalho.
Outro estudo realizado por Sobrinho et al. (2016) [24] foi analisado a ação citotóxica do óleo essencial da espécie Eupatorium ballotifolium, espécie pertencente à família Asteraceae mesma família da espécie P. clematidea, verificou-se que o potencial cito-tóxico foi considerado baixo, dessa forma o estudo sugere que a presença de moléculas polifenólicas no extrato etanólico e sua origem vegetal com espécies ricas em atividade antioxidante confirma os resultados expostos neste estudo.
Silva Filho et al. (2009) [25] testaram a ação tóxica de constituintes químicos flavonoides e terpenos de Baccharis dracunculifolia (Asteraceae) contra fibroblastos, e os resultados obtidos pelos mesmos mostrou que, tais substâncias mesmo nas concentrações mais altas, apresentaram baixa citotoxicidade.
Por outro lado, Sousa and Viccini (2011) [26], testaram o potencial citotóxico do extrato aquoso de Achillea millefolium (Asteraceae) e verificaram que o mesmo apre sentou alto potencial tóxico. Contudo, esses resultados podem ser explicados por dois fatores específicos. O primeiro é que as células utilizadas para o ensaio não eram células animais, e o segundo é que as concentrações utilizadas na produção do extrato aquoso eram mais altas (5,10, 20 e 30 mg/mL) do que as utilizadas no presente estudo.














