Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.53 no.4 Bogotá Oct./Dec. 2002
1 Universidad de Caldas. Manizales, Colombia
2 Child Health Department. University of Newcastle upon Tyne. England.
3 Institut Bioquímica Clínica-Universidad Autónoma de Barcelona. España. Correspondencia: Institut de Bioquímica Clínica. Mejía Lequerica, s/n Edifici Helios III, Planta baixa-08028 Barcelona, España.
RESUMEN
Se han encontrado concentraciones anormales de carnitina en niños asociadas con deficiencias primaria y secundaria de carnitina, con disminución de las concentraciones en sangre y tejidos, así como niveles elevados en algunos errores innatos del metabolismo. El presente estudio tiene como objetivo la obtención de valores de referencia para carnitina libre y total en sangre de cordón umbilical, como herramienta en el diagnóstico temprano de errores innatos del metabolismo. Se analizaron mediante espectrometría de masas en tándem (MS/MS) 130 muestras de sangre de cordón umbilical de nacimientos con embarazos a término y peso normal al nacer (78 niños y 52 niñas) de una población colombiana. No se encontró diferencia estadísticamente significativa dependiente del sexo del recién nacido. Reportamos valores de referencia para carnitina libre y total en sangre de cordón umbilical de 18,5 ± 3,4 µmol/L y 20,9 ± 4,2 µmol/L respectivamente.
Palabras clave: carnitina, cordón umbilical, espectrometría de masas en tándem.
SUMMARY
Abnormal carnitine plasma concentrations have been found in children associated with primary and secondary carnitine deficiency, with decreased concentrations in blood and tissues, as well as elevated levels of the present study is to provide reference values for free and total carnitine from umbilical cord blood, as tool in the early diagnosis of inherited methabolic diseases. 130 cord blood specimens from full-term and normal birth weight children from a Colombian population (78 boys and 52 girls) were analyzed by tandem mass spectrometry. No statistical significant difference between sex was found. Reference values for free and total carnitine in cord blood of 18.5 ±3.4 µmol/L and 20.9 ±4.2 µmol/L respectively are reported.
Key words: carnitine, cord blood, tandem mass spectrometry.
INTRODUCCIÓN
La obtención de energía a través de la oxidación mitocondrial de ácidos grasos es particularmente importante en los primeros días de vida. La función principal de la carnitina (ácido ß-hidroxi-y-trimetilaminobutírico) es la de actuar como lanzadera de ácidos grasos de cadena larga activados desde el citoplasma, al interior de la matriz mitocondrial para ser degradados en la ß-oxidación, y remover del interior de la mitocondria los ácidos grasos de cadena larga, media y corta que se acumulan como resultado del metabolismo normal y anormal, manteniendo niveles adecuados de coenzima A (CoA) libre (figura 1). La L-carnitina interactúa además con diferentes tipos de membranas celulares para cambiar sus propiedades fisicoquímicas.(1)
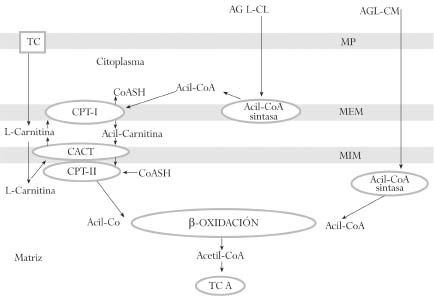
Esto significa que la carnitina modula la relación acil-CoA libre mediante la formación de acilcarnitinas. Si las acil-CoA son producidas a velocidad mayor de la que son utilizadas, el CoA libre intramitocondrial es regenerado mediante la unión de carnitina a grupos acilo y la alta relación de acil-CoA/CoA libre se corrige.(2)
La carnitina está presente en tejidos y fluidos corporales en forma libre, así como esterificada (acilcarnitinas de cardena corta, media y larga), y la carnitina total consiste en la sumatoria de la carnitina libre y todas las acilcarnatinas. La L-carnatina es sintetizada en humanos principalmente en el hígado, pero también en riñón y cerebro, sin embargo el 50% al 75% de los requerimientos diarios son tomados de la dieta.
La determinación de las concentraciones de carnitina libre y total en fluidos corporales y tejidos, es de una importancia en el diagnóstico temprano y en el seguimiento de pacientes con errores congénitos que involucran el metabolismo intermediario,³ sin embargo poco se sabe de la determinación de valores de referencia de este parámetro y otros (acilcarnitinas y aminoácidos) en sangre de cordón umbilical mediante MS/MS, como la herramienta en el diagnóstico temprano de metabolopatías. Cabe anotar que para un número significativo de estos desórdenes metabólicos se han establecido recientemente tratamientos, mejorando el manejo de estos pacientes, previniendo complicaciones futuras que pueden incluso poner en peligro la vida de los mismos.
El presente estudio tiene como objetivo la obtención de valores de referencia para carnitina libre y total en sangre de cordón umbilical, como herramienta en el diagnóstico temprano de errores innatos del metabolismo.
MATERIALES Y MÉTODOS
Materiales
Todos los reactivos utilizados fueron grado analítico. La L-carnitina fue obtenida de Sigma-Aldrich Company, Ltd., Poole, UK. El isótopo estable ²H3-Carnitina fue adquirido de Cambridge Isotope Laboratories Andover, MA, USA.
Pacientes
Se tomaron muestras de sangre de cordón umbilical de 130 nacimientos (78 niños y 52 niñas) producto de embarazos a término, aparentemente sanos para la edad gestacional y peso dentro de percentiles normales al nacer, en las salas de parto del Hospital de Caldas en Manizales (Colombia).
El peso al nacimiento fue 3 100 ± 430 g (promedio ± desviación estándar), la edad gestacional fue de 38,3 ± 1,2 semanas. Ninguno de los neonatos tuvo a 1 minuto valores de Apgar inferiores a 6, a los 10 minutos dichos valores fueron de 9 o 10 en todos los neonatos participantes.
Los neonatos fueron seleccionados previamente por encuesta a las madres participantes en el estudio, tratando de seleccionar aquellos neonatos que no presentarán morbilidad por otras variables que pudieran condicionar los niveles de carnitina en sangre (bajo peso al nacer, prematuros, otras patologías asociadas).
Un formato de consentimiento informado escrito fue firmado por cada uno de los padres y toda la información se consideró confidencial. El estudio cumple con las normas establecidas por los correspondientes comités de ética de la Universidad de Caldas.
Métodos
Preparación de tarjetas de papel de filtro para la determinación de carnitina libre y total
Las muestras de sangre fueron centrifugadas (2300 g durante 5 min) para separar el plasma. Un volumen de estándar interno de 20 mL (300 mmol/L ²H3 - Carnitina en 50% metanol:agua) fue adicionado a 180 mL de plasma. La solución fue mezclada, y se dejó en reposo durante 15 min, para posteriormente dejar caer gotas de la misma sobre papel de filtro (No. 903, 1,88 mm Schleicher & Schuell). Las muestras se dejaron secar a temperatura ambiente durante una hora.
Para la determinación de la carnitina total, se adicionaron 16 mL de KOH 2 mol/L a 100 mL de la mezcla plasma-estándar interno, después de mezclar y centrifugar, (3000 g durante 1 min), las muestras fueron incubadas a 45°C en un baño con agitación durante 60 min para hidrolizar las acilcarnitinas. Después e mezclar y centrifugar por segunda vez, se dejaron caer gotas sobre papel de filtro y se repitió el proceso de secado.
Análisis de muestras de plasma por MS/MS, mediante la utilización de bandejas de 96 pozos (microtitre plates).
Las manchas de plasma fueron recortadas del papel de filtro en círculos (6,35 mm o 0,25 pulgadas de diámetro para cada uno, que corresponden a 12 mL de plasma) y se depositó un círculo en cada pozo. A cada uno fue adicionado metanol puro (500 mL). Las bandejas fueron colocadas en agitador orbital (750 rpm) durante 30 min y luego sonicadas durante 15 min. Posteriormente fueron agitadas nuevamente durante dos horas. Se sonicaron por 30 min y el papel de filtro fue removido de cada pozo. El sobrenadante resultante fue evaporado bajo gas nitrógeno a 45°C hasta secarse y se adicionaron 50 mL de HCL butanólico 1 mol/L a cada muestra (cada pozo) e incubados a 60°C durante 15 min (derivatización). Las muestras fueron evaporadas inmediatamente bajo nitrógeno y redisueltas en 100 mL (cada una) de acetonitrilo al 70% en agua para ser inyectadas al espectrómetro de masas. El estándar interno fue usado para la cuantificación de L-carnitina al analizar la relación entre las señales.
Todos los análisis fueron realizados en un equipo Quatro II, triple quadrupole tandem mass spectrometer (Micromass UK), equipado con una fuente de ionización en espray (ESI), y sistema de análisis datos "micro mass MassLynx". La introducción de las muestras a la fuente se hizo mediante el dispositivo automático Jasco AS980 acoplado a una bomba Jasco PU980 HPLC.
Se usó la prueba t-student para buscar diferencias estadísticas entre sangre de cordón umbilical de niños comparado con niñas.
RESULTADOS Y DISCUSIÓN
Los aminoácidos y la glucosa son la principal fuente de substratos para el metabolismo fetal, siendo bajo el nivel de oxidación de ácidos grasos.(4) Durante el período previo a la lactancia, el neonato depende de la movilización de glicógeno y triglicéridos, jugando un papel importante la ß-oxidación de los ácidos grasos, proceso que requiere carnitina, (5) pero las reservas de carnitina en el neonato son limitadas (6,7) y su concentración es baja probablemente debido a la inmadurez hepática para su síntesis;(8) sin embargo, la distribución de carnitina libre y de los ésteres de carnitina varían con el estado de ayuno, adiposidad, funcionamiento renal, y ejercicio muscular. (9,10)
Los tejidos incluyendo el corazón, cerebro, músculo, hígado, y riñón, son altamente, dependientes de la energía generada por la ß-oxidación, y por lo tanto es esencial para los tejidos tener un aporte suficiente de carnitina.
Debido a que sólo riñón e hígado poseen la totalidad de las enzimas para sintetizar carnitina (11,12), y que la concentración de carnitina en tejidos es 20 a 50 veces mayor que en plasma (11,13), los tejidos dependen de la captación de carnitina de la sangre vía transporte activo. El transporte activo está además involucrado en la reabsorción tubular renal (14), y en la absorción intestinal de carnitina. (15) El transportador activo de carnitina (OCTN) el cual es dependiente de sodio, se encuentra incluido en la familia de transportadores catiónicos (OCT) y a su vez en la subfamilia OCTN (16), siendo ampliamente expresado en tejidos humanos como corazón (miocardio, válvulas y arteriolas), músculo esquelético, riñon (túbulos proximales y distales, glomérulos), placenta, intestino delgado, y algunas áreas cerebrales (corteza, hipocampo, cerebelo) (17,18), ocasionando su déficit. La deficiencia primaria de carnitina, de la cual ya han sido descritas varias mutaciones. (19)
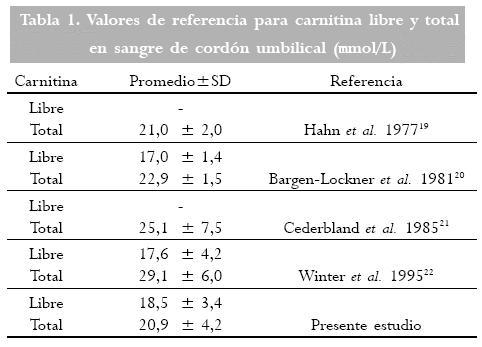
Han sido reportados previamente valores de referencia para carnitina libre y total (20-26), así como para acilcarnitinas en pacientes pediátricos y durante el embarazo, en fluidos corporales y tejidos. Los niveles de carnitina libre y total de cordón parecen ser bajos en niños pre-término y pequeños para la edad gestacional, comparados con niños producto de embarazos a término (27), estando además los niveles de carnitina relacionados con el peso al nacer (7). Los valores para carnitina libre y total que hemos encontrado trabajando con MS/MS en plasma de muestras de sangre de cordón, pueden ser considerados por otros autores (Tabla 1), sin embargo, el uso de MS/MS (28) constituye una gran ventaja en cuanto al ahorro de tiempo, cantidad de muestras a procesar, rapidez en la obtención de resultados, automatización y precisión; además la determinación de las concentraciones de carnitina no implica el uso de sustratos radioactivos como lo requiere el ensayo radio-enzimático, técnica generalmente utilizada para la medición de estos parámetros. (29)
Este trabajo constituye el primer reporte del uso de MS/MS automatizado para el análisis de muestras de plasma de muestras de sangre de cordón en tarjetas, su utilidad radica en que ante la sospecha del nacimiento de un producto con probabilidades de sufrir errores congénitos del metabolismo intermediario, la medición de los niveles de carnitina, una de las pruebas básicas para el diagnóstico temprano de varias metabolopatías, puede llevarse a cabo con alta precisión y de manera automatizada.
AGRADECIMIENTOS
Los autores agradecen a Jarol Quintero G., M.D. y John Jairo Osorio O., M.D. del Hospital de Caldas su colaboración en la coordinación de la toma de muestras.
REFERENCIAS
1. Heinoven OJ. Carnitine and physical exercise. Sports Med 1996;22(2):109-32. [ Links ]
2. Sewell AC, Bohles HJ. Acylcarnitines in intermediary metabolism. Eur J Pediatr 1995;154:871-7. [ Links ]
3. Osorio JH. Complicaciones del embarazo relacionadas con errores hereditarios de la b-oxidación mitocondrial. Rev Colomb Obstet Ginecol 2001;52(2):143-50. [ Links ]
4. Hahn P, Allardyce DB, Frohlich J. Plasma carnitine levels during parenteral nutrition of adult surgical patients. Am J Clin Nutr 1982;36:569-72. [ Links ]
5. Borum PR. Possible carnitine requirement of the newborn and the effect of genetic disease on the carnitine requirement. Nutr Rev 1981;29:385-90. [ Links ]
6. Shenai JP, Borum PR. Tissue carnitine reserves of new-born infants. Pediatr Res 1984;18(7):679-81. [ Links ]
7. Battistella PA, Vergani L, Donzelli F, Rubaltelli FF, Angeline C. Plasma and urine carnitine levels during development. Pediatr Res 1980;14:379-81. [ Links ]
8. Rebouche CJ, Seim H. Carnitine metabolism and its regulation in microorganisms and mammals. Annu Rev Nutr 1998;18:39-61. [ Links ]
9. Alberty R, Albertyova D. Biological variation of free and total carnitine in serum of healthy subjects. Clin Chem 1997;43(12):2441-3. [ Links ]
10. Bremer J. Carnitine. Metabolism and functions. Physiol Rev 1983;63(4):1420-80. [ Links ]
11. Rebouche CJ. Carnitine function and requirements during the life cycle. Faseb J 1992;6(15):3379-86. [ Links ]
12. Stanley CA. New genetic defects in mitochondrial fatty acid oxidation and carnitine deficiency. Adv Pediatr 1987;34:59-88. [ Links ]
13. Engel AG, Rebouche CJ, Wilson DM, Glasgow AM, Romsche CA, Cruse RP. Primary systemic carnitine deficiency; II. Renal handling of carnitine. Neurology 1981;25(1):16-24. [ Links ]
14. Rodrigues-Pereira R, Scholte HR, Luyt-Houwen IE, Vaadrager-Verduin MH. Cardiomyophathy associated with carnitine loss in kidneys and small intestine. Eur J Pediatr 1988;148(3):193-197. [ Links ]
15. Lahjouji K, Mitchell GA, Qureshi IA. Carnitine transport by organic cation transporters and systemic carnitine deficiency. Mol Genet Metab 2001;73:287-97. [ Links ]
16. Tamai I, Ohashi R, Nezu J, Yabuuchi H, Oku A, Shimane M, Sai Y, Tsuji A. Molecular and functional identification of sodium ion-dependent, high affinity human carnitine transporter OCTN2. J Biol Chem 1998; 273:20378-82. [ Links ]
17. Wu X, Prasad PD, Leibach FH, Ganapathy V. cDNA sequence, transport function, and genomic organization of human OCTN2, a new member of the organic cation transporter family. Biochem Biophys Res Commun 1998;246:589-595. [ Links ]
18. Vaz FM, Scholte HR, Ruiter J, Hussaarts-Odijk LM, Rodrigues-Pereira R, Schweitzer S, de Klerk JBC, Waterham HR, Wanders RJA. Identification of two novel mutations in OCTN2 of three patients with systemic carnitine deficiency. Hum Genet 1999;105:157-161. [ Links ]
19. Hahn P, Skala JP, Seccombe DW, Frohlich J, Penn-Walker D, Novak M, Hynie I, Towell ME. Carnitine content of blood and amniotic fluid. Pediatr Res 1977;11:878-80. [ Links ]
20. Bargen-Lockner C, Hahn P, Wittman B. Plasma carnitine in pregnancy. Am J Obstet Gynecol 1981;140(4):412-4. [ Links ]
21. Cederbland G, Niklasson A, Rydgren B, Albertsson-Wikland K, Olegard R. Carnitine maternal and neonatal plasma. Acta Pediatr Scand 1985;74:500-4. [ Links ]
22. Winter SC, Linn LS, Helton E. Plasma carnitine concentrations in pregnancy, cord blood, and neonates and children. Clin Chem 1995;243:87-92. [ Links ]
23. Ingebresen OC, Strand H, Ingebrigtsen M, Hvidsen D. Pediatric reference values for free and total carnitine and acylcarnitine in urine. Clin Chem 1998;44(6):Supl A14. [ Links ]
24. Coude M, Chadefaux D, Rabier D, Kamoun P. Early amniocentesis and fluid organic acid levels in the prenatal diagnosis of organic acidemias. Clin Chim Acta 1990;187:329-32. [ Links ]
25. Novak M, Monkus EF, Chung D, Buch M. Carnitine in perinatal metabolism of lipids; I. Relationship between maternal and fetal plasma levels of carnitine and acylcarnitines. Pediatrics 1981;67(1):95-100. [ Links ]
26. Novak M, Wieser PB, Buch M, Mahn P. Acetyl carnitine and free carnitine in body fluids before and after birth. Pediatr Res 1979;13:10-15. [ Links ]
27. Meyburg J, Schulze A, Kohlmueller D, Linderkamp O, Mayatepek E. Postnatal changes in neonatal acylcarnitine profile. Pediatr Res 2001;49:125-9. [ Links ]
28. Osorio JH, Pourfarzam M. Free and total carnitine measured in children by tandem mass sprectrometry. Braz J Med Biol Res 2002. En prensa. [ Links ]
29. Cederbland G, Lindstedt S. A method for the determination of carnitine in the picomole range. Clin Chim Acta 1972;37:235-243. [ Links ]














