INTRODUCCIÓN
El cáncer de endometrio es la sexta causa de cáncer en la mujer en el mundo. Es la neoplasia más común de origen ginecológico en países desarrollados con una incidencia ajustada por edad de 15,8 por 100.000 mujeres, y una mortalidad ajustada por edad de 2,5 por 100.000 mujeres, diagnosticándose anualmente más de 400.000 nuevos casos 1-3. La incidencia viene aumentando entre el 0,5 y el 1% mundialmente en los últimos 20 años, de acuerdo con el porcentaje de variación promedio de la incidencia (estimated average percentage change - EAPC por sus siglas en inglés) calculado por Gu et al. 4. La incidencia es menor en los países en vía de desarrollo, por ejemplo, en Colombia, según datos de The Global Cancer Observatory (GLOBOCAN) en el 2022 la incidencia y mortalidad ajustadas por edad fueron de 8,8 y 1,8 casos por 100.000 mujeres 3.
El cáncer de endometrio afecta especialmente a mujeres que están en la postmenopausia en un 80 % de los casos, aunque en un 20 % se presenta en la edad fértil, y en un 5% antes de los 40 años. Su manifestación inicial es sangrado uterino anormal, lo que permite su diagnóstico temprano mediante el estudio histológico de una muestra del endometrio y se asocia a un buen pronóstico en un 70-80 % de los casos 1-5.
Este cáncer produce alteraciones en la fertilidad de las mujeres premenopáusicas y también genera morbilidad importante, asociada con el sangrado y la infiltración a órganos vecinos e invasión a distancia cuando es diagnosticado tardíamente o por características intrínsecas de ciertos tipos de tumor que le confieren mayor agresividad. El tratamiento inicial es quirúrgico, se remueve el útero, los anexos y la evaluación ganglionar para no solo hacer la resección del tumor, sino también para definir el pronóstico y establecer el manejo complementario óptimo para cada caso, ya sea observación, hormonoterapia, quimioterapia, radioterapia, inmunoterapia, terapias target o combinación de estos 1.
En cuanto a su clasificación, en 1983 Bokhman categoriza los adenocarcinomas endometriales en tipo I y II de acuerdo con sus diferencias en características histológicas, clínicas y pronósticas 5. En la práctica clínica, desde 2016 se ha utilizado la clasificación de las sociedades europeas de ginecología, oncología y radioterapia (ESGO, ESMO, ESTRO) basada en riesgo de recurrencia mediante la combinación entre la clasificación por estadios FIGO (International Federation of Gynecology and Obstetrics) y hallazgos histológicos (grado, tipo histológico, compromiso del espacio linfovascular) 6.
Si bien esta clasificación mostró importancia pronóstica y capacidad predictiva 6, existen problemas de reproducibilidad de los diferentes grupos histológicos y del grado de diferenciación, siendo estos especialmente importantes entre carcinomas serosos y endometrioides de alto grado, donde las discrepancias llegan a ser de hasta el 30 % 7. Adicionalmente, se observan pacientes con un comportamiento clínico diferente al del grupo de riesgo asignado, demostrando heterogeneidad entre pacientes con características similares, lo que es atribuido a una biología molecular diferencial 8.
En el 2013, el programa Cancer Genome Atlas (TCGA) realizó un análisis genómico, transcriptómico y de caracterización proteómica de muestras de tumores y ADN de la línea germinal correspondiente a 373 pacientes con cáncer endometrial; incluidos 307 casos de histología endometrioide, 53 casos de tipo seroso y 13 de histología mixta. El análisis identificó cuatro grupos moleculares con pronósticos diferentes: POLE (polimerasa épsilon del DNA) ultramutado, inestabilidad microsatelital hipermutado, alto número de copias, y bajo número de copias 9,10. Sin embargo, esta clasificación se hizo mediante secuenciación genómica completa, la cual requiere laboratorios altamente especializados, y es muy costosa, de tal manera que no es fácil de implementar en la práctica clínica diaria.
La doctora A Talhouk et al., en el 2015 desarrolló el estudio ProMisE (Proactive Molecular Risk Classifier for Endometrial Cancer) para identificar marcadores subrogados mediante técnicas de inmunohistoquímica para las proteínas que codifican los genes de inestabilidad satelital (MLH1, PMS2, MSH2, MSH6), conocidas como proteínas del complejo MMR (mismatch repair), y para la proteína p53, generada por el gen TP53, continuando con la realización de estudio molecular para las mutaciones más frecuentes del POLE 11-14. Esta clasificación estableció cuatro grupos pronósticos diferentes, análogos a la clasificación TCGA: POLE mutado (POLEmut), MMR deficiente (dMMR), p53 anormal (p53abn) y p53wt (wild type) o perfil mutacional no específico (NSMP - no specific molecular profile) 11,12.
El grupo POLEmut es de excelente pronóstico, comprende entre el 4 al 12 % de todos los cánceres de endometrio, y su detección se hace mediante la secuenciación de los 11 puntos más frecuentemente comprometidos, que corresponden al casi 100 % de las mutaciones del POLE 15-17.
La determinación por inmunohistoquímica de las 4 proteínas mayores del MMR (MLH1, PMS2, MSH2, MSH6), cuya deficiencia es detectada cuando hay una alteración en los genes de inestabilidad microsatelital, con una concordancia de 93 - 95 %, identifica un grupo de pronóstico intermedio 10,15.
El gen supresor TP53 codifica para la proteína p53, cuando está mutado es el grupo de peor pronóstico, correspondiente entre el 8 y 24 % del total 10,18,19. Se detecta por inmunohistoquímica, identificándose como el grupo p53abn, con una concordancia entre p53abn y la mutación del gen TP53 del 90,7 - 92 %; esta concordancia disminuida es dada especialmente en la detección de los clasificadores múltiples, que si son excluidos dan una concordancia del 94,5 - 95,1% 20-23.
El cuarto grupo se conoce como NSMP o p53wt. Es un grupo en el cual no se detecta ninguna de las otras 3 alteraciones moleculares, siendo el más frecuente (30 a 60 % de todos los casos) 13. Inicialmente se promulgaba como de riesgo intermedio, pero hoy se conoce que es un grupo heterogéneo con diferente pronóstico de acuerdo a la positividad de los receptores hormonales y al grado de diferenciación o cuando tiene histología de los grupos adversos (seroso, células claras, carcinosarcoma) 10,15.
Aproximadamente el 3 a 7 % de todos los carcinomas endometriales manifiestan alteraciones simultáneas en diferentes grupos moleculares (clasificadores múltiples), pudiendo tener alteraciones en 2 o 3 grupos. Se reconoce que su comportamiento clínico en general se asimila más al grupo de mejor pronóstico que lo compone (tabla 1) 15,24.
Tabla 1 Subtipos moleculares y clasificadores múltiples
| P53 | MMR | POLE | SUBTIPO MOLECULAR DEFINITIVO |
|---|---|---|---|
| Normal | MMR proficiente | Mutado | POLE |
| Normal | MMR deficiente | No mutado | dMMR |
| Normal | MMR proficiente | No mutado | NSMP/P53wt |
| Anormal | MMR proficiente | No mutado | P53abn |
| Normal | MMR deficiente | Mutado | Doble clasificador → POLE |
| Anormal | MMR proficiente | Mutado | Doble clasificador → POLE |
| Anormal | MMR deficiente | No mutado | Doble clasificador → dMMR |
| Anormal | MMR deficiente | Mutado | Triple clasificador → POLE |
Fuente: Autores.
Estos nuevos grupos moleculares representan un cambio revolucionario por la alta reproducibilidad, la posibilidad de asignación desde la biopsia inicial a un grupo pronóstico y su potencial para establecer diferentes alternativas de manejo, de acuerdo con los grupos y subgrupos moleculares.
Aunque la clasificación molecular fue integrada por la Organización Mundial de la Salud (OMS) en el 2020, así como recomendada en el enfoque del manejo del cáncer endometrial en consensos y guías internacionales 25-30, demostrándose su costo-efectividad en subgrupos de pacientes 31,32, la implementación universal de esta genera múltiples retos incluso para los países desarrollados, por lo que a la fecha no ha sido adecuadamente implementada en Colombia.
El objetivo de este consenso es dar recomendaciones ajustadas que permitan unificar e implementar la clasificación molecular a nivel nacional bajo un uso racional de recursos y acorde a la disponibilidad de la tecnología para la realización de las pruebas, pues a pesar de que los costos disminuyeron utilizando la subrogación de la secuenciación genética de las pruebas de inmunohistoquímica de las proteínas del MMR y P53, la secuenciación del POLE sigue teniendo un alto costo y requiere de laboratorios especializados.
MATERIALES Y MÉTODOS
Alcance: recomendaciones dirigidas a niveles de atención II al IV del Sistema General de Seguridad Social en Salud (SGSSS) acordes al contexto colombiano para el enfoque del cáncer endometrial de acuerdo con la clasificación molecular. Para todos los niveles de acciones diagnósticas de inmunohistoquímica. En Nivel III y IV para acciones diagnósticas avanzadas (solicitud de pruebas moleculares), decisiones terapéuticas y remisión a genética.
Población: mujeres con cáncer endometrial infiltrante en estadios FIGO 2009 I a IV de cualquier histología.
Usuarios del consenso: ginecólogos oncólogos, oncólogos clínicos, oncólogos radioterápicos, patólogos, genetistas, ginecólogos y obstetras, médicos generales.
Aspectos abordados: generalidades de clasificación molecular, tipo de panel molecular, estrategia de testeo, estudios anatomopatológicos, enfoque por genetista. Se propone algoritmo especificando el papel de cada especialidad y medicina general.
Aspectos no abordados: tipo de tratamiento quirúrgico y esquema de tratamiento adyuvante, complicaciones en el manejo, evaluación económica.
Procedimiento: el grupo líder del consenso estuvo compuesto por expertos metodológicos (AF y JR) y temáticos de las áreas de ginecología oncológica (PC, LM, RF), oncología clínica (MP, AH), patología (RP) y genética (AG). Este grupo se encargó de la concepción del consenso definiendo cinco temas principales para promover la implementación de la clasificación molecular en cáncer endometrial a nivel nacional: a) racionalidad del su uso; b) descripción de pruebas de inmunohistoquímica y genética; c) estrategia de testeo; d) espécimen para evaluación; e) solicitud de pruebas. Con base en esto, se realizó revisión de la literatura, el contacto de panel de expertos seleccionados y formulación de preguntas para recomendaciones, elaborando un cuestionario con matriz para la consolidación y análisis de los resultados en Google Forms (Google LLC, Mountain View, CA, USA). Para calificar las preguntas se estableció una escala de 1 a 9, (definiendo 1 como completamente en desacuerdo y 9 como completamente de acuerdo). Se definió consenso con medianas entre 1 y 3 (no recomendado), o entre 7 y 9 (recomendado). Las respuestas no consensuadas (medianas entre 4 y 6) serían llevadas a rondas subsecuentes de votación hasta lograr consenso, previa retroalimentación. Se aplicó una prueba piloto con tres especialistas para determinar la idoneidad del instrumento.
El grupo líder priorizó de manera autónoma las preguntas más importantes para poder promover la implementación de la clasificación molecular acorde al contexto colombiano con base en la revisión de la literatura. Adicionalmente, planteó un algoritmo diagnóstico para poner a consideración durante el consenso.
El grupo desarrollador estuvo conformado por un panel de 36 expertos seleccionados mediante muestreo por conveniencia, teniendo en cuenta representatividad dentro del campo según región geográfica del país y experiencia, convocando especialistas de diferentes regiones de Colombia. Se contactaron representantes de la Asociación Colombiana de Hematología y Oncología (ACHO), del Grupo Colombiano de Investigación en Ginecología Oncológica (G-CIGO), de la Asociación Colombiana de Ginecólogos Oncólogos (ACGO), de la Sociedad Colombiana de Patología (ASOCOLPAT), de la Asociación Colombiana de Médicos Genetistas (ACMGen) y de la Asociación Colombiana de genética Humana (ACGH).
Metodología del Consenso
El 2 de abril de 2022 se realizó la reunión presencial de consenso nacional en la ciudad de Bogotá D.C, Colombia. La metodología empleada fue una modificación de la técnica de grupo nominal. Se desarrollaron 5 etapas.
Etapa 1: se realizaron presentaciones magistrales, se expuso la evidencia científica basada en la revisión de la literatura descrita. Se detallaron los puntos de controversia para la implementación de la clasificación molecular a nivel nacional, partiendo de una propuesta inicial de algoritmo diagnóstico.
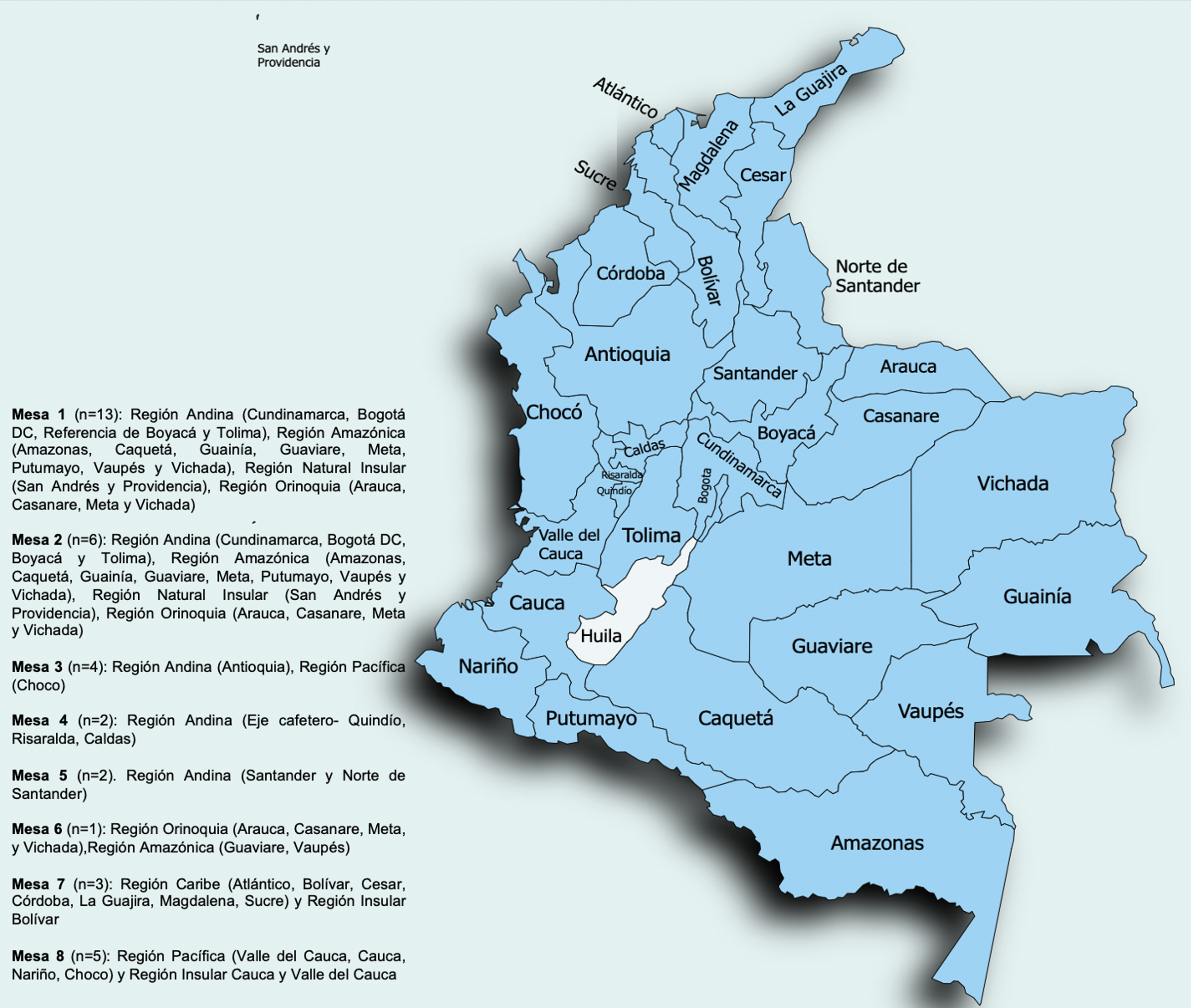
Etapa 2: Se establecieron 8 mesas de trabajo de acuerdo con la cobertura de atención de pacientes por regiones (Suplemento 1). En cada mesa se discutieron los diferentes pasos de la propuesta en términos de asertividad académica, factibilidad de ejecución, recursos tecnológicos, económicos y administrativos. Posteriormente se incitó al diálogo deliberativo con intervenciones abiertas por cada grupo regional, manifestando experiencias, observaciones, dificultades y alternativas según contexto. A su vez, se habilitó un tiempo de contraargumentos liderado por un facilitador del grupo líder.
Etapa 3: se pusieron a consideración del panel las preguntas estructuradas, permitiéndose modificaciones a las mismas hasta determinar las preguntas consensuadas para la votación (suplemento 2). Se envió el cuestionario en formato Google Forms a cada correo electrónico de los participantes mediante enlace de única respuesta, realizándose la primera ronda de votación.
Etapa 4: los expertos metodológicos (AF y JR) realizaron el análisis cuantitativo de las respuestas de los panelistas durante la reunión y se socializaron los resultados de la votación anónima en tiempo real en términos de mediana y rangos de votación. Todas las preguntas/recomendaciones fueron producto de "opinión de expertos", siendo cada una ratificada por el panel, terminando la reunión.
Etapa 5: a las 3 semanas se realizó segunda ronda de votación vía email de la pregunta no consensuada a través de la plataforma de Google Forms, con la misma modalidad de la primera ronda.
Finalmente, el grupo líder elaboró el manuscrito. Se envió el documento final a todos los participantes para obtener las últimas retroalimentaciones y confirmar la aceptación de este.
La síntesis de la información se realiza presentando primero la pregunta a contestar, luego la recomendación sin matiz de la fortaleza de esta. Las recomendaciones finales dan respuesta a las preguntas del consenso que se agrupan de acuerdo con su temática (como preguntas relacionadas) bajo una pregunta general, con el fin de concretar la información y minimizar el número de recomendaciones. Luego se presenta la justificación de la recomendación que surge del consenso de expertos y es soportada por las diferentes referencias derivadas de la búsqueda de la literatura, e incorpora consideraciones de tipo local que hacen los expertos. Por último, se presenta una subsección de "otras consideraciones" en la cual se describen las controversias o vacíos del conocimiento relativos a la evidencia que soporta la recomendación cuando hay lugar. Teniendo en cuenta el tipo de metodología aplicada a este consenso informal no se realizó evaluación del riesgo de sesgos, tampoco evaluación de la calidad metodológica, ni evaluación de la certeza en la evidencia. Adicionalmente, se presenta el ajuste del algoritmo diagnóstico propuesto basado en las recomendaciones finales del consenso.
En el material suplementario se presenta información sobre la distribución de las mesas de trabajo en el consenso de acuerdo con la cobertura de atención de pacientes a nivel nacional y el cuestionario en el formulario Google Forms votado por el grupo desarrollador.
Aspectos éticos. No se requirió la aprobación del Comité de Ética para este consenso, debido a que no se realizó ninguna intervención a sujetos de investigación humanos o animales.
RESULTADOS
Treinta y seis especialistas participaron en el consenso comprendiendo 12 patólogos oncólogos (33,3 %), 11 ginecólogos oncólogos (30,6 %), 6 oncólogos clínicos (16,7 %), y 7 genetistas (19,4 %).
Más del 80 % de los especialistas llevaban más de 6 años de práctica oncológica y de estos el 41,7 % se encontraban ejerciendo la especialidad por más de 10 años. El 50 % de los especialistas trabajan en Bogotá y Cundinamarca, donde se atienden pacientes remitidas de las regiones Andina, Insular, Amazonía y Orinoquia. El otro 50 % provenían de otras regiones del país (suplemento 1).
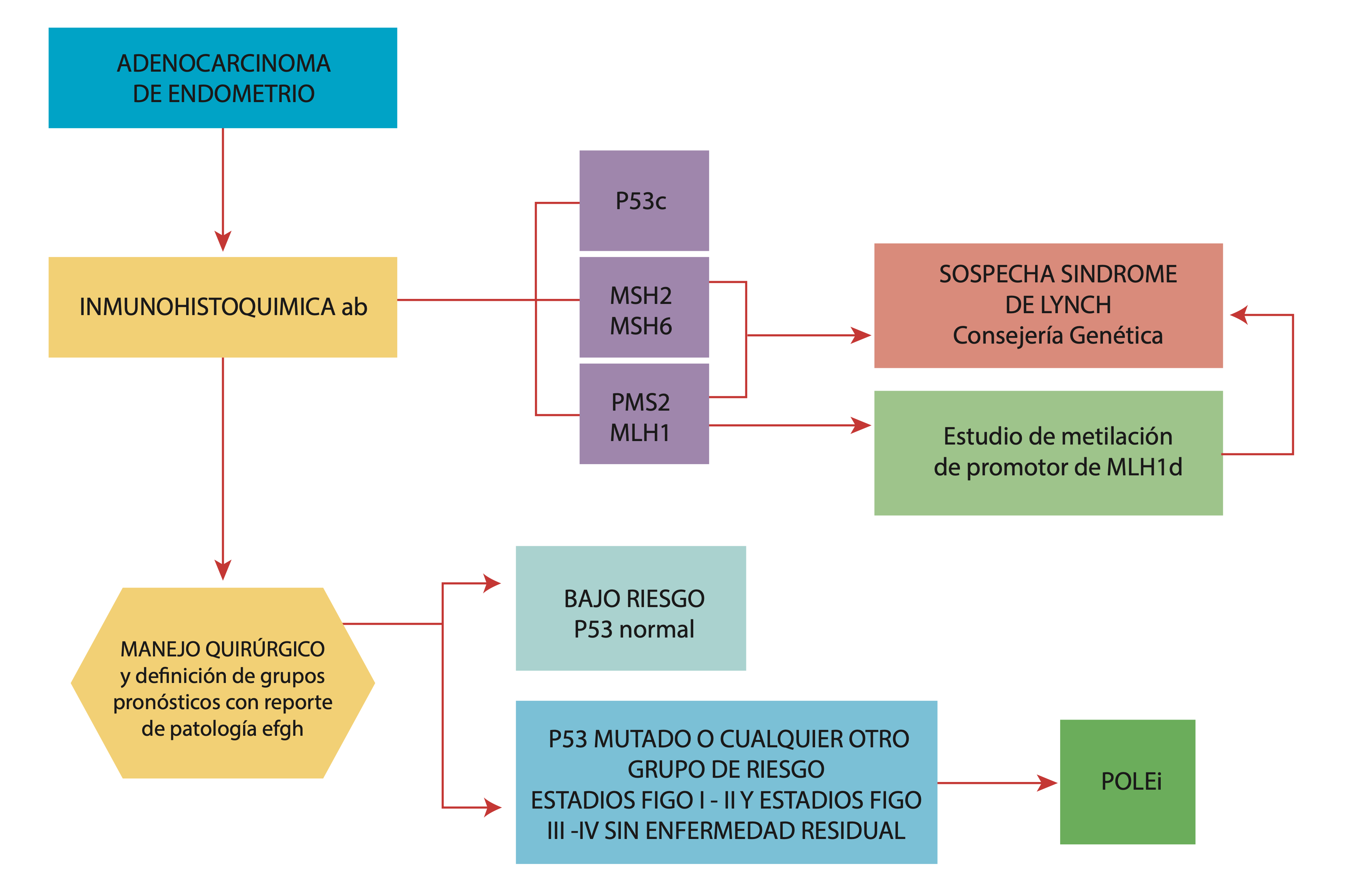
a. Patología en biopsia/legrado.
b. Solicitud por parte de médico general, ginecólogo y obstetra, o ginecólogo oncólogo (quien primero reciba reporte de patología biopsia/legrado) de 10 marcadores de inmunohistoquímica que incluirán los de la clasificación molecular y receptores de estrógenos y progestágenos. Los marcadores adicionales quedan a discreción del patólogo de ser requeridos para diagnóstico de subtipo histológico. Los resultados de los marcadores de inmunohistoquímica deben ser reportados de acuerdo con las recomendaciones de la CAP.
c. Si el patólogo identifica sobreexpresión de p53 debe realizar y reportar inmediatamente HER2 por inmunohistoquímica de acuerdo con las recomendaciones de la CAP.
d. Idealmente solicitud por parte de especialista en genética; no obstante, en regiones donde no haya disponibilidad oportuna de la especialidad puede ser solicitado por otras especialidades.
e. Debe fijarse la pieza uterina en formol inmediatamente se realice exéresis en un recipiente suficiente, tapando la totalidad de la pieza con formol.
f. Se recomienda que los patólogos incluyan en el reporte de patología todos los ítems indicados por la CAP;
g. Por ginecólogo oncólogo al revisar la patología; otro especialista del área oncológica en caso de recibir el informe de patología de primeras
h. Se puede realizar el estudio de inmunohistoquímica en la pieza de histerectomía en caso de no disponibilidad de la biopsia inicial, cambio abrupto en la histología, componente nuevo mixto o material inicial insuficiente o insatisfactorio para la clasificación.
i. Sujeto a disponibilidad del recurso.
Fuente: Autores.
Figura 1 Algoritmo diagnóstico para la clasificación molecular cáncer de endometrio.
Inicialmente, se habían priorizado once preguntas, de las cuales se descartaron dos, se ajustaron cinco, y finalmente se adicionaron ocho, esto con el fin de que cada votación fuese muy específica; quedando al final 17 preguntas consensuadas para la votación (suplemento 2).
En la primera ronda de votación hubo una participación del 100 % y se obtuvo acuerdo en 16 de las 17 preguntas. La pregunta número 17 requirió una segunda ronda de votación, logrando participación del 86,1 % (n=31) del panel convocado, obteniendo consenso en la recomendación.
Basados en las recomendaciones que se presentan a continuación se propone seguir un algoritmo para el diagnóstico molecular en el país (figura 1) donde se realiza inicialmente inmunohistoquímica en paralelo a la biopsia/legrado endometrial de todas las pacientes con cáncer de endometrio independientemente del estadio. Posteriormente, se clasifican las pacientes según los grupos pronósticos ESGO/ESTRO/ESP (European Society of Gynaecological Oncology/European Society Jor Radiotherapy and Oncology/European Society of Pathology) (27), de acuerdo con la patología quirúrgica definitiva, definiendo solicitar el POLE a todos los casos con p53 mutado o grupos de riesgo pronóstico intermedio, alto-intermedio y alto.
RECOMENDACIONES
Pregunta 1
¿En qué casos y cómo se recomienda realizar la clasificación molecular en el cáncer de endometrio? Preguntas relacionadas evaluadas en el consenso
1.1. ¿Se recomienda la clasificación molecular en todos los carcinomas de endometrio? Votación del consenso (mediana 9;7-9).
1.2. ¿Teniendo en cuenta la accesibilidad y rendimiento, se recomienda que se usen los marcadores de inmunohistoquímica como resultados subrogados del perfil molecular inicialmente propuesto en la clasificación del TCGA? Votación del consenso (mediana 9;7-9).
Recomendación 1
Se recomienda realizar la clasificación molecular en todos los carcinomas endometriales utilizando los marcadores de inmunohistoquímica como resultados subrogados del perfil molecular inicialmente propuesto en la clasificación del TCGA.
Justificación
Las sociedades europeas (ESMO, ESGO, ESTRO) y americanas (ASCO, SGO) han establecido guías de manejo basadas en el perfil molecular 27,28,33, por lo que es recomendado realizar dicho perfil en todos los cánceres de endometrio; aproximación que comparte el consenso de expertos.
Desde la clasificación en 1983 de los carcinomas endometriales en dos subtipos: estrógeno dependientes tipo 1 y estrógeno independientes tipo 2 5, el avance más importante ha sido la nueva clasificación molecular 9,11-13,15. Permite no solo una mejor división de la enfermedad en 4 grupos con pronóstico diferente, sino también la oportunidad de mejorar el abordaje terapéutico basado en el perfil molecular de cada grupo 8. Los resultados de estudios recientes con inmunoterapia soportan la importancia de los biomarcadores moleculares para clasificar los carcinomas endometriales con el propósito de refinar el manejo oncoespecífico y evitar el sobre y subtratamiento 34-38.
El uso de los marcadores de inmunohistoquímica es considerada como la aproximación adecuada teniendo en cuenta la alta concordancia entre pruebas, permitiendo clasificar pacientes con cáncer de endometrio en los cuatro subtipos moleculares clínicamente relevantes antes mencionados, derivados de la popular clasificación ProMisE 9,11-13,15. El estudio de inmunohistoquímica tiene aplicación en la práctica clínica de rutina para evaluar la expresión proteica de MMR y p53 como resultados subrogados de alteraciones a nivel genómico 20,21,39,40. La concordancia entre la expresión de la proteína p53 y las mutaciones del gen TP53 es del 92 y el 95 %, siendo reproducible y, por lo tanto, pudiendo brindar buen rendimiento como clasificador 20-23. La falta de expresión de proteínas MLH1, MSH2, MSH6 y PMS2 por inmunohistoquímica ha demostrado una sensibilidad y especificidad de 83 a 91 % y de 83 a 89 %, respectivamente, para el diagnóstico de dMMR, y uno de los beneficios adicionales es que puede guiar los estudios germinales hacia un gen específico 41,42. Para la evaluación de mutaciones POLE no existe un marcador subrogado por esta técnica 41.
Pese a que estos rendimientos no son perfectos, los cuatro subgrupos moleculares, aunque no idénticos, son análogos a los del TGCA, y han demostrado ser igualmente pronósticos en términos de supervivencia 13; por lo que este abordaje representa el mejor método disponible, habiéndose adoptado en la clínica a nivel mundial al ser más sencillo y menos costoso 13,26-28.
El panorama colombiano confiere unos retos específicos; este es un país carente de recursos en salud en general, con inequidad en acceso al sistema de salud, limitación de remisiones oportunas, tiempos de diagnóstico e inicios de tratamiento muy prolongados 43. Por todo lo anterior, es conveniente que se implemente una clasificación que pueda utilizar recursos ya ampliamente disponibles en el país como la inmunohistoquímica 44,45, no solo ahorrando recursos sino también facilitando el trámite administrativo.
Otras consideraciones
Algunos autores no comparten esta aproximación, proponen abordajes que plantean el ahorro máximo de recursos, enfocándose solo en realizar pruebas de clasificación molecular en pacientes con cáncer de endometrio que puedan beneficiarse de un cambio potencial en la conducta terapéutica adyuvante actual 46,47.
Es importante anotar que en las regiones en las cuales no estén disponibles los recursos para hacer la clasificación molecular, la clasificación de riesgo que se debe utilizar es la clasificación basada en los criterios FIGO y los criterios histológicos 6,27,28. La ESMO recomienda que, en esta fase de transición clasificatoria, en tanto existan estas dos formas de clasificación, conviene especificar el sistema de clasificación utilizado, proponiendo que en tumores en los cuales no es posible realizar el perfil molecular completo se especifiquen como cánceres endometriales no especificados (EC not otherwise-specified EC-NOS)28.
Pregunta 2
¿Cuál es la estrategia de testeo recomendada para la clasificación molecular?
Preguntas relacionadas evaluadas en el consenso
2.1. ¿A nivel nacional se recomienda iniciar la estrategia secuencial de testeo por los marcadores de inmunohistoquímica en todas las pacientes, y definir la solicitud del POLE (si se encuentra disponible) de forma diferida de acuerdo con la clasificación de riesgo basado en la pieza quirúrgica? Votación del consenso (mediana 9; 2-9).
2.2. ¿Se recomienda solicitar simultáneamente los marcadores de inmunohistoquímica p53, MLH1, MSH 2, MSH6 y PMS2? Votación del consenso (mediana 9; 3-9).
Recomendación 2
Se recomienda la estrategia secuencial de testeo iniciando por los marcadores de inmunohistoquímica (p53, MLH1, MSH 2, MSH6, PMS2) simultáneamente en todas las pacientes, y definir la solicitud del POLE (si se encuentra disponible) de forma diferida, de acuerdo con la clasificación de riesgo basado en la pieza quirúrgica.
Justificación
Definir la estrategia de testeo requiere un análisis académico, de factibilidad administrativa, logística, económica y de oportunidad de acuerdo con el contexto presente en el SGSSS colombiano. Se busca maximizar la implementación del algoritmo propuesto (figura 1).
La decisión de realizar un testeo secuencial que inicia con los marcadores de inmunohistoquímica radica en dos razones fundamentales: la primera, que la inmunohistoquímica se encuentra disponible en muchos lugares en el orden nacional, permitiendo una implementación más fácil y efectiva a corto plazo; la segunda, se debe dejar la solicitud de POLE de acuerdo con el grupo de riesgo de la paciente con la patología definitiva de la pieza quirúrgica para minimizar costos (ver siguiente recomendación).
En cuanto a la inmunohistoquímica, si bien las estrategias de solicitud de marcadores en secuencia propuestas por otros grupos (Imboden, Betella) podrían ahorrar el gasto de cada marcador 46,47, se consideró una estrategia poco práctica para el país, pues ya se encuentra instaurado a nivel nacional que la solicitud de la inmunohistoquímica se realiza usualmente por bloques de marcadores con costos relativamente fijos (lo que sería difícil de modificar). Además, se debe tener en cuenta que pedir estas pruebas en secuencia aumentaría el número de citas médicas requeridas, trámites administrativos y tiempos de resultados que también en conjunto podrían implicar mayor coste global.
Por tanto, es más eficiente en nuestro contexto la inmunohistoquímica en simultáneo o paralelo, pues desde el punto de vista logístico y administrativo permitiría una adecuada implementación a corto plazo de la clasificación molecular.
En concordancia con lo anterior, la reciente publicación de Talhouk et al. establece una clasificación molecular selectiva (ProMisE-S), solicitando inmunohistoquímica para MMR y p53 desde la biopsia inicial en todos los casos bajo los mismos argumentos mencionados 48.
Otras consideraciones
Desde la incorporación de la clasificación molecular por las sociedades internacionales más relevantes, se han discutido diferentes estrategias de testeo. Tanto la guía del National Comprehensive Cancer Network (NCCN) como la guía de ESMO (European Society for Medical Oncology) recomiendan el algoritmo secuencial partiendo de POLE 26,28,29. De esta forma, se clasifican las pacientes según el subtipo molecular que dictamina el pronóstico, sin necesidad de correr todas las pruebas, pero esto implica la realización de POLE en todos los casos con el consecuente alto costo. Tanto la ESMO como la ESGO/ESTRO/ESP de 2020 son claras en que idealmente el perfil molecular debe realizarse completo a todos los pacientes para conocer los clasificadores múltiples, pero esta última aclara que podría omitirse la realización de POLE en algunos casos (ver siguiente recomendación) 27,28.
Al centrarse específicamente en los marcadores de inmunohistoquímica para MMR, la guía europea propone como alternativa costo efectiva un estudio simplificado realizando primero PMS2 y MSH6, y solo si hay anormalidad realizar MLH1 y MSH2 27. No obstante, como se mencionó previamente, esto carece de practicidad en nuestro contexto. El planteamiento de Imboden et al., también supone una economía máxima de recursos, al realizar inmunohistoquímica para proteínas MMR solo en histología endometrioide p53abn (7.7% de pacientes) 46 . Sin embargo, es la visión del consenso que todos los casos de cáncer endometrial deben ser sometidos a testeo MMR, ya que la dMMR es uno de los marcadores predictivos de buena respuesta a terapias dirigidas (target e inmunoterapia) tanto en primera línea como en recurrencia, lo que comparten Betella et al. 47 . Además, estos pacientes tendrían indicación de evaluación para síndrome de Lynch, y el estado MMR puede definir adyuvancias clásicas diferenciales 38,49-52.
Respecto a la inmunohistoquímica para p53, al no ser realizada en subtipos no endometrioides y solo realizar POLE como sugiere Imboden et al., se desconocería la importancia de esta para definir pruebas adicionales en estudios que determinan terapias target (anticuerpos monoclonales, ARID1a, mTOR, entre otros) 46. Además, el ahorro teórico de 17,1% en la inmunohistoquímica para p53, según Imboden, sería realmente menor, considerando que este marcador es frecuentemente necesario para la subclasificación histológica en cánceres de alto grado 46. Esto último tampoco es tenido en cuenta por Betella et al., quienes sugieren que al realizar p53 exclusivamente en estadios tempranos disminuye la necesidad del test en un 27 %, pues el marcador no define conducta terapéutica para estadios tardíos 47.
3. Pregunta general
¿En qué situaciones clínicas está indicado solicitar el POLE?
Preguntas relacionadas evaluadas en el consenso
3.1. ¿Se recomienda que sea el ginecólogo oncólogo quien solicite el POLE (si se encuentra disponible) desde que se recibe el informe de patología quirúrgica? Votación del consenso (mediana 9; 1-9).
3.2. ¿Se recomienda que el análisis de mutación de POLE (si se encuentra disponible) se omita solo en pacientes con carcinoma endometrial de bajo riesgo según clasificación ESGO? Votación del consenso (mediana 9; 1-9).
3.3. ¿Se recomienda solicitar POLE en todos los cánceres endometriales de estadio I-II, excepto los de bajo riesgo? Votación del consenso (mediana 9; 1-9).
3.4. ¿Se recomienda solicitar POLE en todos los cánceres endometriales de estadio III-IV sin enfermedad residual? Votación del consenso (mediana 9; 1-9).
3.5. ¿Se recomienda que la clasificación molecular en histología no endometrioide se realice solicitando únicamente POLE (sin inmunohistoquímica)? Votación del consenso (mediana 2; 1-9).
Recomendación 3
Se recomienda que sea el ginecólogo oncólogo quien solicite el POLE (si se encuentra disponible) de acuerdo con el reporte de patología definitivo. Esta prueba se debe solicitar a todos los cánceres endometriales de estadio I-II, excepto los de bajo riesgo (estadio IA endometrioide de bajo grado sin invasión linfovascular p53 normal) y estadio III-IV sin enfermedad residual, sin afectar la solicitud de los marcadores moleculares subrogados por inmunohistoquímica de acuerdo a la histología. El consenso propone que la solicitud del POLE se realice posterior a la inmunohistoquímica y de acuerdo con la clasificación del riesgo según las categorías establecidas por la guía ESGO/ESTRO/ESP del 2020 27.
Justificación
Usualmente, durante el control postquirúrgico el ginecólogo oncólogo es quien tiene el primer acceso al reporte patológico definitivo del espécimen quirúrgico tras la cirugía oncológica. Por esto, se propone que sea este especialista quien debe hacer primero la clasificación del riesgo para poder determinar si se debe solicitar el POLE, y proceder con el trámite para disminuir demoras en la formulación de adyuvancia. En la situación en que sea otro especialista del área oncológica quien reciba de primeras el informe de patología, sería necesario que este efectuara la categorización del riesgo y estableciera la solicitud de la prueba.
Ahora bien, es claro que reducir el número de pacientes a quienes se les realiza POLE generará el mayor impacto en términos de disminución de costos, pero decidir a quién no realizar la prueba requiere un análisis profundo. Tener una mutación en POLE se asocia con un muy buen pronóstico de base. Para estadios tempranos, de las 143 pacientes con cáncer endometrial en estadio I de la cohorte de Vancouver,12 eran POLEmut (8,4 %) y 5 tenían histología grado 3 de alto riesgo (42 %); sin embargo, ninguna paciente de este grupo presentó recaída o muerte durante 5 años de seguimiento, independientemente de la adyuvancia 11. Igualmente, la iniciativa TransPORTEC mostró que 14 de 116 pacientes (12 %) que eran POLEmut, tuvieron una supervivencia global (OS) a 5 años del 93 % 19. Bajo estos resultados pronósticos favorables, el POLE define qué pacientes con estadios I y II de riesgo intermedio a intermedio alto no se benefician de tratamiento adyuvante con quimio o radioterapia, consolidándose como una herramienta clave para el de-escalamiento terapéutico 27,49-51.
Sin embargo, en los adenocarcinomas de bajo riesgo (estadio IA endometrioide de bajo grado sin invasión linfovascular p53 normal según la guía ESGO/ESTRO/ESP 2020) 27 que oscila entre el 37,2 % y 42,4 % de todos los casos de cáncer endometrial, la realización del POLE solo brindaría información pronóstica, careciendo de valor como determinante terapéutico; pues independientemente del POLE, no está indicada ningún tipo de adyuvancia per se en esta categoría, dada una supervivencia relativa a 5 años por arriba del 94,6 % 27,46,47,53.
Es por esto que el consenso considera abstenerse de realizar POLE en este grupo. Lo anterior es apoyado por los grupos de Imboden y Betella 46,47.
Al enfocarnos en la enfermedad localmente avanzada, el consenso considera la solicitud de POLEmut en estadio III-IVA sin enfermedad residual (al igual que en carcinoma de células claras con invasión miometrial estadio I-IVA dMMR o NSMP), teniendo en cuenta que no se disponen de datos suficientes para asignar a estos pacientes a un grupo de riesgo pronóstico en la clasificación molecular; este concepto es compartido por Concin et al. 27. En estos escenarios se recomiendan registros prospectivos, ya que el estudio molecular de POLE en estos pacientes, permitirá en un futuro conocer con claridad su pronóstico y poder asignar categorías de riesgo, y quizás definir cambios terapéuticos 27. Para estadios III-IV con enfermedad residual (avanzados - metastásicos) no se recomienda realizar POLE, ya que independientemente del mismo, son un grupo que indefectiblemente requerirá adyuvancia o tratamiento paliativo médico.
Como consideración final, si no es posible realizar el POLE en los casos recomendados por falta de disponibilidad, se estará dejando de diagnosticar al grupo de mejor pronóstico y, por tanto, la clasificación de los grupos moleculares en ese escenario siempre estará incompleta. No se desconoce, de todas formas, que actualmente el POLE se sigue teniendo que realizar mediante estudios de secuenciación genómica costosos, y aun su realización implica laboratorios especializados no fácilmente disponibles en el país. No obstante, se espera que ante una demanda cada vez mayor, más laboratorios dispongan de las plataformas necesarias con la consecuente disminución de costos que permitan su implementación a nivel nacional.
Otras consideraciones
Algunas guías sugieren que el POLE debería realizarse en todos los casos como marcador pronóstico 26-28. No obstante, aunque se están desarrollando pruebas SNaPshot para POLE que son más sencillas y económicas, el estudio molecular de dicho gen continúa teniendo costo elevado para la población colombiana, limitando su implementación generalizada 54.
Otros investigadores están de acuerdo en limitar la realización del POLE, pero con propuestas que difieren a la recomendación del consenso actual. Por ejemplo, el algoritmo ProMisE-S es prácticamente una propuesta igual al ProMisE, con la diferencia que las pacientes con dMMR se salen de la categoría de bajo riesgo y, por tanto, requieren POLE, lo que va en contravía con ESGO/ESTRO/ESP 27,48. La literatura muestra datos controversiales del pronóstico de MSI en bajo riesgo 40,55-57, requiriéndose estudios específicos en este pequeño subgrupo de pacientes para determinar la aproximación más apropiada; por lo tanto, el consenso mantiene la definición de bajo riesgo de la guía ESGO/ESTRO/ESP 2020) 27.
Por otra parte, Imboden y Betella et al. proponen no realizar ninguna clasificación molecular incluido el POLE en ningún estadio III o IV (excepto MMR en la propuesta de Betella), ya que actualmente estos estadios se siguen tratando con quimioterapia y radioterapia a pesar de la clasificación molecular, lo que proporcionaría una reducción absoluta de 67 % en la realización del estudio genético (teniendo en cuenta la no solicitud en estadio IA bajo riesgo); siendo una reducción de 19,6 % más comparada con la conducta recomendada de este consenso 46,47. Sin embargo, esta propuesta desconoce las posibilidades de manejos de segunda línea en pacientes P53abn que tengan sobreexpresión de HER2 y alteraciones de la recombinación homóloga, así como la posibilidad de manejos con radioterapia única en dMMR, el uso de la inmunoterapia en primera y segunda línea y los diagnósticos de síndrome de Lynch en 10 % de este grupo. También descarta la posibilidad a futuro de de-escalar el tratamiento en pacientes POLE en estadios de alto riesgo, según resultados esperados de estudios en curso y en desarrollo 49, e igualmente impide la evaluación de clasificadores múltiples que permiten asignar los grupos moleculares de manera precisa 24.
Además, el grupo de la universidad de Karolinska (Imboden) propone realizar POLE sin los otros marcadores moleculares en los carcinomas no endometrioides en los estadios I y II 46. Sin embargo, esta última iniciativa resta la importancia de clasificar el 33 % de pacientes que comprenden histología no endometrioide 14. Si bien esta propuesta de división histológica para la solicitud de pruebas moleculares fue parte crítica en la discusión del consenso, conllevando a dos rondas para la recomendación actual. Parte de los argumentos adicionales por los cuales se llegó a un consenso en contra fueron: i). Que cuando se realiza únicamente POLE en los estados I y II se asume que el resto son P53abn (lo cual no es cierto); ii). Que en la histología no endometrioide se desconoce la posibilidad de diagnóstico de MMR deficitario (entre 8,3 y 25,7 % de pacientes) y de NSMP 18, que tienen manejos y pronósticos diferentes; y iii). la posibilidad de establecer subgrupos en cada grupo molecular. Teniendo en cuenta todo lo anterior, el consenso no recomienda seguir esta estrategia.
Pregunta 4
4.1. ¿Qué otros marcadores de inmunohistoquímica convendría realizar simultáneamente?
4.2. ¿Se recomienda solicitar inicialmente receptores hormonales en conjunto con los otros marcadores de inmunohistoquímica para pacientes con cáncer endometrial? Votación del consenso (mediana 9; 1-9).
4.3. ¿Se recomienda la realización de HER2 en pacientes con p53abn, independiente del estadio? Votación del consenso (mediana 9; 5-9).
Recomendación 4
Se recomienda realizar simultáneamente con los otros marcadores de inmunohistoquímica la prueba para receptores hormonales en todas las pacientes con cáncer endometrial y el HER2 en las pacientes con p53abn.
Consideración de buena práctica: el patólogo debe realizar la prueba de HER2 de inmediato en los tumores con p53abn, aprovechando el bloque de marcadores de inmunohistoquímica ya autorizado.
Justificación
Conocer el estado de los receptores hormonales en cáncer de endometrio es útil, pues su positividad confiere mejores desenlaces, por lo que el colegio americano de patólogos - CAP (College of American Pathologists) y las guías NCCN recomiendan su evaluación 26,58,59. Recientemente, Vermij et al. describieron que el grupo NSMP podría contener subgrupos de clasificación, en donde aquellos que presentan positividad de ambos receptores hormonales son de mejor pronóstico, exhibiendo características más favorables como histología endometrioide de bajo grado sin sobreexpresión de la molécula de adhesión celular L1 (L1CAM) 60. Además, los receptores hormonales ayudan a seleccionar pacientes que podrían beneficiarse de hormonoterapia, la cual es precisamente más efectiva cuando hay expresión tumoral de estos 6,61.
Respecto al marcador HER2 (ERBB2), vale la pena recordar que es una tirosina kinasa involucrada en el crecimiento, supervivencia y diferenciación celular. ERBB2 se encuentra amplificada, aproximadamente, entre el 25 y 45 % de los carcinomas serosos uterinos de alto grado, y se correlaciona con peor pronóstico 62,63. Cabe resaltar que HER2 guarda más relación estrecha con el subgrupo P53abn que con un subtipo histológico particular 64,65. Análisis retrospectivos informan que estos cánceres HER2 positivos, incluso en estadio temprano, presentan más recurrencias (50,0 % vs 16,9 %; p = 0,001), peor supervivencia libre de progresión (PFS) (aHR 3,50, 95 %CI 1,84-6,67) y sobrevida global (SG) (aHR 2,00, 95 %CI 1,04-3,88) en comparación con los HER2 negativos 66. Adicionalmente, la detección de pacientes HER2 positivo confiere una oportunidad para el uso de terapias dirigidas. Es así como un estudio fase II con 61 pacientes con carcinoma seroso de alto grado, HER2 positivos, estadio III -IV informa que los pacientes que recibieron quimioterapia más trastuzumab tuvieron mejor PFS (12,9 vs 8,0 meses; HR = 0,46; 90 % CI, 0,28-0,76) y OS (29,6 vs 24,4 meses; HR = 0,58; 90 % CI, 0,34-0,99) en comparación con el grupo sin trastuzumab 67. Además, el ensayo DESTINY-PanTumor02, evaluó el tratamiento con trastuzumab deruxtecan (T-DXd) demostrando tasas de respuesta del 84,6 % en pacientes con carcinoma endometrial con expresión de Her2 3+ por inmunohistoquímica y del 47,1 % en Her2 2+ por inmunohistoquímica 68. Dicha terapia es actualmente recomendada por la NCCN 26.
Teniendo en cuenta nuevamente la realización de inmunohistoquímica por bloques de marcadores en nuestro país, y que tanto los receptores hormonales como el HER2 han demostrado ser también marcadores pronósticos y predictivos, se considera conveniente incluir desde el inicio su realización junto con los otros marcadores moleculares recomendados en esta guía, con el fin de favorecer un diagnóstico oportuno y evitarle sobrecostos al sistema.
Además, no es infrecuente que en nuestro medio se pierda la oportunidad de realizar revisión de placas e inmunohistoquímica a posteriori, siendo así el momento del diagnóstico la mejor oportunidad para obtener esta información en el país.
Otras consideraciones
Con la revolución que ha generado la clasificación molecular, y el gran potencial predictivo de la misma, se encuentran en curso ensayos clínicos que evalúan adyuvancia de acuerdo con el perfilamiento molecular. De hecho, el estudio RAINBO contiene en uno de sus brazos la evaluación de respuesta al manejo con hormonoterapia en el subgrupo molecular NSMP, ratificando la importancia de realizar estos marcadores de inmunohistoquímica adicionales 49.
Pregunta 5
¿En qué muestra histológica debe realizarse la clasificación molecular y cómo debe reportarse?
Preguntas relacionadas evaluadas en el consenso
5.1. ¿Se recomienda que los marcadores de inmunohistoquímica (p53, MLH1, MSH2, MSH6 y PMS2) sean realizados en una adecuada muestra inicial de biopsia endometrial o legrado si esta se encuentra disponible? Votación del consenso (mediana 9; 6-9).
5.2. ¿Se recomienda en caso de discrepancia de la histología de la biopsia endometrial/legrado vs pieza quirúrgica, o inmunohistoquímica inicial no concluyente, considerar repetir el perfil molecular? Votación del consenso (mediana 9 7-9).
5.3. ¿Se deben reportar los marcadores de inmunohistoquímica en el resultado de patología de acuerdo con las recomendaciones del College of American Pathologists (CAP)? Votación del consenso (mediana 9; 7-9).
Recomendación 5
Se recomienda que los marcadores de inmunohistoquímica (p53, MLH1, MSH2, MSH6 y PMS2) se realicen en la biopsia/legrado endometrial inicial cuando la muestra es adecuada y está disponible. En caso de inmunohistoquímica inicial no concluyente o discrepancias histológicas entre la patología inicial y definitiva, se recomienda repetir el perfil molecular en la patología quirúrgica. Los marcadores de inmunohistoquímica deben reportarse en el informe de patología de acuerdo con las recomendaciones del CAP, independientemente del tipo de muestra.
Justificación
La clasificación molecular realizada en especímenes de histerectomía tiene un alto grado de concordancia con las muestras obtenidas en biopsias o curetajes endometriales (kappa de 0,86; IC 95 % 0,72-0,93) 69,70. Teniendo en cuenta esta alta concordancia, se considera que es conveniente contar con los resultados de inmunohistoquímica desde un inicio, toda vez que brinda información valiosa. Incluso este perfilamiento inicial puede ser el único material de pacientes que no puede someterse a una histerectomía 70.
Adicionalmente, de acuerdo a la experiencia de los patólogos participantes del consenso, ocasionalmente pueden existir problemas en la fijación y almacenamiento de especímenes quirúrgicos grandes como el útero, generando artefactos o tejido inadecuado para evaluación; mientras que en la mayoría de los casos el tejido proveniente de biopsia o curetaje endometrial se encuentra bien preservado, lo que apoya aún más la recomendación de realizar la inmunohistoquímica en este último tipo de espécimen. Sin embargo, se puede realizar el estudio en la pieza de histerectomía en caso de no haber disponibilidad de la biopsia inicial o si el tejido inicial fue insuficiente o insatisfactorio para la clasificación.
Además, se recomienda repetir el perfil molecular en aquellos casos en donde el estudio inicial de inmunohistoquímica no fue concluyente, bien sea por las características del tejido inicial (mala calidad del tejido, pobre representación del tumor) o por problemas de la prueba de inmunohistoquímica. También se debe repetir en los casos donde haya discrepancia en la histología de la patología inicial y la pieza quirúrgica, ya que podría haber representación de solo un componente en tumores de histología mixta.
El CAP ha establecido unas guías claras de reporte de biomarcadores 58. En la actualidad, muchos de los reportes de inmunohistoquímica que se reciben en la práctica clínica no son uniformes y a veces tienen terminología imprecisa que dificulta la interpretación de los resultados. Por esto, es necesario que siempre se reporten los resultados con un sistema unificado, universal y completo que garantice la adecuada interpretación de estos.
Pregunta 6
¿Qué pruebas genéticas adicionales podrían ser requeridas de acuerdo con la clasificación molecular y cuándo debe remitirse a la paciente a genética?
Preguntas relacionadas evaluadas en el consenso
6.1. ¿En pacientes con alteración MLH1 y PMS2 se recomienda realización de estudio de metilación de promotor de MLH1? Votación de consenso (mediana 9; 7-9).
6.2. ¿Se recomienda que todas las pacientes con déficit de MMR sean enviadas a genética para descartar síndrome de Lynch? Votación de consenso (mediana 9; 5-9).
Recomendación 6
Se recomienda realizar estudio de metilación de promotor de MLH1 en pacientes con pérdida de expresión de MLH1 en la inmunohistoquímica acompañado o no de pérdida de expresión de PMS2. Todas las pacientes con déficit de MMR deben ser enviadas a genética para descartar síndrome de Lynch.
Justificación
Alrededor del 20 % de los cánceres endometriales no seleccionados tienen ausencia de una o más proteínas del complejo MMR (principalmente MLH1-PMS2).
Esta deficiencia de MMR puede corresponder a una alteración somática (debida principalmente a hipermetilación del promotor del gen MLH1 en un 70 % de los casos, o a dobles mutaciones somáticas en alguno de los genes del complejo MMR) o a síndrome de Lynch. Dada la alta tasa de hipermetilación de dicho gen, las guías internacionales como NCCN y Collaborative Group of the Americas on Inherited Gastrointestinal Cancer (CGA-IGC) recomiendan realizar la evaluación de metilación del promotor del gen MLH1 en los pacientes cuyos tumores tienen un patrón inmunohistoquímico de pérdida de expresión de MLH1 acompañado o no de pérdida de expresión de PMS2, con el fin de evaluar si se trata de una alteración somática (presencia de hipermetilación del promotor), lo cual descartaría síndrome de Lynch71,72. En los casos de pérdida aislada de expresión de PMS2 no hay indicación de realizar metilación de promotor MLH172.
De esta forma, la evaluación de proteínas MMR mediante inmunohistoquímica es una estrategia de tamización para síndrome de Lynch y se recomienda que estas pacientes sean remitidas a valoración por genética para definir la estrategia que permita confirmar/descartar este síndrome (estudio somático de metilación del promotor del gen MLH1 o estudio de mutaciones en línea germinal) 71. El profesional en genética es la persona ideal para hacer la evaluación de los síndromes de cáncer hereditario, debido a que realizará una evaluación completa de la historia familiar mediante la elaboración de un árbol genealógico, esto permitirá establecer si es necesaria la evaluación germinal y de cuáles síndromes (en ocasiones es pertinente hacer estudio simultáneo de múltiples síndromes de cáncer hereditario), y realizará un adecuado proceso de asesoramiento genético pre-test y post-test 71.
Otras consideraciones
Pese a que hacer un adecuado abordaje inicial a los síndromes de cáncer hereditario podría evitar sobrecostos (al evitar la solicitud de estudios germinales innecesarios actuales o evitar la necesidad de hacer estudios germinales complementarios futuros), en lugares de acceso limitado a la especialidad de genética, la solicitud de las pruebas para evaluación de línea germinal podría ser realizada por uno de los especialistas a los cuales la paciente tiene acceso.
Pregunta 7
¿Deben tomarse decisiones de adyuvancia basados en la clasificación molecular en la actualidad?
7.1. Preguntas relacionadas evaluadas en el consenso
¿Por el momento, se recomienda tener en cuenta la clasificación molecular, además de los criterios clásicos para la toma de decisiones de adyuvancia? Votación del consenso (mediana 9; 7-9).
Recomendación 7
Se recomienda tener en cuenta la clasificación molecular, además de los criterios histopatológicos clásicos para la toma de decisiones de adyuvancia, tal como los incorpora la clasificación de los grupos pronósticos de la guía ESGO/ ESTRO/ESP del 2020.
Justificación
La clasificación de los grupos pronósticos de la guía ESGO/ ESTRO/ESP del 2020 integra los criterios FIGO 2009, la clasificación histológica de la WHO y la clasificación molecular 27. Esta clasificación establece de forma adecuada los grupos pronósticos bajo la mejor evidencia disponible en la actualidad, y define de manera individualizada los diferentes grupos de tratamiento 27. Dicha clasificación modificó decisiones de adyuvancia en los estadios tempranos (I y II), las cuales han sido incorporadas a la práctica clínica actual, mientras que para los estadios avanzados (III y IV) la evidencia está en construcción y, por tanto, la misma clasificación mantiene las recomendaciones adyuvantes clásicas 27.
Otras consideraciones
Actualmente se llevan a cabo los estudios PORTEC4A, TAPER y RAINBO para definir los efectos de la adyuvancia en pacientes con cáncer endometrial basados en el perfil molecular, los cuales se espera que cambien los estándares de práctica clínica 49-51.
CONCLUSIONES
Es necesario implementar la clasificación molecular de cáncer de endometrio en la práctica clínica acorde al contexto colombiano, dado su valor pronóstico y posiblemente predictivo. Esto permitirá caracterizar a la población colombiana y ofrecer tratamientos guiados de manera individualizada. Se trata de un documento académico y no regulatorio.
Material suplementario
Material suplementario 1 Distribución de las mesas de trabajo de acuerdo con la cobertura de atención de pacientes por regiones en Colombia.
CONSENSO DIAGNOSTICO MOLECULAR EN CÁNCER DE ENDOMETRIO
El cáncer de endometrio es la segunda neoplasia más común de origen ginecológico a nivel mundial, después del cáncer de cuello uterino. Actualmente las decisiones clínicas están basadas en los hallazgos histológicos, la clasificación por estadios de la FIGO y a través de grupos de riesgo (ESMO), que combina estos dos.
El TGCA desarrolló la clasificación molecular para cáncer de endometrio, y definió 4 grupos moleculares: POLE mutado, Mistmach repair deficita rio (MMRdef) ó de inestabilidad microsatelital, P53 mutado (p53abn), perfil mutacional no específico (PMNS). Cada uno de los grupos tiene un impacto oncológico distinto. Esta clasificación busca definir grupos pronósticos de acuerdo a criterios más individualizados.
El objetivo de esta encuesta es analizar la factibilidad de implementar esta estrategia en el tratamiento del cáncer endometrial en Colombia, teniendo en cuenta la opinión de expertos de las diferentes áreas de diagnóstico y tratamiento de esta neoplasia.
Email*
Especialidad*
o Ginecología Oncológica
o Oncología Clínica
o Patología
o Genética
o Oncología Radioterápica
o Otra
Procedencia (Ciudad/es donde ejerce su práctica en el diagnóstico y tratamiento de pacientes con cáncer)*
Your answer
Años de práctica ( diagnóstico o tratamiento de pacientes con cáncer)*
o Menos de 1 año
o 1-5 años
o 6-10 años
o Más de 10 años
Antes de estas reuniones de consenso conocía la clasificación molecular del cáncer de endometrio?
o Si
o No
1. Se recomienda la clasificación molecular en todos los carcinomas de endometrio.*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
2. Teniendo en cuenta la accesibilidad y rendimiento, se recomienda que se usen los marcadores de inmunohistoquímica como resultados subrogados del perfil molecular inicialmente propuesto en la clasificación del TCGA*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
3. A nivel nacional se recomienda la estrategia secuencial de testeo iniciando por los marcadores de inmunohistoquímica en todas las pacientes, y definir la solicitud del POLE (si se encuentra disponible) de forma diferida de acuerdo a la clasificación de riesgo basado en la pieza quirúrgica.*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
4. Se recomienda solicitar inicialmente receptores hormonales en conjunto con los otros marcadores de inmunohistoquímica para pacientes con cáncer endometrial
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
5. Se recomienda solicitar simultáneamente los marcadores de inmunohistoquímica P53, MLH1, MSH 2, MSH6 y PMS2?*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
6. Se recomienda que los marcadores de inmunohistoquímica (p53, MLH1,MSH2,MSH6 y PMS2) sean realizados en una adecuada muestra inicial de biopsia endometrial o legrado si ésta se encuentra disponible*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
7. Se recomienda en caso de discrepancia de la histología de la biopsia endometrial/legrado vs pieza quirúrgica, o inmunohistoquímica inicial no concluyente, considerar repetir el perfil molecular*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
8. Se deben reportar los marcadores de inmunohistoquímica en el resultado de patología de acuerdo con las recomendaciones del College of American Pathologists (CAP)*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
9. Se recomienda que sea el ginecólogo oncólogo quien solicite el POLE (si se encuentra disponible) desde que se recibe el informe de patología quirúrgica.*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
10. Se recomienda que el análisis de mutación POLE (si se encuentra disponible) se omita solo en pacientes con carcinoma endometrial de bajo riesgo según clasificación ESGO*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
11. Por el momento, se recomienda tener en cuenta la clasificación molecular, además de los criterios clásicos para la toma de decisiones de adyuvancia.*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
12. Se recomienda que todas las pacientes con déficit de MMR sean enviadas a genética, para descartar síndrome de Lynch*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
13. En pacientes con alteración MLH1 y PMS2 se recomienda realización de estudio de metilación de promotor de MLH1
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
14. Se recomienda solicitar POLE en todos los cánceres endometriales de estadio I-II, excepto los de bajo riesgo*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
15. Se recomienda solicitar POLE en todos los cánceres endometriales de estadio III-IV sin enfermedad residual*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
16. Se recomienda realización de Her-2 en pacientes con p53 mutado, independiente del estadio*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
17. Se recomienda que la clasificación molecular en histología no endometrioide, se realice solicitando únicamente POLE (Sin inmunohistoquímica)*
Recuerde que 1 significa completamente en desacuerdo y 9 completamente de acuerdo
o 1
o 2
o 3
o 4
o 5
o 6
o 7
o 8
o 9
Comentarios finales