Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.33 suppl.1 Bogotá Oct. 2004
ARTÍCULO DE REVISIÓN
LA CORTEZA CEREBRAL MÁS ALLÁ DE LA CORTEZA
THE CEREBRAL CORTEX BEYOND THE CORTEX
Hernán José Pimienta J*
* Biólogo, profesor titular de la Universidad del Valle, director del Centro de Estudios Cerebrales de la Facultad de Salud, Universidad del Valle.
Resumen
Las funciones mentales superiores se asocian con la actividad de la corteza cerebral y su influencia sobre otras estructuras. Se acepta que la neocorteza evolucionó a partir de dos formas más primitivas: la arquicorteza (hipocampal) y la paleocorteza (olfatorio). El patrón de conectividad y citoarquitectura en las diferentes regiones neocorticales evoca estos ancestros.
La corteza cerebral se caracteriza por su diversidad estructural, neuroquímica y funcional, pero esto no debe usarse para considerarla con criterio reduccionista, sino como un sistema interactivo fundamentado en sus interconexiones. Se reconocen en la corteza cerebral dos tipos de neuronas: las excitatorias (glutamatérgicas, piramidales o eferentes) y las gabérgicas (interneuronas o de circuito local). Estos tipos celulares están interconectados y se disponen en arreglos tangenciales (laminares) y en columnas (translaminar). Las células glutamatérgicas y las gabérgicas reciben aferentes modulatorias de origen extrínseco a la corteza (dopaminérgicas, serotoninérgicas, colinérgicas, norepinefrínicas e histaminérgicas), que proceden de diferentes núcleos localizados, especialmente en el tallo cerebral. El tálamo provee a la corteza de aferentes glutamatérgicas excitatorias relacionadas con información sensorial, motora, visceral y emocional. Un sistema complejo de fibras córtico-corticales, comisurales y de proyección constituyen la salida de cada módulo hacia otras áreas corticales o estructuras subcorticales; de esta manera la corteza cerebral controla el pensamiento, la conciencia, la atención, la memoria, el lenguaje, actividad motora, las emociones, etc.
Palabras clave: corteza cerebral, evolución, conectividad, neurotransmisor, prefrontal.
Abstract
Higher brain functions depend upon the cerebral cortex. This structure influences directly or indirectly the activities of other brain regions and the spinal cord. It is widely accepted that the neocortex evolved in mammals from the archicortex (hippocampal cortex) and the paleocortex (olfactory cortex). Cytoarchitectonic and connectivity patterns evoke in different cortical areas these primitive ancestors. Structural, neurochemical and functional diversity characterizes the cerebral cortex but regional variations should not be used as criteria to visualize the cortex in a reductionistic perspective, instead interactions among different areas and subcortical structures offer a more rational approach.
There are two main types of cortical neurons: excitatory pyramidal or efferent and inhibitory interneurons or local circuit neurons. These neurons interconnect each other and are disposed in tangential (laminar) and columnar (translaminar) arrays. Glutamatergic and gabaergic neurons are connected by extrinsec modulatory afferents (dopaminergic, serotoninergic, cholionergic, norepinephrinic and histaminergic) coming from different subcortical sources specially the brainstem. Excitatory glutamatergic afferents originated in the thalamus provide inputs to the cortex related to sensory, motor, visceral and emotional information. A complex system of cortico-cortical, commissural and projection neurons determine the output of each cortical subunit or module to other cortical areas or subcortical structures. The cortex thus controls thought, consciousness, attention, memory, language, motor activity and emotions.
Key words: Cerebral cortex, prefrontal, evolution, cytoarchitecture, neurotransmitter.
Evolución citoarquitectónica: qué y dónde
La expansión de la corteza cerebral caracteriza la evolución de los mamíferos, de ahí que su alto grado de diferenciación estructural y funcional determine las más complejas conductas conocidas en el reino animal (1). Desde el punto de vista estructural y funcional, la corteza cerebral, a pesar de su heterogeneidad, constituye una entidad integrada con múltiples interacciones consigo misma y con el resto del sistema nervioso central (SNC). Con excepción del cerebelo, que recibe influencias corticales de forma indirecta, el resto de estructuras del SNC recibe axones originados en la corteza, de esta forma axones de la corteza forman parte integral de los núcleos de la base, núcleos basales telencefálicos, núcleos del diencéfalo, núcleos del tallo cerebral y de la médula espinal. Este sistema de proyecciones participa en los mecanismos de control y ejecución motora, actividades emocionales y cognitivas.
Una característica del proceso de encefalización de los mamíferos y, en particular, de los primates no humanos y el hombre es el predominio en número y complejidad de los circuitos córtico-corticales y la mayor influencia sobre estructuras subcorticales, lo cual se expresa en el carácter complejo y segregado de los circuitos córtico-estriado-tálamo-corticales, córtico-póntico-cerebelo-tálamo- corticales y córtico-aminérgico- corticales (Figura 1) (2),(3).

Estas interacciones garantizan el control de funciones tan complejas como la conciencia, el estado de ánimo, la motivación, el pensamiento, la memoria, el lenguaje, la creatividad, la espiritualidad, el altruismo, además de la percepción y programación ejecución y control de la actividad motora voluntaria. Considerado lo anterior, es simplista concebir las funciones corticales aisladas de las influencias que ella ejerce y a su vez recibe de estructuras subcorticales.
En la Figura 1A se ilustran las conexiones de la corteza cerebral con las estructuras subcorticales. Se resaltan las conexiones con las cortezas prefrontal y límbica. En la Figura 1B se ilustra en la parte superior una imagen en volumen del estriado. En la parte inferior se muestra un corte horizontal del mesencéfalo, donde se señalan el área tegmental ventral, la sustancia negra compacta y la sustancia negra reticulada.
Los estudios comparativos y de citoarquitectura evolutiva y conectividad de las últimas dos décadas han fortalecido la concepción de la corteza cerebral como un espectro estructural y funcional en el que se aprecian diferentes estadios de diferenciación, cuyos extremos son la alocorteza (arqui y paleocorteza) y la neocorteza (5),(6),(7),(8),(9). Aunque se aprecia una tendencia de conectividad preferencial entre zonas cronológicamente más próximas, se dan las interacciones entre los extremos del espectro, por ejemplo, la arquicorteza (representada por la corteza hipocampal) se conecta más profusamente con la amígdala y la corteza entorrinal; pero también, aunque en menor grado, proyectan axones hacia la neocorteza prefrontal, ubicada en el extremo de la tendencia evolutiva. De igual manera, sectores del área 46 del giro frontal medio, cuya estructura neuroquímica y de conectividad es fundamentalmente neocortical, tienden a conectarse con estructuras vecinas o distantes con similar o próximo grado evolutivo, pero igualmente pueden extender sus influencias a estructuras corticales más primitivas como la corteza entorrinal y piriforme (8). De esta manera la división entre alocorteza vinculada a lo emocional o límbico y la neocorteza como sustrato de la racionalidad es simplista y cualquier intento de desvincular lo emocional y lo racional transgrediría imperativos neurobiológicos.
Aunque de lo anterior es claro que no es posible en sentido estricto establecer parcelaciones de la corteza, con el fin de aproximarnos a su estudio es útil identificar las diferentes regiones dentro del espectro, así: la arquicorteza, que corresponde al hipocampo, el cual está conectado con zonas vecinas de transición que progresan hacia una mayor complejidad estructural, denominada periarquicorteza (ésta transita a mesocorteza y luego a proisocorteza para alcanzar la neocorteza, representada en un patrón laminar más obvio); la paleocorteza, que es de origen olfatorio, y las zonas adyacentes peripaleocorticales, que progresan en la superficie medial de los hemisferios cerebrales hacia sectores mesocorticales y proisocorticales para terminar en la neocorteza (Figura 2).

Tendencia arquicortical
La arquicorteza y sus zonas de transición incluyen al hipocampo propiamente dicho, es decir, el cuerno de Amón, el giro dentado y el subículo.
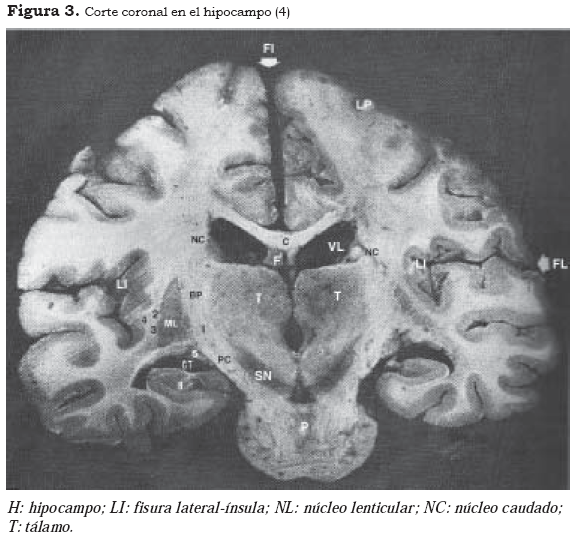
Las zonas de transición corresponden al gancho, al parahipocampo, a la corteza entorrinal y a la ínsula (Figura 3). La arquicorteza presenta una citoarquitectura con predominio de formas piramidales, la cual es reconocible en todos los estadios de su progresión hacia la neocorteza. La vertiente o tendencia arquicortical progresaría desde el hipocampo por la superficie medial del hemisferio en dirección a la cara lateral —que alcanza su máximo de diferenciación, en el caso del lóbulo frontal, en las regiones dorsales del giro frontal medio y en el parietal— hasta el precuneo, en el lobulillo parietal superior (10). Las funciones asociadas con esta tendencia se relacionan con la ubicación espacial, es decir, responderían a la pregunta básica del dónde (11).
Tendencia paleocortical
La paleocorteza propiamente dicha está representada por la corteza olfatoria, que evoluciona desde las regiones orbitofrontales, tomando un curso ventral, hasta alcanzar la superficie lateral de los hemisferios por su borde lateral; en el caso del frontal, termina en la región ventral del giro frontal medio y en el lobulillo parietal inferior. Su estructura histológica recuerda su origen granular y se le relaciona con la pregunta básica del qué.
Según los anteriores conceptos, cualquier sector de la neocorteza tiene un origen dual, por un lado, arquicortical (hipocampal-dónde) y, por el otro, paleocortical (olfatorio-qué). Para ejemplificar consideremos la corteza visual primaria, área 17, con la representación macular con predominio granular de ancestro paleocortical y especializada en la identificación precisa de los objetos, independiente de su posición, y con la representación de la visión periférica, con predominio piramidal de ancestro arquicortical y vinculada con la ubicación de los objetos en el espacio (11). En el caso de la visión, según Ungerleider, la vertiente dorsal relacionada con las funciones espaciales se extiende más allá del lóbulo occipital y continúa por las regiones dorsomediales del lóbulo parietal para alcanzar las áreas prefrontales dorsomediales. La vertiente visual inferior se origina en la corteza que representa la visión macular de la retina (discriminativa), progresa en complejidad hacia áreas ventrales del lóbulo occipital, transición temporooccipital, base del lóbulo temporal y regiones basolaterales del lóbulo frontal (12),(13). Esta vertiente está vinculada con la identificación de objetos desde las formas más elementales hasta las más complejas. Las proyecciones de las vertientes dorsal (espacial) y ventral (identificación de objetos), hacia las áreas prefrontales agregan el reconocimiento en contexto. Es necesario tener en cuenta que existen interacciones entre las vertientes del qué y el dónde a través de circuitos córtico-corticales. Estas interacciones progresan a través de las regiones multimodales.
Especialización funcional y diversidad cortical
Más allá de los mapas citoarquitectónicos clásicos de Brodman, Vogt y Vogt y Walker (14), los cuales han sido de gran utilidad como punto de referencia para los estudios estructurales, evolutivos, de conexiones, de neuroquímica y de imagenología funcional, es importante concebir a la corteza como un sistema ampliamente interconectado, por lo tanto, un sector de la corteza a través de sus axones se convierte en parte integral del sector inervado. Así, estrictamente dónde empieza y termina un área es imposible de definir.
En el siguiente cuadro se presentan de forma breve algunos detalles que deben tenerse en cuenta para reconocer un área cortical y de esta manera aproximarnos a su contribución al todo. Es necesario advertir que los datos acumulados para cada uno de los criterios se derivan de estudios en diferentes especies, especialmente roedores, primates no humanos y estudios neuropatológicos clínicos en el humano.
Características citoarquitectónicas
En lo esencial, las características citoarquitectónicas están descritas y son una herramienta fundamental para cualquiera que intente un estudio de la organización cortical en cualquier ámbito. Estos estudios ganan importancia en la medida en que se tengan en cuenta las relaciones de conectividad de las diferentes láminas corticales, para lo cual la información no es, al presente, suficiente (15),(16).
Patrón y distribución de interneuronas
Desde los tiempos de Ramón y Cajal, los principales tipos de interneuronas corticales se describieron con el método de Golgi. Se ha progresado notablemente en su sistema de conexiones, fundamentalmente con las células eferentes de la corteza (17),(18),(19). Sin embargo, se requiere obtener más información sobre los patrones de distribución laminar y las variantes interhemisféricas, fundamentalmente en las regiones asociativas y multimodales de la corteza. El estudio de esta distribución no es un capricho académico, sino que es fundamental en la comprensión de los mecanismos inhibitorios y desinhibitorios corticales y como base para identificar alteraciones asociadas con las enfermedades neurológicas o mentales (20).
Características de las células de proyección
Las características de las células de proyección son el patrón más común de neuronas corticales, por ello sobre ellas se ha acumulado más información y se dice que generan axones comisurales, asociativos y de proyección. Las proyecciones a distancia de estos sistemas son los más conocidos de la corteza; sin embargo, sus sistemas de colaterales recurrentes, que interactúan con otras células piramidales y con las interneuronas por su complejidad, han sido más difíciles de discernir, aunque se reconoce su papel en los procesos más complejos de interacción intracortical (21).
Características neuroquímicas que incluyen expresión de receptores
La inmunohistoquímica (nivel celular, microscopía de luz y confocal) y la inmunocitoquímica (nivel ultraestructural, microscopía electrónica) han permitido establecer peculiaridades neuroquímicas en subpoblaciones de neuronas corticales, conformadas por dos grandes grupos: piramidales glutamatérgicas y no piramidales gabérgicas. Algunas de ellas coexpresan neuropéptidos como sustancia P, neuropéptido Y, somatostatina y péptido intestinal vasoactivo. La expresión de proteínas atrapadoras de calcio, como calbindina, parvoalbúmina y calretinina, permite establecer subcategorías entre las interneuronas corticales e identificar patrones de organización y variantes regionales, que en el caso del cerebro humano aportan un conocimiento muy valioso (22). El desarrollo de anticuerpos contra subunidades de receptores para identificar su expresión en subtipos de células en diferentes áreas está permitiendo una aproximación para establecer mapas corticales de distribución de receptores. Esta identificación es fundamental para considerar los efectos de los fármacos utilizados en neurología y en psiquiatría.
Aferentes y eferentes de origen cortical
El conocimiento de aferentes y eferentes de origen cortical es fundamental para entender qué sectores influyen sobre un sector de la corteza, a la vez de cuál es la influencia de este sector sobre otros. De manera general se conocen las proyecciones de origen cortical en el humano por los estudios clásicos neuropatológicos y las disecciones post mórtem (6),(7)(23). Sin embargo, los datos más precisos de conectividad requieren el uso de trazadores retrógrados y anterógrados que utilicen marcadores inyectados y el posterior sacrificio del animal experimental. Por razones obvias esta aproximación no es practicable en el humano, por lo tanto, la información más detallada de conectividad resulta de la extrapolación a partir de modelos animales, pero esto en la actualidad no preocupa mucho, dado que se reconoce que los patrones de conectividad obedecen a un plan común en los mamíferos, y particularmente entre los primates. Ya nadie intenta buscar una característica de conectividad o celular propia del humano.
Aferentes y eferentes de origen talámico
Probablemente, los aferentes y eferentes de origen talámico son los circuitos más conocidos hacia la corteza, y aunque las interacciones son de tipo recíproco, se describen con mayor frecuencia las relaciones tálamo- corticales en desmedro de las córtico-talámicas, a pesar de ser éstas las más abundantes, es decir, hay más entradas de corteza al tálamo que del tálamo a la corteza. La razón para lo anterior es que el tálamo, por sus proyecciones corticales, provee el enlace hacia la corteza de las aferentes sensoriales y canaliza las influencias motoras hacia la corteza desde estructuras subcorticales como el pálido y el cerebelo y las influencias viscerales y límbicas recibidas desde el hipotálamo, el hipocampo y la amígdala (24). Las proyecciones córtico-talámicas que se originan en la lámina VI de la corteza han sido más difíciles de estudiar, pero su papel en la regulación de las entradas tálamocorticales y en la atención voluntaria representan un campo fundamental, para aproximarnos a la comprensión de las funciones mentales superiores y su disfunción en la enfermedad mental.
Origen de proyecciones hacia el estriado
Sin excepción, todas las áreas corticales, neocorticales, áreas de transición y límbicas proyectan axones al estriado, a través de un sistema de fibras denominado córtico-estriatal (2),(3). Un aporte fundamental en el conocimiento de este sistema es la identificación de los circuitos paralelos, que se segregan de acuerdo con su origen cortical, su proyección talámica y el retorno a la corteza frontal. De manera esquemática, para ilustrar señalemos tres ejemplos. Primero: el circuito motor, que se origina en las áreas motoras primarias y secundarias, alcanza al putamen, que es parte del estriado, y se proyecta tanto al pálido externo como al pálido interno (que a la vez conecta a los núcleos motores del tálamo ventral anterior y ventral lateral, que retornan a las áreas motoras de origen). La integridad de este circuito garantiza una función motora controlada y precisa. Segundo: el circuito cognitivo, que se inicia en las interacciones córtico-corticales. Las proyecciones de éstas al caudado, de éste a la sustancia negra reticulada y por proyecciones de ésta al núcleo dorsomediano del tálamo, canaliza la información hacia las áreas prefrontales laterales. Este circuito se considera fundamental en las funciones intelectuales y en la memoria operativa. Tercero: el circuito emocional, que se da por convergencia desde las áreas límbicas y paralímbicas (por ejemplo, cortezas orbitofrontal, entorrinal, amígdala y subículo del hipocampo) a las regiones más ventrales del estriado, que incluyen al núcleo acumbens, de éste a los núcleos intralaminares y regiones del núcleo dorsomediano del tálamo, retorna la información a las áreas de origen, especialmente la corteza orbitofrontal. Este circuito es fundamental en el control de impulsos y la regulación de la conducta y el balance de la actividad emocional. Existen otros circuitos paralelos identificados, como el circuito oculomotor, pero por brevedad no se incluyeron.
Es necesario advertir que el carácter 'paralelo' de estos circuitos no implica exclusión, sino que debe en tenderse como una actividad integrada de lo cognitivo, lo motor y lo emocional, con pesos que fluctúan en los diferentes individuos y desde diferentes circunstancias.
Relación con estructuras límbicas
Algunos sectores de la corteza en sí son estructuras pertenecientes al sistema límbico, como el giro cíngulo y las zonas adyacentes vinculadas a la motivación y a la afiliación, neurobiológicamente entendida como identificar al grupo filial al que se pertenece. Asimismo, la corteza entorrinal, localizada estratégicamente en la base inferomedial y anterior del lóbulo temporal en la vecindad del gancho y que representa un punto de convergencia de amplios sectores corticales asociativos o multimodales (25), que a su vez transfiere esa información hacia la amígdala, el hipocampo y las regiones ventrales del núcleo Acumbens. A su vez, la amígdala y el hipocampo devuelven fibras a la corteza entorrinal y ésta transfiere influencias emocionales a los mismos sectores corticales de los que recibió aferencias.
El enlace de la corteza entorrinal entre las estructuras límbicas y la neocorteza asociativa y viceversa se considera importante en los mecanismos de memoria y aprendizaje asociado con un contexto emocional.
Interconexión con sistemas modulatorios Colinérgico y monoaminérgicos
Uno de los más conocidos sistemas de aferentes a la corteza lo constituyen los sistemas de fibras colinérgicas y de fibras monoaminérgicas (26),(27). El primero tiene origen en los núcleos basales telecefálicos, que incluyen el núcleo basal de Meynert, la banda diagonal de Broca y el núcleo del tabique medial. Estas estructuras se localizan en la región innominada y generan sistemas de proyección hacia regiones alocorticales y neocorticales, que guardan una topografía en la cual los grupos de neuronas colinérgicas más mediales (lámina vertical de la banda diagonal de Broca y núcleo del tabique medial) inervan regiones de la corteza prefrontal medial, de la corteza entorrinal y de la formación hipocampal; mientras que el núcleo basal de Meynert, localizado más lateralmente, provee información de la superficie más lateral de la corteza cerebral, especialmente la frontal. Su actividad está relacionada con la modulación de estructuras corticales vinculadas con la memoria y la cognición. Las neuronas colinérgicas descritas reciben aferentes o proyecciones glutamatérgicas desde la corteza.
Los grupos monoaminérgicos que inervan a la corteza cerebral incluyen:
1. Fibras norepinefrínicas procedentes de un reducido número de neuronas, con cuerpos localizados en la transición pontomesencefálica, identificadas como el locus coeruleus. Al igual que otros sectores del encéfalo y la médula espinal, todas las regiones corticales reciben este tipo de inervación, con una tendencia a mayor densidad de inervación en las áreas sensoriales primarias. Este sistema participa en los mecanismos de alertamiento y su actividad se asocia a estímulos que reflejan relevancia. Las neuronas del locus coeruleus están reguladas por múltiples sistemas, pero debemos mencionar para este propósito las amplias proyecciones desde la corteza prefrontal, es decir, si bien el locus coeruleus ejerce una influencia en la modulación cortical, las proyecciones corticofugas hacia el locus coeruleus determinan cambios en la actividad modulatoria noradrenérgica cortical (27).
El considerar las proyecciones descendentes desde la corteza prefrontal al locus coeruleus resuelve la inquietud de cómo tal estructura con tan pocas neuronas podría cambiar en su actividad ante estímulos complejos. La visión del locus coeruleus como modulador de la función cortical se ha sostenido, pero la influencia en sentido contrario puede ser igualmente importante.
2. Fibras dopaminérgicas. La mayor parte de la corteza cerebral recibe fibras dopaminérgicas, pero su mayor densidad de inervación ocurre en el lóbulo frontal. En el caso de la corteza frontal medial se le relaciona con la motivación y en la corteza prefrontal lateral con la modulación de funciones mentales superiores, especialmente en la memoria operativa o working memory. La corteza entorrinal, la amígdala y el hipocampo están profusamente inervados por fibras dopaminérgicas, por lo tanto, desempeñan un papel modulatorio en la actividad emocional. Los cuerpos de las neuronas que dan lugar a fibras dopaminérgicas que terminan en la corteza se localizan en el área tegmental ventral y comparten su inervación, además, con el estriado ventral que incluye al núcleo acumbens. Los sistemas dopaminérgico, mesolímbico y mesocortical se asocian con mecanismos de gratificación y la búsqueda de la novedad. Al igual que para el sistema norepinefrínico, la corteza prefrontal, especialmente la medial, proyecta fibras glutamatérgicas que modulan la actividad de las neuronas dopaminérgicas, que a su vez inervan la corteza y otras estructuras subcorticales (28).
3. Fibras serotoninérgicas. Los cuerpos de las neuronas serotoninérgicas se localizan en los núcleos del rafé en el tallo cerebral; los de localización más cefálica, es decir, los del mesencéfalo, además de inervar al estriado, inervan amplios sectores de la corteza cerebral con una máxima expresión en la corteza visual. La inervación de la corteza orbitofrontal y de las regiones límbicas y paralímbicas del lóbulo temporal, como la amígdala, el hipocampo y la corteza entorrinal se consideran importantes en la regulación del estado de ánimo y en el control de impulsos.
Proyecciones al tallo cerebral y a la Médula espinal
Amplios sectores de la corteza cerebral de los lóbulos temporal, occipital y frontal, especialmente este último, se proyectan a diversos núcleos del tallo cerebral, que a su vez extienden axones al cerebelo como los núcleos rojos y los núcleos pontinos. De esta manera influyen sobre la actividad cerebelosa no exclusivamente relacionada con lo motor, sino que abarcan lo cognitivo y lo emocional. Fibras originadas en el cerebelo transfieren esta información a estructuras del tallo como los núcleos vestibulares, que a su vez influyen sobre la médula espinal, o núcleos rojos, que pueden generar influencias descendentes espinales o ascendentes al tálamo, que a su vez se proyectan a la corteza frontal motora y prefrontal. Las proyecciones corticoespinales son las más conocidas e involucran acciones sobre neuronas motoras espinales y centros de relevo sensitivo de las astas posteriores.
Circuitos corticales, organización modular y transmodular
En las secciones anteriores se pretendió dar una visión macroscópica de las relaciones de la corteza cerebral con el resto de estructuras del sistema nervioso y de la influencia de éstas sobre la estructura y función cortical. El análisis de las interacciones corticales y subcorticales es muy útil, porque permite apreciar la interdependencia de la corteza consigo misma y con otras estructuras, más allá de la descripción meramente citoarquitectónica, que puede inducir a conclusiones erróneas cuando se pretende establecer un correlato funcional basado en imagenología, o analizar los efectos de una lesión o de la acción de un fármaco.
Es útil también aproximarse a la organización celular y a sus interacciones locales, campo en el cual, aunque faltan muchos detalles, se han logrado notables avances en la última década. Para tal fin describiremos el patrón celular y de conectividad más conocido, el cual con variantes regionales puede aplicarse a cualquier sector de la corteza. Es importante advertir que la corteza cerebral presenta una organización modular translaminar cuyos límites en las áreas sensoriales los establecen las aferentes tálamo-corticales, con ramificaciones axónicas que ocupan 500 micras en un plano tangencial. En los sectores asociativos y supramodales, el límite del módulo lo determina el patrón de inervación de fibras córtico-corticales (callosas y asociativas) (29). En este caso, un módulo cortical está definido por las fibras aferentes procedentes de otro sector de la corteza y por el conjunto de células que están bajo la influencia de estas aferentes. Estos módulos podrían equipararse a cilindros casi independientes, con un diámetro aproximado de 200 micras. Cada módulo cortical representa en pequeña escala el patrón general de organización y conectividad de toda la corteza, es decir, cada uno es una unidad eferente que genera, partiendo de la capa II, fibras asociativas; de la capa III, callosas; de la capa V, córtico-estriatales, córtico-pónticas, córticonucleares y córtico-espinales, y de la capa VI, córtico-talámicas.
De igual manera, cada microestructura está alimentada por su propio sistema de aferentes, algunos derivados de otros sectores de la corteza que, como vimos, no sólo respetan la organización modular, sino que determinan y constituyen el sistema más abundante de aferentes a cualquier módulo. Las aferentes derivadas de estructuras subcorticales pueden estar circunscritas al ámbito de un módulo, como en el caso de las cortezas sensoriales primarias (visual, auditiva, somatosensorial), las cuales son el fundamento de los campos receptivos visuotópicos, tonotópicos y somatotópicos. Cada módulo con amplias variantes regionales recibe, además, aferentes cuyo patrón de ramificación es supramodular, ya que este conjunto de fibras surge de grupos de neuronas cuyo sistema de ramificación axonal es muy divergente. En especial se hace referencia a la inervación cortical de los sistemas noradrenérgico, dopaminérgico, serotoninérgico, histaminérgico y, en menor grado, el sistema colinérgico. El ingrediente dopaminérgico, noradrenérgico o serotoninérgico, para citar tres casos, varía en densidad y distribución en los diferentes sectores, por ejemplo, los módulos corticales de la corteza prefrontal y la motora primaria son más ricos en inervación dopaminérgica; mientras que la corteza parietal somatosensorial presenta una mayor inervación noradrenérgica, donde predomina la inervación serotoninérgica en la corteza visual (26),(27),(28). De acuerdo con lo anterior los efectos de la intervención farmacológica sobre estos sistemas desencadenarían respuestas modulares distintas. Una de las fronteras del conocimiento en la quimioarquitectura cortical es establecer el complejo patrón de expresión de receptores en diferentes tipos de módulos corticales, lo cual es fundamental para evitar efectos farmacológicos no deseados o colaterales.
En la Figura 4 se indican algunos de los circuitos más conocidos en el ámbito de un módulo cortical, no obstante, por simplificar sólo se incluyen neuronas piramidales e interneuronas con influencias en la capa III. Por razones prácticas tomemos como eje del módulo cortical las células piramidales, es decir, aquellas que dan lugar a axones que se extienden más allá del límite de la capa de origen, que influyen sobre otros sectores corticales o estructuras subcorticales. Éstas son excitatorias, utilizan glutamato como neurotransmisor y constituyen más del 50% de las células corticales, en algunos casos hasta el 70%.

Las células piramidales son espinosas y poseen un amplio sistema de colaterales recurrentes, que inervan células piramidales vecinas e interneuronas gabérgicas. Sus axones principales, al abordar a otro sector de la corteza o a una estructura subcortical, presentan un patrón de ramificación circunscrito que recuerda su origen modular. Su efecto se ejerce a través de receptores ionotróficos NMDA, AMPA, kainato y metabotróficos mGLUR1-8, localizados, en el caso de la corteza, en otras células piramidales, en células gabérgicas y aun en células gliales, que expresan los receptores mGLUR 1-5 (30).
La salida de la corteza está bajo la regulación de interneuronas gabérgicas, aunque algunas de ellas coexpresan neuropéptidos. Se identifican subtipos de interneuronas gabérgicas por la expresión de proteínas atrapadoras de calcio, por su patrón de descarga y por sus sistemas de terminales axónicas sobre las células piramidales. El patrón de clasificación es más complejo, pero para el presente propósito lo podemos simplificar de la siguiente manera: las células en Chandelier o axoaxónicas inervan el segmento inicial del axón de las células piramidales y son parvoalbúmina positivas; las células en cesta inervan el soma y los sectores proximales de las dendritas, son parvoalbúmina positivas y presentan acoples eléctricos entre sus procesos dendríticos, lo cual las puede hacer descargar sincrónicamente; las células de doble bouquet inervan las dendritas basales y las ramas de las dendritas apicales, además, sus axones tienen una disposición vertical y restringida al módulo de origen e inervan también a las células en cesta, y son calbindina positivas; las células horizontales de la capa I y algunas bipolares de la capa II expresan calretinina y conectan tanto a células piramidales como a interneuronas (1),(17) (tablas 1 y 2). En las tablas 1 y 2 se recuerda que sobre el conjunto de neuronas intrínsecas de un módulo, es decir, células piramidales, excitatorias, glutamatérgicas e interneuronas gabérgicas inhibitorias, influye un conjunto de aferentes específicos e inespecíficos, a su vez sometidos a la influencia directa o indirecta de estas mismas neuronas.


Finalmente, es indudable que estamos lejos de conocer la estructura funcional y neuroquímica de la corteza cerebral y que su complejidad es agobiante, pero la peor estrategia sería nunca intentar su estudio, dado que avanzar en su conocimiento ofrece mejores alternativas para entender el comportamiento y para encontrar mejores soluciones a la enfermedad mental.
Bibliografía
1. DeFelipe J, Alonso-Nanclares L, Arellano JI. Micorestructure of the neocortex: comparative aspects. Journal of Neurocitology 2002;31:299-316. [ Links ]
2. Parent A, Hazrati L. Functional anatomy of the basal ganglia: I the cortico-basal ganglia-thalamo-cortical loop. Brain Research Reviews 1995;20:91-127. [ Links ]
3. Parent A, Hazrati L. Functional anatomy of the basal ganglia. II: the place of subthalamic nucleus and external pallidum in basal ganglia circuitry. Brain Research Reviews 1995;20:128-54. [ Links ]
4. Escobar M, Pimienta J. Núcleos de la base. Sistema nervioso: neuroanatomía funcional, neurohistología, neurotransmisores, receptores y clínica. 3rd ed. Cali: Editorial Universidad del Valle; 2003. [ Links ]
5. Pandya DN, Seltzer B. Input-output organization of the primate cerebral cortex. Comparative Primate Biology 1988; 4:39-80. [ Links ]
6. Petrides N. Specialized systems for the processing of mnemonic information within the primate prefrontal cortex. In: The prefrontal cortex. New York: Roberts Eds; 1998. p. 103-16. [ Links ]
7. Yeterian EH, Pandya DN. Prefrontostriatal connections in relation to cortical architectonic organization in rhesus monkeys. Journal of Comparative Neurology 1991;312:43-67. [ Links ]
8. Barbas H. Architecture and cortical connections of the prefrontal cortex in the rhesus monkey. Advances in Neurology 1992;57:91-115. [ Links ]
9. Pimienta H, Escobar M, Palomino J, Quijano M. Corteza prefrontal: un mosaico evolutivo, estructural, funcional y clínico. In: Primates, evolución e identidad humana México: Instituto Mexicano de Psiquiatría; 1999. p. 73-82. [ Links ]
10. Sanides F. Comparative architectonics of the neocortex of mammals and their evolutionary interpretation. Ann NY Acad Sci 1969;167:404-23. [ Links ]
11. Ungerleider LG, Mishkin K. Two cortical visual systems. In: Ingle DJ, Goodale MA, Mansfield RJW, editors. Analysis of visual behavior. Cambridge (MA): The MIT Press; 1982. p. 549-86. [ Links ]
12. Barbas H. Anatomic organization of basoventral and mediodorsal recipient prefrontal regions in the rhesus monkey. Journal Comparative Neurology 1988; 276:313-42. [ Links ]
13. Desimone R, Ungerleider LG. Multiple visual areas in the caudal superior temporal sulcus of the macaque. Journal of Comparative Neurology 1986;248:164-89. [ Links ]
14. Walker AE. A cytoarchitectural study of the prefrontal area of the macaque monkey. Journal of Comparative Neurology 1940; 73:59-86. [ Links ]
15. Rajkowska G, Goldman-Rakic P. Cytoarchitectonic definition of prefrontal areas in the normal human cortex: I. Remapping of areas 9 and 46 using quantitative criteria. Cerebral Cortex 1995;5:302-22. [ Links ]
16. Thomson AM, Bannister AP. Interlaminar connections in the neocortex. Cerebral Cortex 2003;13:5-14. [ Links ]
17. Valverde F. Estructura de la corteza cerebral: organización intrínseca y análisis comparativo del neocortex. Revista de Neurología 2002;34(8):758-80. [ Links ]
18. Fukuda T, Kosaka T. Ultraestructural study of gap junctions between dendrites of parvoalbumin-containing gabaergic neurons in various neocortical areas of the adult rat. Neuroscience 2003;120:5-20. [ Links ]
19. Escobar MI, Pimienta HJ, Palomino JC, Arévalo M. Dorsolateral prefrontal cortex of the Aotus lemurinus grisseimemebra. A qualitative and quantitative nissl and gaba immunostainning sudy. Azheimer Disease Reviews 1998;57:57-62. [ Links ]
20. Benes TM, Berreta S. Gabaergic interneurons: implications for understanding schizoprenia and bipolar disorder. Neuropsychology 2001;25(1):1-27. [ Links ]
21. Lewis DA, Gonzáles-Burgos G. Proceedings of the human cerebral cortex: form gene to structure and function. Intrinsic excitatory connections in the prefrontal cortex and the pathophysiology of schizophrenia. Brain Research Bulletin 2000;52(5):309-17. [ Links ]
22. Hof P, Glexer I, Condé F, Flagg R, Rubin M, Nimchinsky E, et al. Cellular distribution of the calcium-binding proteins parvoalbumin, calbindin and calretinin in the neocortex of mammals: phylogenetic and developmental patterns. Journal of Chemical Neuroanatomy 1999;16:77-116. [ Links ]
23. Rockland KS. Non-uniformity of extrinsic connections and columnar organization.. Journal of Neurocitology 2002;31:247-53. [ Links ]
24. Jones EG. The thalamic matrix and thalamocortical synchrony. Trends in Neuroscience 2001;24(10):595-601. [ Links ]
25. Gloor P. The temporal isocortex. In: The temporal lobe and the limbic system. New York: Oxford University Press; 1997. p. 113-57. [ Links ]
26. Gu Q. Neuromodulatory transmitter systems in the cortex and their role in cortical plasticity. Neuroscience 2002;111 (4): 815-35. [ Links ]
27. Berridge CW, Waterhouse BD. The locuscoeruleus noradrenergic system: modulation of behavioral state and state dependent cognitive processes. Brain Research Reviews 2003;42(1):33-84. [ Links ]
28. Seamans JK, Gorolova N, Durstewitz D, Yang Ch R. Bidirectional dopamine modulation of gabaergic inhibition in prefrontal cortical pyramidal neurons. The Journal of Neuroscience 2001; 21(10): 3628-38. [ Links ]
29. Szentágothai J, Arbib MA. Conceptual models of neuronal organization. Neuroscience Research Progress Bulletin 1974;12:306-510. [ Links ]
30. Wyszynski M, Sheng M. Targeting and anchoring of glutamate receptors and associated signaling molecules. In: Ottersen OP, Storm-Mathisen JB, editors. Glutamate. Amsterdan: Elsevier; 2000. p. 183-96. [ Links ]














