Introducción
El funcionamiento del ecosistema involucra complejas interacciones que pueden ser afectadas por procesos de cambio del clima (Bellard et al. 2012), cambio de uso de suelo y actividades productivas, que pueden conducir a una irremediable pérdida de especies (Sodhi et al. 2009; Dornelas 2010). Recientemente se ha enfatizado en la gran crisis de co-extinción (extinción en cascada) derivada de las relaciones mutualistas, ya que la abundancia, distribución y riqueza de riqueza de las especies parásitas, es dependiente obligada de la disponibilidad de hospederos específicos (Dunn et al. 2009; Kamiya et al. 2014). Perder una de las especies implica incrementar la crisis de pérdida de biodiversidad considerablemente (Dunn et al. 2009; Colwell et al. 2013).
En insectos, varios estudios muestran que cambios en el clima afectan su distribución y riqueza, en particular, de aquellos que carecen de la habilidad fisiológica para regular la temperatura (Kaspari 2003; Castro-Delgado et al. 2008; Medianero et al. 2010). Además, se ha encontrado una estrecha asociación entre la diversidad y distribución geográfica de las especies de insectos con cambios altitudinales (Arvid 2003; Muñoz y Amarillo-Suárez 2010; Clark-Tapia et al. 2013) y procesos de disturbio (Dornelas 2010; Thuiller et al. 2004). La modificación del hábitat debido a cambio del clima o disturbio conlleva a una modificación de las interacciones entre las especies hospedero-parásito, en algunos casos, implica cambios estructurales en la morfología del hospedero, como las generadas por agallas en plantas (Stone y Schönrogge 2003; Redfern 2011), por lo que es posible cuantificar e identificar parámetros de diversidad.
Las agallas o cecideas son estructuras de crecimientos anormales formadas en los tejidos de las plantas debido a la actividad parasítica de un organismo (Redfern y Shirley 2002), las cuales representan el microhábitat del insecto inductor, y que resulta fundamental para su supervivencia y desarrollo (Vrcibradic et al. 2000; Clark-Tapia et al. 2013). Se han descrito alrededor de 13.000 especies de insectos formadores de agallas que varían en complejidad de estructura y forma (Nieves-Aldrey 2001; Stone y Schönrogge 2003; Raman y Gupta 2007), siendo las avispas de la superfamilia Cynipoidea los inductores de agallas más comunes, pero con requerimientos muy específicos de hospederos (Abrahamson et al. 1998; Ronquist y Liljeblad 2001). Por ejemplo, sólo en Norteamérica, más del 80 % de las avispas de la familia Cynipidae (Insecta: Hymenoptera) utilizan a los encinos (Fagaceae: Quercus) como principales hospederos (Price 2005; Russo 2007) y muchas de ellas muestran alta especificidad a unas cuantas especies (Abrahamson et al. 1998; Nieves-Aldrey 2001; Redfern 2011).
La diversidad, complejidad y distribución de estructuras gallícolas en especies de encinos (Ronquist y Liljeblad 2001; Raman y Gupta 2007; Nieves-Aldrey 2001) está bien documentada en ciertas regiones del mundo. Sin embargo, la información en México es escasa, a pesar de ser el centro de diversificación del género Quercus con alrededor de 150 a 200 especies, de las cuales 115 son endémicas (Valencia-Avalos 2004), todas ellas hábitats potenciales para una gran diversidad de avispas gallícolas. Realizar un estudio de observación directa con avispas cecideas es complicado, debido a su variación temporal y reducido tamaño (Raman y Gupta 2007; Nieves-Aldrey 2001), sin embargo, la observación indirecta del microhábitat (agallas) de las avispas permite evaluar su abundancia y distribución en un área o región.
Hasta el momento, no es del todo claro el tipo de relación presente entre el hospedero y la avispa gallícola, así como tampoco el efecto del cambio climático, cambio de uso de suelo o factores geográficos sobre su abundancia y distribución (Knepp et al. 2005; Kampichler et al. 2008). En tal sentido si se afecta el macrohábitat (entorno físico), el hábitat (especies hospederas) y el microhábitat (agalla) se modificarán las condiciones para el desarrollo de las avispas. Se conoce que los encinos (hábitat) son sensibles a procesos de cambio climático y se pronostica una reducción severa en su abundancia y distribución, así como una reducción de los bosques templados del país (Gómez-Mendoza y Arriaga 2007). En este contexto la ocurrencia de las avispas agalleras puede estar sujeta a los factores ambientales que afectan la distribución geográfica del hospedero, y a los rangos de tolerancia de las avispas. Comprender la tolerancia de una especie a los factores ambientales a lo largo de un gradiente, es un aspecto esencial en ecología, ya que permite describir su nicho ecológico (Dolédec et al. 2000), así como conocer su grado de especificidad, es decir si corresponden a especies generalistas o especialistas, de acuerdo con los rangos de tolerancia y amplitud de las especies (Thuiller et al. 2012).
En este estudio se analiza desde una escala de paisaje utilizando diversas variables ambientales que afectan la abundancia y distribución de las avispas agalleras, analizadas indirectamente a partir de su microhábitat (ocurrencia de agallas) a lo largo de un gradiente en el bosque templado de Sierra Fría, Aguascalientes utilizando un análisis multivariado de marginalidad u OMI por sus siglas en inglés “Outlying Mean Index analysis” (Dolédec et al. 2000), el cual permite determinar la amplitud, marginalidad y tolerancia del nicho de las especies (Tsiftsis et al. 2008; Thuiller et al. 2012) y predecir potenciales efectos de cambio climático, cambio de uso de suelo o disturbio en la diversidad gallícola en Sierra Fría.
Materiales y métodos
Área de estudio
Sierra Fría (SF) es un macizo montañoso localizado a los 22°10’14” N y 102°31’14” O de aproximadamente 112.090 ha localizada al noroeste del estado de Aguascalientes en la Sierra Madre Oriental en la parte meridional. El rango de altitud en esta zona varía entre los 1.600 y los 3.000 msnm (Fig. 1). El clima es templado subhúmedo, semiárido y semicálido con una vegetación predominante de bosques de encino o asociaciones de encino-pino y vegetación de tipo matorral donde domina la manzanita Arctostaphylos pungens (Kunth, 1818) (Ericales: Ericaceae) con asociaciones de encinos arbustivos de las especies Quercus microphylla (Née, 1801) (Fagales: Fagaceae) y Q. potosina (Trel., 1924). El promedio anual de precipitación oscila entre 450 a 600 mm y el de temperatura es de 17 °C. En ambas variables la máxima se registra en junio y julio y la mínima, en diciembre y enero (UMAFOR 2012).
En SF se encuentran registradas 17 especies de Quercus, donde un mayor porcentaje (71 %) son encinos de la sección Quercus (blancos) y un 30 % de la sección Lobatae (encinos rojos) (De la Cerda 1999; Valencia-Avalos 2004). A pesar de ser la mayor zona boscosa para el estado, el grado de perturbación ha ocasionado una alta fragmentación del hábitat. Los factores más comunes son el severo aprovechamiento maderable (extracción para leña o carbón), al desmonte para crear zonas ganaderas o agrícolas, a los incendios forestales, y a la acción de plagas y la actividad humana desde principios del siglo XX. Esta zona puede ser aún más fragmentada debido a las políticas de ordenamiento territorial vigentes para el estado, la cual implica que la tenencia de la tierra está dividida en pequeña propiedad, ejidal y comunal, siendo la pequeña propiedad la más extendida (UMAFOR 2012).
Sitios de muestreo
A lo largo de un gradiente de Sierra Fría se obtuvieron las características físicas de 10 sitios de muestreo (Fig. 1, tabla 1). Cada uno se ubicó geográficamente con un GPS Mobile Mapper 10 de ASTECH, con el cual se obtuvo además la altitud. La pendiente de cada sitio se obtuvo con un clinómetro Suunto modelo PM-5/360. Además, se evaluó el grado de disturbio de manera cualitativa mediante la observación de presencia de procesos de perturbación del ecosistema (manejo forestal, tala, pastoreo, restos de heces fecales de ganado, deterioro del estrato herbáceo y presencia de especies indicadoras de disturbio como por ejemplo Dodonaea viscosa (Boissier, 1760) (Sapindales: Sapindaceae) o A. pungens (Rodríguez-Rivera 2014). Para determinar diferencias significativas en altitud, disturbio y pendiente entre sitios se utilizó una U de Mann-Whitney usando el software XL-STAT v.2015-1.01 (XLSTAT 2015).
Tabla 1 Ubicación de los sitios de muestreo en la Sierra Fría, Aguascalientes, México (ver fig. 1 para la abreviación de los sitos).
| Pb | Lls | Cgl | As | Tp | CoJ | Ala | Sin | Cie | Pnl | |
|---|---|---|---|---|---|---|---|---|---|---|
| LaT N | 22°01’07” | 22°02’39” | 22°02’34” | 22°01’84” | 22°02’43” | 22°01’71” | 22°01’84” | 22°00’64” | 22°06’24” | 22°04’36” |
| LgT O | 102°05’56” | 102°05’15” | 102°05’01” | 102°05’66” | 102°04’55” | 102°05’56” | 102°06’06” | 102°08’26” | 102°41’26” | 102°43’41” |
| AlT m | 2.584 | 2.191 | 2.363 | 2.734 | 2.322 | 2.584 | 2.734 | 2.552 | 2.677 | 2.678 |
| %P | 8 | 0 | 20 | 10 | 20 | 5 | 5 | 10 | 15 | 15 |
| D | 2 | 4 | 3 | 3 | 3 | 3 | 2 | 4 | 2 | 3 |
| Hospederos | Qed* | Qgs+ | Qed* | Qed* | Qrs+ | Qgs+ | Qed* | Qed* | Qpt+ | Qed* |
| Qch+ | Qed* | Qrsa+ | Qpt+ | Qpt+ | Qpt+ | Qpt+ | Qpt+ | Qed* | Qsd* | |
| Qrs+ | Qpt+ | Qgsa+ | Qsd* | Qed* | Qed* | Qgs+ | Cdn | Qsd* | Qrg+ | |
| Qpt+ | Pph | Cdn | Cdn | Qrg+ |
*encinos rojos; +encinos blancos; LaT: Latitud; LgT: Longitud; Alt: Altitud; %P: Pendiente; D: Disturbio; Qed: Quercus eduardii; Qgs- Quercus grisea; Qch: Quercus chihuahuenses; Qpt: Quercus potosina; Qrs: Quercus resinosa; Qsd: Quercus sideroxyla; Qrg: Quercus rugosa; P.ph: Pinus leiophylla; Cdn: Jumiperus deppeana.
Dentro de cada sitio seleccionado, se establecieron dos transectos permanentes de 50 m de largo x 5 m de ancho, ubicados en la misma orientación cardinal. Los árboles hospedero presentes dentro de estos transectos fueron identificados y etiquetados, y se registró la presencia y tipo de estructuras de agallas. Para tener representada la mayor riqueza de agallas se tomó en consideración la emergencia y madurez de hojas, floración y fructificación de los hospederos, por lo cual el muestreo se llevó a cabo durante la época de sequía, que corresponde a invierno (noviembre-diciembre de 2011 a enero de 2012) y la época de lluvias que corresponde a verano (julio-septiembre de 2012). Al momento del registró se consideró que cada agalla (denominada también como cecidea, estructura o morfo), era específica a una especie, es decir que era formada por sólo una especie de avispa de acuerdo a Rodríguez-Rivera et al. (2017).
Los hospederos se inspeccionaron cuidadosamente en diversos estratos para la búsqueda de estructuras. Se coleccionaron muestras de cada hospedero (encinos, ericáceas, pinos, leguminosas, herbáceas) para su identificación taxonómica. Está se realizó en el Laboratorio de Estudios Ambientales de la Universidad de la Sierra Juárez, en casos de encinos, un ejemplar de éstos se envió a la Dra. Susana Valencia (Facultad de Ciencias) para su cotejo.
Análisis estadístico
Se analizó la distribución de las agallas a nivel de especie para determinar la especificidad a ciertos hospederos con el fin de establecer si son generalistas o especialistas. Además, para cada tipo de morfo se registró su ubicación específica: en hoja (haz y envés), en venas (primaria, secundaria o sublaterales) y en ramas (tallo 1: principal y tallo 2: secundario). Para analizar el efecto climático sobre su distribución específica se utilizó el método de ordenación restringido de análisis canónico de coordenadas principales (CAP) (Clarke y Gorley 2006) considerando los dos períodos como la variable predictiva para analizar el efecto ambiental en la distribución específica de las agallas en el hospedero.
La ocurrencia de agallas puede estar sujeta a factores ambientales que afectan la distribución de los hospederos, así como los rangos de tolerancia de las avispas cecideas. Es por ello, que el efecto de las condiciones ambientales se determinó con un análisis de marginalidad (OMI; Dolédec et al. 2000). Este índice permite analizar la asociación de condiciones ambientales utilizadas por cada especie (nicho ecológico) y el efecto que tienen sobre su distribución y abundancia como su grado de especificidad a un ambiente (Heino y Soininen 2005). Se utilizó el software ADE-4 (Thioulouse et al. 1997), para probar el grado de asociación de las variables ambientales con la abundancia de agallas y especies hospederas en 10 sitios seleccionados en SF. Se utilizaron 17 variables: cuatro geográficas (altitud, latitud, longitud y pendiente), la de disturbio (Tabla 1) y 12 climáticas (Tabla 2) obtenidas de la base de datos WorldClim (http://www.worldclim.org).
Tabla 2 Características climáticas de los sitios en la Sierra Fría, Aguascalientes, México (ver fig. 1 para la abreviación de los sitios).
| Sitio | TP | TMiP | TMMC | TMxP | TMMF | TDV | PM | PMMX | PMX | PMXMX | PMXMCL | PMXMF |
| Pb | 15,0 | 6,7 | 22,3 | 22,4 | 21,5 | 8,2 | 17 | 93 | 190 | 26 | 9,4 | 4,7 |
| Lls | 16,5 | 8,1 | 24,9 | 24,9 | 23,7 | 8,9 | 14 | 97 | 160 | 23 | 11,4 | 5,8 |
| Cgl | 15,6 | 7,3 | 23,8 | 23,8 | 22,7 | 8,7 | 15 | 98 | 170 | 27 | 10,4 | 5,2 |
| As | 13,8 | 6,1 | 21,3 | 21,4 | 20,6 | 8,0 | 16 | 91 | 190 | 28 | 8,7 | 4,4 |
| Tp | 16,0 | 7,8 | 24,2 | 24,3 | 23,1 | 8,7 | 15 | 98 | 160 | 25 | 10,9 | 5,5 |
| CoJ | 14,5 | 6,7 | 22,3 | 22,4 | 21,5 | 8,2 | 17 | 93 | 190 | 26 | 9,4 | 4,7 |
| Ala | 13,8 | 6,1 | 21,3 | 21,4 | 20,6 | 8,0 | 16 | 91 | 190 | 28 | 8,7 | 4,4 |
| Sin | 14,3 | 6,6 | 21,9 | 22,1 | 21,1 | 8,1 | 18 | 94 | 190 | 26 | 9,3 | 4,6 |
| Cie | 14,5 | 6,6 | 22,2 | 22,3 | 21,4 | 8,2 | 17 | 95 | 180 | 27 | 9,4 | 4,7 |
| Pnl | 14,3 | 6,5 | 22,0 | 22,1 | 21,2 | 8,2 | 17 | 94 | 190 | 27 | 9,2 | 4,7 |
TP: Temperatura promedio; TMiP: Temperatura mínima promedio; TMMC: Temperatura mínima máxima en el mes más caluroso; TMxP: Temperatura máxima promedio; TMMF: Temperatura máxima del mes más frío; TDV: Desviación estándar de la temperatura; PM: Precipitación mínima; PMMX: Precipitación mínima máxima; PMX: Precipitación máxima; PMXMX: Precipitación máxima máxima; PMXMCL: Precipitación máxima mínima del mes más caluroso; PMXMF: Precipitación máxima mínima del mes más frío.
El análisis utiliza dos matrices: una botánica que contiene la abundancia de las agallas (renglones) en los 10 sitios (columnas) y otra matriz ambiental (climática + geográfica), que contiene valores de las 17 variables ambientales (renglones) en los mismos n sitios (columnas). Como primer paso, se analizó la ambiental con un análisis de componentes principales (ACP) con la finalidad de ordenar los sitios en función de las variables ambientales. Posteriormente, se estimó la variación de la inercia del promedio de condiciones ambientales usadas por la especie, obteniéndose tres parámetros: 1) índice de marginalidad, que mide la distancia entre las condiciones promedio utilizadas por la especie y las condiciones promedio del área de estudio; 2) índice de tolerancia (amplitud de nicho) que describe la variación del nicho a través de las variables ambientales analizadas y 3) tolerancia residual, que corresponde a la variación no estimada. Se utilizó una prueba de Monte Carlo para comparar la marginalidad observada de la especie versus su distribución a través de 10.000 permutaciones y una significancia de P = 0,05, bajo la hipótesis nula que el ambiente no afecta la abundancia de la especie.
El fundamento de este análisis fue medir la marginalidad de la distribución del hábitat de una determinada especie o especies, es decir, la distancia entre las condiciones encontradas en la zona donde se encuentra, así como las condiciones medias del hábitat en toda el área de estudio. Cuando hay valores altos de OMI, indica que las especies tienen valores altos de marginalidad que corresponde a especies especialistas (Dolédec et al. 2000). Este análisis ayuda a determinar la amplitud del nicho (la tolerancia de la especie) a lo largo de los gradientes ambientales donde se encuentra la especie. Cuando hay valores bajos de tolerancia, significa que la especie cuenta con un rango limitado de condiciones (e.g. especies especialistas), mientras que los valores altos implican que se distribuye a través de condiciones ambientales muy variables (e.g. especies generalistas) (Tsiftsis et al. 2008).
Resultados
Características de los sitios
Se encontró que los sitios muestreados presentaron un nivel de moderado a alto de perturbación con un promedio de 2,9 ± 0,74 (Tabla 1). A nivel de paisaje se encontró diferencias en cuanto al grado de disturbio entre los sitios (U = 24; P < 0,05), donde se encontró tres sitios con gran perturbación los Llanos (Lls), Cuesta la Gloria (CGl) y el Sinaí (Sin) y ningún sitio conservado. Sierra Fría tiene una pendiente (% P) moderada (% P promedio de 10,8 ± 6,65) con diferencias significativas entre sitios (U = 123,3; P < 0,03).
En total, se analizaron siete especies de encinos (5 blancos y 2 rojos) y dos de pináceas (Tabla 1). Cada sitio presentó un promedio de tres especies (3,0 ± 0,47), siendo Q. eduardii (Trel., 1922) y Q. potosina (Trel., 1924) las de mayor frecuencia, mientras que Q. rugosa (Née, 1801) y Q. sideroxyla (Humb. et Bonpl., 1809) las menos frecuentes. La abundancia de hospederos analizados por sitio varió de siete a 29 con un promedio de 14 ± 6 individuos. Los sitios con mayor perturbación presentaron el menor número de especies hospederas.
Las especies hospederas que mostraron un mayor número de agallas corresponden a la sección Quercus: Q. potosina (25) y Q. grisea (Liebm., 1854) (24), mientras las que presentaron el menor número de estructuras fueron Q. sideroxyla (5) de la sección Lobatae, así como las pináceas Pinus leiophylla (Schiede ex. Schltdl. & Cahm., 1831) (Pinales: Pinaceae) y Juniperus deppeana (Steud., 1840) (Pinales: Cupressaceae) con un morfo cada especie (Tabla 3). Por otro lado, Q. grisea fue el hospedero con mayor número de agallas especialistas (14), seguido por Q. potosina (13) y Q. resinosa (11) todos de la sección Quercus, mientras que ambas pináceas y Q. chihuahuensis (Trel., 1924) tuvieron el menor número de morfos especialistas, caso particular de Q. sideroxyla que indicó ausencia de agallas especialistas (Fig. 2).
Tabla 3 Parámetros de nicho para las agallas en la Sierra Fría, Aguascalientes, México. Morfo= agalla Cynipidae; Hábitat: haz de hoja (H), envés de hoja (E), vena primaria (Vp), vena secundaria (Vs), vena sublateral (Vt)), rama tallo 1 (Tl1) y rama tallo 2 (Tl2); Inercia = Variabilidad total; OMI = Índice promedio de marginalidad; T1 = Índice de tolerancia; P = Número de simulaciones (1000) que representan un valor mayor del observado en el OMI (NS = no significativo a un valor de P > 0,05). Ver tabla 1 para la descripción de las especies hospederas.
| Morfo | Hospedero | Habitat | Inercia | OMI | T1 | P |
|---|---|---|---|---|---|---|
| 1 | Qed,Qsd,Qch | Tl1 | 24,2500 | 1,2830 | 4,3290 | ns |
| 2 | Qrs | Tl1 | 38,2000 | 5,9960 | 5,1560 | ns |
| 3 | Qrs | E-Vp | 16,7400 | 5,4290 | 0,7479 | ns |
| 4 | Qpt,Qrg,Qed,Qsd | Tl1 | 24,3400 | 0,0314 | 3,6000 | ns |
| 5 | Qed,Qrs | Tl1 | 28,5700 | 1,8760 | 2,1010 | ns |
| 6 | Qrs | E-Vp | 14,4700 | 3,3680 | 0,7601 | ns |
| 7 | Qrs | H-Vs | 34,8300 | 34,8300 | 0,0000 | 0,05 |
| 8 | Qed | E-Vp | 27,4600 | 3,2350 | 2,1150 | ns |
| 9 | Qsd,Qed,Qch | Tl1 | 22,2200 | 3,3490 | 4,1310 | ns |
| 10 | Qpt | P | 22,6200 | 1,2800 | 2,4190 | ns |
| 11 | Qrs | E-Vp | 6,9050 | 6,9050 | 0,0000 | ns |
| 12 | Qed | Ap | 33,3600 | 7,8390 | 4,9450 | ns |
| 13 | Qgr | Tl1 | 21,4900 | 10,5800 | 7,6710 | ns |
| 14 | Qgr | Tl1 | 16,5800 | 4,4730 | 3,6140 | ns |
| 15 | Qpt,Qch,Qgr | Tl1 | 29,1800 | 2,4520 | 11,3300 | 0,05 |
| 16 | Qgr | E-Vs | 32,6200 | 15,0900 | 10,9500 | ns |
| 17 | Qed | Ap | 15,7900 | 15,7900 | 0,0000 | ns |
| 18 | Qpt,Qch,Qgr | E-Vs | 28,5300 | 3,6380 | 5,8560 | ns |
| 19 | Qrs,Qgr,Qpt | E-Vs | 46,5800 | 18,7900 | 1,8370 | 0,05 |
| 20 | Qch,Qrg | Tl1 | 26,2600 | 8,3790 | 1,4440 | ns |
| 21 | Qgr,Qpt,Qrg | E-Vp | 33,9700 | 2,3720 | 7,7650 | ns |
| 22 | Qgr | E-Vt | 6,9050 | 6,9050 | 0,0000 | ns |
| 23 | Qpt | H-Vs | 30,9100 | 6,6860 | 14,2100 | ns |
| 24 | Qpt | H-Vp | 58,3300 | 58,3300 | 0,0000 | 0,05 |
| 25 | Qpt,Qgr | Tl1 | 32,2100 | 7,8530 | 15,2500 | ns |
| 26 | Qpt,Qrs,Qrg,Qch | H-Vs | 24,8400 | 1,5800 | 6,3500 | ns |
| 27 | Qch,Qpt,Qrg | Tl1 | 29,0300 | 6,9630 | 10,7600 | 0,05 |
| 28 | Qrs | E-Vs | 6,9050 | 6,9050 | 0,0000 | ns |
| 29 | Qrs | E-Vs | 28,7800 | 28,7800 | 0,0000 | ns |
| 30 | Qrs | E-Vs | 20,0200 | 7,3640 | 2,0040 | ns |
| 31 | Qgr | Tl1 | 32,6200 | 15,0900 | 10,9500 | ns |
| 32 | Qpt | E-Vs | 38,9300 | 13,1300 | 18,7300 | 0,05 |
| 33 | Qrg,Qgr,Qpt | Tl1 | 38,0900 | 9,8410 | 10,4000 | ns |
| 34 | Qrs | E-Vt | 18,3200 | 18,3200 | 0,0000 | ns |
| 35 | Qed | Tl2 | 58,3300 | 58,3300 | 0,0000 | 0,05 |
| 36 | Qgr,Qch | E-Vp | 46,5800 | 18,7900 | 1,8370 | 0,05 |
| 37 | Qed | Tl1 | 15,7900 | 15,7900 | 0,0000 | ns |
| 38 | Qpt | Tl1 | 34,1200 | 6,0640 | 0,6150 | ns |
| 39 | Qpt,Qch | E-Vp | 36,7800 | 7,5940 | 4,5950 | ns |
| 40 | Qrs,Qpt | H-Vp | 17,8600 | 17,8600 | 0,0000 | ns |
| 41 | Qrs | E-Vp | 28,7800 | 28,7800 | 0,0000 | ns |
| 42 | Qch | H-Vs | 34,8300 | 34,8300 | 0,0000 | ns |
| 43 | Qgr | Tl1 | 21,8100 | 2,8590 | 6,2740 | ns |
| 44 | Qgr | Tl1 | 18,6300 | 18,6300 | 0,0000 | ns |
| 45 | Qgr | E-Vp | 28,7800 | 28,7800 | 0,0000 | ns |
| 46 | Qpt | E-Vp | 18,3200 | 18,3200 | 0,0000 | ns |
| 47 | Qpt | H-Vp | 18,3200 | 18,3200 | 0,0000 | ns |
| 48 | Qed,Qsd | Tl2 | 15,7900 | 15,7900 | 0,0000 | ns |
| 49 | Qgr | P | 6,9050 | 6,9050 | 0,0000 | ns |
| 50 | Cdn | Tl1 | 18,6300 | 18,6300 | 0,0000 | ns |
| 51 | Qgr | E-Vs | 58,3300 | 58,3300 | 0,0000 | 0,05 |
| 52 | Qpt | E-Vt | 23,5500 | 2,2320 | 3,0600 | ns |
| 53 | Qgr,Qed | Tl1 | 18,6300 | 18,6300 | 0,0000 | ns |
| 54 | Qgr | Tl1 | 34,8300 | 34,8300 | 0,0000 | ns |
| 55 | Qrg | Tl1 | 6,9050 | 6,9050 | 0,0000 | ns |
| 56 | Qgr | E-Vs | 23,8300 | 2,5740 | 5,4660 | ns |
| 57 | Qgr | Tl1 | 34,8300 | 34,8300 | 0,0000 | ns |
| 58 | Qch | Tl1 | 58,3300 | 58,3300 | 0,0000 | ns |
| 59 | Qpt | Tl1 | 34,8300 | 34,8300 | 0,0000 | ns |
| 60 | Qrs | E-Vs | 26,1600 | 26,1600 | 0,0000 | ns |
| 61 | Qrg | Tl1 | 58,3300 | 58,3300 | 0,0000 | 0,05 |
| 62 | Qrg | E-Vp | 18,3200 | 18,3200 | 0,0000 | ns |
| 63 | Qed,Qsd,Qpt | Tl2 | 16,7700 | 2,6340 | 2,6980 | ns |
| 64 | Qpt,Qe,Qsd | Tl1 | 18,3200 | 18,3200 | 0,0000 | ns |
| 65 | Qpt | H-Vp | 58,3300 | 58,3300 | 0,0000 | 0,05 |
| 66 | Qpt | P | 28,7800 | 28,7800 | 0,0000 | ns |
| 67 | Qgr | E-Vs | 55,3300 | 55,3300 | 0,0000 | ns |
| 68 | Plh | Tl1 | 17,9000 | 4,2180 | 6,5190 | ns |

Figura 2 Abundancia de agallas especialistas y generalistas presentes en la Sierra Fría, Aguascalientes, México.
A nivel de paisaje se encontró que la sección Quercus difiere significativamente de la sección Lobatae en el promedio de agallas especialistas por hospedero (X 2 = 15,23; P < 0,05). La sección Quercus (8,4 ± 12,6) presentó el doble de agallas que Lobatae (2,5 ± 1,53). Las especies de amplia distribución de la sección Lobatae (Q. eduardii), exhibieron cantidad intermedia de morfos especialistas similar a hospederos de la sección Quercus.
Nicho específico
La ubicación específica de las estructuras mostró preferencia por el envés a nivel de hoja y en la rama principal (Fig. 3). En hojas se encontró un 51 % de las agallas, mientras en tallo un 49 %. A nivel específico, más del 38 % de las agallas se encontraron ubicadas en el envés de las hojas y en el tallo 1 un 42,4 %, sin diferir significativamente entre sí, pero, mostraron diferencias significativas en el porcentaje de agallas con los demás sitios (X 2 = 32,45; P < 0,034), que representan en conjunto menos del 20 %.
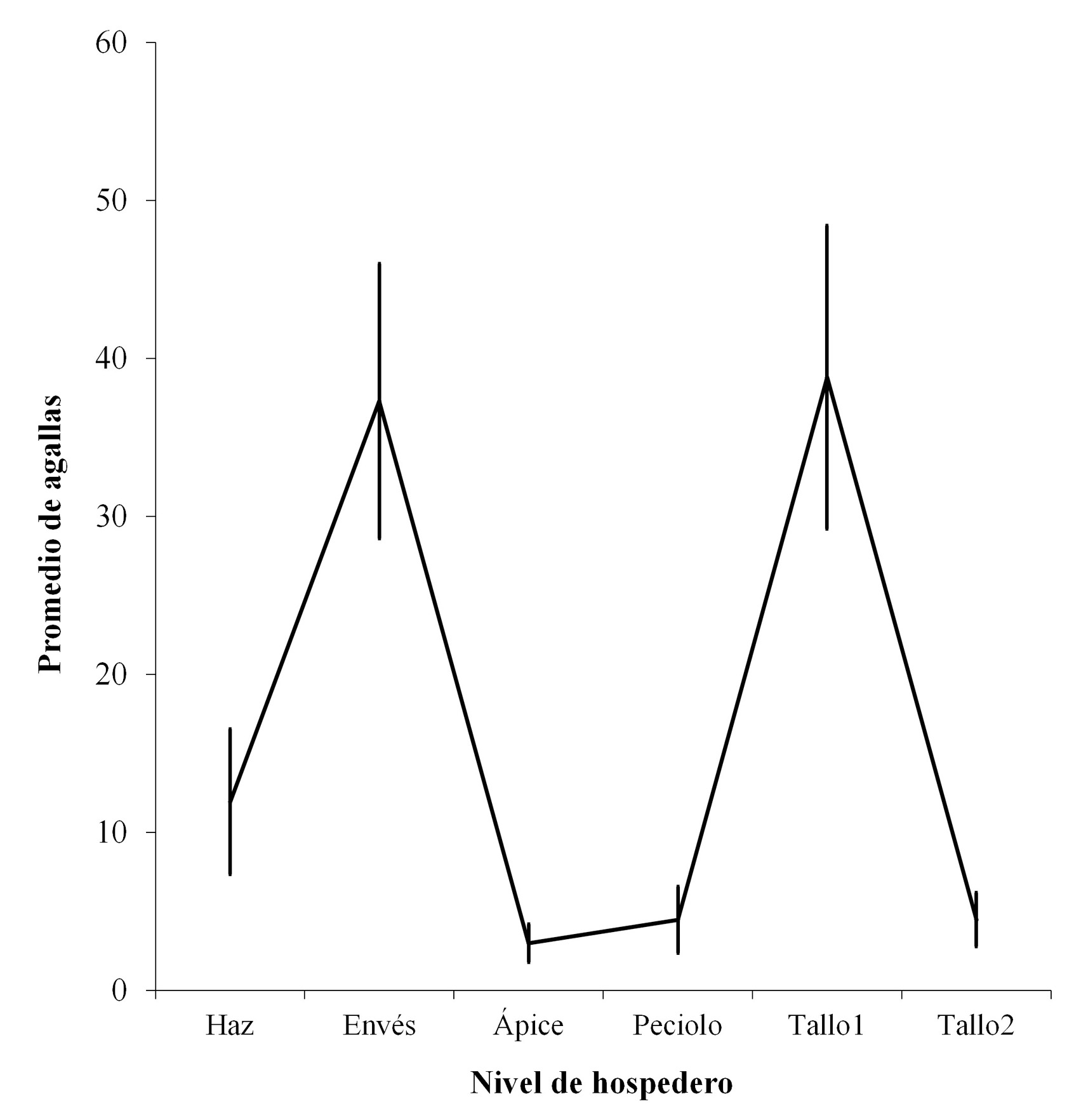
Figura 3 Porcentajes de agallas por ubicación específica dentro del hospedero en la Sierra Fría, Aguascalientes, México.
A nivel de hojas se encontró, que existe un mayor porcentaje de agallas ubicadas en la vena primaria y vena secundaria, y una menor cantidad de agallas en la vena terciaria (Fig. 4). Se observó un porcentaje similar entre la vena primaria y secundaria con diferencias significativas de éstas con respecto a venas sublaterales (X 2 = 14,5; P < 0,05).

Figura 4 Ubicación de agallas a nivel de hoja (vena primaria, secundaria y vena sublateral) en la Sierra Fría, Aguascalientes, México.
El análisis canónico de coordenadas principales (CAP) indicó una asociación significativa de la distribución temporal de las agallas y la ubicación específica dentro del hospedero (Fig. 5). El cuadrado de la correlación canónica (δ2 = 0,92; P = 0,001) fue significativamente alto lo que mostró un buen ajuste del modelo y lo asoció a preferencias de selección de microhábitat para ovoposición entre períodos.

Figura 5 Análisis canónico de coordenadas principales (CAP) en la Sierra Fría, Aguascalientes, México, generada con los coeficientes de disimilaridad (theta) de la matriz de abundancia y distribución de agallas (ver figura 1, para la abreviación de los sitios y tabla 3 para la descripción del hábitat).
Tolerancia y amplitud de las agallas
El análisis del índice de marginalidad indicó un efecto directo de las variables ambientales (climáticas y geográficas) sobre la abundancia y distribución de las agallas marcando un nicho ecológico para cada una de las estructuras. Sólo un 18 % de las estructuras presentaron una influencia significativa a las variables ambientales, con un valor de inercia que varió de 6,90 a 58,33. Se encontró además que un 42 % de las cecideas presentaron una tolerancia baja, es decir, un nicho ecológico con baja amplitud o muy especializado (Tabla 3).
El análisis de marginalidad fue significativo (P = 0,03), siendo los dos primeros ejes los que explican más del 80 % de la variación total (Fig. 6) y donde el primer eje absorbe el 60,77 % y el segundo contiene el 19,23 %. El primer eje (parte inferior) presentó una correlación significativa entre Quercus resinosa (Qrs) y Q. chihuahuensis (Qch) con el disturbio (D) y azimut (Az), mientras Q. eduardii (Qed), Q. grisea (Qgr) y Q. sideroxyla (Qsd) mostraron una alta significancia con la latitud (LT) y la precipitación máxima (PMX). En el eje 2 (parte superior), las especies de encino Q. potosina (Qpt) y Q. rugosa (Qrg) presentaron una correlación significativa en primer orden con variables de temperatura y en segundo con orográficas. Las agallas asociadas a cada hospedero mostraron una correlación significativa a las variables ambientales similar a la obtenida por sus hospederos en primer orden con variables climáticas y en segundo orden con orográficas.

Figura 6 Valores canónicos de las variables ambientales y hospederos y su efecto sobre la distribución de las especies de agallas en la Sierra Fría, Aguascalientes, México. La longitud de las flechas describe la importancia relativa de cada variable analizada y la dirección de la flecha indica la correlación entre variables. Ver tabla 1 y 2 para la descripción de las especies, sitios de muestreo y variables ambientales, respectivamente. Ver tabla 3 para la abreviatura de las agallas y datos de nicho ecológico.
Discusión
Los resultados de este estudio indican que los encinos son los hospederos preferentes de la familia Cynipidae, al encontrarse un 97 % de las agallas presentes en ellos, porcentaje muy superior al registrado en otras especies (pináceas, 3 % y 0 % en otros grupos de plantas). Esta preferencia por los encinos coincide con autores como Nieves-Aldrey (2001), Russo (2007) y Redfern (2011) quienes reportan una alta especificidad por esta familia. Esta especificidad puede ser derivada de la relación filogenética entre hospedero-parásito (Abrahamson et al. 1998), aspectos que pueden estar vinculados al alto porcentaje obtenido de estructuras especialistas a una sola especie de encino o sección.
En este contexto, se ha sugerido que las avispas agalleras son exclusivas de cada sección, esto es, que las agallas que están presentes en la sección Lobatae no lo están en la sección Quercus (Price 2005; Abrahamson et al. 1998). Esta especificidad puede ser derivada de los procesos de coevolución entre encinos y especies agalleras (Price 2005), de ahí que la selección hacia un sitio en particular de oviposición (hojas, tallos, flores o frutos) sea sincrónica con procesos de crecimiento, floración, fructificación o renovación de hojas (De Souza 2001; Clark-Tapia et al. 2013), aspectos que pueden variar debido a procesos climáticos y geográficos que guían la distribución entre las especies de encinos (Challenger 1998) y avispas agalleras (Medianero et al. 2010; Clark-Tapia et al. 2013).
En insectos, varios estudios muestran una estrecha asociación con factores climáticos (Kaspari 2003; Castro-Delgado et al. 2008) como reguladores del tamaño poblacional, cambios en la composición y diversidad de especies en un área. En este sentido, Medianero et al. (2010) reporta que existe un efecto de la temperatura y humedad en la abundancia y distribución de las agallas entre sitios, pero no encontraron diferencias entre estaciones a lo largo del año. Lo anterior coincide con lo obtenido en este estudio, sin embargo, entre períodos de sequía y lluvia se encontraron diferencias significativas en la localización de sitios de oviposición de las estructuras gallícolas. Esto sugiere tolerancia limitada y requerimientos climáticos específicos para el crecimiento y desarrollo de las avispas, así como procesos de sincronización de la oviposición con interacciones mutualistas parásito-hospedero (e.g. épocas de floración, producción de hojas, crecimiento, etc.), lo que demanda evaluarse a profundidad en el futuro.
A nivel nacional se han pronosticado cambios severos en la abundancia y distribución de la mayoría de las especies de encinos y pinos analizadas en este estudio, durante los próximos 50 a 80 años, debido al cambio climático (e.g.Gómez-Mendoza y Arriaga 2007). A nivel mundial, este fenómeno no sólo está afectando directamente la abundancia y distribución de diversidad biológica (Hódar y Zamora 2008; Primack 2012) sino también está generando cambios en las interacciones entre especies (Hódar y Zamora 2004; Lu et al. 2013), lo que puede influir directamente en las interacciones mutualistas entre hospedero-parásito (Dunn et al. 2009; Kamiya et al. 2014), como es el caso de las especies agalleras debido a la dependencia obligada por hospederos específicos y a su alta sensibilidad climática.
El bosque templado de SF varía considerablemente a nivel de paisaje y de un sitio a otro en su clima y geografía, estas diferencias por si solas, generan un ecosistema heterogéneo con gran diversidad de microhábitats. Varios autores como Challenger (1998) y Gobbi et al. (2006) mencionan que existen diversos factores aparte de las variaciones climáticas que provocan una gran heterogeneidad temporal y espacial en la estructura y dinámica natural de las comunidades. En este estudio, se encontró que la altitud afecta la abundancia y riqueza de cecideas, casos similares son reportados por Arvid (2003), Muñoz y Amarillo-Suárez (2010) y Clark-Tapia et al. (2013) debido a que se requiere de una gran estabilidad climática, con ausencia de extremos severos, propiciado en un cambio altitudinal.
Variables geográficas como la latitud y longitud presentaron un efecto significativo en la abundancia y distribución de agallas y hospederos, estas variables pueden incidir en la presencia de las especies. Diversos autores reportan que plantas hospederas de mayor distribución geográfica pueden albergar un mayor número de insectos fitófagos que los de distribución restringida (Price et al. 1980; Strong et al. 1984). Sin embargo, este patrón no se encuentra claramente definido en Sierra Fría, con Q. eduardii, especie de mayor distribución y la cual presenta un menor número de agallas que Q. grisea, Q. resinosa de menor distribución, pero mayor que Q. sideroxyla y Q. chihuahuensis, ambas especies de distribución restringida. Tomando en cuenta que los requerimientos de Q. eduardii son similares a los Q. potosina y Q. resinosa, se puede decir, que el alto porcentaje de estructuras especialistas a un solo hospedero o sección contribuye a las teorías de especificidad hospedero-especie gallícola y a la coevolución entre ambos grupos (Stone y Schönrogge 2003; Price 2005).
El disturbio es un factor causal de pérdida de biodiversidad (Dunn et al. 2009; Colwell et al. 2013) al afectar a la abundancia, distribución y riqueza de las especies, así como a las interacciones entre especies (Gobbi et al. 2006; Murray et al. 2008). No obstante, en este estudio, el disturbio no mostró un efecto negativo en la abundancia y riqueza de agallas, a pesar de los niveles de disturbio observados, lo que concuerda con Medianero et al. (2010) y Clark-Tapia et al. (2013). Sin embargo, en lugares muy fragmentados se observaron cambios en las relaciones tróficas. Por ejemplo, en la densidad de algunos morfos que incrementa el nivel de infestación del hospedero, así como cambios en las interacciones tróficas (e.g. competencia y depredación), lo que puede ocasionar efectos directos en el funcionamiento del ecosistema (Ma et al. 2009; Nicholls et al. 2010).
Sierra Fría, es un bosque templado con dominancia de encinos históricamente aprovechado desde el siglo XVIII y con procesos de cambio de uso de suelo hacia actividades agrícolas y ganaderas (Alfonso-Corrado et al. 2004). El uso actual de encinos para elaboración de carbón continúa, y dada la dependencia de los insectos formadores de agallas con este grupo de hospederos, en sinergia con la sensibilidad de las especies agalleras a factores climáticos y geográficos y la presencia de múltiples interacciones con otras especies, puede conducir a una extinción en cascada de especies y contribuir a la crisis en la pérdida de biodiversidad reportada por diversos autores (e.g.Dunn et al. 2009; Colwell et al. 2013). Actualmente, las relaciones mutualistas, no son consideradas en los criterios de evaluación de especies en riesgo (Lewis y Seniorardos 2011), ni en los criterios de biodiversidad de la certificación forestal (FSC 2011), por lo cual se sugiere incluirlas como estrategias de manejo y conservación de las especies.
Conclusiones
Los resultados indican una alta especialización con el género Quercus como hospederos y la presencia de procesos de coevolución entre encinos y especies agalleras dentro de cada sección del género. Se sugiere una especificidad de las avispas agalleras por los sitios de oviposición cuyo proceso, es sincrónico con aspectos fisiológicos del hospedero (e.g. floración, fructificación o renovación de hojas). Los análisis de nicho ecológico realizados indicaron una tolerancia limitada y requerimientos climáticos específicos para el crecimiento, desarrollo y distribución de las avispas agalleras, en asociación directa con sus hospederos. Finalmente, la ocurrencia de interacciones interespecíficas especializadas en las cecideas y su consecuente eliminación debido la extracción de hospederos puede conducir a una extinción en cascada de especies, aspecto que debe evaluarse a futuro.















