Introducción
Los insectos son el grupo de animales más diverso en la naturaleza y Colombia es uno de los países con mayor diversidad de insectos del mundo debido especialmente, a su exclusiva ubicación geográfica y a las características orográficas que inciden en la formación de distintos gradientes climáticos y edáficos que hacen posible la formación de una gran variedad de ecosistemas, muchos de ellos con un gran número de especies endémicas (Hernández y Sánchez 1992). Entre la diversidad de insectos de Colombia, se destaca la riqueza biológica de las especies de lepidópteros y coleópteros, siendo dos de los órdenes mejor estudiados en el país (SiB Colombia 2020).
Los insectos han colonizado casi todos los ambientes terrestres y esta variedad, ha generado una amplia diversidad de adaptaciones fisiológicas y morfológicas que los convierte en un grupo sensible a los cambios ambientales, por lo que se les considera como buenos indicadores de la calidad ambiental (Bursell 1974; Wainwright 1994; Chown y Nicolson 2004; Danks 2007; Schowalter y Baton 2016). En los ecosistemas terrestres, los insectos cumplen funciones tan importantes como la herbivoría, la polinización, la dispersión de semillas y la descomposición orgánica por lo que tienen un papel fundamental en el reciclado de los nutrientes y en la fertilidad del suelo (Dindal 1990; Weisser y Siemann 2013).
Las cifras más recientes calculan en cerca de 12 mil las especies conocidas de insectos en Colombia (IAvH 2017), aunque el mayor porcentaje de ellas que aún está por descubrir, habitan los ecosistemas de bosques y selvas naturales. La urbanización ha reducido las coberturas boscosas, lo cual ha desplazado y extinguido a la mayoría de las poblaciones de insectos, a la vez que ha reducido la interacción humana con la naturaleza, por lo que existe un desconocimiento generalizado de la biología e importancia de los insectos y de su estrecha relación con las actividades humanas. Se ignora que las grandes zonas verdes de las ciudades proporcionan una gran variedad de hábitats para los insectos, como por ejemplo los humedales, parques, jardines, bordes de vía, riberas y caminos (Gill et al. 2016).
En el caso de Bogotá, ciudad caracterizada por su gran transformación en el paisaje natural, es cada vez menos frecuente encontrar zonas verdes que contribuyan a la conservación de la diversidad biológica, y estas áreas en general se restringen a algunos relictos en las zonas de humedales y a los alrededores urbanos. El campus de la Universidad Nacional en la sede Bogotá, es un espacio que equilibra el ecosistema urbano, siendo uno de los pulmones más importantes de la ciudad que alberga distintas especies nativas de hierbas, árboles y arbustos de ecosistemas andinos (Infante et al. 2008); la amplia gama de zonas verdes del campus, lo convierte en un espacio de gran importancia para la residencia estacionaria y permanente de un gran número de especies animales incluidas las de insectos, y que como patrimonio natural debe conocerse y preservarse.
El presente trabajo buscó hacer una descripción de la composición de la riqueza faunística y la diversidad de los insectos dentro del campus de la Universidad Nacional en Bogotá, a partir de los resultados de los parámetros de caracterización ecológica y de los hábitos tróficos de las familias de insectos recolectados bajo diferentes ambientes en estratos verticales del campus, como parte del proceso de familiarizar a la comunidad universitaria y al público en general con su patrimonio biológico.
Materiales y métodos
Recolección y análisis de muestras.
Entre los años 2018 y 2020 se realizaron muestreos semestrales de insectos en tres ambientes de zonas verdes de la Ciudad Universitaria con distintas coberturas vegetales; arboledas, arbustales e invernaderos, que comprenden pastizales, zonas inundables y jardines (Fig. 1). Las capturas se realizaron en tres estratos verticales: superficial, herbáceo y arbustivo. Para el estrato superficial, se analizaron muestras procedentes de la instalación de 10 trampas de caída de 500 ml ubicadas en línea recta y separadas por distancias de 2 m dentro de transectos aleatorios (Greenslade 1964; Sabu et al. 2011), mientras que en los estratos herbáceos y arbustivos se realizaron tres muestreos con trampas de interceptación de vuelo con cebo volátil a alturas de 80 cm y 2 m respectivamente mantenidas por un tiempo de 48 horas (Peck y Davies 1980). Como complemento de estas técnicas, se utilizaron redes entomológicas para la captura de especímenes. Las muestras se etiquetaron y transportaron en alcohol al 70% al Laboratorio de Biología de Suelos del Departamento de Biología de la Universidad Nacional de Colombia (LABSUN) para su determinación taxonómica a nivel de familia o grupo supraespecífico con base en la clasificación propuesta por Grimaldi y Engel (2005) y mediante el uso de las claves taxonómicas de Johnson y Triplehorn (2005) y Gullan y Craston (2010) , confirmando los nombres válidos en Species 2000 y Catálogo ITIS (Roskov et al. 2019). Una vez terminada esta fase, los especímenes ingresaron a la colección registrada de este laboratorio (RNC 276) de manera permanente. Luego de la determinación taxonómica, se efectuó la asignación de gremios tróficos para cada grupo según la consulta bibliográfica encontrada en Johnson y Triplehorn (2005), Gullan y Craston (2010) y Rafael et al. (2012) en las siguientes categorías: fitófagos, polífagos, micófagos, coprófagos, saprófagos, hematófagos, depredadores y parásitos/parasitoides, incluyendo dentro de los hábitos fitófagos, aquellos grupos de insectos que se alimentan de diversos órganos vivos de las plantas y que contemplan a los polinizadores, defoliadores, trozadores, succionadores y minadores.
Análisis de los datos.
Para el análisis de los datos se evaluó la eficiencia de los muestreos por medio del estimador Chao-1 para hallar la completitud de la riqueza de grupos al relacionar la riqueza observada con la riqueza estimada y por el método de binomiales negativas que utiliza los valores de riqueza de los grupos en las distintas unidades muestrales; además, se realizó un análisis exploratorio de “box-plot” para evaluar la similaridad entre los sitios de muestreo (Montes y Ramírez 1978; Chao y Jost 2012). Se determinaron los modelos de abundancia a partir de los valores de riqueza de los grupos recolectados (MacArthur 1957; Krebs 1989) y se efectuaron dendrogramas de similaridad de Bray-Curtis a partir de los datos de presencia/ausencia a través del método de “single-linkage”. Se calcularon los valores de diversidad alfa de Brillouin (B), más recomendado para este tipo de muestreos, los valores de dominancia (D) y equitatividad de Simpson (1-D) y de diversidad beta de Wittaker (aW) a partir de los valores de abundancia de los grupos mediante el uso de los paquetes STATS (Bolar 2019), MASS (Ripley et al. 2020) y CAR (Fox et al. 2020) en el programa R v. 4.0.3 (R Development Core Team 2017) que fueron validadas mediante pruebas de Kruskal-Wallis. Finalmente, se evaluó la afinidad de la fauna con los sitios de muestreo mediante un Análisis de Correspondencia (DCA) utilizando el programa PAST v. 2.15 (Hammer et al. 2001)
Resultados
Abundancia y diversidad.
Se recolectaron 4.659 individuos en los tres sitios de muestreo, que se incluyen en 15 órdenes y 115 familias (Tabla 1). El 35,7% fue recolectado en las arboledas, el 33,5% en los arbustales y el 30,9% restante en los invernaderos. De los 115 grupos recolectados, 101 se obtuvieron en las arboledas, 91 en los invernaderos y 85 en los arbustales. No se encontraron diferencias en los valores de diversidad entre los sitios de muestreo (Kruskal-Wallis, H = 0,51 p = 0,05), los valores de diversidad en los tres sitios evaluados fueron bajos y con bajos valores de recambio (aW) y dominancia (D). Los valores de mayor diversidad faunística y equitatividad de grupos se obtuvieron en los invernaderos (HB = 3,58; 1-D = 0,96) y el de menor diversidad en las arboledas (HB = 3,49) que a la vez presentaron el mayor valor de dominancia (D = 0,047) (Tabla 2).
Tabla 1 Abundancia relativa de la entomofauna recolectada en tres zonas de muestreo de la Ciudad Universitaria.
| Familia/Grupo | Gremio | Arboledas | Arbustales | Invernaderos | Familia/Grupo | Gremio | Arboledas | Arbustales | Invernaderos | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Aeolothripidae | Fit | 0 | 0 | 0,003 | 59 | Lauxaniidae | Fit | 0,002 | 0,001 | 0 |
| 2 | Aeshnidae | Dep | 0,002 | 0,001 | 0,001 | 60 | Lepismatidae | Sap | 0,001 | 0 | 0 |
| 3 | Agaonidae | Fit | 0,002 | 0,001 | 0,002 | 61 | Libellulidae | Dep | 0,001 | 0,003 | 0,001 |
| 4 | Agromyzidae | Fit | 0,032 | 0,021 | 0,028 | 62 | Lycaenidae | Fit | 0,001 | 0,000 | 0,001 |
| 5 | Aleyrodidae | Fit | 0 | 0,002 | 0,016 | 63 | Lygaeidae | Fit | 0,001 | 0,001 | 0,001 |
| 6 | Amphipsocidae | Sap | 0,005 | 0 | 0,001 | 64 | Melolonthidae | Fit | 0,001 | 0,002 | 0,003 |
| 7 | Anisopodidae | Sap | 0,006 | 0,003 | 0,001 | 65 | Membracidae | Fit | 0 | 0,001 | 0,001 |
| 8 | Aphididae | Fit | 0,010 | 0,014 | 0,030 | 66 | Miridae | Fit | 0,001 | 0 | 0,002 |
| 9 | Apidae | Fit | 0,003 | 0,001 | 0,003 | 67 | Muscidae | Cop | 0,001 | 0,003 | 0,006 |
| 10 | Bibionidae | Sap | 0,004 | 0,005 | 0,008 | 68 | Mycetophilidae | Mic | 0,024 | 0,021 | 0,017 |
| 11 | Blattidae | Pol | 0,004 | 0,003 | 0,005 | 69 | Mymaridae | Psd | 0 | 0 | 0,001 |
| 12 | Braconidae | Psd | 0,001 | 0 | 0 | 70 | Nitidulidae | Fit | 0,017 | 0,020 | 0,031 |
| 13 | Calliphoridae | Sap | 0,010 | 0,003 | 0,005 | 71 | Noctuidae | Fit | 0,001 | 0,002 | 0,006 |
| 14 | Carabidae | Dep | 0,005 | 0,002 | 0,003 | 72 | Notonectidae | Dep | 0,002 | 0 | 0 |
| 15 | Cebrionidae | Fit | 0,001 | 0 | 0 | 73 | Nymphalidae | Fit | 0,001 | 0,004 | 0,006 |
| 16 | Cecidomyiidae | Fit | 0,010 | 0,030 | 0,030 | 74 | Onychiuridae | Sap | 0,025 | 0,042 | 0,033 |
| 17 | Cerambycidae | Fit | 0,001 | 0 | 0,001 | 75 | Pentatomidae | Fit | 0,001 | 0 | 0 |
| 18 | Ceratopogonidae | Hem | 0,007 | 0,009 | 0,006 | 76 | Phalacridae | Pol | 0,001 | 0,007 | 0,004 |
| 19 | Cercopidae | Fit | 0,006 | 0,014 | 0,012 | 77 | Phloeothripidae | Fit | 0,005 | 0,003 | 0,005 |
| 20 | Chalcidae | Psd | 0,003 | 0,005 | 0,002 | 78 | Phoridae | Sap | 0,092 | 0,104 | 0,082 |
| 21 | Chironomidae | Fit | 0,005 | 0,008 | 0,011 | 79 | Pieridae | Fit | 0,001 | 0,003 | 0,001 |
| 22 | Chloropidae | Sap | 0,023 | 0,026 | 0,019 | 80 | Poduridae | Sap | 0,025 | 0,042 | 0,032 |
| 23 | Chrysomelidae | Fit | 0,004 | 0,005 | 0,010 | 81 | Pompilidae | Dep | 0,001 | 0 | 0 |
| 24 | Chrysopidae | Fit | 0,001 | 0 | 0 | 82 | Pselaphidae | Dep | 0,001 | 0,004 | 0,002 |
| 25 | Cicadellidae | Fit | 0,026 | 0,023 | 0,020 | 83 | Psychodidae | Hem | 0,019 | 0,014 | 0,022 |
| 26 | Coccinellidae | Dep | 0,002 | 0 | 0,001 | 84 | Psyllipsocidae | Sap | 0,001 | 0,001 | 0 |
| 27 | Coenagrionidae | Dep | 0,001 | 0,003 | 0 | 85 | Ptiliidae | Mic | 0,024 | 0,034 | 0,008 |
| 28 | Conopidae | Psd | 0,001 | 0,003 | 0,001 | 86 | Pyrrhocoridae | Pol | 0,001 | 0 | 0 |
| 29 | Coreidae | Fit | 0,001 | 0 | 0,001 | 87 | Reduviidae | Dep | 0 | 0 | 0,001 |
| 30 | Culicidae | Hem | 0,001 | 0,004 | 0,001 | 88 | Riodinidae | Fit | 0,001 | 0,001 | 0 |
| 31 | Curculionidae | Fit | 0,007 | 0,005 | 0,002 | 89 | Sarcophagidae | Sap | 0,001 | 0,003 | 0,006 |
| 32 | Cydnidae | Fit | 0,001 | 0,006 | 0,011 | 90 | Satyridae | Fit | 0,001 | 0 | 0 |
| 33 | Delphacidae | Fit | 0,040 | 0,046 | 0,034 | 91 | Scarabaeidae | Cop | 0,008 | 0,010 | 0,008 |
| 34 | Dixidae | Fit | 0,001 | 0 | 0 | 92 | Scatopsidae | Cop | 0,002 | 0,003 | 0,001 |
| 35 | Dolichopodidae | Dep | 0,004 | 0,004 | 0,006 | 93 | Sciaridae | Mic | 0,022 | 0,028 | 0,019 |
| 36 | Drosophilidae | Fit | 0,055 | 0,049 | 0,031 | 94 | Sciomyzidae | Fit | 0 | 0,003 | 0,001 |
| 37 | Dynastidae | Fit | 0,001 | 0,003 | 0,001 | 95 | Scolytidae | Xil | 0,002 | 0,008 | 0,005 |
| 38 | Dytiscidae | Dep | 0,002 | 0 | 0 | 96 | Sepsidae | Sap | 0,002 | 0,009 | 0,004 |
| 39 | Elateridae | Fit | 0,001 | 0 | 0,001 | 97 | Silphidae | Sap | 0 | 0,001 | 0,000 |
| 40 | Electrentomidae | Sap | 0,001 | 0,002 | 0,004 | 98 | Sminthuridae | Sap | 0,053 | 0,042 | 0,029 |
| 41 | Empididae | Dep | 0,007 | 0,010 | 0,006 | 99 | Sphaeroceridae | Sap | 0,002 | 0,001 | 0,001 |
| 42 | Entomobryidae | Sap | 0,046 | 0,029 | 0,047 | 100 | Sphingidae | Fit | 0 | 0 | 0,001 |
| 43 | Erebidae | Fit | 0,004 | 0,003 | 0,006 | 101 | Staphylinidae | Pol | 0,012 | 0,009 | 0,006 |
| 44 | Eulophidae | Psd | 0 | 0 | 0,001 | 102 | Stratiomyidae | Sap | 0,001 | 0 | 0 |
| 45 | Eurytomidae | Psd | 0 | 0,001 | 0 | 103 | Syrphidae | Fit | 0,001 | 0,003 | 0 |
| 46 | Forficulidae | Fit | 0 | 0,003 | 0,006 | 104 | Tabanidae | Hem | 0,001 | 0 | 0,001 |
| 47 | Formicidae | Pol | 0,127 | 0,070 | 0,099 | 105 | Tachinidae | Psd | 0 | 0 | 0,003 |
| 48 | Fulgoridae | Fit | 0,008 | 0,012 | 0,008 | 106 | Tenebrionidae | Sap | 0,006 | 0,006 | 0,001 |
| 49 | Gelechiidae | Fit | 0,001 | 0,004 | 0,002 | 107 | Tenthredinidae | Fit | 0 | 0,001 | 0 |
| 50 | Geometridae | Fit | 0,004 | 0,005 | 0,003 | 108 | Tephritidae | Cop | 0,002 | 0,004 | 0,006 |
| 51 | Heliconiidae | Fit | 0,001 | 0,001 | 0 | 109 | Tettigoniidae | Fit | 0,001 | 0 | 0,000 |
| 52 | Hemipsocidae | Sap | 0,001 | 0 | 0,001 | 110 | Thripidae | Fit | 0,001 | 0,004 | 0,001 |
| 53 | Hesperiidae | Fit | 0 | 0,002 | 0,001 | 111 | Tipulidae | Sap | 0,005 | 0,003 | 0,001 |
| 54 | Histeridae | Dep | 0,001 | 0 | 0 | 112 | Tortricidae | Fit | 0,005 | 0,004 | 0,008 |
| 55 | Hypogastruridae | Sap | 0,026 | 0,015 | 0,045 | 113 | Trichogrammatidae | Psd | 0 | 0,001 | 0,001 |
| 56 | Ichneumonidae | Psd | 0,004 | 0,002 | 0,004 | 114 | Ulidiidae | Pol | 0,013 | 0,011 | 0,008 |
| 57 | Isotomidae | Sap | 0,076 | 0,085 | 0,076 | 115 | Vespidae | Dep | 0,001 | 0 | 0,001 |
| 58 | Labiidae | Sap | 0,002 | 0,001 | 0 |
La abundancia y composición de los grupos presentan pocas variaciones de un ambiente a otro (Fig. 2A). En general, existe una equitativa repartición de la abundancia entre los grupos dominantes y pocos grupos exclusivos de alta abundancia, lo cual es observable en las gráficas de los modelos de abundancia y en su mayor ajuste a los modelos logarítmicos (Fig. 3 A-C ). La riqueza esperada en los sitios de muestreo fue mayor a la encontrada según los valores en el índice Chao-1, del cual se deriva el cálculo del porcentaje de completitud, que fue mayor en los invernaderos (94,4%) y menor en las arboledas (91,8%), por lo que se puede considerar que la mayoría de la riqueza de insectos fue recolectada mediante las técnicas de muestreo utilizadas.
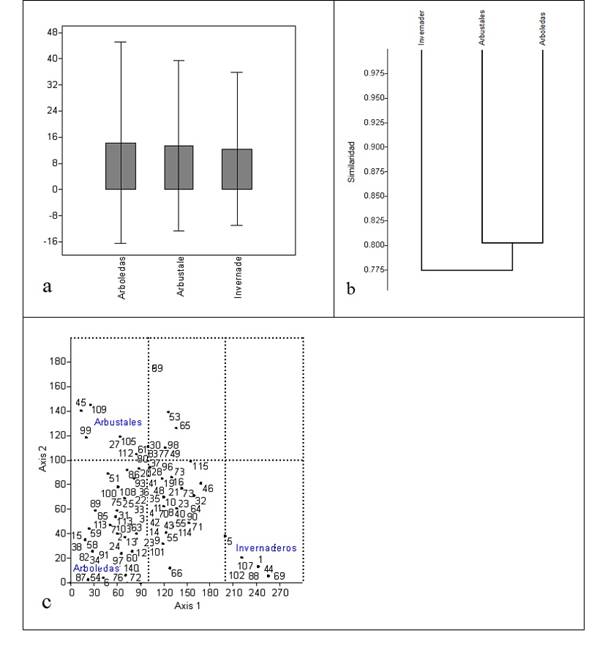
Figura 2 Análisis de “box-plot” (a), similaridad de Bray-Curtis (p = 0,96) según el algoritmo de “single linkage” (b) y análisis de correspondencia (“Eigenvalues”: axis 1 = 0,67, axis 2 = 0,04) (c) de tres zonas de muestreo en la Ciudad Universitaria. El número asignado a cada grupo corresponde a la Tabla 1.
En cuanto a la variación vertical, la mayor riqueza de grupos se encontró en los estratos herbáceos y menor en los superficiales (Fig. 3 D-F). Las familias más abundantes en el estrato herbáceo de las arboledas fueron Formicidae (Hymenoptera), Agromyzidae, Drosophilidae, Phoridae (Diptera), y Delphacidae (Hemiptera); en los arbustales las familias Drosophilidae, Phoridae (Diptera), Formicidae (Hymenoptera), Delphacidae (Hemiptera) y Ptiliidae (Coleoptera), y en los invernaderos las familias Formicidae (Hymenoptera), Drosophilidae, Phoridae (Diptera), Delphacidae (Hemiptera) y Nitidulidae (Coleoptera). Para el caso de los grupos exclusivos, estos representan entre el 5 y el 15% de la fauna colectada en los tres ambientes muestreados, lo cual sugiere una composición faunística muy similar en todos ellos, reflejado en los valores de recambio de diversidad beta (Tabla 2). Las familias exclusivas en las arboledas fueron Braconidae (Hymenoptera), Cebrionidae, Dytiscidae, Histeridae, Staphylinidae (Coleoptera), Chrysopidae (Neuroptera), Dixidae, Stratiomyidae (Diptera), Lepismatidae (Zygentoma), Notonectidae, Pentatomidae, Pyrrhocoridae (Hemiptera), Pompilidae (Hymenoptera), Satyridae (Lepidoptera) y Tettigoniidae (Orthoptera); en los arbustales las familias Eurytomidae, Tenthredinidae (Hymenoptera) y Silphidae (Coleoptera), y en la zona de los invernaderos las familias Aeolothripidae (Thysanoptera), Eulophidae, Mymaridae (Hymenoptera), Reduviidae (Hemiptera), Sphingidae (Lepidoptera) y Tachinidae (Diptera). En la Tabla 1 se muestra la composición y la abundancia relativa de las familias de la artropofauna recolectada en los ambientes estudiados de la Ciudad Universitaria.

Figura 3 Modelos de abundancia para la entomofauna (a, b, c) y abundancia de grupos taxonómicos (d, e, f) de las zonas muestreadas en la Ciudad Universitaria; arboledas (a, d); arbustales (b, e); invernaderos (c, f).
Tabla 2 Estimadores de diversidad alfa y beta para la entomofauna recolectada en tres zonas de muestreo de la Ciudad Universitaria.
| Diversidad Alfa | ||||
|---|---|---|---|---|
| Arboledas | Arbustales | Invernaderos | ||
| Taxa_S | 101 | 85 | 91 | |
| Individuos | 1665 | 1551 | 1443 | |
| Brillouin | 3,492 | 3,542 | 3,587 | |
| Dominance_D | 0,048 | 0,041 | 0,039 | |
| Simpson_1-D | 0,952 | 0,959 | 0,961 | |
| Chao-1 | 110 | 90,14 | 96,35 | |
| Diversidad Beta (aW) | ||||
| Arboledas | Arbustales | Invernaderos | ||
| Arboledas | 0 | 0,183 | 0,177 | |
| Arbustales | 0,182 | 0 | 0,148 | |
| Invernaderos | 0,177 | 0,148 | 0 | |
Los grupos faunísticos se pueden discriminar por su mayor afinidad a las condiciones microclimáticas debido a su abundancia, frecuencia o exclusividad. En la Figura 2C se muestra la mayor afinidad de las distintas familias recolectadas a las condiciones de los ambientes de arboledas, arbustales e invernaderos. Así, para los ambientes de arboledas se observa mayor afinidad de familias como Braconidae (Hymenoptera), Delphacidae (Hemiptera), Carabidae, Chrysomelidae, Dynastidae, Ptiliidae, Scolytidae, Staphylinidae (Coleoptera), Hesperiidae, Noctuidae (Lepidoptera), Lauxaniidae, Sarcophagidae, Ulidiidae (Diptera); para los arbustales, mayor afinidad de las familias Eulophidae (Hymenoptera), Sepsidae (Diptera) y Tenebrionidae (Coleoptera), y para los invernaderos las familias Aeolothripidae (Thysanoptera), Erebidae (Lepidoptera), Mycetophilidae, Sphaeroceridae, Tabanidae (Diptera) y Pyrrhocoridae (Hemiptera).
Gremios tróficos.
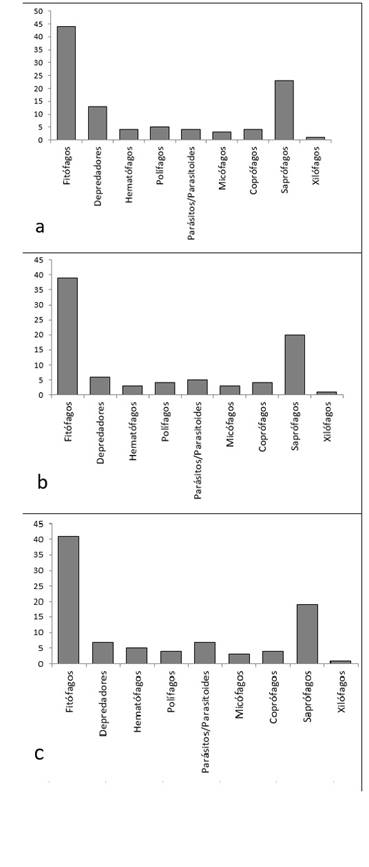
El gremio de los fitófagos (defoliadores, trozadores, succionadores y minadores), fue el más abundante en los tres ambientes seguido de saprófagos y depredadores en las arboledas y arbustales y por los saprófagos, parásitos/parasitoides y depredadores en la zona de invernaderos (Fig. 4). Estos gremios fitófagos están en las arboledas representados por familias de gran abundancia como Formicidae (Hymenoptera), Agromyzidae, Drosophilidae (Diptera), Cicadellidae, Delphacidae (Hemiptera) y Nitidulidae (Coleoptera); en los arbustales por las familias Formicidae (Hymenoptera), Drosophilidae (Diptera), Aphididae, Cicadellidae, Delphacidae (Hemiptera), Agromyzidae, Cecidomyiidae (Diptera) y Nitidulidae (Coleoptera), y en los invernaderos por las familias Formicidae (Hymenoptera), Aphididae, Aleyrodidae, Delphacidae (Hemiptera), Nitidulidae (Coleoptera), Agromyzidae, Cecidomyiidae y Drosophilidae (Diptera), mientras que los gremios saprófagos en los que se deben incluir a los colémbolos debido a su importancia funcional, se representan en las arboledas por insectos de las familias Anisopodidae, Calliphoridae, Chloropidae, Phoridae (Diptera), Tenebrionidae (Coleoptera) y colémbolos como Entomobryidae, Hypogastruridae, Isotomidae, Onychiuridae, Poduridae y Sminthuridae (Collembolla); en los arbustales estos gremios están compuestos por las familias Chloropidae, Phoridae, Sepsidae (Diptera), Entomobryidae, Hypogastruridae, Isotomidae, Onychiuridae, Poduridae, Sminthuridae (Collembola), y en los invernaderos por dípteros de las familias Bibionidae, Chloropidae y Phoridae (Diptera), y por colémbolos pertenecientes a las familias Entomobryidae, Hypogastruridae, Isotomidae, Onychiuridae, Poduridae y Sminthuridae (Collembola). Entre los grupos de hábitos depredadores, terceros en abundancia en arboledas y arbustales, se encontraron las familias Dolichopodidae (Diptera), Coccinellidae (Coleoptera), Aeshnidae, Coenagrionidae, Libellulidae (Odonata), Pompilidae (Hymenoptera), Carabidae, Histeridae, Pselaphidae, Staphylinidae (Coleoptera) y Vespidae (Hymenoptera), mientras que, entre los insectos de hábitos parásitos y parasitoides de las zonas de invernaderos, se encontraron las familias Conopidae, Tachinidae (Diptera), Chalcididae, Eulophidae, Mymaridae y Trichogrammatidae (Hymenoptera).
Discusión
Abundancia y diversidad.
No existe una marcada diferencia en los valores de diversidad entre los ambientes estudiados; los resultados muestran en general, una baja diversidad de insectos propia de zonas con gran impacto de intervención (Kremen et al. 1993; Camero 2002; Weisser y Siemann 2013). La gran cantidad de grupos compartidos, permite considerar ecológicamente a la Ciudad Universitaria, como una zona homogénea cuyas especies se encuentran bajo condiciones microclimáticas similares cuantificable en la gran similaridad en la composición de grupos (Fig. 2B), así como en la similaridad entre los valores de los índices de diversidad alfa y en los valores de recambio medidos mediante el índice de Wittaker (aW) (Tabla 2) (Cornell y Lawton 1992; Halffter y Ezcurra 1992; Colwell y Coddington 1994). De acuerdo con los modelos de abundancia, en todos ambientes se encontraron muchos grupos con pocos individuos o “singletons” (taxones raros con un solo individuo), de tal manera que la diversidad no depende solamente de la riqueza sino también de la cantidad de grupos raros o únicos que se encuentren en la comunidad, y a mayor grado de dominancia de algunos pocos grupos y de la poca abundancia de la mayoría, menor será la diversidad (Gaston 1994; Flather y Sieg 2007). Estos modelos espaciales son comunes en comunidades naturales sometidas a condiciones medioambientales de gran intervención (Schowalter 1985; Novotny y Basset 2000).
Muchos de los mecanismos fisiológicos especialmente en insectos, son muy dependientes de las condiciones ambientales; la humedad y la temperatura son los condicionantes más importantes para el desarrollo y la actividad de los insectos (Schowalter 1985; Basset et al. 2003; Chown y Nicolson 2004). En el suelo, los insectos y otros artrópodos como los colémbolos intervienen en la conformación de las características estructurales, en la porosidad y la aireación de los horizontes superficiales, a la vez que en funciones ecológicas tan importantes como la regulación de poblaciones y la liberación de nutrientes (Coleman y Wall 2015).
Al evaluarse comparativamente la riqueza y abundancia de la fauna en la estructura vertical de los distintos ambientes, se encuentran diferencias especialmente entre la fauna recolectada en el estrato herbáceo con respecto a la fauna superficial y arbustiva (Fig. 3), lo que podría interpretarse como un efecto de las condiciones ambientales más estables en este estrato ante las mayores variaciones microclimáticas de los estratos arbustivos. La temperatura, la humedad del aire afectada por la radiación solar y la transpiración de la vegetación, producen gradientes microclimáticos que inducen a la movilidad de los artrópodos según su tolerancia fisiológica y sus preferencias de hábitat para su alimentación, incubación o el desarrollo de juveniles (Gaston y Lawton 1988; Brühl et al. 1998; Chown y Nicolson 2004); la temperatura está estrechamente relacionada con la mayoría de los procesos metabólicos y con desencadenantes fisiológicos complejos que afectan la dinámica poblacional en aspectos como la metamorfosis y la longevidad (Bursell 1974; Chown y Nicolson 2004).
Gremios tróficos.
El gremio de los fitófagos fue el más abundante en todos los ambientes estudiados y en todos los estratos; en este gremio pueden incluirse también a muchos grupos de hábitos polífagos de insectos que aprovechan los recursos vegetales en sus formas inmaduras o adultas o en algún estado de desarrollo de su ciclo de vida (Johnson y Triplehorn 2005). Los hábitos fitófagos incluyen a muchos grupos de artrópodos, especialmente insectos que se especializan o aprovechan de manera generalizada de todos los tejidos vegetales y que están conformados por grupos de hábitos folívoros, trozadores, succionadores, minadores y libadores (Price 1984; Schowalter et al. 1986); bajo determinadas condiciones, es más común encontrar una mayor abundancia de grupos generalistas que especializados que obtengan el máximo beneficio energético a partir del consumo de las estructuras foliares y de los tejidos de conducción (Novotny et al. 2002, Neves et al. 2010).
La herbivoría es el proceso más importante en la transformación y el flujo de la energía ecosistémica, cuantificable en la biomasa de la fauna herbívora, la cual asimila alrededor del 20% de los órganos más palatables de las plantas, ya sea de los tejidos superficiales de los órganos expuestos o de sus fluidos internos (Price 1984; Del Val 2012). En la estratificación vertical de los bosques naturales, los insectos herbívoros más especializados son más comunes en los estratos superiores como el dosel, debido a la menor palatabilidad de las hojas más viejas (Basset et al. 2003), este aspecto podría explicar en algún grado, la menor abundancia de insectos en los estratos arbustivos de los ambientes muestreados. En los ecosistemas naturales, la mayoría de los insectos herbívoros se incluyen dentro de los órdenes Coleoptera, Diptera, Hemiptera, Hymenoptera, Lepidoptera y Orthoptera, cuya energía y biomasa acumulada es aprovechada por los grupos depredadores y parásitos (Del Val 2012); en los ambientes muestreados en la Ciudad Universitaria la mayor abundancia de insectos pertenece a estos grupos y está representada por Formicidae (Hymenoptera), Agromyzidae, Cecidomyiidae, Drosophilidae (Diptera), Aphididae, Aleyrodidae, Cicadellidae, Delphacidae (Hemiptera) y Nitidulidae (Coleoptera) observadas en la Tabla 1.
En los estratos herbáceos y edáficos se realiza la transformación de la biomasa especialmente por los grupos que conforman los gremios saprófagos, xilófagos coprófagos y fungívoros que contribuyen a la liberación de los nutrientes siguiendo la vía detrítica (Dindal 1990; Odum y Barret 2006; Camero y Chamorro 2021). La actividad de la artropofauna en el suelo acelera la velocidad de desintegración del material vegetal e incrementa la acción microbial relacionada directamente con los ciclos de los nutrientes (Price 1984; Lescure y Boulet 1985). En los ambientes estudiados, los gremios detritívoros y saprófagos fueron los más abundantes después de los grupos fitófagos y están conformados por las familias Anisopodidae, Bibionidae, Chloropidae, Calliphoridae, Phoridae, Sepsidae (Diptera), Tenebrionidae (Coleoptera), y por las familias Entomobryidae, Hypogastruridae, Isotomidae, Onychiuridae, Poduridae y Sminthuridae, (Collembola). La mayoría de estos grupos desempeñan sus funciones ecológicas en estos estratos de manera permanente, pero muchos otros solo desempeñan funciones temporales en alguna de sus etapas de desarrollo (Dindal 1990; Coleman y Wall 2015). Los grupos depredadores, parásitos y parasitoides, conforman los gremios que tradicionalmente conforman la cúspide de las cadenas de energía; sin embargo, estos grupos no solo transforman la energía que proviene de los fitófagos, saprófagos y detritívoros, sino que también son fuente del reciclado de nutrientes a través de los grupos saprófagos, una vez han cumplido su ciclo de vida y se integran al material orgánico del suelo (Weisser y Siemann 2013; Coleman y Wall 2015).
Caracterización de la fauna.
En general, los ambientes estudiados en la Ciudad Universitaria se caracterizan por los bajos valores de diversidad de las comunidades de insectos, altos valores de recambio y un alto porcentaje de grupos muy comunes, con mayores abundancias en los estratos herbáceos en los que se presentan estructuras tróficas con predominio de grupos de hábitos fitófagos y saprófagos; estos últimos mucho más frecuentes en los estratos superficiales debido a la mayor oferta de material orgánico (Basset et al. 2003). La mayor riqueza de grupos en los estratos herbáceos puede interpretarse a la luz de la mayor estabilidad microclimática y la disponibilidad de recursos con mayores ofertas alimenticias que se reflejan en valores cuantificables de abundancia y diversidad (Basset et al. 2003; Chown y Nicolson 2004).