Introducción
La especie Gliricidia sepium (Jacq.) Kunth ex Walp. (Fabales: Fabaceae), conocida en Panamá como balo (es conocida en Colombia como matarratón y en Costa Rica como madero negro), es un árbol que puede llegar a medir entre 5,0 y 15,0 metros de alto y crece a bajas elevaciones en lugares secos o húmedos, principalmente de las provincias de Coclé, Herrera y Los Santos (Arco Seco de Panamá) donde la planta se destina en diversos usos entre los cuales se incluyen postes de cercas vivas, forraje para ganado vacuno, agroforestería, remedios medicinales caseros y rodenticida en las áreas secas (Pérez & Condit, 2020).
Debido a sus altos niveles de proteína y aceptable valor nutritivo, G. sepium se ha transformado en una planta forrajera fuente de suplementación para alimentación animal que ha sido incluida dentro de prácticas silvopastoriles en la región del trópico (Cuervo-Jiménez et al., 2013). La planta es una excelente fuente de leña además de ofrecer un servicio como barreras rompevientos y como planta para controlar la erosión en zonas de laderas (Pizarro, 2005). A pesar de los diversos usos que presenta este árbol, no existe un registro formal de la población de árboles de la especie en Panamá (INEC, 2021; MIDA, 2021).
El árbol de G. sepium se caracteriza por florecer y fructificar de diciembre a mayo. Sus flores, por su color rosa, púrpura o blancas durante el período seco, son atractivas para abejas, mariposas y otros insectos (Pérez & Condit, 2020). La especie G. sepium está incluida dentro de la flora medicinal de interés humano y veterinario en Panamá. Sus principios activos curativos, que incluyen saponósido, taninos, flavonoides, vitamina C, sales minerales silícicas, potásicas, magnésicas y de aluminio, proveen a la planta de propiedades terapéuticas dentro de la actividad fungicida antiparasitaria orientada a resolver problemas de sarnas, hongos, urticarias, infecciones cutáneas y quemaduras en humanos y animales (García, 2008).
Los árboles de G. sepium pueden presentar hasta 295 racimos de flores con hasta 34 flores promedio por racimo, llegando a presentarse hasta 10.030 flores por árbol (Fonte et al., 2013). Las flores de G. sepium pueden presentar contenidos de azúcares simples tales como glucosa (4,82 %), fructosa (10,36 %) y sacarosa (1,73 %), además pueden presentar porcentajes considerables de materia seca (8,69 %), fibra bruta (32,57 %), lignina de Klason (28,80 %), proteína bruta (7,04 %) y calcio (0,99 %) (Fonte et al., 2013). Entre los grupos de insectos que son atraídos por las flores de esta especie se encuentran los trips (orden Thysanoptera) que previamente reportaban preferencia por las flores de una gran diversidad de especies de plantas, incluyendo flores de café (Coffea spp.), mango (Mangifera indica L.), sandía (Citrullus lanatus [Thunb.] Matsum. y Nakai) y arvenses asociadas, entre otras (Barba & Suris, 2015; Infante et al., 2017; Rocha et al., 2012).
Para el caso del G. sepium reportes previos en Colombia asocian sus flores a diversas especies de Thysanoptera, destacando la preferencia del género Frankliniella Karny, 1910, incluyendo Frankliniella insularis (Franklin), 1908 (Thysanoptera: Thripidae) (Ebratt, 2020), así como la especie Scirtothrips dorsalis Hood, 1919 (Thysanoptera: Thripidae) (Ebratt et al., 2018). En Cuba, G. sepium ha sido relacionada con poblaciones de Frankliniella schultzei (Trybom), 1910 (Thysanoptera: Thripidae) (Jiménez et al., 2006) y F. insularis (González et al., 2011). En México se ha reportado G. sepium como planta hospedera del trips depredador Franklinothrips vespiformis (Crawford, 1909) (Thysanoptera: Aeolothripidae) que ha sido reportado como depredador de otras especies de artrópodos que incluyen larvas y adultos de la especie de trips Selenothrips rubrocinctus (Giard, 1901) (Thysanoptera: Thripidae) (Sánchez, 1999).
En Costa Rica, G. sepium se ha reportado como planta hospedera de Hydatothrips gliricidiaeMound & Marullo, 1996 (Thysanoptera: Thripidae) (Lima & Mound, 2016), F. insularis (Retana-Salazar & Rodríguez-Arrieta, 2012) y Frankliniella caribae Retana-Salazar, 2010 (Thysanoptera: Thripidae) (Retana-Salazar, 2015), está última especie definida por otros investigadores como una sinonimia de F. insularis (Mound, 2015). En India, las flores de G. sepium han sido asociadas con la presencia de especies de trips Megalurothrips distalis (Karny), 1913 (Thysanoptera: Thripidae), F. schutzei (Trybom) y Haplothrips ganglbaueri Shmutz, 1913 (Thysanoptera: Phlaeothripidae) (Viswanathan & Ananthakrishnan, 1974).
El principal daño directo de los trips sobre las plantas hospederas está concentrado sobre el tejido vegetal de la superficie epidérmica incluyendo brotes, floración y fruto (Duran et al., 2017; Grové et al., 2001). Aunado a los daños directos sobre plantas, sobre todo aquellas con un estatus de cultivos agrícolas, se suma su capacidad de ser insectos vectores, como ocurre con el reporte de 15 especies de trips con la habilidad de transmitir Tospovirus que afectan un amplio rango de más de 500 especies dentro de 50 familias de plantas (Moritz et al., 2009; Mound, 1996; Rotenberg et al., 2015; Ullman, 1996; Whitfield et al., 2005). De estas especies de trips vectores, Frankliniella cephalica (Crawford, 1910) (Thysanoptera: Thripidae) y F. schultzei, han sido reportadas en G. sepium (Ebratt, 2020; González et al., 2011), pero sin reportes actualmente sobre esta planta en Panamá (Goldarazena et al., 2012). En Panamá, reportes previos indican la asociación de la especie Caliothrips nanus (Hood, 1928) (Thysanoptera: Thripidae) con el árbol de G. sepium (Goldarazena et al., 2012; Sánchez-Monge et al., 2011). El objetivo de este estudio fue estimar la presencia de adultos de la especie F. insularis asociados con flores de G. sepium en el pacífico de Coclé, Panamá.
Materiales y métodos
Se realizaron colectas quincenalmente durante el periodo de diciembre de 2021 (período lluvioso) hasta marzo de 2022 (período seco) asociadas con la etapa de floración en las plantas de G. sepium en la región pacífica de la provincia de Coclé, Panamá.
El estudio fue descriptivo. El tamaño de muestra fue en 10 localidades en un transecto de 103 kilómetros próximos a la carretera Panamericana en la provincia de Coclé. Las localidades se georreferenciaron con un GPS portátil para obtener los datos de latitud, longitud y altitud de las localidades y el tramo de colecta fue presentado en un mapa creado con el software QGIS 3.22.0 (Fig. 1). En cada localidad se seleccionó un árbol de la línea de cerca viva establecida de G. sepium modificando la metodología utilizada por Barba y Suris (2015).
En cada uno de los árboles seleccionados, con alturas entre 1,5 metros y 2,0 metros, se eligieron al azar cuatro flores dentro de cuatro diferentes racimos (Fig. 2), que se ingresaron dentro de viales de 4 Dram de vidrio con tapa, que contenían alcohol al 70 % según la metodología de Retana-Salazar y Rodríguez-Arrieta (2012). Los viales fueron llevados al Laboratorio de Protección Vegetal del Centro de Innovación Agropecuaria de Divisa (CIAD) del Instituto de Innovación Agropecuaria de Panamá (IDIAP) donde se procedió a contabilizar y a separar por morfo especies los especímenes de trips adultos capturados. Se procedió al montaje de láminas fijas siguiendo la metodología propuesta por Mound y Kibby (1998) y modificada por Barba y Suris (2015) , la cual consiste en colocar inicialmente los especímenes en una solución de KOH al 10 % durante 60 minutos, para posteriormente tratar los insectos con un gradiente de alcoholes de 70 % a 100 %. Posteriormente, con una gota del medio de montaje conocido como bálsamo de Euparal y la ayuda de microalfileres se procedió a extender las alas, extremidades y antenas de los especímenes. Las láminas preparadas se colocaron en un horno a una temperatura aproximada de 40 °C durante 12 horas, para ser selladas posteriormente con esmalte.
Las observaciones se realizaron con ayuda de un microscopio Leica DM 1000 LED, con aumento de 40 a 100 X, mientras que su procesamiento se realizó con la ayuda del software Leica Application Suite (LAS). Para la identificación de la especie de trips se utilizó la clave taxonómica de Mound y Marullo (1996) y la clave lucida de Thysanoptera de Mound et al. (2017). Los trips identificados como referencia se depositaron en la colección de Entomología del Laboratorio de Protección Vegetal (LPV) del Centro de Innovación Agropecuaria Divisa (CIAD), Instituto de Innovación Agropecuaria de Panamá (IDIAP), ubicado en Los Canelos, Santa María, Herrera, Panamá.

Figura 1 Recorrido de sitios de muestreo de Gliricidia sepium (Jacq.) Kunth ex Walp. a lo largo de las tierras bajas del pacifico de la provincia de Coclé, Panamá.
Resultados y discusión
Se capturaron 975 especímenes de la especie F. insularis, conocido como el trips de las flores (CABI, 2022; EPPO, 2022), en flores de G. sepium, con un promedio de captura total de 3,05 ± 0,84 especímenes/flor, distribuidos en machos de 0,47 ± 0,15 y de hembras de 2,58 ± 0,72 por flor (tabla 1).
La especie F. insulares (Fig. 3) se caracteriza dentro del género Frankliniella, entre otros caracteres, por presentar una coloración general del cuerpo del insecto de color marrón; con la base del sensorio en el segmento antenal VI con no más de 2 veces más ancho que la base de la seta más cercana; con una distancia entre bases de setas ocelares III mayor que el ancho del primer ocelo; la endofurca mesotorácica con espínula mediana; con el peine del tergito posteromarginal VIII con microtrichia presente lateralmente pero incompleto medialmente (Moritz et al., 2009).

Figura 3 Espécimen hembra (a) y macho (b) de Frankliniella insularis (Franklin) (Thysanoptera: Thripidae).
La especie F. insularis se encuentra distribuida en diversas regiones en el continente americano, que van desde el sur de Norteamérica (sur de los Estados Unidos de América y México), Centroamérica hasta Suramérica desarrollándose en un amplio rango de especies de plantas de diversas familias, que incluyen Fabaceae y Malvaceae (Mound et al., 2017).
Dentro de la familia Fabaceae, la especie F. insularis ha sido reportada en Centroamérica como plaga menor en los géneros Cajanus y Pachyrhizus (Fabaceae) (Goldarazena et al., 2012; Hoddle et al., 2012; Mound & Marullo, 1996); en Brasil ha sido reportada sobre las especies Cajanus cajan (L.), Phaseolus lunatus L. y Vigna unguiculata (Lima et al., 2013).
La especie F. insularis ha sido reportada en México, en frutos y follaje de limón mexicano (Citrus x aurantiifolia (Christm.) Swingle) (Rutaceae), ocasionando daños e incrementando sus poblaciones en los períodos más secos del año (Miranda-Salcedo & Loera-Alvarado, 2019; Miranda-Salcedo et al., 2021a, b).
La asociación de la especie F. insularis a flores de G. sepium expande la capacidad de dispersión de dicha especie de trips, si se considera que G. sepium se encuentra establecida en la región Neotropical y se ha registrado como especie invasora en más de 79 países o islas, que incluyen a Australia, Sudáfrica e India, dentro de en un rango altitudinal que abarca de 5 m s.n.m. a 1900 m s.n.m. (metros sobre el nivel del mar) (Fig. 4) (GBIF Secretariat, 2021). La expansión de G. sepium, se debe también al incremento en el uso de esta planta para cerca viva, horcones, construcción de casas, postes de corral, forraje para alimentación animal y diversos usos medicinales (GBIF Secretariat, 2021).
Aunque F. insularis se considera una plaga secundaría en la actualidad, este estatus, puede modificarse por factores asociados al cambio climático, como el incremento de las temperaturas, la pérdida de la biodiversidad de plantas por concentración y aumento de monocultivos, la aplicación desmedida de pesticidas químicos, así como la expansión y distribución de sus plantas hospederas (Amat-García et al., 2011; González-Tokman et al., 2020). La asociación de F. insularis con G. sepium, hace obligatorio considerar futuros escenarios, por su influencia directa sobre la distribución geográfica, mecanismos fisiológicos, adaptación ecológica y evolución de F. insularis, que hacen necesarios replantear su estatus de plaga secundaria a plaga primaria en atención a daños que se logren registrar en cultivos de interés económico, así como su clasificación como insecto nativo o insecto invasor exótico en atención al historial de presencia en la región donde sea localizada (Amat-García et al., 2011; González-Tokman et al., 2020).
Tabla 1 Número promedio de especímenes de Frankliniella insularis (Franklin) asociados a flores de Gliricidia sepium (Jacq.) Kunth ex Walp. en el pacífico de Coclé, Panamá.
| Sitio | Flores | Especímenes ♂ | Promedio ♂ / total | Especímenes ♀ | Promedio ♀ / total | Especímenes totales | Promedio flor / total |
|---|---|---|---|---|---|---|---|
| 1 | 32 | 20 | 0,63 | 103 | 3,22 | 123 | 3,84 |
| 2 | 32 | 15 | 0,47 | 93 | 2,91 | 108 | 3,38 |
| 3 | 32 | 25 | 0,78 | 120 | 3,75 | 145 | 4,53 |
| 4 | 32 | 17 | 0,53 | 76 | 2,38 | 93 | 2,91 |
| 5 | 32 | 15 | 0,47 | 98 | 3,06 | 113 | 3,53 |
| 6 | 32 | 14 | 0,44 | 76 | 2,38 | 90 | 2,81 |
| 7 | 32 | 12 | 0,38 | 95 | 2,97 | 107 | 3,34 |
| 8 | 32 | 10 | 0,31 | 52 | 1,63 | 62 | 1,94 |
| 9 | 32 | 12 | 0,38 | 58 | 1,81 | 70 | 2,19 |
| 10 | 32 | 10 | 0,31 | 54 | 1,69 | 64 | 2,00 |
| 320 | 150 | 0,47 | 825 | 2,58 | 975 | 3,05 |
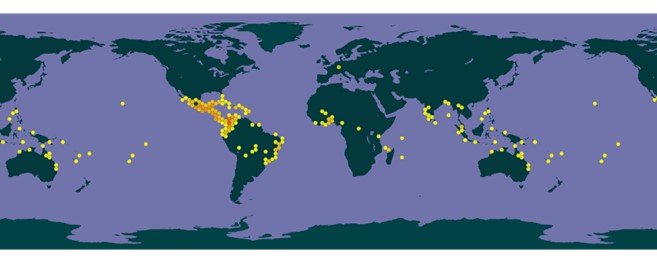
Fuente: GBIF Secretariat (2021)
Figura 4 Distribución mundial de Gliricidia sepium (Jacq.) Kunth ex Walp.
Conclusiones
La especie F. insularis está asociada con flores de G. sepium en la región pacífico de Coclé en Panamá sin reportar daños sobre la planta. Sin embargo, F. Insularis requiere observación por ser reportada como plaga de diversas especies de plantas cultivadas de las familias Fabaceae y Rutaceae, aunado al hecho paulatino de los efectos del cambio climático y expansión geográfica de sus plantas hospederas, que la pueden transformar en una plaga secundaria y primaria de cultivos agrícolas de importancia en Panamá.
















