Introducción
La subfamilia Scolytinae (Coleoptera: Curculionidae) incluye grupos de escarabajos conocidos como descortezadores y ambrosiales (Atkinson, 2017). El primer grupo incluye a las especies que se alimentan del floema de plantas leñosas; el segundo grupo corresponde a los escarabajos que barrenan directamente en la albura y se alimentan de hongos ectosimbióticos (Atkinson, 2017; Wood, 1982). Además de estos dos grandes grupos, también hay especies que se especializan en las médulas de ramas (mielófagas), madera (xilófagas), plantas herbáceas (herbífagas) y semillas (espermatófagas) (Atkinson, 2017).
Los Scolytinae se establecen sobre sus hospedantes para alimentarse y reproducirse, asimismo, juegan un papel importante en el equilibrio de las comunidades vegetales, ya que contribuyen en la descomposición de aquellas plantas moribundas y enfermas, además se incluyen dentro de los grupos principales que participan en el reciclado de materia orgánica, particularmente de la madera (Equihua & Burgos, 2002). Algunas especies pueden convertirse en plagas en áreas agrícolas y forestales, lo que ocurre cuando se introducen en hábitats nuevos (Hulcr & Dunn, 2011; Kendra et al., 2013).
La importancia de las especies de Scolytinae asociadas a árboles de la familia Lauraceae, se ha incrementado por el impacto económico y ecológico que algunas especies del grupo ambrosiales han ocasionado en especies arbóreas urbanas y sobre los cultivos de P. americana, al actuar como vectores de hongos patógenos, como es el caso del complejo ambrosial-hongo Xyleborus glabratus - Raffaelea lauricola (Carrillo et al., 2012; Fraedrich et al., 2008; Hanula et al., 2013; Harrington et al., 2008) y el complejo Euwallacea fornicatus y sus hongos asociados de los géneros Fusarium, Graphium, y Acremonium (Carrillo et al., 2016; Eskalen et al., 2012; Freeman et al., 2013; Gomez et al., 2018; Lynch et al., 2016).
En México, debido a la importancia económica que tiene el cultivo de aguacate, el Servicio Nacional de Sanidad Inocuidad y Calidad Agroalimentaria (SENASICA), a través de la Dirección General de Sanidad Vegetal, implementó un Sistema de Vigilancia Epidemiológica para los complejos X. glabratus- R. lauricola y Euwallacea sp. - F. euwallaceae, para su detección oportuna (SENASICA, 2019a, b). Cabe señalar que las primeras detecciones de Euwallacea sp., en México, ocurrieron en 2015 (Equihua et al., 2016; García-Ávila et al., 2016), y actualmente el estatus de esta especie y sus hongos asociados es transitorio: accionable, en curso de erradicación (SENASICA, 2019a), mientras que, el complejo X. glabratus - R. lauricola se mantiene en estatus de ausente para México (SENASICA, 2019b).
La fluctuación poblacional de insectos es afectada por factores bióticos y abióticos, y el conocimiento de la respuesta de los individuos a estos factores, ofrece una visión amplia del funcionamiento de una comunidad constituida por varias especies, en un mismo espacio y tiempo (Begon et al., 2006).
La disponibilidad de alimento se considera uno de los factores bióticos más importantes en la fluctuación de los insectos; mientras que, entre los factores abióticos, los componentes del clima como la temperatura, precipitación y humedad relativa determinan los límites de la distribución y abundancia de los mismos (Khaliq et al., 2014; Morales et al., 2000; Rudinsky, 1962; Wallner, 1987; Wood, 2007). Para el caso de los Scolytinae, particularmente de los escarabajos descortezadores y ambrosiales, se ha documentado que la mayor abundancia poblacional está íntimamente ligada a factores como la temperatura, humedad y precipitación prevaleciente en el sitio de estudio (Averos et al., 2021; Dorval et al., 2004; Kirkendall et al., 2015; Quezada-García et al., 2014; Rangel et al., 2012; Rudinsky, 1962).
El conocimiento sobre el comportamiento de las poblaciones de insectos, y en especial, sus fluctuaciones a través del tiempo aunado a factores ambientales tienen importancia desde el punto de vista ecológico, y, sobre todo, si se desean implementar estrategias de manejo (Morales et al., 2000).
El objetivo del presente estudio fue analizar la fluctuación poblacional de especies de Scolytinae en huertos de aguacate Persea americana Mill. var. Hass de tres municipios de la zona central del estado de Michoacán, México.
Materiales y métodos
El estudio se realizó de julio de 2016 a junio de 2018, en tres huertos de aguacate Persea americana Mill. var. Hass (Lauraceae), localizados en la zona central del estado de Michoacán. Éstos fueron los siguientes: huerto “El Durazno 2” ubicado en el municipio de Nuevo San Juan Parangaricutiro (19°22′30″N, 102°14′16″O; 2,245 m. s.n.m.), con una superficie de 25 ha y árboles de aproximadamente 35 años, con clima templado húmedo con abundantes lluvias en verano (INEGI, 2010a). La vegetación asociada a este huerto de aguacate se conforma por bosque de pino, bosque de pino-encino, bosque de pino-oyamel y bosque mesófilo de montaña, en donde se mezclan árboles con alturas de 20 a 30 m (Bello-González et al., 2015; Medina-García et al., 2000). La vegetación de esta zona ha sufrido cambios desde el punto de vista florístico, siendo en general heterogénea, debido al aprovechamiento forestal del bosque (Medina-García et al., 2000). La comunidad vegetal en general presenta una distribución aproximada de 77 % de pino, 12 % de encino, 6 % de oyamel y 5 % de latifoliadas (Anónimo, 1988). Asimismo, se encuentran algunos frutales como durazno (Prunus persica) y zarzamora silvestre (Rubus ulmifolius). El huerto “La Piedra China” se localiza en el municipio de Uruapan (19°21′19″N, 102°03′35″O; 1,564 m s.n.m.), con 3 ha y árboles de aproximadamente 30 años, el clima predominante en este sitio es semicálido subhúmedo, con lluvias en verano, de humedad alta (INEGI, 2010b). La vegetación aledaña se compone principalmente de bosque de pino-encino y bosque mesófilo de montaña (Villaseñor, 2005). Además de frutales como cítricos (Citrus spp.), ciruelo (Spondias purpurea) y níspero (Eriobotrya japonica). El huerto “La Ziranda”, se localiza en el municipio de Ziracuaretiro (19°24′00″N, 101°54′57″O; 1,304 msnm), con 3,5 ha y árboles de aproximadamente 10 años, el clima predominante es cálido subhúmedo con lluvias en verano, de humedad media (INEGI, 2009). Las especies asociadas al cultivo son características de bosque tropical caducifolio, bosque tropical subcaducifolio y matorral subtropical (Villaseñor, 2005). Se destacan también diversos frutales tales como nance (Byrsonima crassifolia), ciruelo (Spondias purpurea), mamey (Pouteria sapota), cítricos (Citrus spp.), mango (Mangifera indica), papaya (Carica papaya) y guayaba (Psidium guajava).
En los tres sitios el uso de suelo incluye agricultura de subsistencia (maíz, chile, frijol), ganadería extensiva, huertos de aguacate y aprovechamiento de madera y resina en los bosques de pino (Fregoso et al., 2001; INEGI, 2009, 2010a, b).
La colecta de los insectos se realizó mediante trampeo. Los atrayentes usados para la captura de los insectos, incluyeron tres tratamientos: α-copaeno, etanol al 96 % y la combinación querciverol + etanol, la efectividad de atracción de estos compuestos ha sido comprobada tanto para escolitinos nativos como exóticos (Acevedo-Reyes et al., 2015; Castrejón et al., 2017; Kendra et al., 2014, 2016; Lázaro-Dzul et al., 2020), adicionalmente, se tuvo un testigo (sin atrayente). Los compuestos atrayentes se colocaron en trampas similares a las propuestas por Barrera y Montoya (2006). Estas trampas se elaboraron a base de botellas de PET con capacidad de 2 L, con una abertura lateral de 11 x 10 cm y suspendidas a un árbol con una cuerda; como líquido conservador se utilizó etilenglicol (aproximadamente 300 ml por trampa). El etanol al 96 % se colocó en frascos con capacidad de 40 ml, a los que se les realizó dos agujeros de 0,7 mm de diámetro, los frascos se sujetaron al interior de cada trampa con alambre. Para cada compuesto atrayente incluyendo al testigo se tuvo tres repeticiones, sumando un total de 12 trampas por huerto, las cuales se colocaron a una altura de 1,5 m y distancia aproximada entre trampas de 50 m.
El arreglo de trampas fue lineal, considerando las dimensiones de los huertos. El cambio de los atrayentes comerciales y del etanol se realizó cada dos meses (tomando en cuenta las recomendaciones indicadas en los atrayentes). La revisión de las trampas se realizó mensualmente de julio 2016 a junio de 2018 y los especímenes capturados se conservaron en frascos con alcohol al 70 % para su posterior separación, conteo, montaje e identificación taxonómica en el laboratorio.
La identificación taxonómica de los insectos se realizó con las claves propuestas por Wood (1982) y Gómez et al. (2018), además de realizar comparaciones con material de referencia depositado en la Colección de Insectos del Colegio de Postgraduados, Campus Montecillo, México (CEAM). El material colectado y etiquetado se encuentra depositado en la colección previamente mencionada. La corroboración taxonómica de las especies de Scolytinae fue realizada por el Dr. T. H. Atkinson de la Universidad de Texas, EE. UU.
Los datos de los individuos recolectados mensualmente y de las variables climáticas (precipitación acumulada, humedad relativa y temperatura media, mínima y máxima), de las estaciones meteorológicas más cercanas a los sitios de estudio (APEAM, 2018), se sometieron a un análisis de correlación de Pearson, con la finalidad de determinar su nivel de asociación a través del coeficiente de correlación, con el paquete estadístico SAS versión 9.0 (SAS Institute Inc., 2002). El análisis de correlación de Pearson, permiten establecer de manera cuantitativa la forma en que dos variables numéricas se relacionan entre sí, es decir, conocer si ambas aumentan o disminuyen de manera simultánea, o si una variable disminuye mientras la otra aumenta, o viceversa, e incluso si las variables no tienen relación alguna (Zou et al., 2003).
Resultados
Durante el estudio, se recolectaron en total 15,772 individuos, los cuales pertenecieron a 72 especies de Scolytinae; en el huerto en Nuevo San Juan Parangaricutiro, se registraron 31 especies y en los huertos en Uruapan y Ziracuaretiro, un total de 44 (Tabla 1). Las especies con los mayores porcentajes de captura fueron Microcorthylus invalidus (Wood) (23,44 %), Araptus schwarzi (Blackman) (22,88 %) y Corthylus detrimentosus (Schedl) (10,84 %).
Tabla 1 Abundancia de Scolytinae en huertos de Persea americana Mill. var. Hass de los municipios de Nuevo San Juan Parangaricutiro (SJ), Uruapan (UR) y Ziracuaretiro (ZR), Michoacán durante 2016-2018.
| Especies de Scolytinae | Abundancia | |||
|---|---|---|---|---|
| SJ | UR | ZR | Total | |
| Ambrosiodmus rusticus (Wood) | 3 | 0 | 0 | 3 |
| Amphicranus cordatus (Bright) | 1 | 0 | 0 | 1 |
| Araptus dentifrons (Wood) | 3 | 0 | 0 | 3 |
| Araptus schwarzi (Blackman) | 2,112 | 1,434 | 63 | 3,609 |
| Araptus sp. | 74 | 2 | 0 | 76 |
| Chramesus pumilus (Chapuis) | 1 | 1 | 0 | 2 |
| Cnesinus electinus (Wood) | 0 | 19 | 6 | 25 |
| Cnesinus setulosus (Blandford) | 0 | 5 | 3 | 8 |
| Coptoborus pseudotenuis (Schedl) | 0 | 2 | 0 | 2 |
| Corthylocurus aguacatensis (Schedl) | 112 | 107 | 248 | 467 |
| Corthylus detrimentosus (Schedl) | 1,695 | 14 | 2 | 1,711 |
| Corthylus flagellifer (Blandford) | 8 | 331 | 800 | 1,139 |
| Corthylus fuscus (Blandford) | 1 | 1 | 0 | 2 |
| Corthylus luridus (Blandford) | 1 | 0 | 0 | 1 |
| Corthylus papulans (Eichhoff) | 1 | 0 | 269 | 270 |
| Corthylus petilus (Wood) | 6 | 5 | 1 | 12 |
| Corthylus praeustus (Schedl) | 0 | 45 | 108 | 153 |
| Cryptocarenus lepidus (Wood) | 0 | 0 | 3 | 3 |
| Dendrocranulus cucurbitae (LeConte) | 0 | 5 | 2 | 7 |
| Dendrocranulus declivis (Schedl) | 0 | 1 | 0 | 1 |
| Dendroterus mexicanus (Blandford) | 0 | 0 | 2 | 2 |
| Glochinocerus gemellus (Blandford) | 5 | 0 | 0 | 5 |
| Gnathotrichus dentatus (Wood) | 1 | 1 | 0 | 2 |
| Gnathotrichus perniciosus (Wood) | 0 | 1 | 1 | 2 |
| Gnathotrichus sulcatus (LeConte) | 0 | 2 | 0 | 2 |
| Hylastes fulgidus (Blackman) | 0 | 0 | 1 | 1 |
| Hylocurus dilutus (Wood) | 0 | 4 | 2 | 6 |
| Hylocurus dissidens (Wood) | 0 | 38 | 44 | 82 |
| Hylocurus nodulus (Wood) | 0 | 1 | 2 | 3 |
| Hypothenemus areccae (Hornung) | 0 | 0 | 10 | 10 |
| Hypothenemus crudiae (Panzer) | 0 | 127 | 878 | 1,005 |
| Hypothenemus eruditus (Westwood) | 0 | 35 | 300 | 335 |
| Hypothenemus obscurus (F.) | 0 | 13 | 0 | 13 |
| Hypothenemus rotundicollis (Eichhoff) | 0 | 4 | 361 | 365 |
| Hypothenemus seriatus (Eichhoff) | 0 | 331 | 45 | 376 |
| Micracis detentus (Wood) | 0 | 202 | 34 | 236 |
| Micracis torus (Wood) | 5 | 38 | 17 | 60 |
| Micracis unicornis (Wood) | 19 | 0 | 0 | 19 |
| Micracisella nitidula (Wood) | 28 | 1 | 0 | 29 |
| Microcorthylus demissus (Wood) | 5 | 0 | 0 | 5 |
| Microcorthylus invalidus (Wood) | 3,187 | 511 | 0 | 3,698 |
| Monarthrum conversum (Wood) | 2 | 11 | 1 | 14 |
| Monarthrum desum (Wood) | 0 | 0 | 4 | 4 |
| Monarthrum exornatum (Schedl) | 59 | 100 | 1 | 160 |
| Monarthrum tuberculatum (Wood) | 10 | 2 | 0 | 12 |
| Phloeocleptus atkinsoni (Wood) | 5 | 0 | 0 | 5 |
| Phloeocleptus plagiatus (Wood) | 3 | 18 | 6 | 27 |
| Phloeotribus opimus (Wood) | 0 | 0 | 18 | 18 |
| Pityoborus secundus (Blackman) | 1 | 0 | 0 | 1 |
| Pityophthorus attenuatus (Blackman) | 1 | 2 | 3 | 6 |
| Pityophthorus concinnus (Wood) | 0 | 0 | 10 | 10 |
| Pityophthorus cuspidatus (Blackman) | 0 | 0 | 1 | 1 |
| Pityophthorus obtusipennis (Blandford) | 0 | 1 | 0 | 1 |
| Pityophthorus sapineus (Bright) | 6 | 0 | 0 | 6 |
| Pityophthorus scabridus (Schedl.) | 0 | 0 | 1 | 1 |
| Pityophthorus schwarzi (Blackman) | 0 | 0 | 1 | 1 |
| Premnobius cavipennis (Eichhoff) | 1 | 25 | 1,288 | 1,314 |
| Pycnarthrum hispidum (Ferrari) | 0 | 0 | 6 | 6 |
| Scolytodes clusiacolens (Wood) | 0 | 3 | 0 | 3 |
| Scolytogenes jalapae (Letzner) | 0 | 1 | 0 | 1 |
| Scolytogenes rusticus (Wood) | 6 | 0 | 1 | 7 |
| Scolytogenes trucis (Wood) | 0 | 0 | 1 | 1 |
| Stegomerus mexicanus (Wood) | 0 | 1 | 4 | 5 |
| Stegomerus pygmaeus (Wood) | 0 | 2 | 0 | 2 |
| Tricolus nodifer (Blandford) | 1 | 0 | 0 | 1 |
| Xyleborinus gracilis (Eichhoff) | 0 | 0 | 5 | 5 |
| Xyleborus affinis (Eichhoff) | 0 | 5 | 8 | 13 |
| Xyleborus ferrugineus (F.) | 0 | 8 | 0 | 8 |
| Xyleborus morulus (Blandford) | 0 | 1 | 0 | 1 |
| Xyleborus palatus (Wood) | 0 | 0 | 1 | 1 |
| Xyleborus volvulus (F.) | 0 | 2 | 4 | 6 |
| Xylosandrus curtulus (Eichhoff) | 0 | 0 | 380 | 380 |
| Total de individuos | 7,363 | 3,463 | 4,946 | 15, 772 |
| No. de especies | 31 | 44 | 44 | 72 |
La fluctuación poblacional de Scolytinae durante ambos años de muestreo en el huerto en Nuevo San Juan Parangaricutiro, registró la máxima captura durante julio y agosto, lo que corresponde a la estación de verano (Figura 1). Durante el periodo 2016-2017 se observó una mayor abundancia poblacional de Scolytinae, con 1,394 y 1,053 individuos contabilizados en julio y agosto, en comparación con el periodo 2017-2018 que tuvo 694 y 351 individuos, para los mismos meses. Las especies con la mayor abundancia durante ambos años de muestreo fueron Microcorthylus invalidus con 524 y 132 individuos, Araptus schwarzi con 573 y 263 individuos, y Corthylus detrimentosus con 611 y 363 individuos respectivamente, las cuales representaron el 94,98 % de la colecta total en este sitio (Figura 2), el resto de las especies fueron poco abundantes, incluso en algunas de éstas, únicamente se capturó un espécimen como en Amphicranus cordatus (Bright), Chramesus pumilus (Chapuis), Corthylus fuscus (Chapuis), C. luridus (Blandford), C. papulans (Eichhoff), Gnathotrichus dentatus (Wood), Pityoborus secundus, Pityophthorus attenuatus (Blackman), Premnobius cavipennis (Eichhoff) y Tricolus nodifer (Blandford) (Tabla 1).
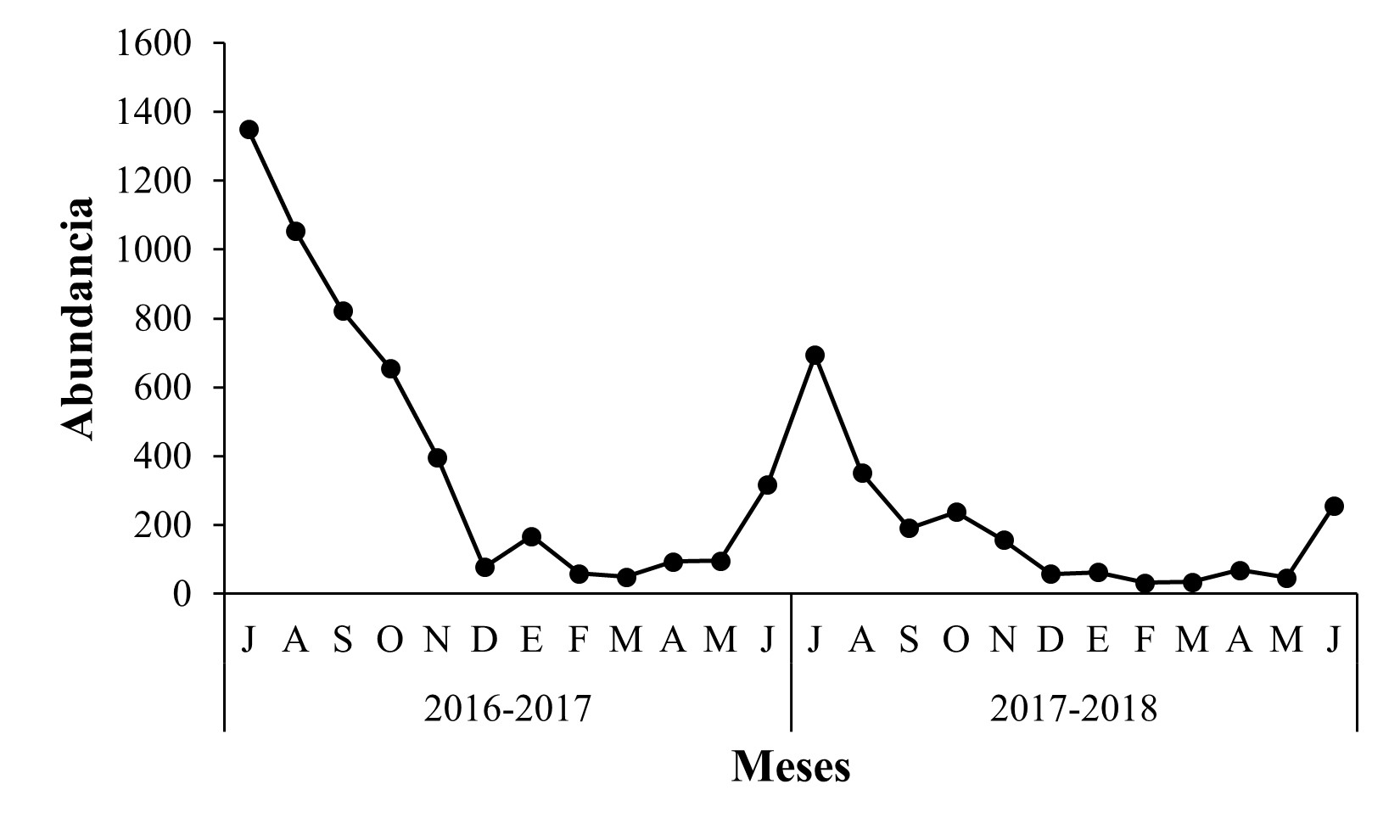
Figura 1 Fluctuación poblacional de Scolytinae en huerto de Persea americana Mill. var. Hass “El Durazno 2”, municipio de Nuevo San Juan Parangaricutiro, Michoacán.

Figura 2 Fluctuación poblacional de las especies Microcorthylus invalidus, Araptus schwarzi y Corthylus detrimentosus, en huerto de Persea americana Mill. var. Hass “El Durazno 2”, municipio de Nuevo San Juan Parangaricutiro, Michoacán.
En “La Piedra China”, el mayor número de capturas ocurrió durante la estación de verano en los meses de julio y agosto, en ambos años de muestreo (Figura 3), observándose que la población de Scolytinae en general, fue más abundante para el ciclo 2016-2017, con 834 y 264 individuos para julio y agosto, en comparación con el ciclo 2017-2018, con 432 y 154 individuos. Las especies que presentaron la mayor abundancia poblacional durante ambos años de muestreo fueron A. schwarzi con 530 y 189 individuos y M. invalidus con 103 y 45 individuos, respectivamente, las cuales en conjunto contribuyeron al 56,15 % de la colecta total en este sitio (Figura 4).
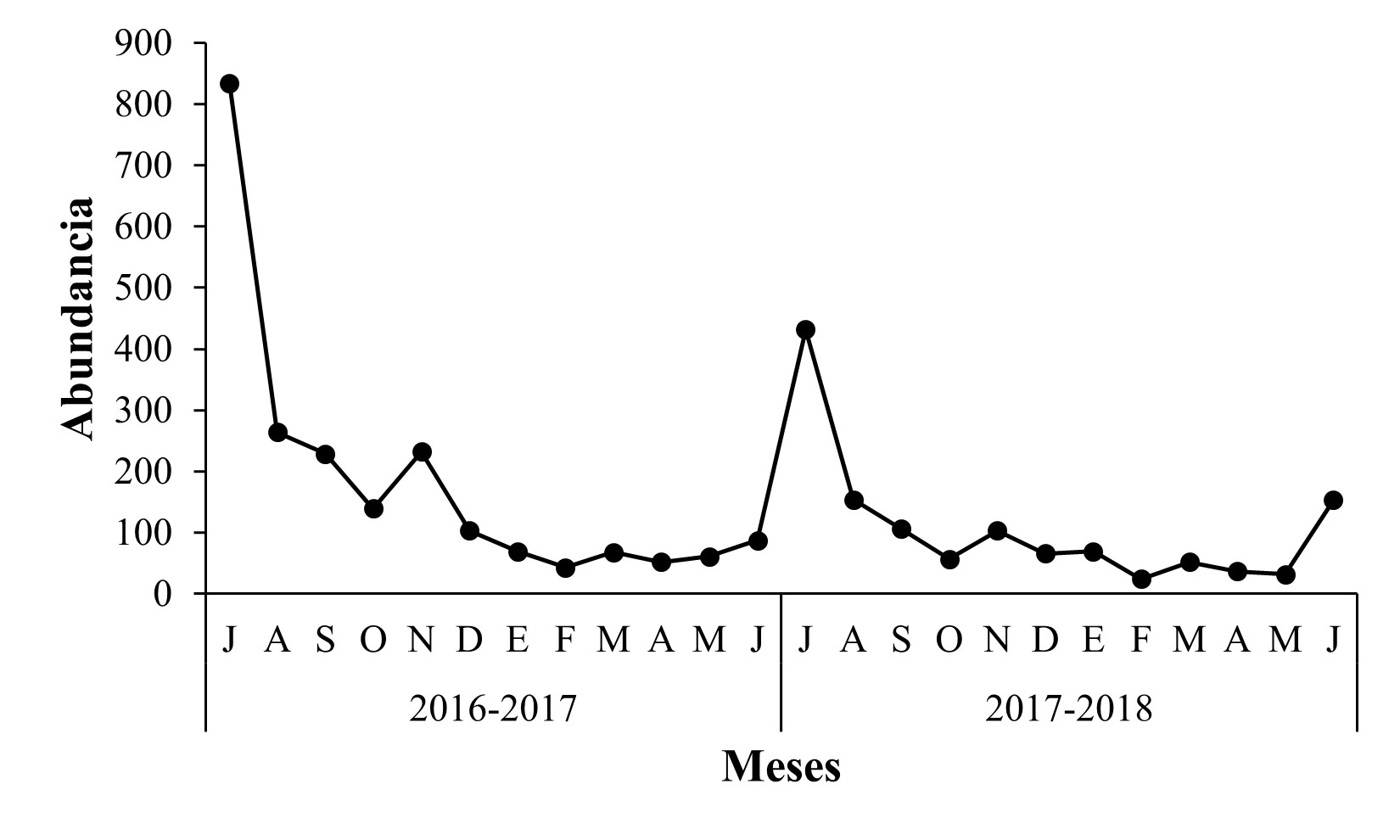
Figura 3 Fluctuación poblacional de Scolytinae en huerto de Persea americana Mill. var. Hass “La Piedra China”, municipio de Uruapan, Michoacán.
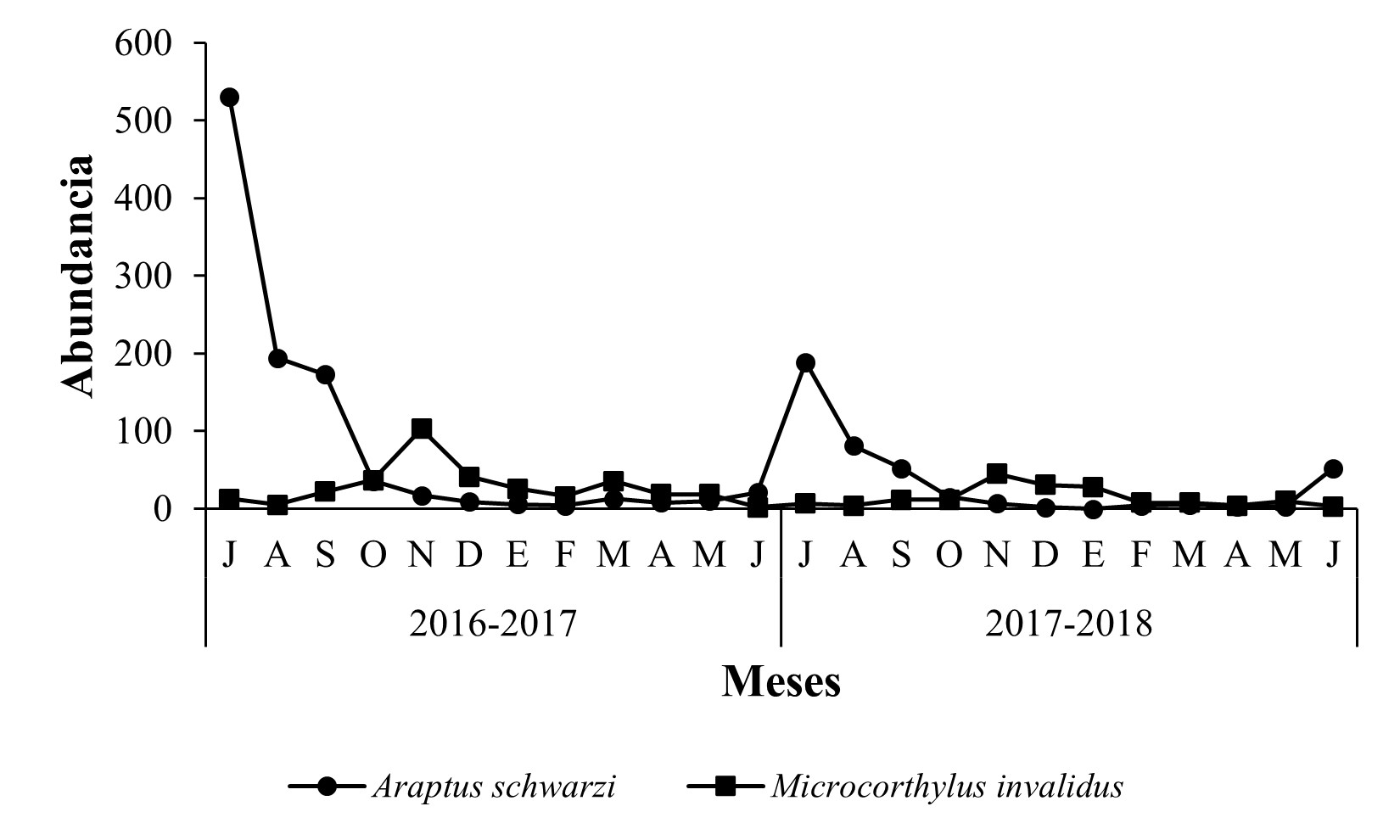
Figura 4 Fluctuación poblacional de las especies Araptus schwarzi y Microcorthylus invalidus, en huerto de Persea americana Mill. var. Hass “La Piedra China”, municipio de Uruapan, Michoacán.
En “La Ziranda”, para el ciclo 2016-2017, la mayor abundancia de Scolytinae se registró en los meses de julio y octubre, que correspondieron a la estación de verano y otoño respectivamente, con 412 y 295 individuos, mientras que para el ciclo 2017-2018, el mayor número de capturas ocurrió durante el otoño en septiembre y octubre, con 478 y 390 individuos. En este huerto, la menor abundancia poblacional de Scolytinae se registró durante el ciclo 2016-2017, en comparación con el ciclo 2017-2018 (Figura 5). Las especies con la mayor abundancia poblacional durante ambos años de muestreo fueron P. cavipennis con 69 y 147 individuos, Hypothenemus crudiae con 229 y 136 individuos, y C. flagellifer con 50 y 136 individuos, respectivamente, las cuales contribuyeron con el 59,96 % de la colecta total de este sitio (Figura 6). En este huerto, únicamente se capturó un espécimen de las especies Gnathotrichus perniciosus (Wood), Hylastes fulgidus (Blackman), Monarthrum conversum (Wood), M. exornatum (Schedl), Scolytogenes rusticus (Wood), S. trucis (Wood), Pityophthorus cuspidatus (Blackman), P. scabridus (Schedl.), P. schwarzi (Blackman) y Xyleborus palatus (Wood) (Tabla 1).
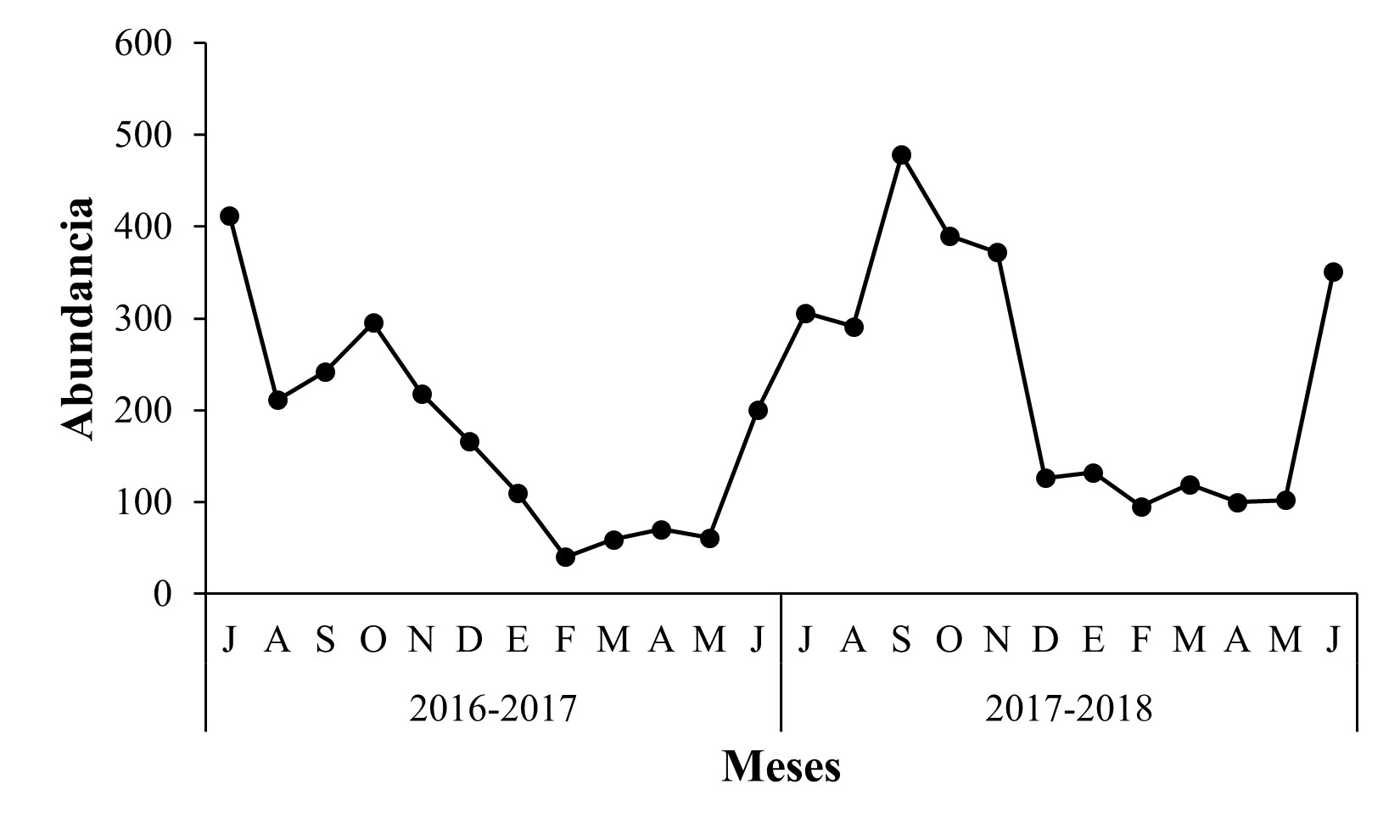
Figura 5 Fluctuación poblacional de Scolytinae en huerto de Persea americana Mill. var. Hass “La Ziranda”, municipio de Ziracuaretiro, Michoacán.
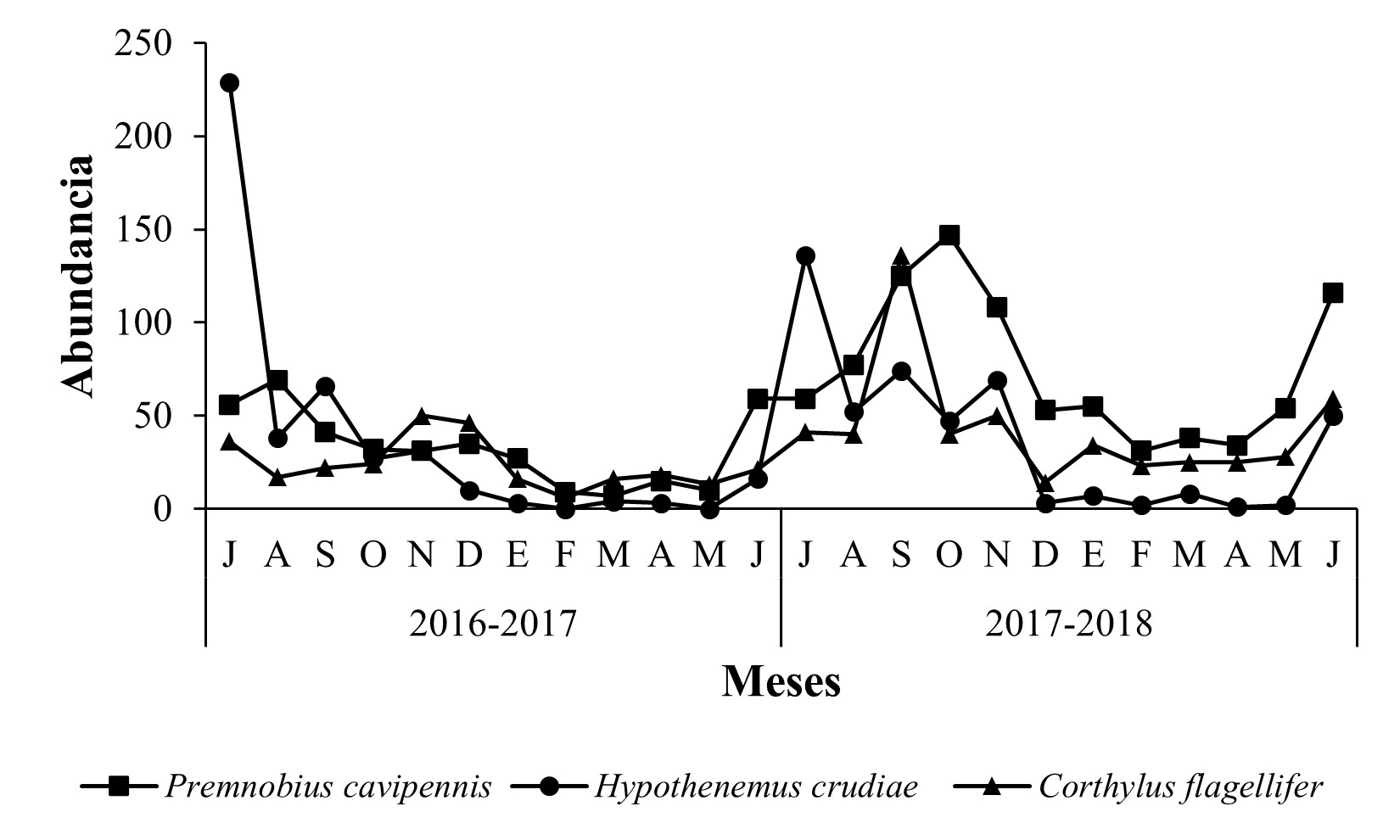
Figura 6 Fluctuación poblacional de las especies Premnobius cavipennis, Hypothenemus crudiae y Corthylus flagellifer, en huerto de Persea americana Mill. var. Hass “La Ziranda”, municipio de Ziracuaretiro, Michoacán.
La abundancia poblacional de Scolytinae fue más elevada durante el primer año de muestreo en Nuevo San Juan Parangarícutiro y Uruapan, en tanto que, en Ziracuaretiro, la mayor abundancia se registró durante el segundo año de muestreo.
Con respecto a la fluctuación de las variables climáticas, se observaron dos periodos bien definidos en la región; un periodo de sequía, con lluvias escasas desde diciembre hasta abril, lo que correspondió a la estación de invierno y comienzo de la primavera y otro con mayor precipitación, de mayo hasta noviembre, que abarcó desde la parte final de la estación de primavera hasta el otoño, alcanzando la máxima precipitación entre los meses de julio y agosto para los huertos “El Durazno 2” (Nuevo San Juan Parangarícutiro) y “La Piedra China” (Uruapan); mientras que, en el huerto “La Ziranda” (Ziracuaretiro) se observó un pico en la precipitación hasta el mes de septiembre. La humedad relativa promedio, en los huertos de estudio tuvo valores máximos entre los meses de agosto y septiembre (Figuras 7-9).
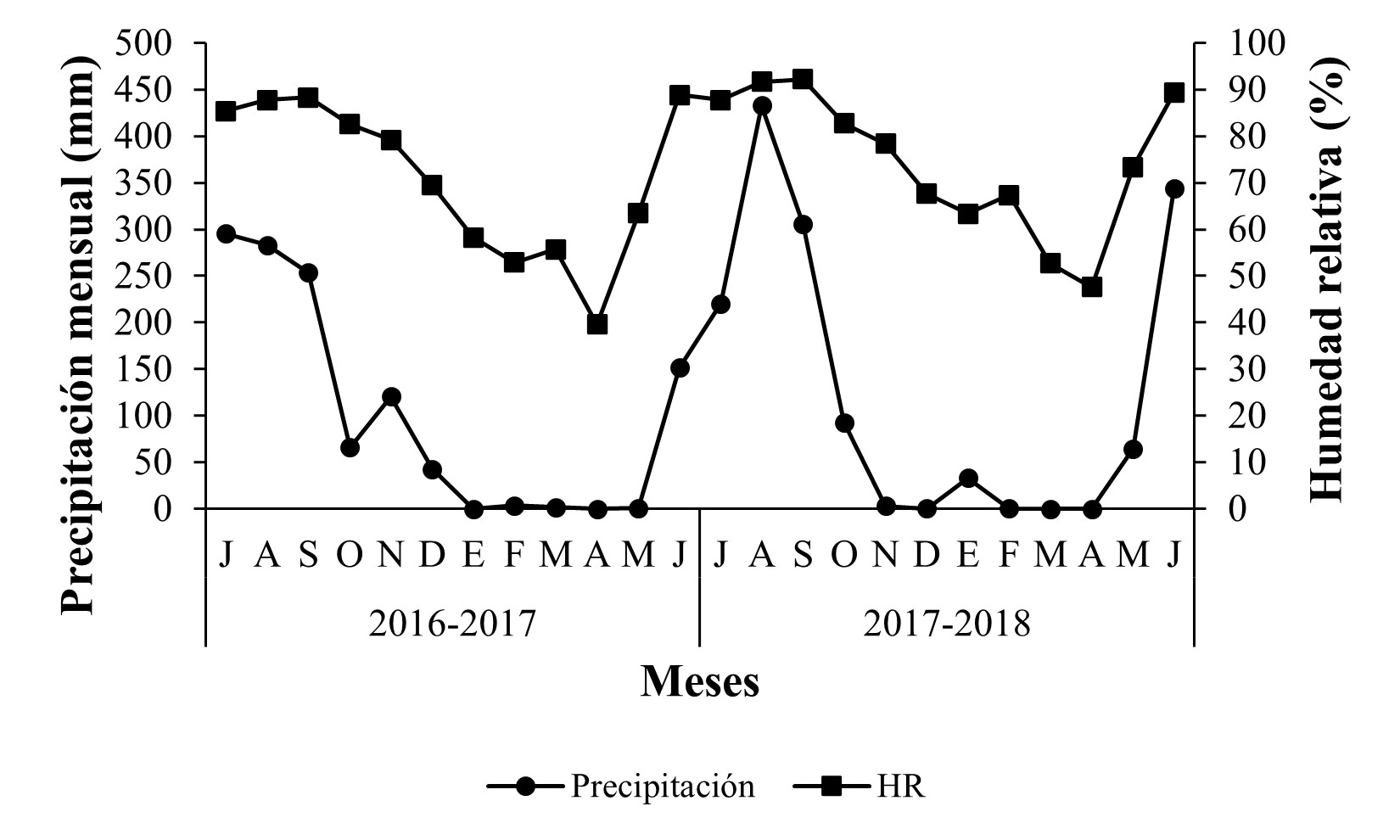
Figura 7 Precipitación mensual (mm) y humedad relativa promedio (%) durante 2016-2018 en Nuevo San Juan Parangaricutiro, Michoacán.
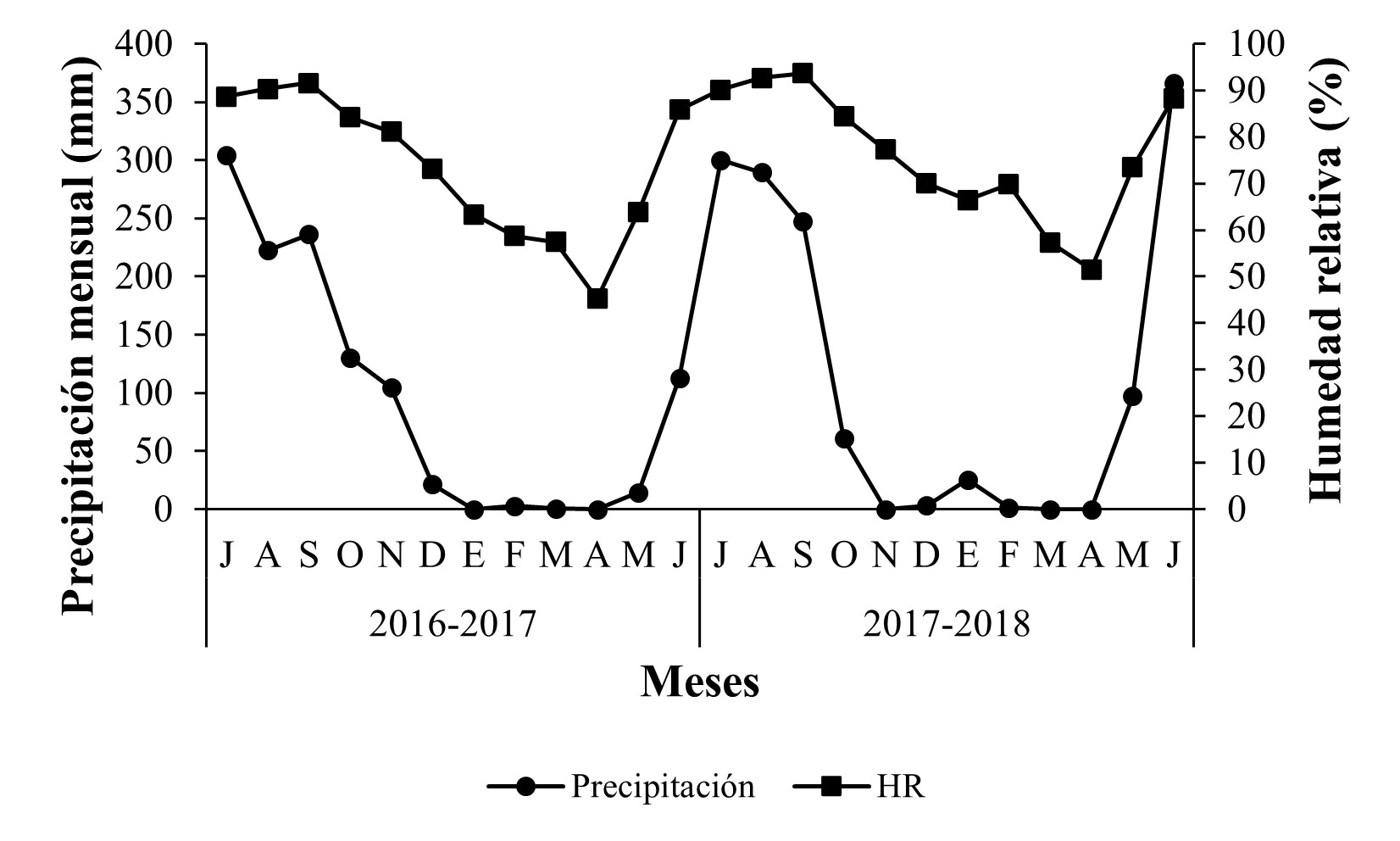
Figura 8 Precipitación mensual (mm) y humedad relativa promedio (%) durante 2016-2018 en Uruapan, Michoacán.
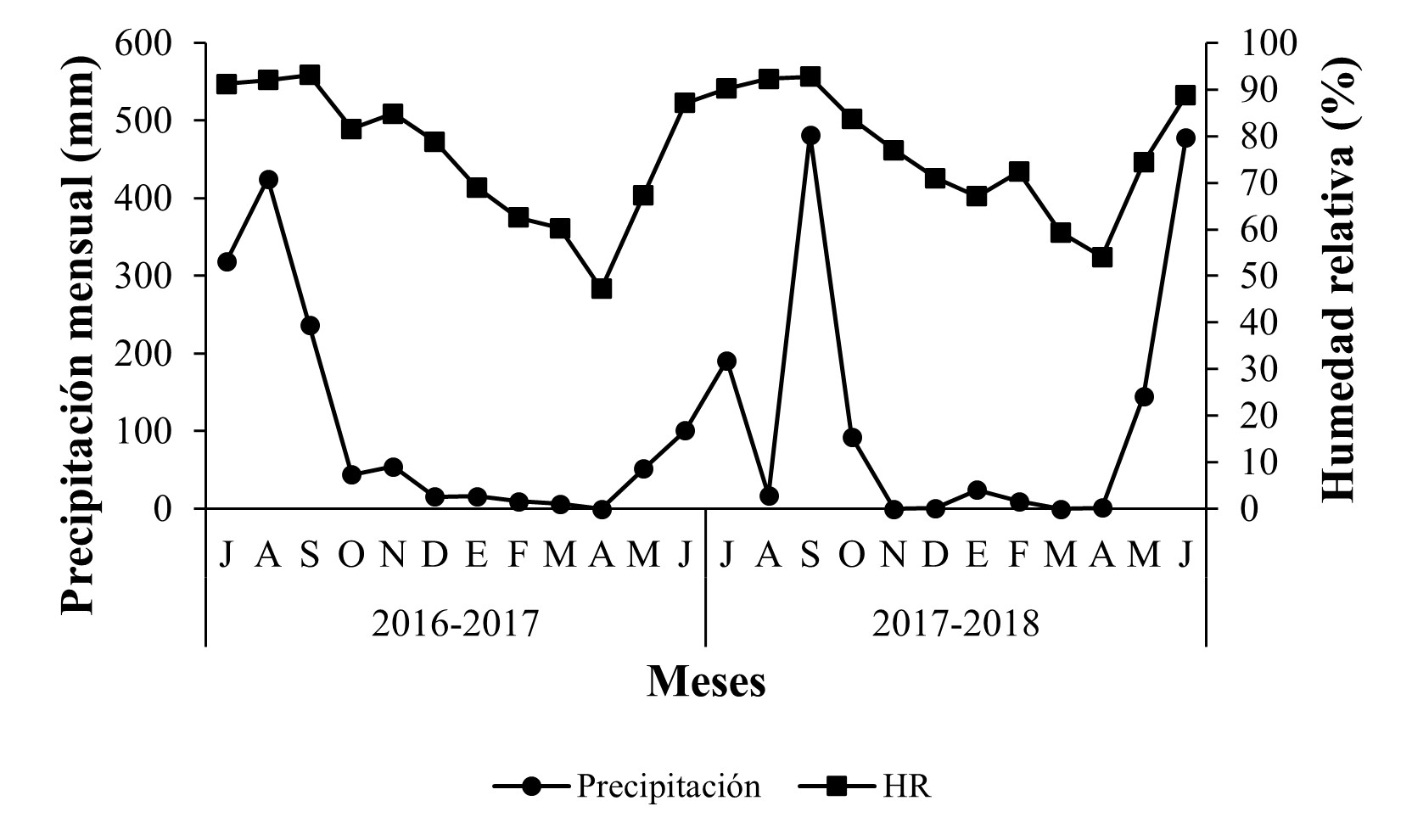
Figura 9 Precipitación mensual (mm) y humedad relativa promedio (%) durante 2016-2018 en Ziracuaretiro, Michoacán.
El análisis de correlación de Pearson mostró una asociación positiva de las variables precipitación y humedad relativa, con la abundancia poblacional de los escolitinos (Tabla 2). Finalmente, con respecto a la temperatura, se observó que únicamente la temperatura mínima mensual, mostró una asociación positiva con la fluctuación poblacional de Scolytinae, tanto para el huerto en Uruapan como en Ziracuaretiro, mientras que, en Nuevo San Juan Parangaricutiro esta variable tuvo poco efecto en la abundancia poblacional de Scolytinae (Tabla 2).
Tabla 2 Correlación entre la precipitación, humedad relativa promedio, temperatura mínima (Tmínima) y abundancia mensual de Scolytinae, en los municipios de Nuevo San Juan Parangaricutiro (SJ), Uruapan (UR) y Ziracuaretiro (ZR), Michoacán.
| Municipio | Precipitación | Humedad Relativa | Tmínima |
|---|---|---|---|
| SJ | 0,62333(0,0011) * | 0,59168(0,0023) * | 0,38693(0,0618) |
| UR | 0,64394(0,0007) * | 0,50213(0,0124) * | 0,39421(0,0566) * |
| ZR | 0,61599(0,0014) * | 0,76913(<0,0001) * | 0,64204(0,0007) * |
*Correlación significativa con un α = 0,05
Con respecto a las especies ambrosiales dominantes en los tres huertos de estudio, se encontró correlación positiva y significativa (p ≥ 0,05) entre la precipitación y humedad relativa con la abundancia poblacional de algunas especies (Tabla 3).
Tabla 3 Correlación entre la precipitación, humedad relativa promedio y abundancia mensual de especies ambrosiales, en los municipios de Nuevo San Juan Parangaricutiro (SJ) y Ziracuaretiro (ZR), Michoacán.
| Municipio | Especies | Precipitación | Humedad Relativa |
|---|---|---|---|
| SJ | Microcorthylus invalidus | 0,28569(0,1760) | 0,40710(0,0483) * |
| Corthylus detrimentosus | 0,52539(0,0084) * | 0,45956(0,0239) * | |
| ZR | Premnobius cavipennis | 0,53448(0,0071) * | 0,57528(0,0033) * |
| C. flagellifer | 0,55349(0,0050) * | 0,46463(0,0222) * |
*Correlación significativa con un α = 0,05
Discusión
Para los tres huertos, los picos máximos poblacionales coincidieron con los periodos de mayor precipitación y altos porcentajes de humedad relativa, que se observaron desde finales de la primavera y se prolongaron hasta el otoño. La fluctuación poblacional encontrada en los huertos de estudio coincide con lo registrado por Wood (1982), quien señaló que las poblaciones de Scolytinae presentan tendencia a bajar actividad durante la estación seca (Figuras 1, 3 y 5), ya que se apreció que después de un periodo de baja o nula precipitación y baja humedad relativa (diciembre-abril), la actividad de los escolitinos disminuyó; además se observó un aumento en las poblaciones de escolitinos, con un incremento de la precipitación y humedad relativa. La menor abundancia poblacional de Scolytinae que se observó durante la estación seca, probablemente está asociada con la condición de humedad del sustrato de reproducción, dado que, el material hospedante, se seca más rápido durante periodos de poca precipitación, lo cual pudo propiciar condiciones desfavorables para algunos escarabajos (Khan, 1989; Madoffe & Bakke, 1995).
Respecto a la asociación positiva entre la precipitación y humedad relativa con la abundancia de algunas especies de escarabajos ambrosiales, cabe mencionar que, los escolitinos, particularmente los ambrosiales y sus hongos asociados (de los cuales se alimentan), están íntimamente ligados a la disponibilidad de alimento con humedad mayor al 50 % y temperatura óptima (mayor a 10 °C y menor a 45 °C) para su establecimiento (Rudinsky, 1962), condiciones que se presentaron en los sitios de estudio casi a mediados del año (del mes de mayo en adelante), lo que coincidió con el inicio de la temporada de lluvias a finales de la estación de primavera. Así se observó una correlación positiva entre la precipitación y la abundancia poblacional de las especies ambrosiales, C. detrimentosus, C. flagellifer y P. cavipennis, en ambos años de muestreo (Tabla 3). Averos et al. (2021), Córdoba et al. (2021), Estrada-Pérez et al. (2012), Pérez-De La Cruz et al. (2009, 2016), Rangel et al. (2012), reportaron resultados similares al observar una mayor abundancia poblacional de escarabajos ambrosiales asociada a condiciones de mayor precipitación y humedad; aunque estos resultados difieren de lo reportado por Morales et al. (2000), Quezada-García et al. (2014) y Martínez et al. (2017), quienes registraron mayor abundancia poblacional de algunas especies ambrosiales en los periodos más secos a lo largo del año. Con respecto a la temperatura, Kirkendall et al. (2015) y Rudinsky (1962) señalaron que la actividad de los escolitinos depende, en primera instancia, de la disponibilidad de hospedantes susceptibles y, los límites de distribución geográfica y abundancia local, están determinados por la temperatura mínima necesaria para el desarrollo de los escarabajos, tal como se observó en el presente estudio, ya que la temperatura mínima mensual fue una de las variables climáticas que se asoció de manera positiva y significativa (p ≥ 0,05) con los mayores picos poblacionales de Scolytinae, principalmente en los huertos de Uruapan y Ziracuaretiro (Tabla 2).
Asimismo, se ha documentado que, para los escolitinos, la humedad ambiental influye en la temperatura y sobre la tasa de desarrollo larvario (Rudinsky, 1962). Mientras que, el contenido de humedad de la madera, se considera un factor limitante en el crecimiento de los hongos ambrosiales, lo cual regula, no sólo la colonización sino también el desarrollo y la supervivencia de los escarabajos ambrosiales (Rudinsky, 1962). En el presente estudio, la humedad relativa se correlacionó positiva y significativamente (p ≥ 0,05) con la abundancia poblacional de algunas especies ambrosiales, tales como M. invalidus, C. detrimentosus, C. flagellifer y P. cavipennis, en los huertos de Nuevo San Juan y Ziracuaretiro, en ambos años de muestreo (Tabla 3). Estos resultados coinciden con lo reportado por Córdoba et al. (2021) y Sittichaya et al. (2012) quienes señalaron que la humedad relativa influye en el patrón de vuelo estacional y abundancia de escarabajos ambrosiales en áreas agrícolas. De igual manera la mayor abundancia de estas especies se asoció a la mayor disponibilidad de plantas hospedantes, para C. detrimentosus, se documentaron cinco plantas hospedantes (Alnus sp., Arbutus sp., Baccharis conferta, D. viscosa y S. purpurea) de familias distintas (Atkinson, 2022; Atkinson & Equihua, 1985a, b; Equihua & Burgos, 2002), para C. flagellifer, se documentaron siete plantas hospedantes (Acacia sp., D. viscosa, Ficus sp., Leucaena pulverulenta, P. persica, Pyrus communis, S. purpurea) de diferentes familias botánicas (Atkinson, 2022; Atkinson & Equihua, 1985c; Atkinson et al., 1986), finalmente para M. invalidus, otra especie abundante, aunque solo se ha registrado una planta hospedante, Ardisia densiflora (Myrsinaceae) (Atkinson, 2022), y no existen registros de esta especie asociada con árboles de aguacate, es muy probable que, como la mayoría de las especies dentro del género Microcorthylus, esta especie también sea polífaga lo cual le permite explotar los recursos alimenticios presentes en el área de estudio (Lázaro-Dzul et al., 2020). Al respecto, Pérez-De La Cruz et al. (2009), Rudinsky (1962) y Wood (1982) mencionaron que la diversificación vegetal, disponibilidad de alimento (hospedantes en condiciones ideales para el desarrollo de sus hongos asociados), competidores, temperatura y humedad, pueden influir en la abundancia de los Scolytinae en un sitio determinado.
La respuesta observada en el caso de la especie P. cavipennis, coincide con lo reportado por Averos et al. (2021), Dorval et al. (2004) y Flechtmann et al. (2000), quienes encontraron mayor abundancia poblacional de P. cavipennis durante periodos lluviosos. Cabe mencionar también, que la población de P. cavipennis fue más abundante en el huerto ubicado en Ziracuaretiro comparado con los huertos localizados en Uruapan y Nuevo San Juan Parangaricutiro, lo cual muy probablemente esté asociado a la mayor diversificación vegetal prevaleciente en este sitio de estudio, que, aunado a las condiciones propicias de precipitación y humedad favorecieron la mayor abundancia de P. cavipennis en Ziracuaretiro; este comportamiento coincide con lo documentado por Pérez-De La Cruz et al. (2009, 2016) quienes señalaron que la fluctuación poblacional de P. cavipennis está influenciada tanto por factores climáticos, como por factores bióticos como disponibilidad de alimento, competencia, depredación, entre otros.
Los máximos poblacionales en ambos años de muestreo, para la especie A. schwarzi, tanto en Nuevo San Juan Parangaricutiro, como en Uruapan, coincidieron con los periodos de mayor precipitación y humedad relativa (Figuras 2, 4, 7 y 8). Aunado a lo anterior, la mayor abundancia poblacional de A. schwarzi en estos huertos, se asoció con la edad de los árboles en la plantación (más de 30 años), con una copa bien desarrollada, que contribuyó a brindar mayor sombra y retención de humedad en el huerto, además de haber mayor disponibilidad de recursos alimenticios (semillas y frutos maduros de P. americana en el suelo), recursos que son preferidos por A. schwarzi para su establecimiento (Equihua-Martínez et al., 2016; Lázaro-Dzul et al., 2020). De igual manera, la mayor abundancia de esta especie muy posiblemente se debe a que actualmente A. schwarzi es una de las pocas especies que se reproducen exclusivamente en plantas de la familia Lauraceae (Lázaro-Dzul et al., 2020). Los resultados de este estudio concordaron con lo reportado por Acevedo-Reyes et al. (2015) y García-Guevara et al. (2018) quienes al realizar colectas de escarabajos ambrosiales asociados al cultivo de aguacate en algunos municipios de Michoacán, también señalaron a A. schwarzi como una de las especies con mayor abundancia poblacional.
Finalmente, cabe mencionar que, en este estudio no se detectó la presencia de especies de los complejos ambrosiales que afectan al cultivo de P. americana, y que se encuentran bajo Vigilancia Epidemiológica Fitosanitaria en México. Es importante señalar que, de las especies que se colectaron, Xyleborus affinis, X. ferrugineus, Xyleborinus gracilis y X. volvulus, se han reportado como vectores laterales potenciales del hongo R. lauricola que afecta a lauráceas, incluyendo P. americana (Carrillo et al., 2012, 2014; Harrington et al. 2008), sin embargo, la abundancia poblacional de estas especies se mantuvo en bajos niveles a lo largo del periodo de estudio (Tabla 1) y no se observaron daños directos en los árboles de aguacate en los huertos, estos resultados difieren de lo reportado por Castrejón-Antonio et al. (2017), quienes sí observaron barrenaciones de X. affinis y X. volvulus, en árboles de aguacate en producción en el estado de Colima, México, por lo que, sugirieron fortalecer su monitoreo en el país, en este sentido, el trampeo realizado en este estudio, contribuye a documentar la presencia y abundancia poblacional presentes en el área y algunas de ellas se han registrado asociadas al aguacate en algunos municipios del estado de Michoacán o en otros estados de México.
Conclusiones
La fluctuación poblacional de Scolytinae mostró que estos insectos se encontraron activos a lo largo del periodo de estudio, aunque sus poblaciones permanecieron bajas durante la mayor parte del año; las especies más abundantes fueron Microcorthylus invalidus, Araptus schwarzi, Corthylus detrimentosus, Premnobius cavipennis y Corthylus flagellifer en orden de abundancia. En los tres sitios de estudio las capturas máximas coincidieron con los periodos de mayor precipitación y porcentajes de humedad relativa elevada. La información generada en este estudio puede ser de utilidad en programas de manejo de algunas de las especies encontradas, ya que permite detectar las épocas de mayor actividad y abundancia de especies de escolitinos a lo largo del año en el área estudiada, y algunas de ellas están asociadas directamente al cultivo de aguacate.















