Introducción
La cordillera de los Andes es una de las regiones más biodiversas del planeta (Myers et al., 2000). En Colombia, esta cordillera atraviesa el país en tres ramales: Occidental, Central y Oriental. La cordillera Occidental es la más baja y pequeña de las tres (Iriarte, 2006). Sin embargo, contiene cinco Parques Nacionales Naturales (PNN), entre los que se encuentra el PNN Farallones de Cali (Parques Nacionales Naturales de Colombia, 2023). Este parque es el área protegida más grande del Valle del Cauca, con un área de 196.364 hectáreas, funciona como un reservorio de especies endémicas y en peligro de extinción y en él nacen más de 30 ríos (Parques Nacionales Naturales de Colombia, 2023). Su altitud se encuentra entre los 200 y 4100 m s.n.m., donde se originan diversas formaciones vegetales, según su rango altitudinal (CVC et al., 2003).
Los bosques montanos de los Andes tropicales reciben el nombre de bosques andinos y se clasifican en bosque subandino, bosque andino, bosque altoandino y páramo (CVC et al., 2003). Dentro de los Andes tropicales, los bosques de montaña representan el paisaje dominante, que abarca desde el piedemonte (500 ± 100 m s.n.m.) hasta el límite arbóreo superior, que varía de acuerdo con la latitud, pero generalmente se encuentra alrededor de los 3.200 m de elevación (Sarmiento-Pinzón & León-Moya, 2015). A pesar de que los bosques montanos ocupan solamente el 0,2 % de la superficie del planeta, son los mayores centros de endemismo y diversidad biológica (Estrada & Fernández, 1999). Los ecosistemas de montaña y los gradientes de altitud inherentes a éstos se destacan por presentar una gran variedad de formas de vida y procesos ecológicos como la depredación, competencia y productividad, producto de la heterogeneidad espacial, proveniente de los cambios abióticos que ahí se presentan (Larsen et al., 2011). Esto permite formular preguntas acerca de las comunidades asociadas a los hábitats de los diferentes cinturones altitudinales (Amat-García & Vargas, 1991; Ashton, 2013; Guerrero & Sarmiento, 2010).
A pesar de ser el grupo más diverso de los ecosistemas terrestres (Grimaldi & Engel, 2005), los insectos son de los animales menos representados en estudios dentro de los bosques andinos (Estrada & Fernández, 1999). Los insectos presentan cualidades de gran importancia para los seres humanos-a menudo incluidas dentro de, o asociadas con los “servicios ecosistémicos” (Millennium Ecosystem Assessment, 2005)-como el control de plagas (Nourmohammadpour-Amiri et al., 2022), la polinización (Gonzalez et al., 2021), la bioturbación (Viles et al., 2021), el reciclaje de nutrientes (Maldonado et al., 2019), entre otros. Sin embargo, su conservación frecuentemente se deriva de esfuerzos orientados a plantas y vertebrados (Estrada & Fernández, 1999). Entre los insectos, existen dos grupos que, además de brindar servicios ecosistémicos, son útiles para evaluar el efecto de la transformación de hábitats naturales: las hormigas (Solar et al., 2016) y los escarabajos carábidos (Cajaiba et al., 2018).
Las hormigas (Hymenoptera: Formicidae) constituyen una de las familias de insectos más comunes y mejor estudiadas en varios aspectos de su biología y sistemática (Fernández et al., 2019). Su alta diversidad y ubicuidad está asociada a procesos ecológicos como la herbivoría y la dispersión de semillas, los cuales están relacionados con plantas (Armbrecht & Perfecto, 2017). También existen relaciones mutualistas con otros organismos y un estrecho vínculo con el reciclaje de nutrientes del suelo debido a la bioturbación producidA al excavar sus nidos y a la incorporación de materia orgánica con sus desechos alimenticios y cadáveres. No obstante, la presencia y diversidad de hormigas depende de la disponibilidad de energía, la temperatura ambiental, precipitaciones, humedad, el estado de la vegetación, entre otros parámetros (Hölldobler & Wilson, 1994) que se encuentran relacionados con la altitud y pueden explicar los patrones de composición y riqueza de especies de hormigas y otros taxones, en términos de gradientes de elevación (Guerrero & Sarmiento, 2010; Pérez-Toledo et al., 2021). Colombia es el octavo país con mayor número de especies de hormigas, con 911 especies registradas hasta el momento (Antwiki, 2023), sin embargo, existe poca información sobre cómo puede verse limitada su distribución en función de la altitud (Guerrero & Sarmiento, 2010).
Por otra parte, los escarabajos (Coleoptera) tienen entre 350.000 y 400.000 especies descritas. Paradójicamente, aunque existen aproximadamente 1,5 millones de especies biológicas descritas en todo el mundo, una estimación reciente propuso que pudiesen existir entre 1,7 y 2,1 millones de especies solo del orden Coleoptera (Stork et al., 2015), lo que lo convertiría el grupo biológico más diverso que existe. Entre los coleópteros, los carábidos (Coleoptera: Carabidae) son la tercera familia con más riqueza (40.000 especies), después de Staphylinidae (56.000) y Curculionidae (51.000) (Bouchard et al., 2009). Su importancia en un ecosistema radica en su capacidad de limitar las poblaciones de potenciales plagas gracias a su amplia dieta, ya que pueden ocupar una gran cantidad de microhábitats diferentes. Al tiempo, estos individuos también son presas de otros depredadores y dispersores de semillas (Waite et al., 2022; Wehnert et al., 2021). Al igual que las hormigas, los factores bióticos y abióticos modelan los patrones de composición de especies a lo largo de un gradiente altitudinal (Pérez-Toledo et al., 2021), por lo que su respuesta a la transformación del hábitat y su gran variedad, amerita y recomienda el estudio de su biodiversidad en el contexto de la conservación de hábitats naturales tropicales.
A pesar de la importancia de las hormigas y los carábidos como grupos fundamentales para los procesos ecológicos y servicios ecosistémicos, son escasos los estudios que se han realizado sobre su diversidad en el PNN Farallones de Cali (Arenas et al., 2015; Bustos & Chacón de Ulloa, 1997), y tampoco existe mucha literatura sobre la variación de su diversidad en función de la altitud (Bustos & Chacón de Ulloa, 1997; Camero, 2003; Guerrero & Sarmiento, 2010; Morales et al., 2022). Por lo tanto, el presente estudio tuvo como objetivo reconocer y evaluar la diversidad de hormigas y carábidos en hábitats naturales de cuatro diferentes altitudes, en el PNN Farallones de Cali.
Materiales y métodos
Área de estudio.
Este estudio se realizó en el PNN Farallones de Cali, ubicado sobre la cordillera Occidental. Éste abarca los municipios de Jamundí, Santiago de Cali, Dagua y Buenaventura. Se muestrearon cuatro localidades del parque, cada una con un tipo de conformación vegetal natural: Pance (1600 m s.n.m., bosque subandino - 03°20′12″N, 76°38′29″W), Cominal (2.400 m s.n.m., bosque andino - 03°20′60″N, 76°38′50″W), Minas del Socorro (3.200 m s.n.m., bosque altoandino - 03°24′06″N, 76°41′45″W) y Balcones (3.800 m s.n.m., páramo - 03°19′51″N, 76°41′37″W) (Figura 1). En cada expedición se emplearon cinco días para el muestreo.
Muestreo e identificación de hormigas y carábidos.
La captura de hormigas y carábidos se realizó con trampas de caída, captura manual y agitación de follaje, cernido de hojarasca, y trampa de luz (solo para carábidos). Se instaló una parcela de 100 m x 40 m, donde se definieron tres transectos de 40 m de largo separados entre sí por 50 m. En cada transecto se ubicaron cinco trampas de caída, separadas una de la otra por 10 m (Figura 1), que permanecieron instaladas durante cinco días. Las trampas de caída consistieron en vasos plásticos de 500 ml, enterrados a ras del suelo, llenos en 2/3 de su capacidad con alcohol etílico al 70 %.
La captura manual y la agitación de follaje consistieron en una búsqueda activa en un radio de cinco metros alrededor de cada trampa de caída durante diez minutos (un investigador por cada método), este protocolo se repitió por tres días (7,5 h efectivas). El cernido de hojarasca consistió en la recolección de cinco muestras de 1m2 hojarasca, tomadas de entre los espacios de separación de transectos (Figura 1), esta se depuró con un saco cernidor y se dispuso durante 72 h en sacos mini-Winkler para la extracción de artrópodos. Así mismo, en el centro de la parcela, se instaló una trampa de luz blanca sobre una pantalla plástica blanca cada noche entre las 18:30 y las 20:30 con el objetivo de capturar carábidos voladores (10 h efectivas). Estos individuos se retiraron de manera manual de la pantalla y se almacenaron en frascos con alcohol al 96 % y debidamente etiquetados. En adición, por fuera de la parcela se realizaron dos jornadas de recolecta libre de 2,5 h (cinco horas efectivas), empleando los métodos de captura manual y agitación de follaje. Todos los individuos recolectados se almacenaron en tubos de 1,5 ml con alcohol etílico al 96 %.
Cada trampa de caída, y la ejecución de cada método de captura se tomó como una unidad muestral (UM), exceptuando las muestras de recolecta libre, donde cada día representó una UM (dos UM de recolecta libre en total por localidad). Las capturas casuales de hormigas y carábidos realizadas (colectas fuera del tiempo y lugares establecidos para el muestreo), se tuvieron en cuenta como recolecta libre, registrando la información de recolección pertinente. En total se tomaron 52 UM por localidad para hormigas y 53 para carábidos (15 trampas de caída, cinco muestras de hojarasca, 15 capturas manuales, 15 agitaciones de follaje, dos jornadas de recolecta libre y, sólo para Carabidae, un muestreo con trampa de luz). Todas las expediciones fueron realizadas en luna nueva (ideal para recolecta de insectos con trampa de luz) y época lluviosa.

Figura 1 Representación espacial de las localidades muestreadas, con el diseño de parcela utilizado en cada una de ellas. A) Fragmento del PNN Farallones de Cali, del territorio de la Ciudad de Cali y parte del territorio del municipio de Jamundí B) Mapa de Colombia señalando la ubicación del departamento del Valle del Cauca y de la Ciudad de Cali, C) Diseño de la parcela de estudio empleada en cada localidad, representando las trampas de caída como círculos rojos, las subparcelas de recolección de la hojarasca como cuadrados verdes y el radio en torno al cual se buscaron especímenes con captura directa y agitación de follaje (el mismo radio para todas las trampas de caída) como círculos de línea punteada.
Las hormigas y los carábidos se identificaron hasta la categoría taxonómica más baja posible, usando las claves morfológicas en Fernández et al. (2019) y Martínez (2005). Algunas especies de Carabidae fueron identificadas por el tercer autor mediante comparación directa con ejemplares de series tipo.
Análisis estadísticos.
Se evaluó la diversidad alfa de hormigas y carábidos usando la aproximación conceptual de Jost y González-Oreja (2012). Se graficó la riqueza observada de especies (q0) y el error estándar con base en matrices de incidencia para hormigas, ya que estas son insectos sociales, y una colonia podría reclutar varias obreras si está cerca de la unidad muestral, por lo cual no habría independencia. Para los carábidos se utilizaron matrices de abundancia ya que no son sociales (Groc et al., 2014) y cada individuo constituye una unidad reproductiva, a diferencia de las hormigas. Se estimó el número equivalente de especies de orden 1 (NEE; q1) como una medida de la diversidad que tiene en cuenta las abundancias relativas de las especies (o incidencias, en el caso de las hormigas), lo que permite hacer comparaciones más fiables entre localidades. Estos análisis se realizaron con el paquete iNEXT (Hsieh et al., 2016) del programa R (R Core Team, 2019).
Para comparar la composición de las comunidades de hormigas y carábidos, se graficaron dendrogramas basados en distancia de Bray-Curtis, mediante el programa PAST (Hammer et al., 2001), así mismo, para determinar cuáles fueron las especies que contribuyeron mayoritariamente a la diferenciación entre comunidades, se realizó un análisis porcentaje de similitud (SIMPER) con el paquete vegan (Oksanen et al., 2022) del programa estadístico R versión 4.2.1 (R Core Team, 2019) en la plataforma RStudio versión 2021.9.0.351. Debido a la ausencia de hormigas a 3800 m s.n.m., esta altitud no se incluyó en el análisis de comunidades.
Resultados
Se recolectaron 892 hormigas (datos no mostrados) pertenecientes a 30 géneros, y 66 morfoespecies, que ocuparon 306 UMs (en adelante, “especies”; Tabla 1). Se reportan por primera vez para el Valle del Cauca las especies Neivamyrmex emersoni (Wheeler, 1921), Neivamyrmex punctaticeps (Emery, 1894), Camponotus zonatus (Emery, 1894), Octostruma batesi (Emery, 1894), Lachnomyrmex fernandezi (Feitosa & Brandão, 2008), Cyphomyrmex kirbyi (Mayr, 1887), Crematogaster obscurata (Emery, 1895), Crematogaster tenuicula (Forel, 1904), Acromyrmex subterraneus (Forel, 1893), Solenopsis stricta (Emery, 1896) y Leptogenys rasila (Lattke, 2011). El género con mayor riqueza de especies fue Pheidole (Westwood, 1839) (13 especies), seguido de Solenopsis (Westwood, 1840) (7 especies) y Camponotus (Mayr, 1861) (6 especies). Por su parte, Linepithema angulatum (Emery, 1894), Megalomyrmex cyendyra (Brandão, 1990) y Nylanderia steinheili (Forel, 1893) fueron las especies más abundantes, representando el 58 %, 54 %, y 42 % respectivamente, del total de las UM en la localidad de Pance.
La mayoría de las morfoespecies de hormigas (60) fueron recolectadas con métodos directos (agitación de follaje y captura directa, incluyendo recolecta libre), de las que el 70 % fueron exclusivas (i.e. especies no compartidas entre localidades, y por ende alturas, pero no necesariamente especialistas de hábitat). Por otro lado, los métodos pasivos (saco Winkler y trampa de caída) recolectaron 24 especies, de las cuales sólo el 25 % fueron exclusivas.
Tabla 1 Hormigas capturadas en las cuatro altitudes del PNN Farallones de Cali. Localidades ordenadas de menor a mayor altura: P, Pance (1600 m s.n.m.); C, Cominal (2400 m s.n.m.); M. Minas del Socorro (3200 m s.n.m.); B, Balcones (3800 m s.n.m.); Métodos de captura: Af, agitación de follaje; Ch, cernido de hojarasca; Cm, captura manual; Rl, recolecta libre; Tc, trampa de caída. UM ocupadas: número de unidades de muestreo ocupadas (máximo 52 por localidad).
| Subfamilia | Especie | Método de captura | UM ocupadas | Total | |||
|---|---|---|---|---|---|---|---|
| P | C | M | B | ||||
| Dolichoderinae | Azteca sp. 1 | Af | 1 | 0 | 0 | 0 | 1 |
| Linephitema angulatum (Emery, 1894) | Af, Rl, Cm, Tc | 30 | 3 | 0 | 0 | 33 | |
| Dorylinae | Labidus praedator (Smith, 1858) | Cm, Tc | 6 | 0 | 1 | 0 | 7 |
| Labidus spininodis (Emery, 1890) | Cm | 6 | 0 | 1 | 0 | 7 | |
| Neivamyrmex emersoni (Wheeler, 1921) | Cm | 2 | 0 | 0 | 0 | 2 | |
| Neivamyrmex punctaticeps (Emery, 1894) | Cm | 0 | 0 | 1 | 0 | 1 | |
| Ectatomminae | Holcoponera andina (Lattke, 1995) | Af, Rl, Tc | 7 | 0 | 0 | 0 | 7 |
| Holcoponera striatula (Mayr, 1884) | Tc | 4 | 0 | 0 | 0 | 4 | |
| Heteroponerinae | Heteroponera monticola Kempf & Brown, 1970 | Af, Cm, Tc | 3 | 5 | 0 | 0 | 8 |
| Formicinae | Brachymyrmex heeri Forel, 1874 | Rl, Cm | 1 | 0 | 0 | 0 | 1 |
| Camponotus atriceps (Smith, 1858) | Tc | 1 | 0 | 0 | 0 | 1 | |
| Camponotus zonatus Emery, 1894 | Cm | 0 | 5 | 0 | 0 | 5 | |
| Camponotus sp. 1 | Cm | 0 | 3 | 0 | 0 | 3 | |
| Camponotus sp. 2 | Rl | 1 | 0 | 0 | 0 | 1 | |
| Camponotus sp. 3* | Af | 1 | 0 | 0 | 0 | 1 | |
| Camponotus sp. 28* | Af, Rl, Cm | 5 | 0 | 0 | 0 | 5 | |
| Myrmelachista zeledoni Emery, 1896 | Af, Rl, Cm | 2 | 0 | 0 | 0 | 2 | |
| Nylanderia steinheili (Forel, 1893) | Af, Rl, Cm, Tc | 22 | 0 | 0 | 0 | 22 | |
| Nylanderia sp. 1 | Rl, Cm, Ch | 9 | 4 | 0 | 0 | 13 | |
| Nylanderia sp. 2 | Rl, Cm, Ch | 7 | 3 | 0 | 0 | 10 | |
| Myrmicinae | Acromyrmex subterraneus (Forel, 1893) | Rl | 2 | 0 | 0 | 0 | 2 |
| Atta cephalotes (Linnaeus, 1758) | Af, Rl, Cm, Tc | 4 | 0 | 0 | 0 | 4 | |
| Crematogaster obscurata Emery, 1895 | Rl, Cm, Ch | 1 | 2 | 0 | 0 | 3 | |
| Crematogaster sotobosque Longino, 2003 | Af, Rl, Cm, Tc | 8 | 0 | 0 | 0 | 8 | |
| Crematogaster tenuicula Forel, 1904 | Af | 1 | 0 | 0 | 0 | 1 | |
| Cyphomyrmex dixus Snelling & Longino, 1992 | Rl, Cm | 6 | 0 | 0 | 0 | 6 | |
| Cyphomyrmex flavidus Pergande, 1896 | Cm, Tc, Ch | 7 | 0 | 0 | 0 | 7 | |
| Cyphomyrmex kirbyi Mayr, 1887 | Cm, Tc | 0 | 2 | 0 | 0 | 2 | |
| Lachnomyrmex fernandezi Feitosa & Brandão, 2008 | Rl, Cm | 2 | 0 | 0 | 0 | 2 | |
| Megalomyrmex cyendyra Brandão, 1990 | Af, Rl, Cm, Tc | 28 | 0 | 0 | 0 | 28 | |
| Monomorium floricola (Jerdon, 1851) | Cm | 0 | 1 | 0 | 0 | 1 | |
| Octostruma batesi (Emery, 1894) | Rl, Cm | 3 | 0 | 0 | 0 | 3 | |
| Pheidole aff. pygmaea | Rl, Cm, Ch | 11 | 11 | 0 | 0 | 22 | |
| Pheidole sp. 1 | Rl, Cm | 2 | 0 | 0 | 0 | 2 | |
| Pheidole sp. 2 | Rl, Cm | 3 | 0 | 0 | 0 | 3 | |
| Pheidole sp. 3 | Cm | 1 | 0 | 0 | 0 | 1 | |
| Pheidole sp. 4 | Rl, Cm | 4 | 0 | 0 | 0 | 4 | |
| Pheidole sp. 5 | Rl | 1 | 0 | 0 | 0 | 1 | |
| Pheidole sp. 6 | Rl | 1 | 0 | 0 | 0 | 1 | |
| Pheidole sp. 7 | Rl | 3 | 0 | 0 | 0 | 3 | |
| Pheidole sp. 8 | Rl | 2 | 0 | 0 | 0 | 2 | |
| Pheidole sp. 9 | Rl, Cm, Ch | 2 | 3 | 0 | 0 | 5 | |
| Pheidole sp. 10 | Ch | 1 | 3 | 0 | 0 | 4 | |
| Pheidole sp. 11 | Rl | 2 | 0 | 0 | 0 | 2 | |
| Pheidole sp. 12 | Af, Cm | 1 | 2 | 0 | 0 | 3 | |
| Procryptocerus sp. 1 | Af, Rl | 2 | 0 | 0 | 0 | 2 | |
| Rhopalothrix ciliata Mayr, 1870 | Tc | 0 | 1 | 0 | 0 | 1 | |
| Solenopsis bicolor (Emery, 1906) | Cm | 1 | 0 | 0 | 0 | 1 | |
| Solenopsis franki Forel, 1908 | Rl, Cm, Ch | 3 | 0 | 0 | 0 | 3 | |
| Solenopsis rugiceps Mayr, 1870 | Rl | 1 | 0 | 0 | 0 | 1 | |
| Solenopsis stricta Emery, 1896 | Cm | 1 | 0 | 0 | 0 | 1 | |
| Solenopsis vinsoni Pacheco & Mackay, 2013 | Rl, Cm, Ch | 7 | 0 | 0 | 0 | 7 | |
| Solenopsis zeteki Wheeler, 1942 | Af, Tc | 0 | 3 | 0 | 0 | 3 | |
| Solenopsis aff. geminata | Cm | 1 | 0 | 0 | 0 | 1 | |
| Strumigenys gundlachi (Roger, 1862) | Cm, Ch | 1 | 1 | 0 | 0 | 2 | |
| Strumigenys biolleyi Forel, 1908 | Cm | 1 | 0 | 0 | 0 | 1 | |
| Strumigenys vartana (Bolton, 2000) | Ch | 1 | 0 | 0 | 0 | 1 | |
| Ponerinae | Hypoponera foeda (Forel, 1893) | Cm | 5 | 0 | 0 | 0 | 5 |
| Hypoponera aff. opaciceps | Cm | 0 | 3 | 0 | 0 | 3 | |
| Leptogenys rasila Lattke, 2011 | Tc | 2 | 0 | 0 | 0 | 2 | |
| Mayaponera becculata (Mackay & Mackay, 2010) | Rl, Cm, Ch | 6 | 0 | 0 | 0 | 6 | |
| Neoponera carbonaria (Smith, 1858) | Cm | 0 | 3 | 0 | 0 | 3 | |
| Odontomachus chelifer (Latreille, 1802) | Rl | 2 | 0 | 0 | 0 | 2 | |
| Odontomachus erythrocephalus Emery, 1890 | Rl | 1 | 0 | 0 | 0 | 1 | |
| Rasopone ferruginea (Smith, 1858) | Rl, Cm | 5 | 0 | 0 | 0 | 5 | |
| Proceratiinae | Discothyrea sp. 1 | Cm | 1 | 0 | 0 | 0 | 1 |
| Total | 245 | 58 | 3 | 0 | 306 | ||
*Se refiere a las morfoespecies de la clave de Fernández et al. (2019).
Respecto a los carábidos, se recolectaron 283 individuos pertenecientes a 10 tribus, 19 géneros y 43 morfoespecies (Tabla 2). Uno de estos géneros, que pertenece a la tribu Ctenodactylini, aún no está descrito para la ciencia (com. pers. Dr. Pierre Moret, octubre 5, 2023) es decir, al grupo de especies al que pertenece este carábido aún no se le puede asignar a un género. El género Dyscolus Dejean, 1831, fue el más especioso, con 12 especies registradas, mientras que Xystosomus sp. 1 fue la especie con mayor cantidad de ejemplares registrados (Tabla 2). Se destaca el registro, por primera vez en el país, de los géneros GuatemaltecaErwin y Zamorano, 2014 y Balligratus Moret & Ortuño, 2017. De igual forma, se reportan por primera vez para el Departamento del Valle del Cauca las siguientes especies: Notiobia concolor Putzeys, 1878, Pelmatellus columbiana (Reiche, 1843), Dyscolus subviolaceus (Chaudoir, 1842), Incagonum aeneum (Reiche, 1843) y Glyptolenoides azureus (Chaudoir, 1859). A su vez, se reportan datos precisos para especies descritas para Colombia, de las cuales no se conocía alguna localidad específica: Dyscolus cyanonotus Chaudoir, 1850 y Dyscolus longipennis (Reiche, 1843).
La gran mayoría de morfoespecies (36) se recolectó con métodos directos, de las cuales el 78 % fueron exclusivas. Por su parte, con los métodos pasivos (los mismos usados con hormigas más trampa de luz), se registraron 15 morfoespecies; de éstas, el 53 % fueron exclusivas. Se depositó una colección de referencia tanto de hormigas como de carábidos en el museo de entomología de la Universidad del Valle MUSENUV.
Tabla 2 Carábidos capturados en cuatro localidades del PNN Farallones de Cali. Localidades ordenadas de menor a mayor altura: P, Pance (1600 m s.n.m.); C, Cominal (2400 m s.n.m.); Minas del Socorro (3200 m s.n.m.); B, Balcones (3800 m s.n.m.). Métodos de captura: Af, agitación de follaje; Ch, cernido de hojarasca; Cm, captura manual; Rl, recolecta libre; Tc, trampa de caída; Tl, trampa de luz.
| Tribu | Especie | Método de captura | Abundancia | Total | |||
|---|---|---|---|---|---|---|---|
| P | C | M | B | ||||
| Bembidiini | Bembidion chimborazonum Bates, 1871 | Cm, Rl | 0 | 0 | 0 | 5 | 5 |
| Paratachys sp. 1 | Cm, Tl | 19 | 0 | 0 | 0 | 19 | |
| Xystosomus sp. 1 | Cm | 0 | 33 | 13 | 0 | 46 | |
| Ctenodactylini | Ctenodactylini sp. 1 | Tl | 0 | 3 | 0 | 0 | 3 |
| Harpalini | Notiobia concolor Putzeys, 1878 | Tl | 5 | 0 | 0 | 0 | 5 |
| Notiobia sp. 1 | Cm | 0 | 23 | 3 | 0 | 26 | |
| Pelmatellus sp.1 | Cm, Ch | 0 | 4 | 1 | 0 | 5 | |
| Pelmatellus columbianus (Reiche, 1843) | Cm | 0 | 0 | 7 | 0 | 7 | |
| Selenophorus sp. 1 | Cm | 2 | 0 | 0 | 0 | 2 | |
| Selenophorus sp. 2 | Cm | 2 | 0 | 0 | 0 | 2 | |
| Lachnophorini | Balligratus sp. 1 | Cm | 0 | 2 | 0 | 0 | 2 |
| Guatemalteca sp. 1 | Cm | 1 | 0 | 0 | 0 | 1 | |
| Lebiini | Dromius sp. 1 | Tl | 1 | 0 | 0 | 0 | 1 |
| Lebia sp. 1 | Cm, Tl | 0 | 4 | 4 | 0 | 8 | |
| Lebia sp. 2 | Af | 0 | 5 | 0 | 0 | 5 | |
| Lebia sp. 3 | Af | 0 | 6 | 0 | 0 | 6 | |
| Lebia sp. 4 | Cm | 0 | 0 | 1 | 0 | 1 | |
| Lebia cf. chlorotica | Cm, Tl | 5 | 0 | 0 | 0 | 5 | |
| Odacanthini | Pentagonica sp.1 | Cm | 0 | 1 | 0 | 0 | 1 |
| Perigonini | Perigona sp. 1 | Cm | 1 | 0 | 0 | 0 | 1 |
| Platynini | Dyscolus aff. laticollis | Cm | 0 | 1 | 0 | 0 | 1 |
| Dyscolus cyanonotus Chaudoir, 1850 | Tl | 1 | 0 | 0 | 0 | 1 | |
| Dyscolus longipennis (Reiche, 1843) | Af | 0 | 1 | 0 | 0 | 1 | |
| Dyscolus purpuratus Reiche, 1843 | Cm | 0 | 1 | 0 | 0 | 1 | |
| Dyscolus sp. 1 | Af, Cm, Rl | 0 | 19 | 0 | 0 | 19 | |
| Dyscolus sp. 2 | Cm | 0 | 7 | 0 | 0 | 7 | |
| Dyscolus sp. 3 | Af | 0 | 1 | 0 | 0 | 1 | |
| Dyscolus sp. 4 | Cm, Ch | 0 | 0 | 2 | 0 | 2 | |
| Dyscolus sp. 5 | Cm | 0 | 0 | 2 | 0 | 2 | |
| Dyscolus sp. 6 | Cm | 0 | 0 | 0 | 2 | 2 | |
| Dyscolus sp. 7 | Cm | 0 | 0 | 0 | 2 | 2 | |
| Dyscolus subviolaceus (Chaudoir, 1842) | Tl | 6 | 0 | 0 | 0 | 6 | |
| Glyptolenoides azureus (Chaudoir, 1859) | Cm, Tl | 0 | 7 | 2 | 0 | 9 | |
| Glyptolenoides sp. 1 | Cm | 0 | 0 | 3 | 0 | 3 | |
| Glyptolenoides sp. 2 | Cm | 0 | 0 | 0 | 3 | 3 | |
| Glyptolenus sp. 1 | Af, Tl | 0 | 7 | 0 | 0 | 7 | |
| Glyptolenus sp. 2 | Af | 0 | 1 | 0 | 0 | 1 | |
| Glyptolenus sp. 3 | Tl, Af, Cm | 0 | 16 | 0 | 0 | 16 | |
| Incagonum aeneum (Reiche, 1843) | Cm, Af | 0 | 1 | 3 | 0 | 4 | |
| Pterostichini | Loxandrus sp. 1 | Tc | 1 | 0 | 0 | 0 | 1 |
| Trechini | Oxytrechus sp. 1 | Ch | 0 | 0 | 12 | 0 | 12 |
| Oxytrechus sp. 2 | Cm | 0 | 0 | 0 | 13 | 13 | |
| Oxytrechus sp. 3 | Cm | 0 | 0 | 0 | 18 | 18 | |
| Total | 44 | 143 | 53 | 43 | 283 | ||
Tendencias de la riqueza respecto a la elevación altitudinal
En términos generales, la riqueza de hormigas presentó una tendencia muy severa a la disminución monótona a medida que aumentó la altitud; alcanzando el mayor valor a 1600 m s.n.m. (55 especies), seguido de 2400 m s.n.m. (19 especies) y 3200 m s.n.m. (3 especies). En el punto de muestreo más alto, a 3800 m s.n.m., no se encontraron hormigas a pesar de ejecutarse rigurosamente el protocolo de muestreo. Por su parte, los carábidos estuvieron presentes en todas las altitudes, su riqueza presentó un patrón de joroba, acumulando la mayor riqueza a 2400 m s.n.m. (20 especies), y presentando menores valores a 1600 m s.n.m. (11 especies), 3200 m s.n.m. (12) y 3800 m s.n.m. (6 especies). La riqueza (q0) de hormigas alcanzó una cobertura general de muestreo (basada en el número de UM ocupadas) del 93,49 %, mientras que los Carabidae tuvieron una cobertura general de muestreo (basada en el número de ejemplares recolectados) de un 95,77 % (Figura 2).
Para las hormigas, el mayor número de especies esperadas (q0) se dio a 1600 m s.n.m. (66), con una fuerte pendiente de descenso hacia los 2400 m s.n.m. (23); los carábidos por su parte, tuvieron un patrón de riqueza en forma de joroba, donde la mayoría de las especies esperadas se encontró a los 2400 m s.n.m. (37) (Figura 3a). Por su parte, al computar el número equivalente de especies de orden 1 (q1), se observó un patrón similar al de la riqueza de especies (q0), pero con una marcada disminución en la cantidad estimada de especies de carábidos a 2400 m s.n.m., incluso menor que la de hormigas (Figura 3b).
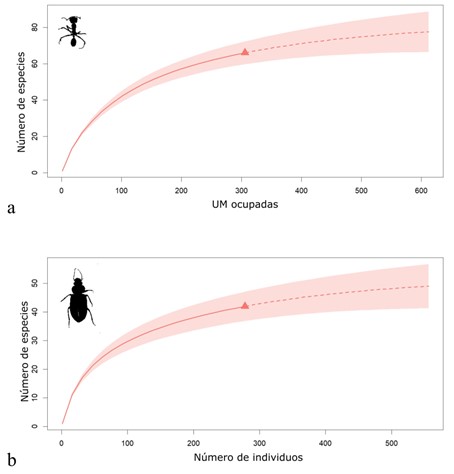
Figura 2 Rarefacción (línea continua) y extrapolación (línea punteada) de la riqueza (q0) de (a) hormigas y (b) carábidos en todas las localidades agrupadas.

Figura 3 Tendencias de la riqueza de especies de hormigas y carábidos con respecto a la elevación altitudinal, para hábitats naturales en cuatro localidades a diferentes altitudes del PNN Farallones de Cali. (a): Riqueza de especies (q0) observada y su diferencia (barra de error) respecto a la riqueza estimada de especies. (b): Número equivalente de especies de orden 1 (NEE; q1): para este caso, las barras error representan los intervalos de confianza del 95 %.
Diferenciación entre comunidades
El análisis de composición de las comunidades mostró valores muy bajos de similitud para hormigas: Pance (1600 m s.n.m.) y Cominal (2400 m s.n.m.) alcanzaron apenas un 15 % de similitud, mientras que Minas del Socorro (3200 m s.n.m.) no guardó similitud con las dos primeras (Figura 4a), las hormigas no estuvieron representadas en Balcones (3800 m s.n.m.). Por su parte, la mayor similitud entre las comunidades de carábidos (Figura 4b) se presentó entre las localidades de Cominal y Minas del Socorro (aproximadamente 25 %), mientras que Balcones y Pance se diferenciaron completamente, cada una de ellas con un ensamblaje único, con especies que no se presentaron en ninguna otra localidad. En resumen, las localidades fueron, en general, muy diferentes en cuanto a su composición.
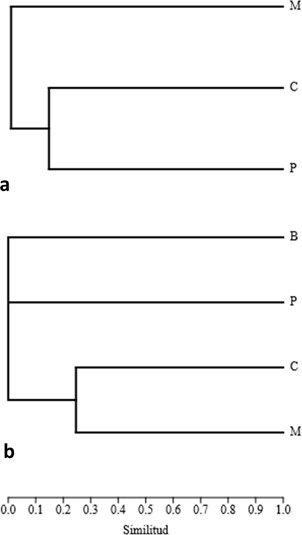
Figura 4 Dendrograma de similitud con base en distancia de Bray-Curtis para las comunidades de (a) hormigas y (b) carábidos de cuatro localidades de los Farallones de Cali. B: Balcones (3800 m s.n.m.), M: Minas del Socorro (3200 m s.n.m.), C: Cominal (2400 m s.n.m.), P: Pance (1600 m s.n.m.).
El análisis SIMPER mostró que las especies Megalomyrmex cyendyra, Linepithema angulatum y Nylanderia steinheili aportaron alrededor del 33 % de la diferenciación entre las altitudes de 1600 y 2400 m s.n.m. (Tabla 3), las demás altitudes no pudieron ser comparadas, dadas las muy bajas incidencias de especies. Por otra parte, los géneros de carábidos más influyentes en la diferenciación entre localidades fueron Xystosomus Schaum 1863, Oxytrechus Jeannel, 1927, Paratachys Casey, 1918, Dyscolus, Glyptolenus Bates, 1878, y la especie Bembidion chimborazonum Bates, 1871.
Tabla 3 Especies de hormigas y carábidos que aportan más a la disimilitud entre pares de localidades, de acuerdo con la prueba SIMPER. B: Balcones (3800 m s.n.m.), C: Cominal (2400 m s.n.m.), M: Minas del Socorro (3200 m s.n.m.), P: Pance (1600 m s.n.m.).
| Familia | Pares de localidades | Especie | Aporte a la diferenciación (%) | P-valor |
|---|---|---|---|---|
| Formicidae | P-C | Megalomyrmex cyendyra | 12,41 | 0,001 |
| Linepithema angulatum | 11,01 | 0,042 | ||
| Nylanderia steinheili | 9,23 | 0,008 | ||
| Carabidae | P-C | Xystosomus sp. 1 | 27,82 | 0,095 |
| Paratachys sp. 1 | 11,18 | 0,217 | ||
| Dyscolus sp. 1 | 9,54 | 0,018 | ||
| Glyptolenus sp. 3 | 8,17 | 0,016 | ||
| Notiobia sp. 1 | 6,12 | 0,317 | ||
| P-M | Xystosomus sp. 1 | 20,98 | 0,313 | |
| Paratachys sp. 1 | 16,03 | 0,024 | ||
| Oxytrechus sp. 1 | 12,17 | 0,018 | ||
| Selenophorus sp. 1 | 5,50 | 0,179 | ||
| Glyptolenoides sp. 1 | 5,13 | 0,126 | ||
| P-B | Paratachys sp. 1 | 17,9 | 0,036 | |
| Oxytrechus sp. 3 | 12,76 | 0,044 | ||
| Bembidion chimborazonum | 12,09 | 0,012 | ||
| Selenophorus sp. 1 | 10,81 | 0,034 | ||
| Oxytrechus sp. 2 | 9,21 | 0,044 | ||
| C-M | Xystosomus sp. 1 | 19,25 | 0,432 | |
| Dyscolus sp. 1 | 8,97 | 0,03 | ||
| Glyptolenus sp. 3 | 7,66 | 0,021 | ||
| Oxytrechus sp. 1 | 7,48 | 0,309 | ||
| Notiobia sp. 1 | 6,72 | 0,112 | ||
| C-B | Xystosomus sp. 1 | 28,50 | 0,107 | |
| Oxytrechus sp. 3 | 9,96 | 0,146 | ||
| Dyscolus sp. 1 | 9,23 | 0,084 | ||
| Glyptolenus sp. 3 | 7,93 | 0,079 | ||
| Oxytrechus sp. 2 | 7,20 | 0,146 | ||
| M-B | Xystosomus sp. 1 | 24,69 | 0,196 | |
| Oxytrechus sp. 3 | 12,31 | 0,058 | ||
| Oxytrechus sp. 1 | 12,24 | 0,061 | ||
| Bembidion chimborazonum | 9,91 | 0,05 | ||
| Oxytrechus sp. 2 | 8,89 | 0,058 |
Discusión
Este estudio contribuyó con el reconocimiento de aspectos de biodiversidad y conservación de hormigas y carábidos dentro de uno de los sitios más biodiversos del mundo; el PNN Farallones de Cali es una fuente de aprovisionamiento hídrico para una ciudad de creciente población, que está amenazada por actividades de origen antrópico (algunas de ellas, de origen ilegal), a su vez, éstas influyen en el registro de especies biológicas. Se encontraron 11 nuevos registros de especies de hormigas y cinco de carábidos para el Valle del Cauca, hallazgos que aportan a la disminución del déficit wallaceano (Hortal et al., 2015) en la región. De igual forma se destaca el registro de dos géneros de Carabidae no conocidos en Colombia, cuyo reporte era esperable, dada la distribución del hábitat donde se registraron las especies ya descritas, y por la amplitud distribucional (Erwin & Zamorano, 2014; Moret & Ortuño, 2017). Finalmente, se registraron ejemplares de un género que no ha sido descrito, de la tribu Ctenodactylini (Moret, com. pers. A.A.).
Si bien este estudio no tuvo como objetivo detallar aspectos relacionados con la categorización del estado de amenaza de las especies registradas, al menos para los Carabidae se puede sugerir que existen elementos suficientes para justificar su categorización como “vulnerable” (UICN, 2012). Esto teniendo en cuenta elementos como su presencia en el páramo, la relación positiva entre la cantidad especies braquípteras conforme aumenta la altitud, la incidencia de endemismos, la limitada área de ecosistema natural disponible y el aislamiento entre unidades orográficas de alta montaña (Maveety & Browne, 2014; Moret, 2005). Se destaca la alta cantidad de especies reportadas con medios de captura activos (con respecto a los pasivos), tanto para hormigas como para carábidos, lo que denota la importancia de abordar el estudio de la composición faunística de una localidad, a través de métodos de captura que se relacionen mejor con la historia de vida de los organismos estudiados; si solamente se hubiera muestreado con base en métodos pasivos, con el mismo esfuerzo de muestreo, nuestros hallazgos habrían registrado solamente un 36,4 % de la fauna de hormigas, y un 34,8 % de la fauna de carábidos.
Este estudio permitió apreciar las tendencias de riqueza (q0) de hormigas y carábidos con respecto a la elevación altitudinal, encontrándose diferencias en los dos grupos. Por un lado, la riqueza de hormigas disminuyó alrededor de un 65 % entre los 1600 (cobertura de muestreo del 74 %) y los 2400 m s.n.m. (cobertura de muestreo del 92 %), y cerca del 95 % comparada con la altitud de 3200 m s.n.m.. Este patrón guarda semejanzas con hallazgos previos en la región neotropical, donde la mayor riqueza se acumula en altitudes más bajas y se presenta una caída más o menos constante hasta los 1500 m s.n.m., con un fuerte descenso hacia los 2000 m s.n.m. (Longino & Colwell, 2011; Longino et al., 2019). Nuestros resultados de mayor riqueza (57 especies a 1600 m s.n.m.) se ubican en medio del descenso constante en las curvas previamente reportadas.
Los Carabidae, en cambio, presentaron la mayor acumulación de especies a 2400 m s.n.m. Este patrón difiere del reportado por Maveety et al. (2011), quienes hallaron un patrón de disminución monótono de la riqueza de Carabidae en Perú, cuyos mayores valores se concentraron a 1500 y 2000 m s.n.m., con 28 morfoespecies cada una. En contraste, un análisis posterior de Maveety et al. (2014), con el mismo grupo de datos, mostró que la riqueza de Carabidae se acumuló hacia los 2000 m s.n.m. Finalmente, la amplitud altitudinal de los Carabidae fue mayor que la de las hormigas, si bien la riqueza de estas fue mucho mayor a la altitud más baja, los Carabidae pueden estar representados hasta más de 4000 m (Moret, 2005). Aunque se reconoce que hubo una porción de la fauna que no fue detectada, consideramos nuestros datos confiables debido a: (1) un protocolo riguroso, intenso, y replicado en todas las alturas y (2) el método de colecta manual es uno de los más eficientes que existen y se realizó continuamente por varios días, (3) uso de varias técnicas de captura y estandarización en cuanto al muestreo del hábitat natural más conservado (e.g. leñoso) que existiera en todas las alturas.
Se destaca que, a pesar de los muestreos estandarizados, no encontramos hormigas para alturas de páramo en el área de los Farallones de Cali (muy pocas en 3200 y ninguna en 3800 m s.n.m.), lo que tampoco significa necesariamente que no puedan haber, ya que la precipitación y aspectos comportamentales de estos organismos pudieron haber afectado la ausencia de registros. Sin embargo, no se descarta que esta drástica disminución pueda asociarse a efectos de tipo ambiental (desafortunadamente no se pudieron tomar estos datos en campo), pues se ha reportado la riqueza de hormigas está positivamente relacionada con la temperatura, que a su vez disminuye a medida que se asciende en el gradiente altitudinal (Perillo et al., 2021). Las temperaturas bajas disminuyen la actividad de las hormigas (metabolismo, alimentación y desarrollo de huevos y larvas) y limitan sus rangos de dispersión, provocando bajas tasas de colonización, retención de los individuos en un mismo tipo de hábitat y muerte de los colonizadores en lugares no aptos para su desarrollo (Kunene et al., 2022). A su vez, otro aspecto como la estrecha relación entre algunas especies de hormigas y plantas (Armbrecht & Perfecto, 2017; Ramírez et al., 2001) puede determinar su presencia, de modo que el efecto que el clima propio de cada altitud tiene sobre la diversidad vegetal (Gómez-Díaz et al., 2023), también podría afectar la diversidad de hormigas. La disminución (o ausencia) de una especie en un sitio dado puede deberse a varias posibilidades (1) nunca estuvo allí; (2) alguna vez migró al sitio y se extinguió localmente; (3) evolucionó en el sitio, pero se extinguió localmente. Nuestros resultados son consistentes con los estudios de Guerrero y Sarmiento (2010) y Morales et al. (2022) que reportan que la riqueza de hormigas disminuye con la altura en diferentes escenarios colombianos.
El q1 o número de especies equivalentes para hormigas y carábidos siguió una tendencia similar a lo que ocurrió con q0, lo que se interpreta como consistente y refuerza a los resultados, ya que q1 le da peso a la abundancia relativa de las especies, más allá de su riqueza (Jost & González-Oreja, 2012). Se debe resaltar que, para el caso de las hormigas, la abundancia se contabilizó como incidencia en las unidades muestrales y no se tuvo en cuenta el número de obreras (individuos) colectados debido a que son organismos eusociales (por lo tanto, hay más posibilidad de colectar muchos individuos si se está cerca del nido).
Por otra parte, es necesario destacar que la baja superposición en cuanto a composición en las diferentes alturas hace sospechar la vulnerabilidad que poseen los organismos a fenómenos estocásticos o antropogénicos de destrucción de su hábitat. Este estudio encontró una similitud muy baja en la composición de las comunidades de hormigas y carábidos a diferentes altitudes, lo que sugiere que cada hábitat posee una fauna propia, y que cada hábitat en particular aporta elementos faunísticos propios. Por tanto, se deben diseñar estrategias para conservar hábitats naturales a lo largo del gradiente altitudinal y fomentar la conectividad a través de las alturas. En otras palabras, todos los hábitats naturales deben ser conservados a lo largo del gradiente altitudinal de la montaña, y no solo en una altitud en particular.
Finalmente, se reconoce que una sola expedición (aunque muy intensa) no es suficiente para tener una completa representatividad biológica cercana al 100 % (lo cual es difícil en insectos), por lo que sería de gran aporte repetir el protocolo de muestreo para incrementar el esfuerzo de muestreo. Los resultados aquí reportados se asocian a una época anual lluviosa y de luna nueva, aportando una investigación valiosa al vacío de información de la diversidad de insectos en el PNN Farallones de Cali, pero no es posible extrapolar a otras épocas del año. Por otra parte, se requiere un inmenso esfuerzo logístico y financiación para estas expediciones; inclusive, aunque se tomaron algunas mediciones de hábitat en cinturones altitudinales, las condiciones extremas de los sitios más altos en páramo afectaron los equipos y las variables ambientales no se pudieron reportar aquí para fines comparativos. Sería de gran aporte realizar estudios a largo plazo y en diferentes épocas del año para dar luces acerca de los efectos del cambio climático en la biota silvestre en diferentes alturas.
Conclusiones
Se confirmó que la distribución de hormigas y carábidos en el PNN Farallones de Cali se puede asociar a la regla altitudinal de Rapoport, pero es necesario tener en cuenta los factores bióticos y abióticos como la heterogeneidad de hábitat y la temperatura, respectivamente, que acompañan al cambio de altitud y les asignan características espaciales distintivas a los diferentes cinturones altitudinales. Este estudio logró construir, por primera vez, la base de un inventario taxonómico de hormigas y carábidos para este gradiente de los Farallones, a través de un muestreo estandarizado y riguroso que incluye nuevos reportes a nivel departamental y nacional, la cual servirá como punto de partida para monitoreos futuros, planes de manejo ambiental, seguimiento de la salud ecológica del ecosistema y descripción de nuevas especies. La baja similitud en la composición de especies entre las alturas para ambos grupos de insectos genera preguntas y preocupación sobre la vulnerabilidad y peligro que pueden enfrentar estas poblaciones de insectos en cuanto a factores antropogénicos y relacionados con el cambio climático.















