Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.2 Medellín Apr./June 2006
Cultivo de dorada (Brycon sinuensis Dahl, 1955) en jaulas flotantes a diferentes niveles de proteína
Ingris Mercado Burgos1, Acuic; José Luis García1, Acuic; Robinson Rosado Cárcamo2, IP; Charles W Olaya-Nieto1, IP, MSc; Fredys F Segura-Guevara1, Acuic; Samir B Brú-Cordero1, Acuic; Glenys Tordecilla-Petro1, Acuic
1Laboratorio de Investigación Biológico Pesquera-LIBP,
2CINPIC, Departamento de Ciencias Acuícolas, Universidad de Córdoba. AA 895.Montería, Colombia.
(Recibido: 21 abril, 2005; aceptado: 18 abril, 2006)
Resumen
Se evaluó el cultivo de dorada (Brycon sinuensis) en jaulas flotantes durante 180 días. Se determinó el crecimiento mediante la ganancia en longitud, ganancia en peso, tasa de crecimiento específico, sobrevivencia final, biomasa total, factor de condición y factor de conversión alimenticia. Se sembraron 816 juveniles con talla promedio de 17.8 cm de longitud total y peso promedio de 78.7 g, en cuatro tratamientos con densidad de siembra de 25 peces/m3 y tres réplicas cada uno. Las dietas balanceadas (proteína bruta) suministradas fueron: tratamiento 1: 20%; tratamiento 2: 32%; tratamiento 3: 28%; y tratamiento 4: 24%, con diseño experimental completamente aleatorio. Se puede afirmar que la dorada consumió las dietas de origen vegetal de igual manera que las de origen animal, sin embargo la dieta del 28% de proteína bruta (tratamiento 3) muestra los mejores resultados, sin diferencias significativas entre tratamientos (p>0.05). En todos los trabajos anteriores, la ganancia en peso diaria fue baja, pero mejor que las obtenidas en esta investigación. Mientras que el rendimiento en biomasa fue mayor que los reportados para cultivos en estanques, para todos los tratamientos en este estudio fue muy bajo.
Palabras clave: biomasa, cultivo intensivo, fibra animal, fibra vegetal, proteína bruta.
Introducción
La dorada Brycon sinuensis (7) es un pez reofílico nativo del Río Sinú tradicionalmente capturado y de importancia comercial, de los más afectados por la construcción de la Represa de Urrá al interrumpírsele su migración aguas arriba de la presa (22). Al igual que otros miembros del género Brycon, es un alimento importante en Centro y Sur América, en donde muchas especies son de interés comercial en la pesquería de los ríos Suramericanos tras-andinos desde el norte de Perú hasta el sistema del Lago de Maracaibo en Venezuela (18).
Los Brycónidos son omnívoros, consumiendo principalmente alimento alóctono, como frutas, semillas, e insectos (14, 17, 30), al igual que la dorada (15), lo que ha permitido cultivarla individualmente (37, 38) y con otras especies como bocachico Prochilodus magdalenae (10), mojarra amarilla Caquetaia kraussii (12), mojarra negra Petenia umbrifera (11) y cachama negra (Colossoma macropomum) (13), señalando que es una especie promisoria para la piscicultura por su rápido crecimiento.
Sin embargo, el comportamiento de la dorada en confinamiento, a pesar de la información con que se cuenta, no ha permitido definir una metodología de cultivo de la especie, especialmente en sistemas intensivos, a pesar de ser un pez que acepta alimento artificial, con algunos rendimientos en cultivos en estanques. Por lo tanto, este trabajo tuvo como objetivo evaluar el cultivo de la dorada en jaulas flotantes a diferentes niveles de proteína.
Materiales y métodos
El estudio se realizó en el reservorio de la Granja Piscícola Tamarindo, El Espinal, Colombia, con las siguientes coordenadas geográficas: 4°9´ de latitud norte y 74°53´ de longitud oeste, altura de 323 msnm, precipitación promedio anual de 1227.4 mm y temperatura promedio de 29 °C. El reservorio tiene una extensión de una hectárea, profundidad media de dos metros, y es llenado por aguas lluvias, recirculación del agua usada en la granja y un pozo auxiliar subterráneo.
Para el levante se utilizaron 12 jaulas cuadradas de 1.5 m de arista con varillas de hierro corrugado de ½ pulgada, sumergidas a una altura de 1.20 m, volumenútil de 2.7 m3 y tamaño de malla de 2.54 cm. Las jaulas fueron cubiertas con polipropileno para evitar que los animales se escaparan, con un orificio central para facilitar la alimentación. En la parte exterior de las jaulas se colocaron dos tubos de PVC de 4 pulgadas de diámetro anclados a dos postes ubicados en tierra quedando suspendidas a 0.50 m del fondo del reservorio. Cada una tenía una malla “comedero” de 4 mm de diámetro cubriendo 0.5 m de jaula verticalmente para evitar la pérdida del alimento.
Se sembraron 816 juveniles con longitud total (LT) y peso total promedio (WT) de 17.8 cm y 78.7 g, respectivamente, obtenidos en la Universidad de Córdoba. La densidad de siembra fue de 25 peces/ m3 por jaula. Durante los 180 días de cultivo se observó el comportamiento de los animales diariamente, y se revisaron y limpiaron las jaulas semanalmente. El alimento suministrado fue elaborado en INVERANGEL S.A. El diseño experimental constó de cuatro tratamientos con tres réplicas cada uno, así: T1 (20%), T2 (32%), T3 (28%) y T4 (24%) de proteína bruta. Se alimentó “a saciedad” dos veces por día (8:00 y 16:00) y después se aumentó la frecuencia a tres veces por día (8:00, 14:00 y 17:00).
Las variables físico-químicas del agua se midieron quincenalmente, registrándose el Oxígeno (mg/L) usando un oxímetro digital marca Pinpoint Oxigen Meter, capacidad entre 0.0 y 20 ppm, pH por colorimetría con equipo Merck, rango entre 0.3-8.2 (Ref. 108038.0001), temperatura utilizando termómetro de mercurio marca Ertco, escala entre - 20 y 110 °C subdividido en décimas de grado, la transparencia (cm) se midió con disco Secchi, y el amoníaco por colorimetría usando un equipo Merck con rango entre 0.02-2.0 ppm (Ref. 1,11117.0001); lo mismo que las biometrías.
La ganancia en longitud se obtuvo con GL= Ltf - Lto, en donde: Ltf= Longitud total promedio final y Lto= Longitud total promedio inicial; la ganancia en peso, con GP= Wf - Wo, en donde: Wf= Peso promedio final y Wo= Peso promedio inicial; la tasa específica de crecimiento en peso, con TECW= 100 Ln (Wf- Wo)/Dt, en donde, Wf= Peso total final, Wo= Peso total inicial y Dt= Período de tiempo; el factor de condición, con ǿ= WT/LTq, en donde: WT= Peso total, LT= Longitud total y q= Constante relacionada con el tipo de crecimiento del pez (b).
Para estimar la curva de crecimiento en longitud se aplicó la expresión matemática de Von Bertalanffy (39) adaptada a la piscicultura (34): Lt= L¥ [1-e– k (tc +fc)], en donde, Lt= Longitud total media de los individuos en un tiempo, L¥= Longitud asintótica alcanzada en las condiciones de cultivo, e= base del logaritmo neperiano, K= Constante que expresa la tasa a la cual se alcanza L¥, tc= Tiempo de cultivo y fc= Factor de corrección del tiempo de cultivo, la curva de crecimiento en peso se estimó con la ecuación de Santos (34): Wt= W¥ [1-e– k (tc +fc)] q, en donde, W¥= Peso asintótico, y la relación longitud-peso se obtuvo con WT= a LTb (25), en donde, a= Coeficiente de regresión, o factor de condición y b= Constante relacionada con el crecimiento del pez (q).
Al final del experimento se determinó la sobrevivencia utilizando la relación S=100*(No/Nt), en donde, No= Número de individuos sembrados y Nt= Número de individuos cosechados; la biomasa total con la ecuación Bt = Nt * Wt; y el factor de conversión alimenticia con la fórmula FCA= Cantidad de alimento suministrado en un tiempo/Incremento en peso de la población en igual tiempo.
El diseño estadístico fue completamente al azar, los resultados se presentan como promedio ± desviación estándar, a los cuales se les aplicó la técnica de análisis de varianza (p<0.05). Como prueba de significancia, se aplicó el test de comparaciones múltiples de Tukey- Kramer (p<0.05).
Resultados
El comportamiento de las variables físico-químicas del agua se muestra en la figura 1. El Oxígeno fluctuó entre 7.0 y 7.8, promedio de 7.5±0.3 mg/L, el pH entre 7.5 y 8.0 con promedio de 7.7±0.2; la temperatura entre 29.5 y 31.0 °C, con promedio de 30.2±0.5 °C; la transparencia entre 30.0 y 50.0 cm, promedio de 41.0±5.5 cm; y el amoníaco entre 0.2 y 0.7 ppm, promedio de 0.4±0.1 ppm.
La ganancia en longitud (GL) fue: T1 =7.3±0.06 cm, T2= 7.2±0.3 cm, T3 =7.3 ±0.3 cm y T4 =6.9±0.3 cm, sin diferencias significativas entre los tratamientos (F =1.647; p =0.2544; gl =11) (véase figura 2). La ganancia en peso (GP) fue: T1 =117.6 ±5.0 g, T2 =116.5±1.9 g, T3 =122.6±0.6 g y T4 =112.6±1.8 g, sin diferencias significativas entre los tratamientos (F =6.304; p =0.0168; gl =11) (véase figura 3). La tasa de crecimiento específico en peso (TCEW) alcanzada fue: T1=0.51±0.02%, T2 =0.51±0.01%, T3 =0.52±0.0001% y T4 =0.49±0.0001%, sin diferencias significativas entre tratamientos (F=2.938; p =0.0962; gl =11). En la figura 4, se aprecia que T3 alcanzó el mejor factor de condición (0.08±0.03), sin diferencias significativas entre tratamientos (F =0.7112; p =0.5721; gl =11).
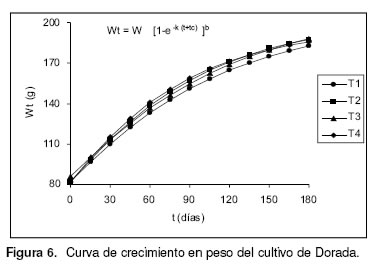
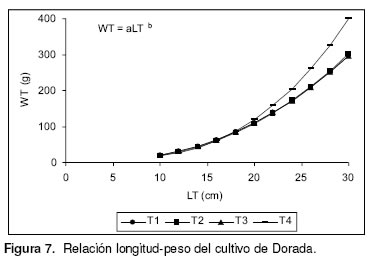
Las figuras 5 y 6 muestran las curvas de crecimiento para cada uno de los tratamientos, mientras que la relación longitud-peso se muestra en la figura 7. Se encontró que T3 alcanzó la mayor longitud (L¥) y peso asintótico (W¥), que el coeficiente de crecimiento (b=q) de la relación longitud-peso osciló entre 2.45 (T1, T3) y 2.53 (T2) con alta correlación (r =0.99) entre las variables comparadas, T1 (96.1±2.2%) y T3 (96.1±4.2%) presentaron la mejor sobrevivencia (véase Figura 8), sin diferencias significativas entre ellos (F =1.323; p =0.3328; gl =11), en tanto que el promedio del cultivo fue 93.9%. La biomasa total de cada tratamiento se muestra en la figura 9, siendo T3 (13.2±0.5Kg) el mejor, sin diferencias significativas entre ellos (F =2.762; p =0.1114; gl =11). En la figura 10 se presenta el factor de conversión alimenticia (FCA), con el mejor resultado para T1 y T3 (2.7:1), sin diferencias estadísticamente significativas entre tratamientos (F =2.976; p =0.0966; gl =11).
Discusión
El análisis de los parámetros físico-químicos del agua permite afirmar que todas las variables, excepto la temperatura, se encontraron dentro de los rangosóptimos para la especie.
Concentraciones de 3 mg/lt o menos son peligrosas para los peces y la mayoría de su fauna acompañante, debiendo ser de 5 mg/lt o más (8) a excepción de las truchas (40). Todo organismo tiene un rango de pH dentro del cual se hace posible su crecimiento (6.5 - 8.0) en el caso de los peces (40), y muy pocas especies pueden crecer a pH inferiores a 2.0 o superiores a 10 (26). Aguas con pH entre 6.5-9.0 en las primeras horas del día son muy convenientes para el cultivo de peces (8), mientras que la reproducción disminuye considerablemente con pH menores a 6.5 (20). El pH del agua no afectó los procesos de crecimiento de la dorada, debido a que se mantuvo en el rango recomendado.
La tolerancia a la temperatura, en los organismos acuáticos cultivables, depende de la que presente en su medio natural (40). Las especies tropicales y subtropicales no crecerán bien si la temperatura del agua es menor de 26-28 °C y morirán por debajo de los 10-15 °C (27). De acuerdo con lo reportado por diferentes investigadores es posible que los valores alcanzados por este parámetro no fueran los óptimos para la especie cultivada.
Aguas verdes con transparencia de 30.0-40.0 cm son ideales para la mayoría de los peces (26), aguas de color verde o verde-marrón con visibilidad mediana de 30.0-60.0 cm tienen buena concentración de fitoplancton, oxígeno y fertilidad óptima (40). La turbidez reduce la luz y la fotosíntesis en los estanques fertilizados, en donde los peces dependen de alimento natural, mientras que no causa daños esenciales en la nutrición de los peces en los estanques donde se proporciona alimento artificial (5).
La presencia del amonio muestra contaminación con materia orgánica, aunque no se tuvieron problemas de mortalidad por toxicidad con amonio durante el período de cultivo. El mecanismo primario de toxicidad del amonio es desconocido, pero sí se conocen un buen número de efectos fisiológicos en los peces (36). El amoníaco es tóxico a concentraciones relativamente bajas aumentando su efecto con la temperatura, mata las larvas y alevinos cuando es mayor de 0.2 ppm y la mayoría de los peces cuando es mayor que 1.0 mg/lt (40) y niveles tan bajos como 0.1 ppm son estresantes aún cuando la exposición sea breve (35).
En cuanto al crecimiento se refiere, después de analizar la ganancia en longitud, (GL), la ganancia en peso (GP) y la tasa de crecimiento específico en peso (TCEW), se infiere que el crecimiento de la dorada fue similar para todas las dietas (20, 24, 28 y 32%). Se observó que la talla promedio obtenida en este estudio (25.0 cm) es similar a la de Barreto y Tapias (3) y mayor que la de Peña (20.0 cm) (23), lo mismo que la ganancia en longitud (7.2, 7.5 y 5.7 cm). Sin embargo el peso promedio (196.0 g) fue mayor que el alcanzado por Barreto y Tapias (3) (185.6 g) y Peña (20.0 cm) (23) y menor que el reportado por González et al (11) en monocultivo (321.0 g) y cultivo mixto (346.5 g) y González et al (13) en monocultivo (360.0 g) y cultivo mixto (296.8 g), aunque la tasa de crecimiento específico en peso estimada (0.5 g/día) fue menor que la de Barreto y Tapias (3) y Peña (23), y mucho menor que 1.2 y 0.8 g/día informado por Saint-Paul y Werder (32) para el cultivo de Brycon melanopterus a densidades de 1 y 2 peces/m2, y 1.0 g/día reportado para Matrinchã (B. orbignyanus) cultivado en jaulas flotantes y alimentado con dietas del 35% de proteína bruta y 3200 Kcal de energía metabolizable/kg (4). Lo anterior permite inferir que el crecimiento en peso para la dorada fue irregular y no respondió a lo esperado según la literatura revisada.
Varios investigadores (2, 21, 28) han comprobado que el factor de condición es altamente variable, incluso usando el mismo tratamiento en cultivos controlados, debido a que la influencia de factores internos y externos es muy acentuada sobre este coeficiente, reflejando variaciones fisiológicas de los individuos en función del medio ambiente, indicando la condición o bienestar de los peces, basándose en la hipótesis de que los peces más pesados de una misma talla están en mejor condición que los menos pesados (2). También se utiliza para comparar dos o más poblaciones que estén bajo condiciones de alimentación, densidad poblacional y condiciones ambientales similares o diferentes y para explicar variaciones en la población atribuibles a la dieta suplementaria.
Se encontró que la mayor longitud y peso asintóticos se corresponden con el mejor factor de condición y con el menor coeficiente de crecimiento con respecto a los demás tratamientos (T3). Sin embargo, todas las tallas asintóticas fueron similares entre tratamientos, al igual que los pesos asintóticos, excepto el T4. Para los peces óseos, el coeficiente de crecimiento puede variar entre 2.0-4.0 (2) o entre 2.5–4.0 (16, 25) promediando generalmente 3.0 debido a que la relación de crecimiento se da en tres dimensiones mientras que la longitud en una sola (28, 29), por lo que se puede afirmar que los estimados en este trabajo son alométricos negativos (b¹3). Por lo anterior, se infiere que el crecimiento de la dorada fue similar tanto en longitud como en peso para los diferentes porcentajes de proteína suministrados a cada tratamiento sin alcanzar las tallas y pesos esperados de acuerdo con el tiempo de cultivo, lo que significa que no hubo un ritmo de crecimiento sostenido.
La sobrevivencia observada para cada tratamiento, lo mismo que el promedio del cultivo son altas, lo que indica que los peces se adaptaron a las condiciones físico-químicas del cuerpo de agua y al manejo por muestreo y limpieza. El factor de conversión alimenticia (FCA) de este trabajo fue similar al obtenido en el cultivo de Brycon melanopterus (2.7:1) por Saint-Paul y Werder (31). Werder y Saint-Paul (41) reportan los mejores resultados con el uso de dietas con rangos entre el 34 y 35% de proteína bruta en la alimentación del Matrinxâ (B. cephalus), siendo ésta la mitad de origen animal, y estudiaron la influencia de las fuentes proteínicas de origen animal y vegetal en el crecimiento del Matrinxá, concluyendo que el aprovechamiento es igual para ambas fuentes. Cyrino et al (6), utilizaron cinco dietas isoprotéicas (35%) e isocalóricas (3200 Kcal/kg), variando la cantidad de proteína vegetal de 0 a 80%, sin observar diferencias significativas entre los tratamientos, concluyendo que el Matrinxâ (B. cephalus), parece tener la capacidad de digerir bien la proteína, independientemente de su origen.
Pereira Filho et al (24) utilizaron dietas con diferentes niveles de proteína y fibra bruta en un ensayo para determinar sus efectos en la alimentación de Matrinxâ (B. cephalus), observando que las dietas del 20% de fibra no afectaron la ganancia en peso de los peces. Esquivel et al (9) realizaron un estudio con Piracanjuba (B. orbignyanus), encontrando las mejores respuestas en las dietas que contenían el mayor porcentaje de fibra bruta (9%) después de 105 días de cultivo, y que la utilización de raciones de fibra por encima de las empleadas comúnmente proporcionó bajos niveles de grasa. Afirman, además, que una de las características más importantes de estos peces es el aparente fácil manejo de dietas con altos niveles de fibra, lo que puede conllevar al mayor uso de fuentes de origen vegetal. Meurer (19) y Zaniboni-Filho y Meurer (42) afirman que juveniles de Pirancajuba presentan mayores coeficientes de digestibilidad aparente para ingredientes de origen vegetal con respecto a los de origen animal. El efecto de tres niveles de proteína (T1: 20, T2: 25 y T3: 30%) fue evaluado en el engorde de yamú (B. amazonicus), sembrando 1.5 alevinos/500 m2, con recambio del 10% durante 120 días, en donde el mejor rendimiento se presentó en el tratamiento 2 (1). El yamú es definido como una especie que aparentemente necesita niveles bajos de proteína para alcanzar su máximo crecimiento (33).
A pesar de que la temperatura del agua osciló fuera del rango recomendado para el desarrollo de la dorada, siendo un factor limitante para su crecimiento, los diferentes puntos de vista sobre el papel que desempeñan la fibra vegetal y animal y la proteína bruta en la composición de la dieta suministrada al género Brycon, sumado a que dentro del género se pueden presentar diferencias en las necesidades de proteína dependiendo de la especie, es importante seguir realizando ensayos para encontrar la dieta requerida por cada especie.
En todos los trabajos anteriores realizados en Colombia, la ganancia en peso diaria fue baja, pero mejores que las obtenidas en este trabajo, en donde el rendimiento en biomasa fue mayor que los reportados para cultivos en tierra, pero muy bajo. En este estudio, el tratamiento 1 (20% de proteína bruta) contenía el mayor porcentaje de fibra, aunque totalmente de origen vegetal, mientras que los otros mezclaban fibra de origen vegetal y animal, observándose que la aceptación era similar para los tratamientos 1 y 3. Por tanto, la dorada consumió las dietas de origen vegetal al igual que las de origen animal, sin embargo la dieta de 28% de proteína bruta (T3) presenta los mejores resultados.
Agradecimientos
Los autores expresan sus agradecimientos a Ricardo Angel e hijos S.C., a la Empresa Piscícola Pijaos y sus funcionarios por el apoyo financiero y técnico.
Summary
Dorada´s culture (Brycon sinuensis Dahl, 1955) in floating cages at different levels of protein
Dorada´s culture (Brycon sinuensis) in floating cages during 180 days was evaluated. The increment in length, increment in weight, specify growth rate, final survival, total biomass, condition factor and nutritional conversion factor were determinated. 816 fishes with mean length of 17.8 cm total length and mean weight of 78.9 g were stocked in four treatments with stocking densities of 25 fishes/m3 and three replica each one. The balanced diets (gross protein) supplied were: treatment 1: 20%, treatment 2: 32%, treatment 3: 28%, and treatment 4: 24%, with experimental design random completely. Can be affirmed that the dorada fed the diets of vegetable origin as equal way than those of animal origin, although the diet of 28% gross protein (treatment 3) shows best perfomance, without significant differences between treatments (p>0.05). In other works with this species, the daily gain in weight was low, but better than the one obtained in this work; whereas the biomass yield was greater than the biomass yield reported for ponds cultures, the results of this study were very low.
Key words: Animal fiber, biomass, gross protein, intensive culture, vegetal fiber.
Referencias
1. Arias CJA, Rodríguez CM. Experimentos con tres niveles de proteína en la ración para engorde del Yamú Bryconsiebenthalae. En: Memorias VI Jornada de Acuicultura“Segunda reunión regional del género Brycon”. UniLlanos – IALL – PLANTE 2000: 11-13. [ Links ]
2. Bagenal TB, Tesch FW. Age and growth. In: Bagenal TB, editor. Methods for assessment of fish production in fresh waters. IBP Handbook No. 3, Oxford: Blackwell Scientific Publications; 1978. p. 101-36. [ Links ]
3. Barreto L, Tapias W. Evaluación del cultivo de dorada (Brycon moorei sinuensis, Dahl 1955) en jaulas flotantes a diferentes densidades de siembra. Trabajo de pregrado. Departamento de Acuicultura, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba, Montería, 2002. 52 p. [ Links ]
4. Borghetti JR, Canzi C, Nogueira SVG. A influência da proteína no crescimento do matrinchã (Brycon orbignyanus) em tanques-rede. Revista Brasileira de Biología, 1991; 51: 695-99. [ Links ]
5. Buck DH. Effects of turbidity on fish and fishing. Trans N Amer Wild Conf 1956; 21: 249-61. [ Links ]
6. Cyrino JEP, Castagnolli N, Pereira Filho M. Digestibilidade da proteína de origem animal e vegetal pelo matrinxã (Brycon cephalus (Günther, 1869) (Euteleostei, Characiformes, Characidae). In: Anais do V Simpósio Brasileiro de Aqüicultura 1986: 49-62. [ Links ]
7. Dahl G. An ichthyological reconnaissance of the Sinu River. Revista Linneana 1955; 1: 11-19. [ Links ]
8. Ellis MM. Detection and measurement of stream pollution. US Bureau of Fish Bull 1937; 22: 367-437. [ Links ]
9. Esquivel JR, Pezzato LE, Zaniboni-Filho E, Vicentini C A. Utilização da fibra bruta na nutrição do piracanjuba (Brycon orbignyanus). Acta Scientiarum 1999; 21: 725–31. [ Links ]
10. González A, Solano JM, Otero RJ. Monocultivo y cultivo mixto de bocachico (Prochilodus reticulatus magdalenae) y dorada (Brycon moorei), con tres tratamientos alimenticios. Trabajo de investigación. CINPIC. Informe final presentado al convenio INDERENA-AID-Universidad de Córdoba, Montería, 1981. 15 p. [ Links ]
11. González A, Solano JM., Otero RJ. Policultivo de peces en aguas cálidas continentales de Colombia. Trabajo de investigación. CINPIC. Informe final presentado al convenio IFS - Universidad de Córdoba, Montería, 1982. 22 p. [ Links ]
12. González A. Policultivo del bocachico (Prochilodus reticulatus), la dorada (Brycon moorei) y la mojarra Amarilla (Petenia kraussii) en aguas calidas de Colombia. In: Verreth JAJ, Carrillo M, Zanuy S, Huisman EA, editores. Investigación Acuícola en América Latina. Wageningen: Centre for Agricultural Publishing and Documentation; 1987. p. 158-64. [ Links ]
13. González A, Solano JM, Otero RJ. Estudios comparativos de monocultivo mixto de dorada (Brycon moorei sinuensis) y cachama (Colossoma macropomum) a altas densidades de siembra y con diferentes niveles de alimentación. Trabajo de investigación. CINPIC, Universidad de Córdoba, Montería, 1987. [ Links ]
14. Goulding M. The fishes and the forest: explorations in Amazonian natural history. 1st edi. Berkeley: University of California Press; 1980, 280p [ Links ]
15. Laboratorio de Investigación Biológico Pesquera-LIBP. Base de datos biológico pesqueros en la cuenca del Río Sinú. LIBP. Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba, Lorica, 2004. [ Links ]
16. Lagler KF, Bardach JE, Miller RR, et al. Ictiología. 1ra edi. México DF: AGT; 1984. [ Links ]
17. Lima FCT, Castro RMC. Brycon vermelha, a new species of characid fish from the Rio Mucuri, a coastal river of eastern Brazil (Ostariophysi: Characiformes). Ichthyol Explor Freshwaters 2000; 11: 155-62. [ Links ]
18. Lima FCT. Subfamily Briconinae. In: Reis RE, Kullander SO, Ferraris CJ Jr., editors. Checklist of the freshwater fishes of South and Central America. 1st ed. Porto Alegre: Editora da Pontifícia Universidade Católica do Rio Grande do Sul –EDIPUCRS, 2003. p. 174-81. [ Links ]
19. Meurer S. Digestibilidade aparente da matéria seca, proteína e energia brutas de alguns ingredientes para juvenis de piracanjuba, Brycon orbignyanus. Dissertação de Mestrado, Departamento de Aquicultura, Centro de Ciências Agràrias, Universidade Federal de Santa Catarina, Florianópolis, 1999. 91 p. [ Links ]
20. Mount DI. Chronic effect of low pH on fathead minnow survival, growth and reproduction. Water Res 1973; 7: 987-93. [ Links ]
21. Olaya-Nieto CW, Atencio-García VJ. Manual de biología pesquera para piscicultura. Documento de trabajo. Laboratorio de Investigación Biológico Pesquera-LIBP, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia. Universidad de Córdoba, Montería, 2005. 100 p. [ Links ]
22. Olaya-Nieto CW, Tordecilla-Petro G, Segura-Guevara FF, et al. Relación longitud-peso de la dorada (Brycon sinuensis Dahl, 1955) en el Río Sinú, Colombia. Documento de trabajo. Laboratorio de Investigación Biológico Pesquera-LIBP, Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia. Universidad de Córdoba, Montería, 2005. 16 p. [ Links ]
23. Peña G. Evaluación del cultivo de Dorada (Brycon moorei sinuensis, Dahl, 1955) a diferentes densidades de siembra. Trabajo de pregrado, Departamento de Zootecnia, Facultad de Ciencias Agropecuarias, Corporación Universitaria de Ciencias Aplicadas y Ambientales – UDCA, Bogotá, 1999. 90 p. [ Links ]
24. Pereira Filho M, Castagnolli N, Graef EW, et al. Protein and crude fiber level in diets for young matrinchã (Brycon cephalus), an Amazonian fish. Aquaculture 1994; 124: 66. [ Links ]
25. Ricker WE. Computation and interpretation of biological statistics of fish population. J Fish Res Board Can 1975;191: 1-382. [ Links ]
26. Roldán G. Manual de limnología. Medellín: Editorial Universidad de Antioquia; 1989. [ Links ]
27. Rowland SJ. Site selection, design and operation of aquaculture farms. In: Owen P, Bowden J, editors. Freshwater Aquaculture in Australia. 1st ed. Brisbane: Rural Press Queensland; 1986. p. 11-22. [ Links ]
28. Sá MFP. Efeito da abundação orgânica sobre o crescimento de Cyprinus carpio, Prochilodus cearensis e Colossoma macropomum em experimento de policultivo. Dissertação de Mestrado. Departamento de Ciências Biológicas, UFSCar, São Carlos, 1989. 62 p. [ Links ]
29. Sá MFP, Barbieri G, Verani JR. Análise do comportamento de Cyprinus carpio, Prochilodus cearensis e Colossoma macropomum em experimento de policultivo, embasado nos factores de condição. Boletim do Instituto de Pesca São Paulo 2000; 26 (2): 181-187. [ Links ]
30. Sabino J, Sazima I. Association between fruit-eating fish and foraging monkeys in western Brazil. Ichthyol Explor Freshwaters 1999; 10: 309-312. [ Links ]
31. Saint-Paul U, Werder U. Aspectos generales sobre la piscicultura en Amazonas y resultados preliminares de experimentos de alimentación de Brycon melanopterum con raciones peletizadas con diferentes composiciones. Primer Simposio de la Asociación Latinoamericana de Acuicultura 1978, 22p. [ Links ]
32. Saint-Paul U, Werder U. The potential of some Amazonian fishes for warm water aquaculture. In: Tiews K, editor. Proc World Symp on Aquaculture in Heated Effluents and Recirculation Systems 1981. Vol. II. p. 275-287. [ Links ]
33. Salinas JC, Arias JA. Sistemas de producción, alimentación y nutrición del Yamú Brycon siebenthalae, la experiencia del Instituto de Acuicultura de los Llanos. Monografía, Instituto de Acuicultura de los LLanos-IALL, Universidad de los Llanos, sf. 8 p. [ Links ]
34. Santos EP Dos. Dinámica de populacões aplicada à pesca e piscicultura. Primeira edição. São Paulo: HUCITEC/EDUSP; 1978. [ Links ]
35. Schmittou HR. Cultivo de peces a altas densidades en jaulas de bajo volumen. USA: Asociación Americana de Soya-ASA; 1994. [ Links ]
36. Schwedler TE, Tucker CS, Beleau MH. Non-infectious diseases. In: Tucker CS, editor. Channel Catfish Culture. Amsterdam: Elsevier Sci Publ Co; 1985. p-.497-541. [ Links ]
37. Solano JM, Giraldo M, Negret E, Quirós H, González A. Investigación bio-ecológica de la Dorada (Brycon moorei sinuensis Dahl, 1955) su comportamiento y desarrollo en confinamiento. Trabajo de investigación. CINPIC, Universidad de Córdoba. Montería, 1978; 44 p. [ Links ]
38. Solano JM. Informe de trabajos realizados con Dorada (Brycon moorei sinuensis Dahl, 1955). En: Memorias del Simposio Sistemas de Acuicultura para Colombia. Universidad de Caldas 1983: 45-5. [ Links ]
39. Von Bertalanffy L. A quantitative theory of organic growth. Human Biol 1938; 10 (2): 181-13. [ Links ]
40. Wedler E. Introducción a la acuicultura, con énfasis en los neotrópicos. 1ra edi. Santa Marta: Editorial Litoflash; 1998. [ Links ]
41. Werder U, Saint-Paul U. Feeding trials with herbivorous and omnivorous Amazonian fishes. Acuacultura 1978; 15: 175-77. [ Links ]
42. Zaniboni-Filho E, Meurer S. Digestabilidade aparente da proteína e energia brutas de alguns ingredientes para juvenis de piracanjuba, Brycon orbignyanus. In: Anais do XI Simpósio Brasileiro de Acuicultura 2000: 1. [ Links ]