Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.20 no.4 Medellín Oct./Dec. 2007
Evaluación de los efectos tóxicos y concentración letal 50 del surfactante Cosmoflux® 411F sobre juveniles de cachama blanca (Piaractus brachypomus)¶
Assessment of toxic effects and lethal concentration 50 of surfactant Cosmoflux® 411F on juveniles of cachama blanca (Piaractus brachypomus)
Iang S Rondón-Barragán1x, MVZ; Wilson F Ramírez-Duarte1, MVZ; Pedro R Eslava-Mocha1, MV, MS.
1Grupo de Investigación en Sanidad de Organismos Acuáticos, Instituto de Acuicultura de los Llanos (IALL), Universidad de los Llanos, Km 12 Vía Apiay. Fax: (578) 6698700. AA 110. Villavicencio, Colombia.
(Recibido: 25 agosto, 2006; aceptado: 27, septiembre 2007)
Resumen
En Colombia, el surfactante Cosmoflux® 411F es usado en fumigaciones de cultivos ilícitos para mejorar la efectividad del glifosato. El uso del Cosmoflux® 411F no está soportado por estudios toxicológicos. Los objetivos del presente trabajo fueron determinar las lesiones anatomopatológicas derivadas de la exposición al Cosmoflux® 411F y establecer la concentración letal 50 (CL50) a 96 horas en cachama blanca (Piaractus brachypomus). Se utilizaron juveniles de cachama blanca (~40 g) en dos experimentos: 1) toxicidad subletal (n =126) y, 2) determinación de la CL50 (n =84). Las concentraciones del ensayo de toxicidad subletal fueron: 0 mg/l (Tratamiento 0), 0.17 mg/l (Tratamiento 1), 0.34 mg/l (Tratamiento 2), 0.68 mg/l (Tratamiento 3), 1.36 mg/l (Tratamiento 4), y 2.72 mg/l (Tratamiento 5), en sistema semiestático. Para determinar la CL50 las dosis fueron: 3000, 3450, 3900, 4350 y 4800 mg/l de Cosmoflux® 411F. La CL50 obtenida fue de 4417.99 mg/l. En los peces se evidenció leve disminución de la actividad de nado. A la necropsia se halló palidez del hígado y acumulación de material mucoso en las branquias. Por histopatología se halló: vacuolización de hepatocitos, hiperplasia de células epiteliales, de cloro y caliciformes branquiales, vacuolización de enterocitos, aumento de centros melanomacrófagos renales, gliosis, degeneración neuronal e infiltración de células granulares eosinofílicas/células mastocitos en telencéfalo. Los hallazgos concuerdan con lo reportado en peces expuestos a surfactantes, exceptuando las lesiones del sistema nervioso central que pueden tener consecuencias sobre interacciones sociales, de alimentación y reproducción de la especie; siendo necesario profundizar la investigación sobre dicho efecto. El hígado, branquias y piel constituyen órganos blanco de la acción tóxica. La CL50 hallada (4417.99 mg/l) es alta comparada con lo reportado en surfactantes no-iónicos. Se prevé un efecto sinérgico en la mezcla asperjada; sin embargo, el desconocimiento de la estructura del surfactante limita el análisis de su dinámica.
Palabras clave: anatomopatología, cachama blanca, CL50, Cosmoflux® 411F, lesiones histopatológicas, surfactantes no iónicos, toxicología ambiental
Summary
In Colombia, surfactant Cosmoflux® 411F is used for the fumigation of illicit crops in order to improve the glyphosate herbicide activity. The use of Cosmoflux® 411F is not supported by toxicological surveys. The aims of this study were to determinate the anatomopathological lesions due to the exposure to Cosmoflux® 411F and to establish lethal concentration 50 (LC50) to 96 hours in cachama blanca (Piaractus brachypomus). Juveniles of cachama blanca (~40 g) in two assays were used: 1) sublethal toxicity (n= 126) and 2) determination of LC50 (n=84). Sublethal toxicity assay concentrations were: 0 mg/l (Treatment 0) 0.17 mg/l (Treatment 1), 0.34 mg/l (Treatment 2), 0.68 mg/l (Treatment 3), 1.36 mg/l (Treatment 4), and 2.72 mg/l (Treatment 5); through semi-static system. For the determination of LC50 of Cosmoflux® 411F 3000, 3450, 3900, 4350 y 4800 mg/l concentrations were used. LC50 was 4417.99 mg/l. Animals showed slight decrease in swimming activity. At necropsy examination were found paleness in liver and whitish material accumulation in top of gill filament. Histopathologically, it was found fatty degeneration and hepatocyte vacuolization, epithelial cells, chloride cells and mucous cells hyperplasia, enterocyte vacuolization, increase in the expression of melanomacrophage centres in kidney, gliosis, neuronal degeneration and infiltration of eosinophilic granule cells/mast cells in telencephalon. With exception of central nervous system lesions, the findings are according to the reported in literature about surfactant exposure in fish. Central nervous system effects can have consequences on feeding, reproductive and social interactions, due to close telencephalon/olfactory system relationship, being necessary to deep in research to these processes. In same way, liver, gills and skin are target organs of toxic action of this xenobiotic. LC50 is high (4417.99 mg/l) compared with that reported for other nonionic surfactants. Nevertheless, the lack of information about the structure of surfactant restrict the analysis of the dynamic and implications of xenobiotic in the generation of lesions, although, a synergic effect on the mixture is foreseen.
Key words: anatomopathological lesions, cachama blanca, Cosmoflux® 411F, environmental toxicology, LC50, non-ionic surfactants.
Introducción
La política de aspersión de cultivos ilícitos en Colombia se inició en la década de 1970, debido a la gran producción nacional de marihuana. Desde entonces, las prácticas de cultivo de marihuana, coca y amapola y la distribución de coca y opio/heroína han constituido un objetivo de intervención del gobierno colombiano a través de un programa nacional de control y erradicación de cultivos ilícitos. En 1984, ante la escalada narcoterrorista en el país reforzó la lucha contra la producción de drogas, permitiendo la aspersión aérea con glifosato. Desde 1992, se inició la práctica de aspersión con glifosato bajo la presentación comercial Roundup® Ultra por aplicación aérea para el control de los cultivos de amapola y coca (14). El glifosato además es usado como madurante de caña, desecante de granos y para el control de malezas en cultivos de arroz (40, 52).
La mezcla de aspersión sobre cultivos de coca y amapola se compone de glifosato utilizado bajo la presentación comercial Roundup® Ultra constituyendo el 44% de la mezcla en proporción volumen/volumen lo que determina una concentración de 180 g de glifosato como principio activo por litro de la mezcla, además de un surfactante catiónico poliexietilamina (POEA) (72); este producto además contiene un surfactante no-iónico denominado Cosmoflux® 411F, cuyo uso se realiza únicamente en Colombia, al 1%, y el 55% restante de la mezcla está constituido por agua. La tasa de aspersión de la mezcla sobre los cultivos para el Roundup® Ultra es de 17.6 a 30.8 l/ha (14).
Hasta el 2004, se han utilizado 1’420.130 litros de Roundup Ultra (Solomon et al, 2005), mientras que en el 2005, las áreas de coca y amapola asperjadas fueron 138.775 y 1624 hectáreas, respectivamente (69).
Marc et al (34) determinaron que el glifosato, en diferentes productos comerciales conteniendo agentes surfactantes, a una concentración de 0.01 a 0.12 mM (variable dependiendo del producto comercial y por ende de los compuestos surfactantes presentes en el producto) en una microgota asperjada es suficiente para ocasionar una disregulación en la transición del ciclo celular, la cual es inferior a la concentración recomendada para aspersión de 40 mM, siendo incluso más baja a la concentración de glifosato en la aspersión de cultivos de coca y amapola realizada en Colombia que es de 234 mM. Conjuntamente con el retraso en la progresión del ciclo celular, estos mismos autores han descrito que los herbicidas a base de glifosato inhiben la síntesis del ADN durante la fase S (33). En Colombia, se ha descrito citotoxicidad y genotoxicidad en células humanas expuestas in vitro al glifosato (37), lo cual concuerda con resultados de estudios hechos en el Ecuador (43).
Aun cuando se han adelantado estudios en Colombia tendientes a dilucidar el efecto de la aspersión con glifosato y sus mezclas, aquellos que favorecen la inocuidad (61) de este herbicida están basados en el principio activo glifosato y no en el producto comercial de aspersión el cual contiene surfactantes que han demostrado ser mas tóxicos que el glifosato solo (16) y que en mezcla muestran sinergismo (14). Con respecto al Cosmoflux 411F, de acuerdo con el concepto toxicológico LP-0593-93 del Ministerio de Salud de Colombia es un producto de categoría toxicológica IV (ligeramente tóxico) y posee licencia de venta del Instituto Colombiano Agropecuario - ICA (Nº 054-2186).
La ausencia de trabajos acerca de las características toxicológicas del Cosmoflux 411F hace notable la carencia de respaldo argumentado en bioensayos (in vitro o in vivo) que permitan determinar la viabilidad ecológica, tanto a corto como largo plazo de la adición del Cosmoflux 411F a la mezcla de aspersión, cuyos componentes presentan características toxicológicas y riesgosas para el ambiente. Los posibles mecanismos por los cuales los surfactantes pueden influir en la toxicidad del glifosato incluyen la reducción de la tensión superficial así como la alteración de la permeabilidad de membranas biológicas y barreras de difusión o procesos de transporte de membrana, incluyendo la permeabilidad al glifosato e interactuando directamente con el glifosato alterando, de este modo, la disposición del herbicida (12).
Este trabajo tuvo por objeto determinar las lesiones macro y microscópicas en branquias, piel, cerebro, intestino, hígado y riñones del Cosmoflux® 411F en cachama blanca, (Piaractus brachypomus), así como la determinación de la concentración letal 50 (CL50) a 96 horas.
Materiales y método
Comité de ética
El estudio contó con la aprobación del Comité de Bioéctica de la Universidad de los Llanos para los procedimientos de experimentación animal (Acta 001 del Consejo Institucional de Investigaciones, del 19 de enero de 2005).
El trabajo se realizó en el Laboratorio de Bioensayos del Instituto de Acuicultura de los Llanos (IALL), Universidad de los Llanos, Villavicencio (Meta) Km 4 Vía Puerto López. Vereda Barcelona. A una altitud de 420 msnm y temperatura promedio de 25 ºC.
Animales experimentales
En el estudio se utilizaron juveniles de cachama blanca (Piaractus brachypomus), obtenidos de un mismo desove de la estación piscícola del IALL, clínicamente sanos y criados en estanques en tierra; con un peso de ~42 g, alojados en acuarios de vidrio, con un volumen de 48 l de agua, acondicionados con aireación constante, sin filtro. Los animales experimentales fueron alimentados dos veces al día (7 a.m. y 4 p.m.) con concentrado comercial "Mojarra" al 30% de proteína bruta con una ración correspondiente al 2% del peso. Los animales fueron aclimatados por un periodo de 15 d y fueron medidos los parámetros de calidad de agua: pH (Pinpoint pH Monitor, American Marine Inc. USA), temperatura y oxígeno disuelto (Hach Portable LDO HQ10 Dissolved Oxygen Meter, USA) a la misma hora cada día (07:00 am).
El experimento de toxicidad subletal se basó en un sistema semiestático con recambio diario del 50% del volumen de agua con mantenimiento de la concentración mediante la adición de la mitad de la dosis. Para la determinación de la CL50 se empleó un sistema estático.
Sustancia experimental
El Cosmoflux 411F es elaborado por la empresa colombiana Cosmoagro, del cual no se describe la composición exacta, pero se sabe contiene como ingredientes activos una mezcla de sustancias tensoactivas estereoespecíficas no-iónicas basada en alcoholes lineales etoxilados propoxilados con pequeñas cantidades de un compuesto aril etoxilado y se le adiciona aceite isoparafínico.
Diseño experimental
Toxicidad subletal. En el estudio se evaluaron concentraciones de Cosmoflux 411F de: 0 (Tratamiento 0), 0.17 (Tratamiento 1), 0.34 (Tratamiento 2), 0.68 (Tratamiento 3), 1.36 (Tratamiento 4), y 2.72 mg/l (Tratamiento 5). Los animales fueron sometidos a dichas concentraciones por un periodo de 96 h y fueron realizadas tres réplicas (n total = 126; n tratamiento = 21). Las concentraciones subletales se tomaron a partir de la concentración letal 50 y sus pruebas piloto realizadas en el Laboratorio de Bioensayos del IALL.
CL50 (Concentración letal 50). Las concentraciones del experimento de determinación de la CL50 del Cosmoflux 411F a 96 h fue establecida con base en una prueba piloto que arrojó un valor de CL50 de 4583 mg/l. Dicho valor fue tomado como base para la determinación de las concentraciones del surfactante a usar durante el bioensayo. Las concentraciones utilizadas fueron las siguientes (en orden ascendente del grupo 1 al 5): 0 (Tratamiento 0), 3000 (Tratamiento 1), 3450 (Tratamiento 2), 3900 (Tratamiento 3), 4350 (Tratamiento 4) y 4800 mg/l (Tratamiento 5). Se realizaron dos replicas, incluyendo un grupo control sin exposición a la sustancias experimental y se expusieron peces diferentes a los usados para el ensayo de toxicidad subletal, exponiendo 7 peces por acuario (n total = 84; n tratamiento = 14).
Determinación de CL50. El valor de CL50 se determinó mediante el análisis de la mortalidad a las 96 horas por medio del programa Trimmed Spearman – Karber- TSK versión 1.0 (18).
Previo al periodo de aclimatación, para todos los experimentos, los peces fueron sometidos a un baño con cloruro de sodio (NaCl) industrial (no yodado) al 1 %/60 min con el objetivo de eliminar ectoparásitos de acuerdo con lo descrito por Francis-Floyd (17).
Muestreo de los peces
Los animales fueron tranquilizados mediante inmersión en agua fría a 5 °C/30 seg, para la medición de la longitud estándar y pesaje con una balanza digital Scout Pro 400 x 0.1 g. Al cabo de las 96 h de la fase experimental se registró la mortalidad de cada tratamiento, y los peces sobrevivientes fueron tranquilizados con agua fría como se describió previamente. Dos peces sobrevivientes de cada acuario (seleccionados al azar) fueron insensibilizados mediante sección de la médula espinal, dorsal a los opérculos. Además de estos dos ejemplares, a todos los peces muertos durante la fase experimental se les realizó la necropsia siguiendo el protocolo descrito por Reimschuessel et al, (51). Para histopatología se tomaron: estómago, intestino, hígado, riñón caudal, piel y cerebro, y para branquias se tomó el segundo arco branquial izquierdo. Las muestras se fijaron en formalina tamponada al 3.7 % para el procesamiento histológico, embebidas en parafina, realizando cortes de 4–5 μm de grosor y tinción con hematoxilina-eosina tradicional. La evaluación histopatológica se realizó en un microscopio óptico Nikon Eclipse 80i (Nikon Corporation, Japan) y se fotografiaron utilizando una cámara DS-5M (DS Camera Head + DS Camera Control Unit DS-L1, Nikon Corporation, Japan).
De la misma forma, los patrones de nado fueron evaluados en los animales experimentales, mediante observación directa.
Análisis estadístico
Los resultados de mortalidad se analizaron tomando cada acuario como unidad experimental. Las lesiones halladas al examen de necropsia fueron descritas y expresadas en porcentaje de animales afectados y las alteraciones histopatológicas de acuerdo con el grado de severidad. Los parámetros de calidad del agua se analizaron mediante ANOVA, utilizando SPSS® para Windows versión 12 y son expresados como promedio ± desviación estándar.
Resultados
Ensayo de toxicidad subletal
Las variables de temperatura (24.5 ± 1.2 °C), oxígeno disuelto (7.2 ± 0.6 mg/l) y pH (7.13 ± 0.17) del agua no mostraron variaciones significativas entre tratamientos durante el periodo de aclimatación ni durante la fase experimental (p<0.05).
Comportamiento
En todos los tratamientos de exposición al Cosmoflux 411F se evidenciaron leves alteraciones en el patrón de nado durante las 96 h del experimento y fue posible observar movimiento aleatorio en los tres tercios del acuario, algunos se describen a continuación: a las 2 h del inicio de la fase experimental, dos individuos del tratamiento 2 (0.34 mg/l) manifestaron episodios de nado explosivo. A las 4 horas los individuos del tratamiento 1 (0.17 mg/l) se mostraron pasivos comparados con los demás tratamientos, incluyendo el grupo control. A las 8 h los animales del tratamiento 3 (0.68 mg/l), tratamiento 4 (1.36 mg/l) y tratamiento 5 (2.72 mg/l) evidenciaron quietud en el tercio inferior del acuario; por otra parte, en el tratamiento 4 tres individuos mostraron quietud en el tercio medio. En los tratamientos 3 y 4, aunque presentaron movimientos aleatorios, la velocidad del movimiento se redujo considerablemente. En el tratamiento 4 a la 8ª hora, los animales permanecieron en el tercio inferior de manera estática, sin embargo, respondieron con prontitud al estímulo de amenaza visual. A las 24 h los animales del tratamiento 5 manifestaron hiperactividad comparados con los demás tratamientos.
Hallazgos de necropsia
Tanto en el grupo control como en los tratamientos en la exposición subletal no fueron halladas alteraciones macroscópicas relevantes.
Histopatología
Los hallazgos histopatológicos aumentaron en severidad con el aumento en la concentración del tóxico:
Branquia: en el tratamiento 0 fue posible hallar leve hiperplasia de células de moco, mientras en los tratamientos 2-4 se observó posible observar necrosis epitelial interlamelar basal y denudación lamelar severa. En todos los tratamientos se evidenciaron algunas formaciones quísticas por myxosporidios en las lamelas.

Hígado: el grupo control no evidenció cambios morfológicos (véase Figura 1). En los tratamientos 1-5 se encontró vacuolización lipídica de los hepatocitos, cariorrexis evidente de algunos hepatocitos acompañada de infiltración de células mononucleares (véase Figura 2). En el tratamiento 1 se halló anisocitosis de los hepatocitos, mientras en el tratamiento 2 se observó picnosis de los hepatocitos. Por otra parte el tratamiento 4 mostró congestión severa y picnosis de algunos hepatocitos.

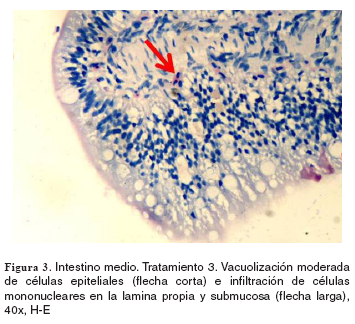
Estómago e intestino: el grupo control no evidenció cambios morfológicos. En los tratamientos 1-5, tanto en el estómago como en el intestino se hallaron hiperplasia moderada de células caliciformes e infiltrado de linfocitos y de células mononucleares en la lámina propia. Por otra parte, en los tratamientos 2-5 en el intestino se observó hiperplasia moderada de células caliciformes acompañada de vacuolización moderada de enterocitos, de carácter generalizado (véase Figura 3).
Riñón: el grupo control no evidenció cambios morfológicos. En los tratamientos 1-5 se observaron centros melanomacrófagos (CMMs) aumentados de distribución multifocal, picnosis tubular así como algunos quistes por myxosporidios y pérdida de la densidad celular. En el tratamiento 4, por otra parte, se observó degeneración leve de células epiteliales tubulares y desprendimiento de las mismas.
Piel: el grupo control no evidenció cambios morfológicos. En los tratamientos 1-5, se evidenció infiltración de células mononucleares en la dermis, activación de células de alarma, hiperplasia de células de moco y edema en la dermis observándose separadas las fibras de colágeno y presencia de pigmentos en la dermis.
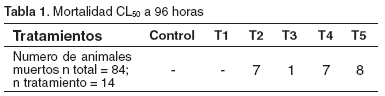
Concentración Letal 50 (CL50 )
La CL50 fue de 4417.99 mg/l. La mortalidad de los diferentes tratamientos se registra en la tabla 1.
Hallazgos de necropsia
En el grupo control no fueron hallados signos relevantes a excepción de una leve palidez en uno de los animales. En el tratamiento 1 se evidenció una coloración clara de la piel. En el hígado se observó una coloración roja intensa en algunos animales (2/14) mientras en otros animales (4/14) se halló un hígado con coloraciones blanquecinas leves focales circulares. Además, en algunos individuos (2/14) se encontró el riñón pálido. El tratamiento 2 mostró dos animales con palidez severa del hígado (2/14).
En el tratamiento 3 fue posible evidenciar en branquias, acumulación de material blanquecino en el tercio distal de los filamentos (14/14) (véase Figura 4). El hígado, al igual que en el tratamiento I, evidenció coloraciones blanquecinas leves más definidas y de mayor extensión acompañada de palidez leve (7/14). En este tratamiento se observó contenido gástrico blanquecino (14/14) al igual que en el tratamiento 5 (14/14). En el tratamiento 4 se halló palidez en el hígado así como presencia de coloraciones blanquecinas difusas moderadas (2/14) al igual que en el tratamiento 5 (14/14). Los animales también presentaban residuos blanquecinos en el tercio distal de los filamentos branquiales (12/14). En el tratamiento 5 se observaron residuos blanquecinos en el extremo distal de los filamentos branquiales, así como cambios en la coloración de la porción distal de los filamentos branquiales compatibles con hemorragias (14/14).

Histopatología para la CL50
La severidad de las lesiones histopatológicas aumentó con el incremento en la concentración del Cosmoflux 411F.
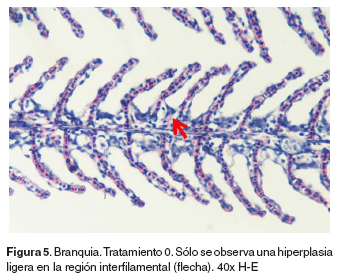
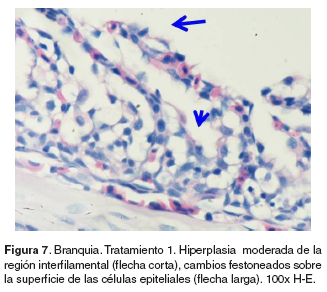
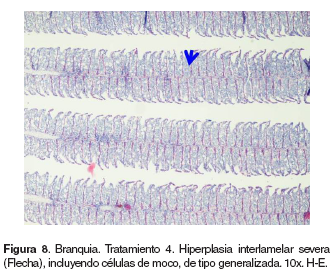
Branquias: en el tratamiento 0, las branquias presentaron hiperplasia leve filamental distal e interfilamental (véase Figura 5). En los tratamientos 1-5, en la región faríngea, se evidenció un aumento del grosor de la mucosa, así como infiltración leve de células mononucleares acompañada de infiltración en la región interfilamental (véase Figura 6), en algunos ejemplares se hallaron quistes de myxosporidios de severidad variable ocupando una a varias lamelas, acompañados de focos de hiperplasia leve. También se evidenciaron cambios festoneados en la superficie celular, congestión, edemas subepiteliales leves, infiltraciones interfilamentales proximales, hiperplasia interfilamental y activación de células de cloro (véase Figura 7). En el tratamiento 3, la branquia mostró congestión y hemorragias lamelares multifocales, rupturas de células pilar acompañado de pequeños aneurismas en las lamelas así como fusión lamelar con reacción inflamatoria. En los tratamientos 4 y 5 se evidenció hiperplasia de células de moco y fusión lamelar severa (véanse Figuras 8, 9 y 10).
Hígado: el grupo control no mostró lesiones en el hígado. En los tratamientos 1-5 se observó vacuolización lipídica de hepatocitos acompañada de congestión leve. De la misma manera, se observaron algunos focos quísticos por myxosporidios en algunos ejemplares. En los tratamientos 3-4 se observó anisocitosis de hepatocitos, apoptosis y cariorrexis. En los tratamientos 4 y 5 se halló degeneración parenquimatosa de los hepatocitos así como necrosis de coagulación.


Estómago e intestino: el grupo control no evidenció lesiones. En los tratamientos 3-5, en el estómago se halló congestión en los vasos de la lámina propia y submucosa. Adicionalmente, se halló congestión en serosas de los órganos digestivos, cambios degenerativos en glándulas gástricas e hiperplasia de células de moco. En los tratamientos 1-3, el intestino medio mostró vacuolizaciones leves no generalizadas de los enterocitos en la región apical. También fue posible hallar infiltraciones de células mononucleares en la lámina propia. En los tratamientos 4 y 5 se halló infiltración de células mononucleares, aumento de la producción de moco, necrosis de enterocitos y vacuolización leve de la región apical de algunos enterocitos.
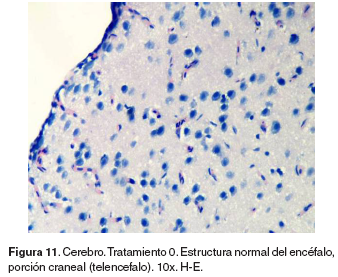
Cerebro: el grupo control no evidencio lesiones (véase Figura 11). En la región anterior del encéfalo correspondiente al telencéfalo, de los tratamientos 1-5 se hallaron infiltración perivascular de CGE/CM y células de la glía en la corteza, congestión en meninges, plejos coroidales y vasos sanguíneos de la región cortical y cuerpos de neuronas apoptóticas (véase Figura 12).
Riñón: el grupo control no evidenció lesiones o cambios compatibles con patologías. En los tratamientos 1-2 se observó un aumento en la presencia de CMMs (~15-20 %), de gran tamaño y localizados principalmente en los túbulos y algunos granulomas pequeños (lesión crónica nodular) los cuales corresponden a respuestas a esporas de myxosporidios. En el Tratamiento III se hallaron CMMs grandes activados de manera multifocal asociados a lesiones tubulares, así como asociados a esporas de myxosporidios, necrosis tubular leve y congestión vascular cortical. En el tratamiento 4 se presentó menor densidad de CMMs aun cuando en mayor extensión que en los grupos anteriores, áreas de necrosis de coagulación a nivel tubular con infiltración de células mononucleares y de CGE/CM.


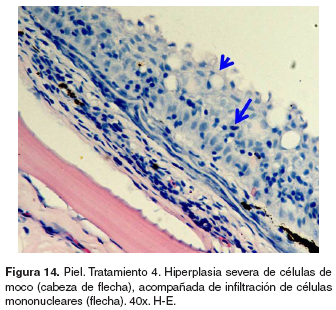
Piel: el grupo control presentó normalidad en la piel (véase Figura 13). En los tratamientos 1-5 se observó ligera hiperplasia de células de moco e infiltración de células mononucleares en el estrato basal de la epidermis. En los tratamientos 3-5 se halló engrosamiento de la epidermis, hiperplasia de células pavimentosas y de moco, infiltración moderada de células mononucleares (véase Figura 14) y espongiosis leve.

Discusión
La evaluación de los efectos de los surfactantes sobre los organismos vivos, y en especial en organismos acuáticos, ha sido de gran interés, dada la alta tasa de descarga desde diversas fuentes, así como por el desconocimiento de los efectos reales de los mismos, debido a que su modo de acción es amplio (gracias a su carácter anfifílico y a sus propiedades de solubilización de membranas, disrupción endocrina, entre otras) (12, 31). Se debe tener en cuenta que gran parte, sino la totalidad, de los trabajos de investigación realizados acerca del efecto de los surfactantes sobre cuerpos de agua están descritos en países que poseen regulaciones estrictas acerca de la descarga de sustancias (i.e. detergentes, compuestos de amonio cuaternario, etc) a cuerpos de agua; por lo cual los niveles ambientales esperados son mucho mas bajos. De esta manera, los estudios encaminados a evaluar dichos efectos utilizan concentraciones mas bajas y la evaluación es de carácter subletal y crónica.
En Colombia, la fumigación aérea se soporta en estudios (61) en los cuales no es tomada en cuenta la inclusión de un surfactante (Cosmoflux 411F®) en la mezcla de aspersión. Además, se desconoce la estructura molecular del compuesto, bajo lo cual se podría evaluar parcialmente la toxicidad, teniendo en cuenta relaciones estructura/actividad descritas para otros compuestos (38, 74).
Algunos autores argumentan que las concentraciones nocivas para surfactantes no-iónicos, con algunas excepciones, exceden 0.5 mg/l (28). Además, se ha demostrado que los peces perciben surfactantes a bajas concentraciones, evitando aguas contaminadas incluso a 0.001 mg/l (62).
En el presente trabajo se observaron alteraciones en el comportamiento y la actividad de nado a la 4ª hora del inicio del ensayo, sin que estas fueran conservadas a lo largo del experimento. Dichas alteraciones, se pueden explicar por la aclimatación al tóxico o como una consecuencia del gasto energético que involucra el metabolismo del mismo. No obstante, Abel y Skidmore (1), en peces expuestos a laurilsulfato sódico, evidenciaron un incremento inmediato en la actividad de nado y episodios de tos. Hofer et al, (20) demostraron disminución en la capacidad de nado de alevinos de trucha arco iris expuestos a surfactantes. Así mismo, algunos autores han descrito una secuencia de cambios de comportamiento asociados con la intoxicación: excitación, nado errático con incremento en la frecuencia respiratoria, boqueo, convulsión y muerte (25). Dichas alteraciones en el comportamiento son relevantes debido a la importancia en la conservación de la habilidad de escape que determina gran parte de la supervivencia de las especies en el medio natural.
Histopatología
Los hallazgos histopatológicos tanto para el ensayo de toxicidad subletal como para la determinación de CL50, son similares y de mayor severidad a mayor concentración del Cosmoflux 411F, por lo cual el análisis se plantea de forma global, discerniendo acerca de las diferencias a las que haya lugar. En las branquias las lesiones interlamelares, tanto proliferativas como inflamatorias, han sido descritas ante la exposición a otros surfactantes (1, 2, 60). El incremento en la celularidad ha sido sugerido como una respuesta adaptativa que reduce la difusión del toxico hacia la sangre (41, 67). No obstante, dicha celularidad implica un aumento en la distancia de difusión del oxigeno al torrente sanguíneo, permitiendo el desarrollo de hipoxia y estrés respiratorio (10, 32). La concentración crítica a la cual ocurre la transición de respiración independiente a dependiente es de 2 mg O2/l (a 30 °C) (56), dichos niveles están por debajo de los registrados para este ensayo. Por lo tanto, la hipoxia desarrollada en este experimento puede deberse a una disminución en la difusión de O2 debido a las lesiones ocasionadas de forma directa por el surfactante y a los cambios proliferativos del epitelio branquial. Estas respuestas proliferativas generan deformación de las lamelas, fusión lamelar y pseudoepitelización, lo cual ha sido descrito en exposición a contaminantes (3, 5). Esta respuesta adaptativa aumenta el espacio de difusión de iones, oxigeno y del tóxico hacia la sangre.
El levantamiento de las células epiteliales branquiales es similar a lo descrito en trabajos anteriores en los cuales las células en sus estadios finales de lesión comenzaron a levantarse (2, 5, 60). Dicho proceso incrementa la barrera de difusión agua-sangre, limitando igualmente la difusión del tóxico hacia la sangre (60). El festoneamiento de las células epiteliales ha sido descrito por otros autores tras exposición a contaminantes (39) y puede ser generado por la capacidad de los surfactantes no-iónicos de solubilizar proteínas presentes en las membranas celulares (11).
En este experimento se halló hiperplasia leve de células compatibles con células de cloro, hiperplasia leve de células de moco así como infiltración de CGE/CM, lo cual ha sido descrito de manera similar ante exposición a otros contaminantes (3, 5, 25). Las células de cloro proveen protección frente al estrés osmorregularorio branquial (6, 44).
La proliferación de células de moco constituye una respuesta adaptativa ante agentes irritantes (3, 10, 55) y es desencadenada por niveles elevados de cortisol (26). El estrato mucoso de las branquias posee un papel de ionorregulación, sin embargo su incremento limita la difusión de iones, debido al aumento de la barrera de difusión iónica (19, 55, 59).
Las CGE/CM han sido descritas en estrecha asociación a las paredes de los capilares sanguíneos (47) y muestran marcadas semejanzas con las células mastocitos de mamíferos (46). La proliferación de células mononucleares en los espacios interlamelares ha sido descrita como reacción de alarma frente a la exposición a surfactantes y otros contaminantes (1-3). En este trabajo, de la misma forma, no fueron evidenciables CGE/CM activas en el filamento branquial descritas por otros autores tras la exposición a surfactantes (1, 2).
La presencia de aneurismas y hemorragias puede ser explicada porque gradualmente las células pilar fueron distendidas y colapsaron, dicho colapso progresa desde la región proximal hacia la distal de la lamela, este fenómeno ha sido descrito por otros autores (1). En dicho trabajo las células pilares ocluyeron los espacios vasculares y se presentó la formación de hematomas lo cual fue evidente en este trabajo. Los eritrocitos aunque enlagunados dentro del sistema pilar estuvieron aparentemente confinados dentro del epitelio lamelar (1). Por otra parte, han sido descritos cambios en los mecanismos de control adrenérgicos y vasodilatación en branquias de salmón a concentraciones de alkilbenceno sulfonato lineal de 0.6 mg/l o mayores (28).
La lisis de células pilar así como la necrosis de células epiteliales puede deberse a una acción toxica del Cosmoflux 411F por alteración de la membrana generando una pérdida de la función celular (hipoxia asfixia o falla osmorregulatoria) (32). Los surfactantes son capaces de alterar el potencial transepitelial branquial en ausencia de gradientes de difusión, lo que sugiere un efecto inhibitorio directo del transporte iónico electrogénico (63). Además, los surfactantes no-iónicos así como los aniónicos forman canales de conducción catiónica en bicapas lipídicas (63) y generan desequilibrios iónicos (por flujo de electrolitos a través de los mismos) afectando el estatus ionorregulatorio del pez.
Las vacuolizaciones lipídicas en el hígado evidenciadas en el presente trabajo, han sido descritas en peces expuestos a otros contaminantes (39, 42, 65) y representan una estrategia para reducir la disponibilidad de xenobióticos lipofílicos. Algunos autores explican dicha vacuolización debido a la presencia de retículo endoplásmico rugoso dilatado así como a cuerpos de mielina en el citoplasma (39, 42). Además son compatibles con la evidencia macroscópica de coloraciones blanquecinas halladas.
En la piel, se halló en los tratamientos 2, 3 y 4, hiperplasia leve de células de moco y de alarma así como CGE/CM infiltradas; dicha respuesta representa una reacción inflamatoria ante un agente irritante; el edema generado tras los cambios vasculares inflamatorios se evidenció como espongiosis. Esta proliferación de CGE/CM ha sido evidenciada en truchas arco iris expuestas a agua ácida, en las cuales, además, se acumulan macrófagos y linfocitos dentro de la epidermis (21) y en peces expuestos a otros contaminantes (5, 8). Además el moco que cubre la superficie epidermal es la primera línea de defensa contra patógenos invasores (15). Los surfactantes son capaces de reducir el componente lipídico en las células de moco, células epiteliales y células de alarma. Sin embargo, la secreción de moco generada por el surfactante no es suficiente para contrarrestar, como barrera, el efecto del mismo (53).
En el intestino la vacuolización de los enterocitos fue mayor a medida que aumentaba la concentración de Cosmoflux 411F. Esta vacuolización podría corresponder a surfactante transportado (pinocitosis) por los enterocitos, gracias a la lipofilicidad del mismo que permite atravesar las membranas celulares. El estrés generado por la exposición a xenobióticos desencadena degeneración de la mucosa intestinal y perturbación de la función de barrera y mecanismos de absorción (36, 57)
La presencia de CMM en el estroma renal se vio incrementada de manera directa con el aumento en la concentración del surfactante. La formación leve de vacuolas o gotas proteicas (degeneración hialina) en células epiteliales tubulares renales ha sido descrita por otros autores (24, 49, 50), y podría corresponder a la absorción de proteínas del filtrado glomerular (23) o a sobrecarga en los lisosomas tubulares proximales (48).
En el presente trabajo, la formación de estructuras nodulares y la expresión de CMMs en el riñón se vio incrementada con el aumento en la concentración del Cosmoflux 411F, evidenciando una relación directa entre el nivel de respuesta de depuración requerido y la presentación de áreas de reacción a esporas de myxosporidios las cuales son halladas de manera frecuente en ejemplares de cachama blanca clínicamente sanos, de forma aislada, sin que se presenten lesiones severas significativas a nivel renal (22). Los CMMs probablemente se han acentuado en los grupos experimentales debido a una subrregulación del sistema inmune lo cual puede generar una disminución en los factores solubles así como en la capacidad de respuesta celular. Estos procesos están acorde con trabajos de otros autores (54); gracias al efecto del estrés y la liberación de corticoesteroides (4, 54, 71) por activación del eje hipotálamo-hipofisiario inter-renal (54).
En el sistema nervioso central fue posible hallar lesiones en el telencéfalo, en estrecha relación con el bulbo olfatorio, tales como degeneración neuronal, cambios apoptóticos neuronales, gliosis e infiltración de CGE/CM (satelitosis) tanto en las meninges como en la superficie cerebral. Es de destacar que a nuestro conocimiento, este es el primer reporte sobre este tipo de hallazgos en exposición a surfactantes. El daño en el epitelio olfatorio así como en el encéfalo anterior, puede ocasionar alteraciones reproductivas y de comportamiento grupal. La respuesta primaria estaría generada a partir de las células de glía y una posterior infiltración de CGE/CM gracias a la quimiotaxis generada, bien desde las células neuronales en proceso de apoptosis y necrosis así como de las células de glía. La interacción de CGE/CM con neuronas puede ocurrir a través de fenómenos de contacto celular (transgranulación) como ha sido descrito en el sistema nervioso central (73). El cerebro del pez se distingue de los mamíferos por su habilidad para reemplazar neuronas perdidas (76). La apoptosis evidenciada en este trabajo puede ser resultado de un daño directo del surfactante sobre las células nerviosas, por vía hemática o por las narinas debido a la focalización de la lesión en el área anterior del cerebro (telencéfalo) y su relación con el sistema olfatorio; y a la falta de una respuesta generalizada, la cual estaría presente si el fenómeno se presentara por vía hemática. Además, dada la remoción de detritos generada por el sistema fagocítico mononuclear, se puede estar generando, además de un efecto directo sobre los somas neuronales, un imbalance en la proporción destrucción/remoción:generación de neuronas, como han descrito otros autores (27).
Las CGE/CM presentes en el encéfalo se caracterizaron por la presencia de gotas hialinas y gránulos de tamaño variable en relación con las observadas en otros órganos (lamina propia intestinal y branquias), este fenómeno puede deberse a la inmadurez de CGE/CM que eventualmente son incapaces de degranularse (35); sin embargo, algunos autores describen que la maduración de dichas células ocurre en el proceso de migración por lo cual son efectivas en el sitio de acción, gracias a cambios en el ambiente (70) y que los gránulos son capaces de regenerarse (35). Por otra parte, Pfeifer (45) sugirió que la apariencia de CGE/CM en proceso de degranulación puede corresponder a cuerpos multivesiculares. Las células mastocitos (CGE/CM en peces) están en estrecha asociación con estructuras mielinadas (47) y que las interacciones entre neuronas y células mastocitos se deben a estrés y en algunos casos a reacciones de hipersensibilidad (76). Lewis (28) demostró que la exposición a surfactantes posee efectos sobre la fisiología de la olfación, y que dichos efectos ocurrieron a concentraciones que excedieron los 0.1 mg/l en la mayoría de los casos (28, 64).

Modificado de Madsen et al (31).
Concentración letal 50
El valor de CL50 (4417.99 mg/l) se encuentra por encima del rango descrito para surfactantes no-iónicos, incluyendo alcoholes etoxilados (AE) como se muestra en la tabla 2. Debido al desconocimiento de la estructura molecular del Cosmoflux 411F, los análisis acerca de la variación de la toxicidad con respecto a otros surfactantes no-iónicos, basados en relaciones estructura/actividad, son difíciles de conjeturar. Dado el valor de CL50 tan alto se podría considerar cierta resistencia por parte de la cachama blanca ante este xenobiótico. Respecto a la baja mortalidad en el tratamiento 3, no fue posible hallar una explicación, a parte de una variación individual.
En conclusión, la piel, el hígado, las branquias, el cerebro y en menor proporción el riñón y el tracto digestivo, constituyen órganos afectados morfológicamente por el Cosmoflux 411F. Los cambios en las branquias corresponden en su mayoría a fenómenos adaptativos, en los cuales a través de respuestas proliferativas y, en menor proporción, inflamatorias, se limita la difusión del tóxico a la sangre, por incremento de la barrera de difusión agua/sangre. Sin embargo, algunos hallazgos tales como el festoneamiento de células epiteliales branquiales, aneurismas, entre otros, constituyen resultado del efecto toxico del Cosmoflux 411F. En el hígado se hallaron cambios degenerativos posiblemente asociados al metabolismo de los compuestos del Cosmoflux 411F así como a los efectos directos del mismo por alteración de la permeabilidad de la membrana. En el intestino los efectos son de importancia dada la vacuolización severa de los enterocitos, lo cual puede afectar de manera considerable su capacidad de absorción, gracias a cambios en su permeabilidad. La piel desarrolla una respuesta proliferativa de células de moco, debido a un posible efecto irritativo del surfactante. En el cerebro los surfactantes pueden generar lesiones significativas, dada la relación del área anterior del encéfalo con la olfacción y las funciones intrínsecas asociadas a la misma.
Aun cuando la CL50 de 4417.99 mg/l es alta y se encuentra de manera poco probable en ambientes naturales, el estudio de los efectos de dicha concentración es de interés para el entendimiento de la dinámica de los surfactantes a nivel celular, así como de importancia biológica y en salud pública. Además, se recomienda diseñar trabajos encaminados a evaluar la susceptibilidad de otras especies incluyendo plantas, macro y microinvertebrados, encargados de la dinámica poblacional acuática, permitiendo discernir el efecto real en ecosistemas acuáticos. Igualmente, deben realizarse ensayos subletales y crónicos, que semejen la situación real de los cuerpos de agua en condiciones de campo. Se aconseja dilucidar la estructura molecular del Cosmoflux 411F con el fin de mejorar la evaluación completa de sus posibles efectos. De la misma forma se recomienda profundizar sobre su acción en el sistema nervioso central, así como en el papel de las CGE/CM en relación con las lesiones descritas.
Agradecimientos
Los autores agradecen al Instituto de Acuicultura de los Llanos, IALL, así como al Instituto Investigaciones de la Orinoquia Colombiana, IIOC de la Universidad de los Llanos.
Referencias
1. Abel PD, Skidmore JF. Toxic effects of an anionic detergent on the gills of rainbow trout. Wat Res 1975; 9:759-765. [ Links ]
2. Abel PD. Toxic action of several lethal concentrations of an anionic detergent on the gills of brown trout (Salmo trutta L.). J Fish Biol 1976; 9:441-446. [ Links ]
3. Anderson M, Cacela D, Beltman D, The S, Okihiro M, et al. Biochemical and toxicopathic biomarkers assessed in smallmouth bass recovered from a polychlorinated biphenyl-contaminated river. Biomarkers 2003; 8:371-393. [ Links ]
4. Barton BA, Bollig H, Hauskins BL, Jansen CR. Juvenile pallid (Scaphirhynchus albus) and hybrid pallid shovelnose (S. albus platorynchus) sturgeons exhibit low physiological responses to acute handling and severe confinement. Comp Biochem Physiol Part A 2000; 126:125-34. [ Links ]
5. Bernet D, Schmidt-Posthaus H, Wahli T, Burkhardt-Holm P. Evaluation of two monitoring approaches to assess effects of waste water disposal on histological alterations in fish. Hydrobiologia 2004; 524:53-66. [ Links ]
6. Berrill M, Taylor G, Savard H. Are chloride cells involved in low pH tolerance and sensivity? The mayfly possibility. Can J Fish Aquat Sci 1991; 48:1220-1225. [ Links ]
7. Brooke L. Acute and chronic toxicity of nonylphenol to ten species of aquatic organisms. Report to the U.S. Environmental Protection Agency, Duluth, MN (contract no. 68-C1-0034). Lake Superior Research Institute, University of Wisconsin-Superior, Superior, Wis. 1993. [ Links ]
8. Burton D, Burton MP, Idler DR. Epidermal condition in post-spawned winter flounder, Pseudopleuronectes americanus, (Walbaum) maintained in the laboratory and after exposure to crude petroleum. J Fish Biol 1984; 25:593-606. [ Links ]
9. Calamari D, Marchetti R. The toxicity of mixtures of metals and surfactants to rainbow trout (Salmo gairdneri Rich.). Wat Res 1993; 7:1453-1464. [ Links ]
10. Cardellini P, Ometto L. Teratogenic and toxic effects of alcohol ethoxylates and alcohol ethoxy sulfate surfactants on Xenopus laevis embryos and Tadpoles. Ecotoxicol Environ Safety 2001; 48:170-177. [ Links ]
11. Dayeh VR, Chow SL, Schirmer K, Lynn DH, Bols NC. Evaluating the toxicity of Triton X-100 to protozoan, fish, and mammalian cells using fluorescent dyes as indicators of cell viability. Ecotoxicol Environ Safety 2004; 57:375-382. [ Links ]
12. Diamond L, Durkin R. Effects of surfactants on the toxicity of glyphosate, with specific reference to RODEO®. New York. 1997. Prepared under USDA FS Contract No. 53-3187-5-12. Final Report. February 6. p. 32. [ Links ]
13. Dorn P, Salanitro J, Evans S, Kravetz L. Assessing the aquatic hazard of some branched and linear non-ionic surfactants by biodegradation and toxicity. Environ Toxicol Chem 1993; 12:1751-1762. [ Links ]
14. Eslava-Mocha PR, Ramírez-Duarte WF, Rondón-Barragán IS. Sobre los efectos del glifosato y sus mezclas: impacto sobre peces nativos. Editorial Juan XXIII. Universidad de los Llanos; 2007. p150. [ Links ]
15. Fast MD, Sims DE, Burka JF, Mustafa A, Ross NW. Skin morphology and humoral non-specific defence parameters of mucus and plasma in rainbow trout, Coho and Atlantic salmon. Comp Biochem Physiol Part A 2002; 12:645-657. [ Links ]
16. Folmar LC, Sanders HO, Julin AM. Toxicity of the herbicide glyphosate and several of its formulations to fish and aquatic invertebrates. Arch Environ Contam Toxicol 1979; 8:269-278. [ Links ]
17. Francis-Floyd R. The use of salt in aquaculture. Fact Skeet VM 86. Series of the Department of Large Animal Clinical Sciences, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. 1995. (Fecha de acceso: 15 enero de 2007)(URL: http://hammock.ifas.ufl.edu). [ Links ]
18. Hamilton MA, Russo RC, Thurston RV. "Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays". Environ Sci Technol 1977; 11:714-719. [ Links ]
19. Handy RD, Eddy FB, Romain G. In vitro evidence for the ionoregulatory role of rainbow trout mucus in acid, acid/aluminium and zinc toxicity. J Fish Biol 1989; 35:737-747. [ Links ]
20. Hofer R, Jeney Z, Bucher F. Chronic effects of linear alkylbenzene sulfonate (LAS) and ammonia on rainbow trout (Oncorhynchus mykiss) fry at water criteria limits. Wat Res 1995; 29:2725-2729. [ Links ]
21. Iger Y, Balm PHM, Bonga SEW. Cellular responses of the skin and changes in plasma cortisol levels of trout (Oncorhynchus mykiss) exposed to acidified water. Cell Tissue Res 1994; 278:535-542. [ Links ]
22. Iregui C, Eslava P, Martínez E, Figueroa J. Descripción de una caso de myxosporidiasis clínica en cachama blanca, Piaractus brachypomus. Dahlia. Rev Asoc Colomb Ictiol 1999; 3:17-29. [ Links ]
23. Jiraungkoorskul W, Upatham ES, Kruatrachue M, Sahaphong S, Vichasri-Grams S, et al. Acute toxicity of Roundup, a glyphosate herbicide, to nile tilapia (Oreochromis niloticus). Sci Asia 2002; 28:119-125. [ Links ]
24. Jiraungkoorskul W, Upatham ES, Kruatrachue M, Sahaphong S, Vichasri-Grams S, et al. Biochemical and histopathological effects of glyphosate herbicide on nile tilapia (Oreochromis niloticus). Environ Toxicol 2003; 18:260-267. [ Links ]
25. Jonsson CM, Toledo MC. Acute toxicity of endosulfan to the fish Hyphessobrycon bifasciatus and Brachydanio rerio. Arch Environ Contam Toxicol 1993; 24:151-155. [ Links ]
26. Laurent P, Perry SF. Effects of cortisol on gill chloride cell morphology and ionic uptake in the freshwater trout, Salmo gairdneri. Cell Tissue Res 1990; 259:429-442. [ Links ]
27. Lema SC, Hodges MJ, Marchettic MP, Nevitt GA. Proliferation zones in the salmon telencephalon and evidence for environmental influence on proliferation rate. Comp Biochem Physiol Part A 2005; 141:327-335. [ Links ]
28. Lewis M. Chronic and sublethal toxicities of surfactants to aquatic animals: a review and risk assessment. Wat Res 1991; 25:101-113. [ Links ]
29. Lussier S, Champlin D, Livolsi J, Poucher S, Pruell R. Acute toxicity of para-nonylphenol to saltwater animals. Environ Toxicol Chem 2000; 19:617-621. [ Links ]
30. Macek KJ, Krzeminski SF. Susceptibility of bluegill sunfish (Lepomis macrochirus) to nonionic surfactants. Bull Environ Contam Toxicol 1975; 13:377-384. [ Links ]
31. Madsen T, Petersen G, Seierø S, Tørsløv J. Biodegradability and aquatic toxicity of glycoside surfactants and a nonionic alcohol ethoxylate. J Am Oil Chem Soc 1996; 73:929-933. [ Links ]
32. Mann RM, Bidwell JR. The acute toxicity of agricultural surfactants to the tadpoles of four Australian and two exotic frogs. Environ Pollut 2001; 114:195-205. [ Links ]
33. Marc J, Bellé R, Morales J, Cormier P, Mulner-Lorillon O. Formulated glyphosate activates the DNA-response checkpoint of the cell cycle leading to the prevention of G2/M transition. Toxicol Sci 2004; 82:436-442. [ Links ]
34. Marc J, Mulner-Lorillon O, Bellé R. Glyphosate-based pesticides affect cell cycle regulation. Biol Cell 2004; 96:245-249 [ Links ]
35. Matsuyama T, Lida T. Degranulation of eosinophilic granular cells with possible involvement in neutrophil migration to site of inflammation in tilapia. Dev Comp Immunol 1999; 23:451-457 [ Links ]
36. Meddings JB, Swain MG. Environmental stress-induced gastrointestinal permeability is mediated by endogenous glucocorticoids in the rat. Gastroenterology 2000; 119:1019-1028. [ Links ]
37. Monroy CM, Cortés AC, Sicard DM, Groot de Restrepo H. Citotoxicidad y genotoxicidad en células humanas expuestas in vitro a glifosato. Biomédica 2005; 25:335-345. [ Links ]
38. Morral DD, Belanger SE, Dunphy JC. Acute and chronic aquatic toxicity structure-activity relationships for alcohol ethoxylates. Ecotox Environ Safety 2003; 56:381-389. [ Links ]
39. Munday BL, Nowak BF, Deavin JG. Toxicity of eucalypt-based pulp mill effluents as assessed by acute and chronic assays. In: Environmental Fate and Effects of bleached pulp mill effluents. Proceedings of a SEPA, conference held at Grand Hôtel Saltsjöbaden, Stockholm, Sweeden, 19-21. November 1991. Report 4031. [ Links ]
40. Nivia E. Las fumigaciones aéreas sobre cultivos ilícitos sí son peligrosas. Algunas aproximaciones. Conferencia "Las guerras en Colombia: drogas, armas y petróleo" "The wars in Colombia: drugs, guns and oil". Instituto Hemisférico de las Américas Universidad de California, Davis, Mayo 17-19, 2001. [ Links ]
41. Nowak B. Histological changes in gills induced by residues of endosulfan. Aquat Toxicol 1992; 23:65-84. [ Links ]
42. Nowak B. Relationship between endosulfan residue tissue level and ultrastructural changes in the liver of catfish, Tandanus tandanus. Arch Environ Contam Toxicol 1996; 30:195-202. [ Links ]
43. Paz-y-Miño C, Sánchez ME, Arévalo M, Muñoz MJ, Witte T, et al. Evaluation of DNA damage in an Ecuadorian population exposed to glyphosate. Genet Mol Biol 2007; 30:456-460. [ Links ]
44. Perry SF. The chloride cell: structure and function in the gills of freshwater fishes. Ann Rev Physiol 1997; 59:325-47. [ Links ]
45. Pfeifer U. Functional morphology of the lysosomal apparatus. In: Glaumann H, Ballard FJ (editores). Lysosomes: their role in protein breakdown. London: Academic Press; 1987. p.3-60 [ Links ]
46. Powell MD, Wright GM, Burka JF. Morphological and distributional changes in the eosinophilic granule cell (EGC) population of the rainbow trout (Oncorhynchus mykiss Walbaum) intestine following systemic administration of capsaicin and substance P. J Exp Zool 1993; 266:19-30. [ Links ]
47. Powell MD, Wright GM, Burka JF. Eosinophilic granule cells in the gills of rainbow trout, Oncorhynchus mykiss: evidence of migration? J Fish Biol 1990; 37:495-497. [ Links ]
48. Read NG. The role of lysosomes in hyaline droplet nephropathy induced by a variety of pharmacological agents in the male rat. Histochem J 1991; 23:436-443. [ Links ]
49. Reimschuessel R, Bennet RO, May EB, Lipsky MM. Renal histopathological changes in the goldfish (Carasius auratus) after sublethal exposure to hexachlorobutadiene. Aquat Toxicol 1989; 15:169-180. [ Links ]
50. Reimschuessel R, Bennet RO, May EB, Lipsky MM. Renal tubular cell regeneration, cell proliferation and chronic nephrotoxicity in the goldfish Carassius auratus following exposure to a single sublethal dose of hexachlorobutadiene. Dis Aquat Org 1990; 8:221-224. [ Links ]
51. Reimschuessel R, May E, Bennett R, Lipsky M. Necropsy examination of fish. Vet Clin North Amer Trop Fish Med: Small Anim Pract 1988; 18:427-433. [ Links ]
52. Romero ER, Scandaliaris J, Olea I, Sotillo S. Maduración química de la caña de azúcar. Gacetilla Agroindustrial 1997; 58. Acceso 10 de Septiembre de 2007 (URL: http://www.produccion.com.ar/1997/97may_13.htm) [ Links ]
53. Roy D. Effect of an anionic detergent on the lipid moieties of various cell types in the opercular epidermis of Rita rita. Bull Environ Contam Toxicol 1988; 41:352-359. [ Links ]
54. Ruane NM, Wendelaar Bonga SE, Balm PHM. Differences between Rainbow Trout and Brown Trout in the regulation of the pituitary-interrenal axis and physiological performance during confinement. Gen Comp Endocrinol 1999; 115:210-219. [ Links ]
55. Saboia-Moraes SMT, Hernandez-Blazquez FJ, Mota DL, Bittencourt AM. Mucous cell types in the branchial epithelium of the euryhaline fish Poecilia vivipara. J Fish Biol 1996; 49:545-548. [ Links ]
56. Saint-Paul U. Physiological adaptation to hypoxia of neotropical characoid fish Colossoma macropomum serrasalmidae. Environ Biol Fishes 1984; 11:53-62. [ Links ]
57. Saunders PR, Kosecka U, Mckay DM, Purdue MH. Acute stressors stimulate ion secretion and increase epithelial permeability in rat intestine. Am J Physiol Gastrintest Liver Physiol 1994; 30:G794-G799. [ Links ]
58. Servos M. Review of the aquatic toxicity, estrogenic responses and bioaccumulation of alkylphenols and alkylphenol polyethoxylates. Wat Qual Res J of Canada 1999; 34:123-177. [ Links ]
59. Shepard KL. The influence of mucus on the diffusion of ions across the esophagus of fish. Physiol Zoology 1982; 55:23-24. [ Links ]
60. Smart G. The effect of ammonia exposure on gill structure of the rainbow trout (Salmo gairdneri). J Fish Biol 1976; 8:471-475. [ Links ]
61. Solomon KR, Ananon A, Cerdeira AL, Marshall J, Sanin LH. Estudio de los efectos del programa de erradicación de cultivos ilícitos mediante la aspersión aérea con el herbicida glifosato (PECIG) y de los cultivos ilícitos en la salud humana y en el medio ambiente. Informe contratado para la Comision Interoamericana para el Control del Abuso de Drogas (CICAD), division de la Organización de los Estados Americanos (OEA). Washington, D.C.USA. 31 de marzo de 2005; p143. [ Links ]
62. Sprague JB. Avoidance reactions of salmonid fish to representative pollutants. Wat Res 1968; 2:23-24. [ Links ]
63. Stagg RM, Shuttleworth TJ. Surfactants effects on adrenergic responses in the gills of the flounder (Plathichthys flesus L). J Comp Physiol B 1986; 156:727-733. [ Links ]
64. Sutterlin A, Sutterlin N, Rand S. The influence of synthetic surfactants on the functional properties of the olfactory epithelium of atlantic salmon. Fish Res Bd Can Tech Rep 1971; 287:1-8. [ Links ]
65. Szarek J, Siwicki A, Andrzejewska A, Terech-Majewska E, Banaszkiewiez T. Effect of the herbicide RoundUp™ on the ultrastructural pattern of hepatocytes in carp (Cyprinus carpio). Marine Environ Res 2000; 50:263-266. [ Links ]
66. Talmage S. Environmental and human safety of major surfactants. Alcohol ethoxylates and alkylphenol ethoxylates. The Soap and Detergent Association. Boca Raton: Lewis publishers; 1994; p.374. [ Links ]
67. Tolls J, Kloepper-Sams P, Sijm D. Surfactant bioconcentration - a critical review. Chemosphere 1994; 29:693-717. [ Links ]
68. Turner A, Abram F, Brown V, Painter H. The biodegradability of two primary alcohol ethoxylate nonionic surfactants under practical conditions, and the toxicity of the biodegradation products to rainbow trout. Wat Res 1985; 19:45-51. [ Links ]
69. UNODC. Censo de cultivos de coca - 2005 Colombia, Monitoreo de cultivos de coca. 2006. Acceso 10 de Septiembre de 2007. (URL: http://www.acnur.org/pais/docs/1456%20-%20COIinformeunodc2005colombia20jun06.pdf). [ Links ]
70. Vallejo AN, Ellis AE. Ultrastructural study of the response of eosinophil granule cells to Aeromonas salmonicida extracellular products and histamine liberators in rainbow trout Salmo gairdneri Richardson. Dev Comp Immunol 1989; 13:133-148. [ Links ]
71. Varsamos S, Flik G, Pepin JF, Wendelaar Bonga SE, Breuil G. Husbandry stress during early life stages affects the stress response and health status of juvenile sea bass, Dicentrarchus labrax. Fish Shellfish Immunol 2006; 20:83-96. [ Links ]
72. WHO (World Health Organization), United Nations Environment Program, The International Labour Organization. Glyphosate. Environmental Health Criteria Nº 159. Geneva, Switzerland. 1994. p177. [ Links ]
73. Wilhelm M, Silver R, Silverman AJ. Central nervous system neurons acquire mast cell products via transgranulation. Eur J Neurosci 2005; 22:2238-2248. [ Links ]
74. Wind T, Belanger SE. Acute and chronic toxicity of alcohol ethoxylates to the green alga, Desmodesmus (=Scenedesmus) subspicatus, and the subsequent development of structure activity relationships. Bull Environ Contam Toxicol 2006; 76:218-225. [ Links ]
75. Wong D, Dorn P, Chai E. Acute toxicity and structure-activity relationships of nine alcohol ethoxylate surfactants to fathead minnow and Daphnia magna. Environ Toxicol Chem 1997; 16:1970-1976. [ Links ]
76. Zupanc GKH. Neurogenesis and neuronal regeneration in the adult fish brain. J Comp Physiol A 2006; 192:649-670. [ Links ]
¶ Para citar este artículo: Rondón-Barragán IS, Ramírez-Duarte WF, Eslava-Mocha PR. Evaluación de los efectos tóxicos y concentración letal 50 del surfactante Cosmoflux® 411F sobre juveniles de cachama blanca (Piaractus brachypomus). Rev Col Cienc Pec 2007; 20:431-446.
*Autor para el envío de correspondencia y la solicitud de separatas: Instituto de Acuicultura de los Llanos (IALL), Universidad de los Llanos, Km 12 Vía Apiay. AA 110. Villavicencio, Colombia. E-mail: iangrondon@gmail.com














