Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.24 no.1 Medellín Jan./Mar. 2011
Artículos originales
Exposure of Red Tilapia (Oreochromis spp.) eggs to 17 α-Methyltestosterone and the sex ratio of the fish offspring¤
Inmersión de ovas de tilapia roja (Oreochromis spp.) en diferentes estadíos de fertilización en una solución de 17 α- metiltestosterona y la proporción fenotípica del sexo
Efeito da imersão de ovas de tilápia vermelha (Oreochromis spp.) em diferentes fases de fertilização numa solução de 17α- metiltestosterona sobre a proporção fenotípica do sexo
Mónica C Botero 1,2,*, Zoot, PhD; Juan C Pineda 1, Zoot; Natalia Gallego1, Zoot.
1Grupo GRICA, Facultad de Ciencias Agrarias, Universidad de Antioquia.
2Docente Escuela de Producción Agropecuaria, Facultad de Ciencias Agrarias, Universidad de Antioquia. AA 1226. Medellín, Colombia
(Recibido: 26 febrero, 2010; aceptado: agosto, 2010)
Summary
This study evaluated the proportions of sex reversals which occurred after red tilapia (Oreochromis spp.) eggs were immersed into various solutions of 17 α-Methyltestosterone (0, 800 and 1200 ug/L of water). Two fertilization stages of the eggs, i.e., reflecting clear or dark colors, were included in this study. Besides sex proportions, other parameters studied included hatching, fry and fingerling survival, final weight and length. There were no significant differences between the sex proportions obtained relative to hormone concentration or egg color (49.59% males from dark eggs and 46.36% males from light eggsversus the control, which had 55.24% males). In contrast, the percentage of hatching was significantly higher in dark eggs (60.27% ± 11.52). Survival of fry was higher when born from dark eggs compared with clear eggs (51.74% ± 27.01 versus 28.97% ± 1.52, respectively). Fingerling survival was not related to the color of the eggs (59.28% ± 23.73 versus 65.58% ± 9.01 for initially dark and clear eggs, respectively). However, surviving males were longer and heavier (6.75 cm ± 1.29 and 5.45 g ± 3.09) than females. This data suggest a possible interaction between hatching, survival, and egg color.
Key words: hormonal induction, masculinization, sexual reversal.
Resumen
Este trabajo tuvo como objetivo evaluar la reversión sexual por inmersión de ovas de tilapia roja (Oreochromis spp.) clasificadas por estadíos de fertilización (color de ovas claras y oscuras) a diferentes hormonales 0, 800 y 1200 μg de 17 α- Metil Testosterona (17αMT/L) por litro de agua. El trabajo fue realizado en la estación piscícola de la Universidad de Antioquia, midiendo como variables: proporción sexual, porcentaje de eclosión, sobrevivencia en larva y alevinaje, peso final, longitud total. Para porcentaje de reversión sexual no se encontró diferencia significativa (p>0.05) con respecto a las concentraciones hormonales y al color de ovas, cuyos valores promedio fueron 49.59% de machos para ovas oscuras y 46.36% de machos para ovas claras, respecto al tratamiento testigo que tuvo 55.24% de machos. Para los demás parámetros, tales como porcentaje de eclosión, se encontró diferencia altamente significativa (p<0.01) con respecto al color de las ovas siendo mayor la eclosión en ovas de color oscuro con un valor de 60.27 ± 11.52%. Para sobrevivencia en larva se encontró diferencia significativa (p<0.05) hallándose 51.74 ± 27.01% para las larvas provenientes de ovas oscuras y 28.97 ± 1.52% para las provenientes de ovas claras. Para sobrevivencia en la etapa de alevinaje, no hubo diferencia significativa (p>0.05) con respecto al color de las ovas, encontrándose 59.2 ± 23.73% para los animales provenientes de ovas oscuras y de 65.58 ± 9.01% para los animales provenientes de ovas claras. En las variables peso y longitud se observó diferencia altamente significativa (p<0.001) con respecto al sexo siendo de mayor tamaño y peso los machos con una media de 6.75 ± 1.29 cm y 5.45 ± 3.09 g, respectivamente.
Palabras clave: inducción hormonal, masculinización, reversión sexual.
Resumo
Este estudo teve como objetivo avaliar a reversão sexual por imersão em ovas de tilápia vermelha (Oreochromis spp.), classificadas por fases da fecundação (ovas de cores claras e escuras), com diferentes concentrações hormonais, 0, 800 e 1200 μg17α MT / L de água. Este trabalho foi realizado na Estação Piscícola da Universidade de Antioquia, medindo variáveis, tais como: percentagem de Eclosão, percentagem de Sobrevivência das larvas e alevinagem, Peso fim, Comprimento total, e proporção sexual. Para a variável Eclosão, foi encontrada uma diferença altamente significativa (p<0.01), sendo maior a quantidade de ovas escuras, com uma média de 60.27% e um desvio padrão de ± 11.52%. Na sobrevivencia das larvas não foi encontrada diferença significativa (p<0.05) com respeito a cor das ovas, havendo uma média de 51.74% e um desvio padrão de ± 27.01% para as larvas das ovas escuras; uma média de 28.97% e com desvio padrão de ± 1.52% para as larvas das ovas claras. Durante a etapa da alevinagem não houve diferença significativa (p>0.05), encontrado uma média de 59.28% e um desvio padrão de ± 23.73% para os animais provenientes de ovas escuras; uma média de 65.58% e um desvio padrão de ± 9.01% para animais provenientes de ovas claras. Nas variáveis Peso e Comprimento, foi observada diferença altamente significativa (p <0.001); sendo os machos, de maior tamanho e peso, com uma média de 6.75 centímetros e um desvio padrão de ± 1.29 cm para a variável comprimento. Para a variável peso, ocorreu uma média de 5.45 gr e um desvio de ± 3.09 g. Para a Reversão, não foi encontrada diferença significativa (p>0.05), no que diz respeito ao concentrações hormonais e a cor das ovas.
Palavras chave: indução hormonal, masculinização, reversão sexual.
¤ Para citar este artículo: Botero M, Pineda JC, Gallego N. Inmersión de ovas de tilapia roja (Oreochromis spp.) en diferentes estadíos de fertilización en una solución de 17α metiltestosterona y la proporción fenotípica del sexo. Rev Colomb Cienc Pecu 2011; 24:38-47
* Autor para correspondencia: Mónica Botero Aguirre. Grupo de Investigación en Ciencias Agrarias GRICA, Escuela de Producción Animal, Facultad de Ciencias Agrarias, Universidad de Antioquia. AA1226, Medellín, Colombia. Correo electrónico: mo.botero@hotmail.com
Introducción
La producción nacional de peces involucra principalmente tilapia, trucha y cachama, con participación conjunta en los últimos 12 años del 96.3% del total de la piscicultura y el 65.3% de la producción acuícola. La producción de tilapia ha participado con el 49% de la actividad piscícola (Martínez y González, 2005).
El sexo en peces está determinado genéticamente de forma definitiva. Factores externos como temperatura, comportamiento social y extirpación quirúrgica de las gónadas, inducen a la reversión del sexo (Haniffa et al., 2004). Como el sexo fenotípico no se ha diferenciado, puede ser manipulado por administración de hormonas esteroides, ya sea por suplementos alimentarios, por inmersión o por trasferencia sistémica (Haniffa et al., 2004).En varias especies de peces es utilizada la reversión sexual inducida por hormonas esteroides (Hunter y Donaldson, 1983 En: Wassermann y Bertolla- Afonso, 2003), siendo los andrógenos y los estrógenos usados como agentes masculinizantes y feminizantes respectivamente (Pandian y Sheela, 1995).
En el caso particular de la tilapia, el periodo de indiferenciación en la morfogénesis llega hasta los 15 días después de la eclosión, lo que ha permitido la utilización de técnicas de inducción hormonal para el cambio fenotípico del sexo (Hepher y Pruginin, 1991). En la reversión sexual se espera que por lo menos el 95% de la población sea machos (Martínez y González, 2005), aunque en este proceso lo ideal es alcanzar el 100% de efectividad, debido a que la especie alcanza la madurez sexual muy rápidamente. El cultivo de ambos sexos generalmente conduce a una reproducción no deseada ocasionando superpoblación y bajas ganancias de peso (Guerrero, 1975; Blázquez et al., 1995). Esta ha sido la principal razón para que se produzcan poblaciones monosexo, sólo machos (Wassermann y Bertolla-Afonso, 2003).
Los métodos actuales de masculinización se hacen por administración de andrógenos en el alimento, lo que acarrea que el excedente hormonal contamine el agua de cultivo y las cuencas que la reciben. Como otra falla, está la distribución desigual, tanto del alimento como de hormona, dando lugar a la formación de jerarquías (Bart et al., 2003). Como alternativa a reversión por alimentación, se está implementando inmersión de ovas en solución con hormona masculinizante para salmónidos y tilapias (Piferrer y Donaldson 1989; Piferrer 1995, Fiest et al., 1995; Contreras- Sánchez et al., 1999).
Se pretende evaluar el efecto de la inmersión de ovas tilapia roja (Oreochromis spp) en diferentes estadíos de fertilización en una solución de 17 α metiltestosterona sobre la proporción fenotípica del sexo.
Materiales y métodos
El trabajo de campo se realizó en la Estación Piscícola de San José del Nus de la Universidad de Antioquia, localizada en el Municipio de San Roque, con una altitud de 840 metros sobre el nivel del mar, con una precipitación anual de 2000 mm, temperatura ambiente promedio de 22 °C y temperatura del agua de 24 ± 3 °C. De acuerdo a parámetros establecidos, dicha estación está clasificada como zona de vida de bosque húmedo tropical (bh-T) (Holdrigde, 1996).
Se emplearon 10 reproductoras de tilapia roja, de las cuales se extrajeron todas las ovas de la cavidad oral para el experimento; éstas se recolectaron en dos recipientes y se clasificaron en dos grupos: ovas claras (OC) y ovas oscuras (OO), asociando su coloración al estadío de fertilización. Se tomó una alícuota de 2 ml de ovas de cada color y se contaron seis veces para determinar la cantidad promedio de huevos, dando como resultado 79 huevos/ml. Cada grupo de ovas (OC y OO) se colocó en tres tratamientos (T1, T2 y T3) con 0, 800 y 1200 μg/L de la hormona 17α-metiltestosterona, respectivamente. Cada tratamiento tuvo cuatro repeticiones (incubadoras), con promedio de 458 OC (5.6 ovas/cm2)) o 155 OO (1.89 ovas/ cm2). Las ovas de color oscuro se sembraron a menor densidad, dado que la mayoría de hembras capturadas con huevos en cavidad bucal, se encontraban al inicio de la incubación.
Las incubadoras usadas fueron de tipo artesanal, con un diámetro de 81.7 cm2. Éstas fueron ubicadas en parejas dentro de un acuario de 50 x 40 x 30 cm con volumen de 13 L de agua, con aireación al 100%, temperatura promedio de 24 °C, para 12 acuarios en total. Una vez recolectadas las ovas, se homogenizaron entre sí, para garantizar que todas las réplicas de cada tratamiento tuviesen una distribución uniforme de ovas por color y así obtener una menor dispersión en los resultados/ réplica. Tras este procedimiento, tanto las OC como las OO se sometieron a inmersión en solución con la hormona hasta eclosión. Durante este tiempo, se midieron los grados hora y las horas de contacto con la hormona, para asociarlos a la proporción fenotípica de sexo obtenida. Los parámetros físicoquímicos del agua tales como temperatura del agua, OD (mg/L), saturación de oxígeno y pH fueron medidos diariamente con oxímetro marca Orión y pHmetro WTW respectivamente, para verificar que se conservaran dentro de los valores adecuados para los procesos fisiológicos de ovas y larvas.
Se hizo recambio diario del 100% del agua durante el período de incubación, para garantizar que la hormona no hubiese perdido su principio activo hasta el momento de la eclosión. La hormona fue solubilizada en agua a una concentración de T1 (0 μg 17μαMT/L), T2 (800 μg 17α-MT/L) y T3 (1200 μg 17α-MT/L), producida por The Central Pharmaceutical Co., Ltda (Tianjin, China), distribuída para el país por Acuagranja Ltda. (Pureza 100%, un gramo de 17 α metiltestosterona contiene 1 g).
Luego de la eclosión, las larvas de cada incubadora fueron trasladadas a acuarios de 50 cm x 40 cm x 30 cm para un total de 24 (acuario/réplica). A los 67 días de la eclosión fueron trasladados con un peso promedio de 0.5 gr a cinco jaulas de 2.8 m x 1.2 m x 0.6 con un ojo de malla de 3 mm, divididas en 5 compartimentos cada una. Las jaulas fueron ubicadas en el lago de la estación piscícola (6.360 m2) con temperatura promedio de 27 °C y concentración de oxígeno disuelto de 6 mg/L en promedio. La jaula y el compartimiento para los tratamientos y sus réplicas fueron asignados de manera aleatoria. Desde el inicio de la alimentación, las poslarvas fueron alimentadas 5 veces al día con alimento comercial de 32% de proteína. Se llevó registro de mortalidad hasta alcanzar la talla para realizar diferenciación de gónada mediante squash (Guerrero y Shelton, 1974).
Para la determinación de sexo se empleó la técnica histológica. Para la evaluación histológica se realizó al día 55 un corte ventral para extraer ambas gónadas, las cuales fueron observadas al microscopio. Antes de ser observadas, se sometieron a un leve aplastamiento (squash) con el cubreobjetos y a tinción con azul de metileno al 3%. En el microscopio se realizó un barrido de ambas gónadas para evaluar la presencia de ovocitos o de tejido granular (testículos), de acuerdo al procedimiento descrito por Guerrero y Shelton (1974).
Se utilizó un diseño factorial: Dos tipos de ovas (OC y OO) por tres concentraciones hormonales (T1, T2 y T3). Las variables porcentaje de eclosión, porcentaje de sobrevivencia en larvas y en alevinos, se presentan como promedio ± DE y fueron transformadas con función raíz cuadrada. Las variables peso y longitud final fueron analizadas teniendo en cuenta los siguientes efectos: tipo de ova, concentración, interacción tipo por concentración y sexo del alevino. La comparación de medias fue realizada con la prueba de Tukey- Kramer al 5% de significancia. La variable proporción de machos y hembras fue analizada mediante un análisis de chi-cuadrado. Se utilizó el programa estadístico SAS (versión 8.1).
Resultados
Variable dependiente: eclosión
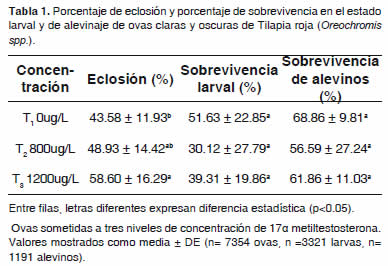
La variable eclosión obtuvo los mejores resultados para el T3 con 58.60 ± 16.29%, seguido de T2 con 48.93 ± 14.42% y por último el T1 con 43.58 ± 11.93%. Se halló diferencia significativa (p<0.05) entre T3 (1200 μg 17αMT/L) y T1 (0 μg 17αMT/L) (Tabla 1).
Con respecto al color de ova para el porcentaje de eclosión (Tabla 2) se observó diferencia estadística altamente significativa (p<0.01) con respecto a las ovas oscuras, obteniéndose valores de 60.27 ± 11.52% y de 40.47 ± 11.39% para OO y OC, respectivamente. No se encontró diferencia (p>0.05) en la interacción concentración hormonal - ova.
La eclosión se presentó en ovas oscuras a los 1.824 Unidades Térmicas Acumuladas (UTA, °C) hora (67.55 horas) y en las ovas claras a los 3.074 UTA, °C hora (113.85 horas), posterior al momento de la siembra en las incubadoras.
Variable dependiente: sobrevivencia larval
Respecto a la sobrevivencia de larvas, el tratamiento con mejores resultados fue el T1 con 51.63 ± 22.85%, seguido del T3 con 39.31 ± 19.86% y el T2 presentó la sobrevivencia larvaria más baja (30.12 ± 27.79%) (Tabla 1). No se encontró diferencia significativa (p>0.05) entre las concentraciones hormonales (Tabla 1). Se observó diferencia significativa (p<0.05) para sobrevivencia larval en OO y en OC, con valores de 51.71 ± 27.00% y 28.97 ± 15.23%, respectivamente. No hubo diferencia significativa en la interacción de concentración hormonal más color de ova (p>0.05, p=0.7726). Sin embargo, la interacción concentración hormonal. Ova se encontró un mejor desempeño en T1 (0 μg 17αMT/L) con OO con respecto a OC.
Variable dependiente: sobrevivencia alevino
La variable sobrevivencia de alevinos no obtuvo ninguna diferencia significativa (p>0.05) con respecto a las concentraciones hormonales (Tabla 1), color de ova (Tabla 2) e interacción concentración hormonal. Ova; sin embargo, se observó en la concentración T1 un mejor desempeño, seguido de T3 y T2 con valores de 68.86 ± 9.81%, 61.86 ± 11.03% y 56.59 ± 27.24% respectivamente. Con relación al color de la ova, se observó una media para sobrevivencia de alevinos más alta en las OC (65.58 ± 9.00%) que en OO. En cuanto a la interacción concentración hormonalova, se encontró un mejor desempeño en T1 con OO, seguido de T2 con OC y de T3 con OC.
Variable dependiente: peso final
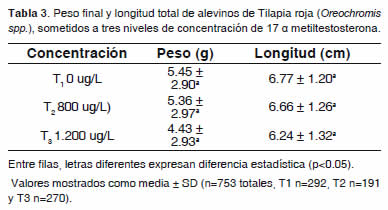
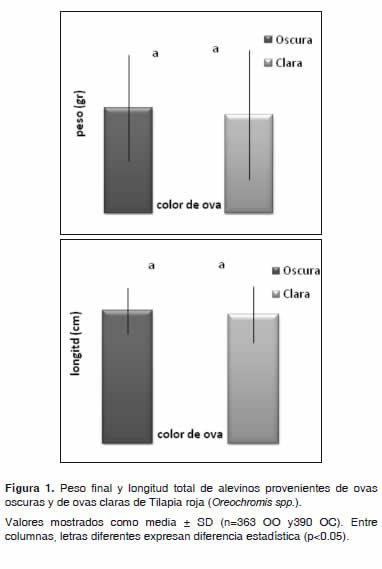
El peso final presentó una diferencia altamente significativa (p<0.01) con respecto al sexo, mostrando mejor respuesta los machos (Figura 2). Para las concentraciones (Tabla 3), color de ova (Figura 1) e interacción tratamiento por color de ova, no se encontró diferencia significativa (p>0.05); sin embargo, se observó un mejor desempeño en el T1 (5.45 ± 2.90 g) seguido de T2 (5.36 ± 2.97 g).
De acuerdo al color de ova se encontró un mejor desempeño en las de color oscuro sin observarse diferencia significativa (p>0.05) (Figura 1). En cuanto a la interacción concentración hormonal por color de ova se observó un mejor desempeño en el T1 en ovas de color oscuro seguido del T2 en ovas claras.
Variable dependiente: longitud total
Con respecto a la longitud total, los valores hallados fueron de 6.77 ± 1.20 cm, 6.66 ± 1.26 cm y 6.24 ± 1.32 cm para T1, T2 y T3 respectivamente (Tabla 3), sin observarse diferencia significativa (p>0.05). La variable longitud total, presentó una diferencia altamente significativa (p<0.01) con respecto al sexo, logrando una mejor respuesta de los machos (Figura 2). Para las concentraciones hormonales (Tabla 3), color de ova (Figura 2) e interacción concentración por color de ova, no se encontró diferencia significativa (p>0.05); sin embargo, se observó un mejor desempeño en el T1, seguido de T2 y por último T3. De acuerdo al color de ova se encontró un mejor desempeño en las ovas de color oscuro. En cuanto a la interacción concentración hormonal por color de ova, se observó un mejor desempeño en el T1 para OO seguido del T2 con OC.
Variable dependiente: proporción sexual
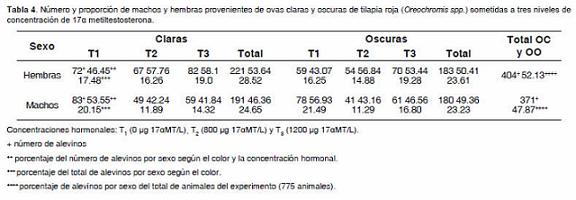
De 363 animales provenientes de ovas oscuras se encontraron 183 hembras (50.41%) y 180 machos (49.59%). De la población anterior, las hembras representaron el 23.63 % y los machos el 23.23%, de un total de 775 animales de la población experimental. De 412 animales provenientes de ovas claras se encontraron 221 hembras (53.64%) y 191 machos (46.36%), siendo las hembras el 28.52% y los machos el 24.65%, de la totalidad de la población experimental (Tabla 4). En los tratamientos no hubo diferencia significativa con la prueba de Chi-cuadrado, pero se obtuvo la mejor respuesta fue con T1 (0 μg 17αMT/L), observándose que a medida que la concentración hormonal aumentaba, también aumentaba la cantidad de hembras.
Discusión
Eclosión
En el presente trabajo se observó una diferencia altamente significativa (p=0.0001) en el porcentaje de eclosión a favor de las ovas oscuras, lo cual concuerda con lo reportado por Suárez y Ceballos (2007), quienes observaron en tilapia roja, que la manipulación de las ovas en estadíos de fertilización temprana, afecta negativamente el porcentaje de eclosión. Por lo tanto, podría asumirse que la coloración de las ovas estaba asociada al porcentaje de eclosión. En el presente trabajo, la diferencia en el porcentaje de eclosión entre ambos tipos de ova, se relacionó más con la alta manipulación y no necesariamente con las concentraciones hormonales trabajadas, ya que a las ovas oscuras les faltaba menos tiempo para eclosionar (67.55 horas en promedio) que a las ovas claras, lo que hizo que tuvieran menor manipulación en los momentos de recambio de agua. Las ovas claras tuvieron un tiempo de inmersión mayor (113.85 horas en promedio) siendo así más manipuladas. La literatura existente no reporta trabajos donde se mencione el estadío de fertilización, asociado a la manipulación y su efecto en el porcentaje de eclosión.
Respecto a los grados hora para la eclosión observados en este trabajo, difieren de lo reportado por Prieto y Olivera-Ángel (2002), quienes obtuvieron 2.304 UTA, °C hora hasta la eclosión y de lo obtenido en la estación piscícola en ensayos realizados (sin publicar) quienes obtuvieron 2.820 UTA, °C horas; lo que pudo deberse a la temperatura del agua de la estación, dado que el trabajo se realizó en época de invierno, lo que tiene una alta relación con las horas grado sumadas.
Los valores porcentaje de eclosión para este trabajo fueron bajos, comparado con los que se obtienen en procesos de incubación natural (Contreras-Sánchez et al., 1999). Dentro de los factores que pudieron afectar este parámetro está la luminosidad, pues las ovas en el medio natural están en una ambiente oscuro dentro de la cavidad bucal de la madre y en el experimento se empleó incubación artificial de ovas mediante la extracción bucal (Prieto y Olivera-Ángel, 2002), donde se expusieron las ovas a una mayor intensidad lumínica, dado que las incubadoras permanecieron en acuarios sin protección de iluminación.
Sobrevivencia
La sobrevivencia al inicio del experimento se vio afectada por la alta manipulación a la que fueron sometidas las ovas. Adicionalmente en un sistema de incubación artificial, el movimiento de las ovas no es igual al que tienen en incubación bucal, lo que facilita la adherencia de partículas del agua con mayor facilidad obstruyendo así la respiración de éstas. Otro factor que pudo haber incidido sobre la sobrevivencia, fue el descarte de las ovas muertas de la incubadora, las cuales no pudieron ser retiradas en su totalidad, lo que generó un hongo que se fijó a las ovas sanas causando mayor mortalidad. De igual manera, las ovas muertas pudieron haber alterado los factores fisicoquímicos del agua. A pesar de realizarse un recambio de agua diario, transcurría un largo periodo de tiempo entre cada recambio permitiendo que estos parámetros se modificaran.
La sobrevivencia en la etapa de larvas se pudo ver afectada por la carencia de un sistema de recirculación del agua, que limpiara y evitara que las larvas muertas y los sobrantes del alimento suministrado estuvieran en contacto con las larvas con vitelo, aumentando el contacto de éstas con agentes patógenos que causaron una alta mortalidad antes de poder emplear filtros. En la etapa de alevinaje la mortalidad fue mínima y los casos presentados se atribuyen a depredación y a estrés, causado por el traslado de los peces desde acuarios hacia jaulas, ya que en su mayoría las muertes se observaron entre los cuatro y cinco días posteriores a la siembra.
En trabajos similares, los demás autores (Cagauan et al., 2004; Prieto y Olivera-Angel, 2002 y Wassermann y Bertolla-Afonso, 2003) no se analizan los resultados obtenidos en cuanto a sobrevivencia a la eclosión, en fase de larva con saco vitelino y en alevino. Sin embargo, en el presente trabajo sólo en la fase de ova, se presentaron diferencias estadísticas para sobrevivencia, en la fase de larva y de alevinos, no hubo diferencias para este parámetro, por lo que la discusión fue enfocada a aspectos metodológicos, más que a influencia de las concentraciones hormonales.
Peso y Longitud
Se encontró una alta relación entre las variables peso y longitud con respecto al sexo, observando que los machos fueron más pesados y largos que las hembras, no teniendo ninguna relación con las concentraciones hormonales ni con el color de las ovas, pues en tilapia roja los machos crecen más que las hembras. Teniendo en cuenta que las variables peso y longitud no presentaron diferencia estadística (p>0.05) en las concentraciones hormonales empleadas y que la literatura no analiza el efecto de la hormona y la proporción sexual sobre dichas variables, los resultados obtenidos se analizaron dentro del mismo trabajo.
Por lo anterior, también se observó una alta diferencia significativa (p<0.01) cuando se analizó la interacción concentración hormonal por color de ova con respecto a cada una de las réplicas; lo que pudo ser debido a la baja densidad de animales en la réplica tres de T2 (800 μg 17α-MT/L) en ovas de color oscuro y en la réplica dos de T2 (800 μg 17α-MT/L) de ovas claras, causado por una alta mortalidad en cada tratamiento, lo que pudo disminuir la competencia por alimento y aumentar la ganancia de peso y de talla.
Proporción fenotípica de sexo
Los resultados obtenidos en el presente trabajo para la variable reversión no presentaron diferencia significativa (p>0.05) entre las concentraciones 800 ug/L y 1200 ug/L de 17αMT con respecto a la concentración de 0ug/L de metil testosterona (MT), concordando con los resultados obtenidos por Fizpatrick et al. (1996) quienes concluyeron que la MetilTestosterona (MT) a concentraciones de 500 mg/L no tiene efecto masculinizante.
Otro factor que pudo haber afectado los porcentajes tan bajos de reversión, se puede atribuir al tipo de hormona utilizada pues Fizpatrick et al. (1996) reportan mayor porcentaje de reversión en la utilización de Metil dihidrotestosterona (MDHT) en concentraciones de 500 mg/L que con MT en iguales cantidades. Lo anterior se debe, a la conversión de MT a una forma menos activa o simplemente, a una mayor velocidad de degradación en el organismo, como lo afirman Piferret et al. (1993) al observar que MT no es un agente masculinizante tan potente como sí la MDHT, que es dos veces más potente, sin explicar las razones que pudiesen dar origen a ésto.
Los resultados de reversión sexual obtenidos en el presente trabajo, fueron similares a los obtenidos en ensayos similares (sin publicar) en la estación piscícola de la Universidad de Antioquia, quienes trabajaron con inmersión de ovas en solución con hormona 17α-metiltestosterona a concentraciones de 0, 1200, 1650 y 2100 ug/L agua, encontrándose proporciones de 47%, 63.79%; 58.23% y 52.87% de machos para las diferentes concentraciones hormonales, respectivamente, sin diferencias significativas entre estos (p>0.05). De otro lado, comparados con los obtenidos por Cagauan et al. (2004) en ovas de la especie Oreochromis niloticus sometidos a inmersión en una solución acuosa de 17α-metiltestosterona se observan que son muy bajos, ya que reportan valores de 91.09%, 89%, y 88% de machos obtenidos, utilizando concentraciones de 800 ugMT/L, 600 ugMT/L y 400 ugMT/L, respectivamente, durante 96 horas. La diferencia en cuanto a la proporción fenotípica de machos obtenida en el presente trabajo pudo deberse a que no hubo extrusión de ovas y semen para la fertilización. Las ovas fertilizadas se obtuvieron de cavidad bucal, sin conocerse las horas posfertilización de las ovas, disminuyéndose ostensiblemente el tiempo de contacto con la hormona, en especial para las ovas de color oscuro, lo que coincide con resultados de otros ensayos realizados en la estación piscícola (sin publicar).Esto en el caso particular de la tilapia y su bajo porcentaje de reversión, se puede deber a que el período de indiferenciación en la morfogénesis llega hasta los 15 días después de la eclosión (Hepher y Pruginin, 1991, Feist et al. 1995); mientras que en este experimento las ovas sólo se expusieron a la hormona hasta el momento de la eclosión, de acuerdo a lo sugerido por Cagauan et al. (2004); sin embargo, este autor, no hace una clara referencia a muchas condiciones metodológicas.
Otro factor que igualmente pudo haber influenciado los resultados obtenidos para esta variable, fue contar con ovas que provenían de varias hembras, lo que seguramente significó diferentes UTA, °C horas posfertilización, lo que permitiría pensar que sus procesos de división celular estarían en distintas etapas y su respuesta a esteroides sexuales fuese baja. Así mismo Hiott and Phelps (1993); Koger et al. (2000) y Fitzpatrick et al. (2009), reportan que la respuesta a los tratamientos hormonales puede ser distinta dependiendo de la etapa ontogénica en que se encuentren. Autores como Bambordelli et al. (2007), reportaron un porcentaje de 73.02% de machos en tilapia nilótica (Oreochromis niloticus); sugiriendo que la masculinización obtenida requiere la existencia de un periodo de máxima sensibilidad a las concentraciones hormonales a los 23.3 días poseclosión. La existencia de este periodo ontogénico de mayor sensibilidad a las concentraciones hormonales, ha sido verificado en diversas especies como salmón (Oncorhynchus kisutsh) (Goetz and Thomas, 1995; Piferrer y Donaldson, 1989), Dicentrarchus labrax (Blazquez et al. 1995), Oryzias latipes (Koger et al. 2000) o trucha arcoíris (Oncorhynchus mykiss) (Krisfalusi y Nagler, 2000).
El valor de un gramo de hormona 17α metiltestosterona es de $ 18.000

El alimento de 45% de proteína se suministro en la etapa de larva y el de 32% en la etapa de alevinaje.
El método de análisis de costos se realizó basado en las variables más influyentes en la investigación, tales como la hormona 17α-metiltestosterona y el alimento de los animales hasta la etapa de alevinaje, puesto que se utilizaron métodos de incubación artesanales, lo que hace que los costos de más influencia sean estos dos. Se puede observar (Tabla 5) cómo los costos son ostensiblemente menores para la reversión sexual por inmersión. Si bien, los resultados en la proporción sexual de machos logrados por inmersión no fueron satisfactorios para este método, la diferencia en costos con respecto al método tradicional, sugiere estandarizar la técnica para lograr además de los beneficios económicos y productivos, contribuir a la sostenibilidad ambiental (Tabla 5).
El bajo porcentaje de reversión sexual alcanzado pudo ser atribuído a las bajas concentraciones hormonales y al poco tiempo de inmersión a que fueron sometidas las ovas, puesto que el estadio de fertilización de las ovas (color claro u oscuro) no influyó en el resultado de la reversión, pero si en el porcentaje de eclosión, teniendo una alta relación con factores externos, principalmente la manipulación, así como la densidad, la depredación y los parámetros fisicoquímicos del agua entre otros. Se observó que los parámetros productivos como peso y longitud no se relacionaron con la concentración hormonal, ni con el color de la ova, pero sí con el sexo; lo que indica un desempeño propio para esta especie. La tecnología experimental de incubación de las ovas fue inconveniente para la recirculación, lo que afectó el porcentaje de eclosión. La técnica de reversión sexual por inmersión necesita ser más investigada, hasta lograr una estandarización hasta lograr mayores o iguales resultados de reversión que los alcanzados con la inclusión de la hormona en el alimento.
Para futuras investigaciones se requiere obtener las ovas y el semen por extrusión, dado que es uno de los factores altamente influyentes no sólo para el tiempo de contacto con la hormona, sino para la manipulación y así, no exponer las ovas a la separación por color, proceso dispendioso y estresante para la ova. Se propone que a futuro, las incubadoras sean forradas con material oscuro, para evitar la incidencia de luz directa sobre las ovas. La reversión sexual por inmersión requiere inversión en infraestructura y tecnología como laboratorio, filtros, motores para recirculación y otros. Se recomienda incluir como parámetro a evaluar la relación entre tamaño de la gónada y el sexo, para confirmar lo observado en este trabajo; donde las gónadas de mayor tamaño correspondían a hembras, considerando que no se reportan trabajos que den información al respecto.
Agradecimientos
Los autores expresan sus agradecimientos a todas las personas que colaboraron en la realización de este trabajo, en especial a Jaime Hernán Uribe Valencia, administrador de la Estación Piscícola de la Universidad de Antioquia, Juan Carlos Londoño administrador (e) y a los operarios Otoniel Franco, Diego Duque, Fabio Estrada y Herman Cano.
Referencias
1. Bambordelli RA, Sanches EA, Pinto DFH, Marcos RM, Barbero L. Idade de maior sensibilidade de tilápias-do-nilo aos tratamentos demasculinização por banhos de imersão. Rev Soc Bras Zootec 2007; 36:1-6. [ Links ]
2. Bart AN, Athauda AR, Fitzpatrick MS, Contreras-Sanchez WM. Ultrasound Enhanced Immersion Protocols for Masculinization of Nile Tilapia, Oreochrornis niloticus. J World Aquaculture Soc 2003; 34:210-216. [ Links ]
3. Blázquez M, Piferrer F, Zanuy S, Carrillo M, Donaldson EM. Development of sex control techniques for European sea bass (Diacentrarchus labrax L.) aquaculture: effects of dietary 17 α-metiltestosterone prior to sex differentiation. Aquaculture 1995; 135:329-342. [ Links ]
4. Cagauan AG, Baleta FN, Abucay JS. Sex reversal of nile tilapia, Oreochromis niloticus by egg immersion technique: the effect of hormone concentration and immersion time. Manila, (Filipinas); 2004. [ Links ]
5. Contreras-Sanchez WM, Fitzpatrick MS, Marquescouturier G, Schreck CB. Masculinization of Nile tilapia Oreochromis niloticus by immersion in synthetic androgens: timing and eficacy. CRSP Research Repot 1999; 236-239. [ Links ]
6. Feist, G, Yeoh CG, Fitzpatrick MS, Schreck CB. The production of functional sex-reversed male rainbow trout with 17a-methyltestosterone and 11b-hydroxyandrostenedione. Aquaculture 1995; 131:145-152. [ Links ]
7. Fitzpatrick MS, Schreck CB, Gale WL. Masculinization of Tilapia through Immersion in 17α-Methyltestosterone or 17α-Methyldihydrotestosterone. [Internet] CRSP Fourteenth Annual Technical Report [acceso 26 de Febrero de 2009]. [ Links ]
8. Goetz FW, Thomas P. (Eds.). Proceedings of the 5th International Symposium on the Reproductive Physiology of Fish. The University of Texas, Austin, Austin, Texas, USA, pp. 158.160. July2-8, 1995. [ Links ]
9. Guerrero RD. Use of androgens for the production of all-male tilapia aurea (Steindachner). Trans Am Fish Soc 1975; 104:342- 348. [ Links ]
10. Haniffa MA, Sridhar S, Nagarajan M. Hormonal manipulation of sex in stinging catfish Heteropneustes fossilis (Bloch). Current Scie Assoc 2004; 86:1012-1017. [ Links ]
11. Hepher B, Pruginin Y. Cultivo de peces comerciales. México. Editorial Limusa; p. 316, 1991. [ Links ]
12. Hiott AE, Phelps RP. Effects of initial age and size on Sex reversal of Oreochromis niloticus fry using methyltestosterone. Aquaculture 1993; 112: 301-308. [ Links ]
13. Holdrigde LR. Ecología basada en zonas de vida. 5a ed. San José (CR): IICA 1996; 216. [ Links ]
14. Koger CS, Teh SJ, Hinton DE. Determining the sensitive developmental stages of intersex induction in medaka (Oryzias latipes) exposed to 17 β.estradiol or testosterone. Mar Environ Res 2000; 50:201-206. [ Links ]
15. Krisfalusi M, Nagler JJ. Induction of gonadal intersex in genotypic male rainbow trout (Oncorhynchus mykiss) embryos following immersion in estradiol - 17β. Mol Reprod Dev 2000; 56:495-501. [ Links ]
16. Martínez Covaleda HJ, González Rodríguez FA. La cadena de la piscicultura en Colombia: una mirada global de su estructura y dinámica 1991-2005. Doc trab [Internet] 2005 diciembre; [acceso 29 de Abril de 2008]; (106). URL: http://www.agronet.gov.co/www/docs_agronet/2005112164315_caracterizacion_ piscicultura.pdf [ Links ]
17. Pandian TJ, Sheela SG. Hormonal induction of sex reversal in fish. Aquaculture 1995; 138:1-22. [ Links ]
18. Piferrer F, Donaldson EM. Gonadal differentiation in coho salmon, Oncorhynchus kisutch, after a single treatment with androgen or estrogen at different stages during ontogenesis. Aquaculture 1989; 77:251-262. [ Links ]
19. Piferrer F, Baker IJ, Donaldson EM. Effects of natural, synthetic, aromatizable, and nonaromatizable androgens in inducing male sex differentiation in genotypic female Chinook salmon (Oncorhynchus tshawytscha). Gen Comp Endocrinol 1993; 91:59-65. [ Links ]
20. Prieto CA, Olivera-Ángel M. Incubación artificial de huevos embrionados de tilapia roja Oreochromis spp. Rev Colomb Cienc Pecu 2002; 15:115-119. [ Links ]
21. Wassermann GJ, Bertolla-Afonso LO. Sex reversal in nile tilapia (Oreochromis niloticus linnaeus) by androgen immersion. Aquaculture Res 2003; 34:65-71. [ Links ]