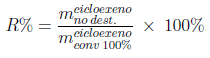Introdução
Reações de eliminação são uma das mais importantes e fundamentais classes de reações químicas. Basicamente, o mecanismo da eliminação compreende a saída de dois átomos ou grupos de átomos em uma molécula orgânica. Eliminações do tipo 1,2 fornecem ligações duplas, sendo uma ótima metodologia para a preparação de alcenos [1].
Quando um álcool é aquecido na presença de um ácido forte, ocorre a eliminação de água com formação de um alceno. Esta reação é conhecida como desidratação de álcoois. Quando tratados com ácidos, álcoois secundários e terciários geralmente eliminam água através de um mecanismo envolvendo a participação de um carbocátion como intermediário [2]. No caso da reação de um álcool primário como o ciclohexanol, tem-se a seguinte reação:
Esta reação deve acontecer na presença de ácido fosfórico ou ácido sulfúrico em temperaturas elevadas (90 - 120 0C). Dependendo de uma série de fatores (substrato, temperatura, condições reacionais) as reações de substituição nucleofílica também podem ocorrer no meio reacional, fornecendo éteres como sub-produtos.
A reação do ciclohexanol - que é considerado uma ferramenta para medir acidez e basicidade de óxidos metálicos - pode ser realizada empregando catalisadores após submetê-los a condições redutoras ou oxidantes. Gnanamani et al. [3] tem apresentado resultados da desidratação de 1,5-pentanodiol em catalisadores CeO2 e CeO2 modificados com MeOx e sugerem que, independentemente das condições de pré-tratamento, a acidez total se correlaciona com a atividade catalítica, mas que a seletividade para álcoois lineares varia dependendo da natureza do MeOx adicionado, bem como as condições de pré-tratamento do catalisador. No geral, MnOx e ZnO aceleram a conversão do ciclohexanol, e isso provavelmente está ligado à produção de sítios ácidos adicionais.
O estudo sobre a capacidade de desidratação dos catalisadores é muito investigada usando a desidratação de ciclohexanol como reação. Bezouhanova e Al-Zihari [4] observaram que o ciclohexanol pode sofrer desidratação para ciclohexeno em sítios ácidos de Brønsted; por outro lado, sítios básicos - neste caso, íons de oxigênio de rede - catalisam a desidrogenação que leva à ciclohexanona. Segundo Knözinger [5] e Gnanamani et al. [6], Os óxidos metálicos são conhecidos por catalisar reações de desidratação.
A formação de ciclohexeno é atribuída à adsorção de ciclohexanol em sítios ácidos médios. O trabalho de Prabhu et al. [7] mostrou que o Ce pode gerar sítios ácidos de Bronsted e assim o ciclohexanol pode ser convertido principalmente em éter diciclohexílico e ciclohexeno. Eles fizeram a desidratação em fase vapor do ciclohexanol sobre Ce-KIT-6 na faixa de 175 a 350 ºC com vazão de 3 mL/h. Verificaram que os produtos eram éter diciclohexílico e ciclohexeno. A conversão aumentou com o aumento da temperatura de 175 para 300 ºC, mas a 350 ºC observou-se cerca de 10 % de redução na conversão. A diminuição da conversão a 350 ºC é devido à formação de coque. A formação de coque na superfície do catalisador foi verificada fisicamente.
A atividade catalítica dos materiais Ce-KIT-6 foi avaliada na desidratação em fase vapor do ciclohexanol a ciclohexeno e éter diciclohexílico em diferentes temperaturas com várias razões molares Si/Ce. Ce-KIT-6 (25) apresentou maior atividade com 54 % de conversão de ciclohexanol e 64 % de seletividade ao ciclohexeno. Os resultados catalíticos indicaram que materiais mesoporosos Ce-KIT-6 podem ser usados como catalisadores ácidos versáteis e estáveis.
Hintermeier et al. [8] realizaram a desidratação de ciclohexanol, trans-2-metilciclohexanol, bem como isômeros cis e trans de 4-alquilciclohexanois que ocorreu predominantemente por meio de um caminho do tipo E1, enquanto a desidratação de cis-2-metilciclohexanol ocorreu principalmente por meio de um caminho do tipo E2. (Figura 1)
Recentemente, Milakovic et al. [9] observarma que a atividade catalítica para desidratação depende, em grande parte, diretamente da entalpia de transição. Essa dependência é tanto mais forte quanto menor for a entropia de transição. É independente se a desidratação ocorre de forma combinada ou gradual, ou seja, se segue um mecanismo E1 ou E2. Também é independente da ordem da reação e se ocorre dentro dos poros da zeólita ou na fase aquosa simples. As taxas dependem da localização do grupo OH do álcool, com os álcoois terciários apresentando a maior entropia de transição e os álcoois primários a mais baixa.
A síntese do ciclohexeno a partir da desidratação do ciclohexanol será investigada neste experimento. O procedimento escolhido para esta experiência envolve a catálise com ácido sulfúrico ou ácido fosfórico. A literatura tem informado que melhores resultados são obtidos quando o ácido fosfórico é empregado, pois o ácido sulfúrico provoca carbonização e formação de óxido de enxofre, além da possibilidade de fornecer produtos secundários através de reações de polimerização.
Quando uma mistura contendo ciclohexanol e o ácido é aquecida num recipiente equipado com coluna de fracionamento, ocorre a formação de água através da reação de eliminação. Água e ciclohexeno destilam pelo princípio da destilação em corrente de vapor. Um esquema da montagem pode ser ilustrado na Figura 2 a seguir,
Terminada a destilação, a coluna fica saturada com a mistura água + ciclohexeno que refluxa e não destila. Para auxiliar na destilação do produto desejado um outro solvente é adicionado e a destilação continua. Um solvente aconselhado é o xileno (P.E. = 140 oC). Quando seus vapores destilam, carregam o ciclohexeno mais volátil para fora da coluna. A diferença entre o ponto de ebulição do ciclohexeno e do xileno é suficiente para uma separação adequada. É importante notar que a não utilização de um solvente carregador acarreta em um decréscimo considerável no rendimento.
Neste trabalho será realizada a reação de desidratação à quente observando-se a influência do tempo reacional no rendimento e a temperatura de reação. As observações a respeito das características de “não-destilar” e menor rendimento devido o não uso de solventes adicionais devem ser verificadas experimentalmente.
Metodologia experimental
A reação de desidratação será realizada com o ciclohexanol, marca: Synth com 99,9 % de pureza na presença de ácido fosfórico da marca Reagen, com 99,55 de pureza. Em balança semi-analitica (Marca- Modelo, ±0,01 g) serão pesados cerca de 20,00 g de ciclohexanol e 4,00 - 5,00 g de ácido fosfórico concentrado, em um balão de fundo redondo de 200 mL. Adiciona-se alguns fragmentos de porcelana porosa (ou pérolas de vidro) visando quebrar as bolhas durante a ebulição dos fluidos. Ajusta-se o balão a um sistema para destilação fracionada, inicia-se o aquecimento, lingando a manta aquecedora. A Figura 3 é uma foto que representa o equipamento.

Figura 3 Foto do equipamento experimental empregado na obtenção dos dados experimentais. (Foto do autor)
A temperatura deve ser controlada efetuando-se leituras no termômetro (±0,1 °C) fixado na extremidade superior da coluna de forma que não exceda a 95 °C. A chave da manta aquecedora (Fisatom) será mantida entre 1 e 2 para não permitir que haja superaquecimento durante o processo reacional. O tempo de reação deverá ser cronometrado e deve ficar entre 20 e 60 min de forma que possa ser verificada sua influência no rendimento de ciclohexeno. A Figura 4 mostra a mistura em ebulição.
O frasco coletor de destilado, por precaução, deve ser mergulhado num banho de gelo para impedir perdas por evaporação. A água de resfriamento do condensador foi alimentada a 10 °C. A destilação é finalizada de acordo com o tempo que se deseja que deve ser menor que 60 min ou quando restar apenas um pouco de resíduo a ser destilado. Deixa-se que o sistema esfrie um pouco para iniciar a desmontagem. Em seguida, pesa-se o destilado e o transfere para um pequeno funil de separação, como pode ser visto na Figura 5. Pesa-se, também o resíduo reacional que ficou no balão de destilação.

Figura 5 Foto em que se pode identificar as fases superior e inferior quando o conteúdo reacional do balão é tratado com salmora ao final da reação.
Procedimentos adicionais: Caso deseje, sature o destilado com cloreto de sódio, adicione 2 mL de carbonato de sódio a 5 % (para neutralizar traços de ácido livre) e agite. Despeje o ciclohexeno bruto pela boca do funil para o interior de um erlenmeyer, adicione 3 - 4 g de cloreto de cálcio anidro (ou sulfato de sódio), agite por 2 - 3 min e deixe em repouso por 15 minutos com agitação ocasional. Filtre para um balão de destilação de 25 - 50 mL, adicione fragmentos de porcelana porosa e destile o ciclohexeno, utilizando novamente um sistema para destilação fracionada. Colete a fração de P.E. = 81 - 83 °C.
Neste trabalho, a quantidade de ciclohexeno obtida será calculada através da estequiometria da reação levando-se em conta que a massa de destilado pesada ao final do experimento, contém o orgânico e água.
A literatura tem incentivado o experimentador a realizar algumas reações de caracterização do produto obtido. Dessa forma é apresentada uma sequência que pode ser realizada visando identificar a presença de ciclohexeno na mistura ou destilado final.
Agite 0,5 mL de ciclohexeno com 1 mL de água de bromo e registre o resultado.
Adicione 1 - 2 mL de solução de bromo em tetracloreto de carbono a 0,5 mL de ciclohexeno. Observe se há desprendimento de gás bromídrico.
Adicione 0,5 mL de ciclohexeno a 1 mL de solução de permanganato de potássio a 5 % e 0,5 mL de ácido sulfúrico diluído e agite. Se o meio reacional descorar, adicione pequenas quantidades a mais da solução oxidante.
Adicione cautelosamente 0,5 mL de ciclohexeno a 1 mL de ácido sulfúrico concentrado. Agite suavemente. Observe se ocorre alguma mudança na cor ou na temperatura.
Resultados e discussões
Os experimentos iniciais foram realizados e os resultados estão apresentados na Tabela 1. Durante a realização dos experimentos observou-se que o destilado, realmente, não foi coletado no bécher mergulhado no gelo. Dessa forma, após o resfriamento do sistema, desconectava-se o condensador e cuidadosamente, coleta-se o destilado em um recipiente para se efetuar a pesagem. Notou-se que é fundamental a ventilação do laboratório e o uso de máscara anti-vapores pois o odor de ciclohexeno é marcante.
Tabela 1 Resultados com o experimento de reação do ciclohexanol na presença de ácido fosfórico.
| n° | C6H12O m inicial | C6H12O m final | Teb oC | t ferv min | V ac fosf mL |
|---|---|---|---|---|---|
| 1 | 20,53 | 18,65 | 83 | 20 | 5,0 |
| 2 | 21,65 | 8,83 | 85 | 35 | 4,0 |
| 3 | 23,01 | 21,00 | 82 | 35 | 4,3 |
| 4 | 19,78 | 21,03 | 78 | 40 | 5,0 |
Na Tabela 1 pode-se conferir a massa de ciclohexanol
 usada inicialmente e remanescente ao final do experimento. O tempo de experimento (t
ferv
) em min, a temperatura de ebulição média (T
eb
) em que se deu a reação e o volume de ácido fosfórico usado (V
ac fosf
). A massa de destilado que continha o ciclohexeno foi calculada por diferença.
usada inicialmente e remanescente ao final do experimento. O tempo de experimento (t
ferv
) em min, a temperatura de ebulição média (T
eb
) em que se deu a reação e o volume de ácido fosfórico usado (V
ac fosf
). A massa de destilado que continha o ciclohexeno foi calculada por diferença.
De acordo com os dados da Tabela 1 e a reação estequiométrica de desidratação pode-se calcular a massa de ciclohexeno obtida no destilado. A Tabela 2 contém os resultados em que o rendimento da reação (R%) é calculado pela Equação 2,
Em que: mcicloexeno no dest. é a massa de ciclohexeno no destilado e mcicloexeno conv 100% é a massa de ciclohexeno se todo o ciclohexanol reagisse.
Tabela 2 Resultados do rendimento com o experimento de reação do ciclohexanol na presença de ácido fosfórico.
| n° | destilado m total | C6H10 m no dest | C6H10 m conv 100% | R% |
|---|---|---|---|---|
| 1 | 1,88 | 1,5416 | 16,83 | 9,16 |
| 2 | 2,82 | 2,3124 | 17,75 | 13,0 |
| 3 | 2,01 | 1,6482 | 18,87 | 8,74 |
| 4 | 1,25 | 1,0300 | 16,20 | 6,40 |
O rendimento da reação, em cada experimento realizado, foi calculado tomando por base a massa de produto coletada que continha o ciclohexeno mais água formada. Os valores obtidos estão mostrados na Tabela 2. A temperatura em ocorre o experimento parece ser fator importante para uma melhor, e maior, conversão em ciclohexeno. Temperaturas mais altas favorecem melhores rendimentos em alceno na desidratação do ciclohexanol. A comparação com as informações da literatura mostra e confirma que, realmente, no experimento, ocorre a retenção de ciclohexeno no vaso de destilação que deveria ser arrastado com a adição de um solvente. O cheiro do cicloexeno formado é característico e pode ser identificado facilmente. Em termos de quantidade de produto formado, por ser muito pequena, foi possível identificar o cicloexeno fazendo-se o seguinte: Adicionou-se cerca de 1 - 2 mL de solução de bromo em tetracloreto de carbono a 0,5 mL de cicloexeno. Observou-se que há desprendimento de gás bromídrico (coloração marrom claro).
Conclusão
O experimento atingiu os objetivos propostos onde pode ser verificado que o produto final realmente fica retido no condensador de destilação, identificado pelo odor, e deve ser removido com cuidado para que não haja perdas na pesagem. Em adição, na presença de tetracloreto de carbono, o produto libera gás bromídrico de cor marrom. Ademais, verificou-se, como esperado, um baixo rendimento de ciclohexeno devido a não adição de um solvente auxiliar ao processo. Finalmente, percebeu-se que aumentando a temperatura de reação há um acréscimo razoável de alceno no produto.