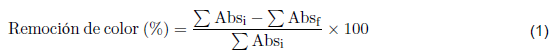Introducción
Dado el uso intensivo de sustancias inorgánicas de carácter ácido y básico en las etapas de desengrasado y decapado y la consecuente producción de grandes cantidades de aguas residuales contaminadas con metales pesados, la industria de galvanoplastia es catalogada como una de las más peligrosas en cuanto a la composición de sus efluentes y posibles impactos negativos tanto al ambiente como a los seres vivos en general [1]. Específicamente, metales pesados como Cr (III y VI), Ni (II), Zn (II) y Fe (II) son utilizados en esta industria para producir recubrimientos superficiales en placas y protegerlas de la corrosión [2]. De acuerdo con datos reportados en la literatura (Tabla 1), cantidades significativas de estos contaminantes son vertidas directamente a fuentes hídricas, afectando el pH del agua y generando impactos negativos en la flora, la fauna y la salud humana [3]. Además, a diferencia de la mayoría de contaminantes orgánicos, los metales pesados no son biodegradables y se acumulan en los organismos vivos causando efectos carcinogénicos, mutagénicos y teratogénicos [4].
Tabla 1 Datos de metales pesados encontrados en efluentes y residuos de la industria de galvanoplastia.
| Metal | Concentración de Metal (mg/L) Referencias | |||||||
|---|---|---|---|---|---|---|---|---|
| Actual | [5] | [6] | [7] | [8] | [9] | [10]* | [11] | |
| Zn | 18,73 | 972,3 | - | - | 50,6 | 119,5 | 105 000 | - |
| Ni | 10,1 | - | 87,8 -121 | 183 | 1,96 | - | 17 300 | 547,2 |
| Fe | 11,2 | - | - | - | - | - | 42 400 | 2,19 |
| Cu | 36,7 | 1499,4 | - | 46 | 9,63 | 8,35 | 7 700 | 12,7 |
| Cr | 0,44 | 3965,3 | - | 87 | - | 5,7 | 19 200 | 6,15 |
*Datos encontrados en un lodo.
El anterior contexto ha conllevado a que se exploren diferentes tecnologías para remover dichos contaminantes, de las cuales la más utilizada consiste en la implementación de técnicas de adsorción con carbón activado comercial; debido a su estructura porosa, su elevada área superficial, estabilidad química y alta capacidad de adsorción [12]. Sin embargo, el uso de este material tiene algunos inconvenientes como su elevado costo de producción y su procedencia a partir de materias primas fósiles como el carbón, la brea de petróleo y la resina fenólica [13]. Con el fin de disminuir el uso de fuentes no renovables en la obtención de carbón activado comercial, amortiguar su alto costo, y buscar procesos que sean amigables con el ambiente, en las últimas décadas se han propuesto diversas metodologías de síntesis para el desarrollado de numerosos bioadsorbentes a partir de una gran variedad de residuos agroindustriales [14]. La eficiencia de los procesos de adsorción depende de varios factores, entre los cuales se resalta el tipo, cantidad, composición superficial y características fisicoquímicas del adsorbente; la naturaleza química y concentración del adsorbato; las condiciones del proceso de adsorción como el pH del medio, la temperatura y los tiempos de residencia; entre otros [15]. De esta manera, cada día son más numerosas las investigaciones orientadas a obtener un "mejor adsorbente" que logre remociones significativas de diferentes metales pesados, para lo cual se han implementado varios métodos fisicoquímicos, basados en el montaje de sistemas complejos y tiempos prolongados de síntesis, el uso de reactivos químicos costosos, peligrosos y difíciles de encontrar en el mercado [16] o la aplicación de métodos emergentes como ultrasonido,microondas y plasma [17], complicados de implementar a gran escala. Estos procesos desvirtúan la argumentación inicial de buscar alternativas más económicas, simples y ambientalistas, convirtiéndose en una forma diferente de hacer las cosas, pero con otras desventajas que a la fecha continúan sin resolverse.
Por otra parte, en la mayoría de los estudios realizados se utilizan soluciones ideales o aguas residuales industriales sintéticas con un único contaminante, en las cuales las condiciones evaluadas se alejan completamente de la realidad por lo que la información sobre la aplicación práctica de estos adsorbentes en aguas residuales reales es todavía limitada [18,19]. Por lo tanto, el uso de aguas residuales reales en estudios de adsorción continúa siendo un reto, debido a su compleja composición y a la variación de este tipo de efluentes [20]. La obtención de bioadsorbentes a partir de residuos agroindustriales, mediante procesos simples, económicos y ambientalmente amigables y comparables con los usados actualmente a nivel comercial para la remoción de diferentes contaminantes continúa siendo un desafío para los investigadores.
En Colombia existen grandes oportunidades de producción agroindustrial a razón de la fertilidad que caracteriza los suelos en las diversas regiones del país. Una de las industrias más reconocidas y fortalecidas a lo largo de los años es la industria bananera, la cual tiene cobertura de 22 departamentos en sus 204 municipios, de los cuales se destacan principalmente Valle del Cauca, Quindío, Antioquia, Cundinamarca, Huila, Chocó y Nariño por su cantidad de producción. El creciente aumento y desarrollo de este sector industrial ha traído consigo grandes problemáticas socioambientales como lo es la generación de altas cantidades de residuos sólidos orgánicos, esto principalmente debido a la morfología de la planta; la cual se divide en rizomas cortos, de los cuales crece un tallo de tamaño significativo y un racimo de fruto comestible. Así, luego de que el racimo de fruto comestible se desprende del tallo para ser comercializado, el resto de la planta se convierte en un residuo de volumen bastante pronunciado. Además, de la totalidad en masa del fruto comestible solo el 20 o 30 % es usado y el resto es desechado [21,22].
En la presente investigación se propone una solución simultánea para estas dos problemáticas abordadas, haciendo un aprovechamiento integral de los residuos de la industria bananera para usarlos en la preparación de adsorbentes mediante tratamientos físicos simples y económicos, a partir tanto de pseudotallo como de cáscaras de banano, y evaluar su desempeño en la remoción de metales pesados tóxicos presentes en ARnD de la industria de galvanoplastia. Para esto, se realizaron pruebas de adsorción usando un ARnD real, lo que permitió determinar porcentajes de remoción de metales pesados, bajo las condiciones reales y fenómenos de competencia e interacción con otros contaminantes presentes en la matriz, lo cual difiere de la mayoría de los estudios reportados en la literatura, realizados con soluciones ideales o simuladas. Adicionalmente, la eficiencia de los bioadsorbentes obtenidos se compararon con la capacidad de adsorción de un carbón activado comercial en condiciones de proceso similares.
Metodología
Obtención de los diferentes tipos de biomasa seca en polvo
Se recolectaron pseudotallos de plantas de banano de la especie Crash Michael cosechados en un cultivo en el municipio de Girardota, Antioquia, se cortaron en rodajas y se secaron al sol durante 24 h eliminando parcialmente la humedad del material. Posteriormente, se secaron en un horno por convección a 100 °C durante 72 h para eliminar el agua restante. El material seco, se cortó en trozos de alrededor de 1 cm de longitud, se molió en un molino de cuchillas y Analmente se codificó como BPT. Para la obtención de la biomasa en polvo a partir de las cáscaras de banano de misma especie Crash Michael, se despulpó la fruta de desecho suministrada por la Asociación Gremial Asohofrucol ubicada en Itagüí, Colombia. Las cáscaras se lavaron con agua desionizada para remover impurezas, se trozaron con tamaños de aproximadamente 2 cm y se llevaron a secado durante 24 h a 80 °C en un horno por convección para Analmente molerse en un molino de cuchillas y codificarse como BCB. Ambos materiales, se tamizaron a través de una malla ASTM 80 con el fin de obtener la biomasa seca en polvo con un tamaño de partícula homogéneo (Figura 1). Además, durante todo el proceso se realizaron los pesajes correspondientes para calcular los rendimientos hacia la biomasa en polvo obtenida. El carbón activado comercial (CAC) tipo Darco 20 x 40 y producido por Norit (Norit Americas Inc.) fue seleccionado para las comparaciones de adsorción de los metales con los bioadsorbentes preparados en este estudio.
Jornada de muestreo y aforo del ARnD
El efluente proveniente de la industria de galvanoplastia se obtuvo de una empresa ubicada en la ciudad de Medellín. Para recolectarlo se realizó una jornada de aforo y un plan de muestreo, esto con el fin de obtener una muestra compuesta representativa, además, todas las muestras fueron conservadas y vigiladas de manera adecuada para garantizar la integridad en la cadena de custodia de las mismas. La jornada de muestreo consistió en tomar un volumen de muestras de 2 L de ARnD cada media hora por 6 h, midiendo parámetros fisicoquímicos in situ como temperatura, pH, color, turbiedad y conductividad. Se analizaron parámetros ex situ como DQO, DBO5, COT y los metales pesados de interés. Todos los muestreos y la caracterización fisicoquímica se realizaron siguiendo los Métodos Estándar de Examen de Aguas Superficiales y Aguas Residuales (Tabla 2).
Tabla 2 Caracterización fisicoquímica del ARnD real cruda.
| Parámetro | Método | Valor | LMP [29] |
|---|---|---|---|
| pH (U de pH) | AWWA-4500H+ | 3,65 | 6 - 9 |
| Temperatura (°C) | AWWA-4500H+ | 22,5 | - |
| Conductividad (μS/cm) | AWWA-2510B | 20,1 | - |
| Turbiedad (UNT) | AWWA-2130B | 97,3 | - |
| Color (UPC) | AWWA-2120 | 500 | - |
| Sólidos Totales (mg/L) | AWWA-2540B | 1 180 | - |
| Sólidos Suspendidos Totales (mg/L) | AWWA-2540E | 122,22 | 50 |
| Sólidos Disueltos Totales (mg/L) | AWWA-2540C | 955 | - |
| DQO (mgO2/L) | AWWA-4500 C | 360 | 250 |
| DBO5 (mgO2/L) | AWWA-5210B | 10,6 | 100 |
| COT (mg/L) | AWWA-5310B | 94,6 | - |
| Zn Total (mg Zn/L) | AWWA-3500 Zn B | 18,73 | 3,00 |
| Ni Total (mg Ni/L) | AWWA-3500 Ni B | 10,1 | 0,50 |
| Fe Total (mg Fe/L) | AWWA-3500 Fe B | 11,2 | 3,00 |
| Cu Total (mg Cu/L) | AWWA-3500 Cu B | 36,7 | 1,00 |
| Cr Total (mg Cr/L) | AWWA-3500-Cr B | 0,44 | 0,5 |
Para determinar las concentraciones y llevar un seguimiento a los metales de estudio antes y después del proceso de adsorción en el ARnD real, se utilizó un espectrofotómetro de absorción atómica, con llama aire-acetileno-óxido nitroso, marca Agilent, 240 FS. Inicialmente se optimizaron los parámetros de desempeño del equipo para la determinación de cada metal. Una vez establecidas estas condiciones, se prepararon 6 estándares en donde cada uno contenía los 5 metales (Fe, Cu, Ni, Zn y Cr) para obtener las curvas de calibración. Durante estos análisis se tomaron las debidas precauciones para eliminar o disminuir la presencia de interferencias en la técnica instrumental de absorción atómica de llama, donde se detectaron algunos aspectos que podían generar una variabilidad en los datos experimentales. A modo de ejemplos, la presencia de sulfatos en este tipo de efluentes afecta la medición de hierro [23], las altas relaciones de Zn/Cu afectan los datos de Cu, la presencia de sólidos disueltos interfiere en la obtención de datos exactos de Zn, la existencia de elementos como Fe, Co y Cr en solución afectan la medición de Ni y algunos elementos como Co, Fe, Cu, Ba, Al, Ca y Ni pueden impactar de manera negativa la cuantificación de Cr [24].
Caracterización fisicoquímica de las biomasas
Los diferentes tipos de biomasa seca en polvo obtenidas y el carbón activado comercial evaluado, se caracterizaron por difracción de rayos X (DRX) usando un difractómetro Bruker (D-8) con una fuente de radiación Ka del Cu con filtro de Ni a 40 kV y 40 mA y una longitud de onda igual a 1,54 Å. Las propiedades texturales se determinaron en un equipo marca Micromertics (Asap 2020) mediante isotermas de adsorción-desorción de N2, del bioadsorbente se hizo a 75,2 K. Los espectros Infrarrojo por transformada de Fourier con Reflectancia Total Atenuada (FTIR/ATR) se obtuvieron en un espectrofotómetro IR Shimadzu (IRAffinity-IS). El punto isoeléctrico o punto de carga cero (pzc) de las biomasas se determinó por titulación de masas, encontrando el valor asintótico del pH de una suspensión del bioadsorbente/agua a medida que aumenta el contenido de masa. Finalmente, se determinó la concentración de grupos superficiales fenólicos, carboxílicos y lactónicos por el método de Boehm mediante titulaciones potenciométricas con soluciones estandarizadas 0,05 M de NaOH, Na2CO2 y NaHCO3.
Procesos de adsorción
Los procesos de adsorción se llevaron a cabo con 200 mL del ARnD real cruda en matraces de 250 mL, con un agitador de baño isotérmico (Autoshaking LABWIT ZWY-100H) a 200 rpm durante 2 h a temperatura ambiente y pH igual a 3,65. Se realizaron pruebas preliminares para determinar el equilibrio de adsorción y se varió la cantidad de los adsorbentes entre 1- 5 mg. Adicional a la cuantificación de la concentración de los metales pesados antes y después de la adsorción, también se llevó a cabo un seguimiento de decoloración del ARnD usando un equipo GENESYS 10S UV-vis a partir de las lecturas de absorbancia en el rango de longitud de onda entre 270 - 800 nm. La eliminación del color en el ARnD se calculó utilizando la ecuación (1). Donde Abs j y Abs f son la absorbancia inicial y la absorbancia final a las 2 h, respectivamente.
Resultados
Caracterización fisicoquímica del ARnD real cruda
En la Tabla 2 se describen los resultados de la caracterización fisicoquímica del ARnD real cruda. Los valores obtenidos para la DQO, el pH y los sólidos suspendidos totales son menores que los reportados en la literatura para aguas residuales de la misma naturaleza [20], no obstante, estos valores superan el Límite Máximo Permisible (LMP) establecido en la normatividad colombiana. Parámetros como la conductividad, turbiedad, color, sólidos totales y sólidos totales disueltos, no son contemplados en la normatividad colombiana para ser controlados en este tipo de efluentes, además sus valores son significativamente menores que los reportados en la literatura para otros efluentes similares [25]. El valor obtenido para la DQO supera el LMP establecido en la normatividad colombiana, mientras que la DBO5 se encuentra por debajo del LMP. Sin embargo, los valores para ambos parámetros son muy inferiores a los reportados en la bibliografía para este tipo de aguas [30] polyhydroxylbutyrate (PHB). En cuanto al COT, no se encontraron datos en la literatura consultada, además, este parámetro no se contempla en la normatividad colombiana citada.
El índice de biodegradabilidad calculado (tomado como la relación DBO5/DQO) fue de 0,029, lo que indica la presencia de materia mayoritariamente inorgánica difícil de biodegradar, lo cual en este caso corresponderá principalmente a sales de metales pesados. Por el contrario, el valor alto obtenido para la relación DQO/COT (3,80) indica un bajo contenido de compuestos orgánicos y de naturaleza biodegradable [28]. Adicionalmente, la concentración analizada para los diferentes metales pesados identificados (Zn, Ni, Fe, Cu excepto el Cr) supera los límites máximos permisibles establecidos en la normatividad colombiana citada. De acuerdo con los datos encontrados en la bibliografía consultada en cuanto a la caracterización fisicoquímica de este tipo de efluentes (Tabla 2), se puede observar una gran variedad de metales pesados, algunos de ellos iguales a los identificados en el presente estudio, sin embargo el amplio rango de composición de los mismos dificulta hacer una comparación entre ellos. No obstante, como se puede observar claramente en la Tabla 2, en la mayoría de los casos las concentraciones encontradas en el presente estudio son sustancialmente menores a las reportadas en la literatura.
Caracterización fisicoquímica de las biomasas
En la Tabla 3 se indican los valores para los parámetros fisicoquímicos analizados en las biomasas secas en polvo obtenidas y el carbón activado comercial usado como material de comparación. Los rendimientos obtenidos para la biomasa seca en polvo del pseudotallo y de las cáscaras de banano están acordes a la literatura, ya que ellos reportan valores entre (8 - 30) % y (40 - 90) %, respectivamente [30,31]. Tanto para la biomasa BCB como para la BPT se observaron áreas BET bastante pequeñas (< 3 m2/g) en comparación con la del carbón activado comercial seleccionado para realizar las confrontaciones, lo cual inicialmente sugeriría la necesidad de someter estos materiales a tratamientos fisicoquímicos adicionales y más complejos para incrementar este valor. No obstante, las áreas superficiales de los adsorbentes obtenidos se encuentran dentro del rango publicado para las biomasas obtenidas a partir de este tipo de residuos agroindustriales [32]. Además, se observa que hay similitudes en las propiedades texturales de los biomateriales sintetizados (BCB y BPT), donde las diferencias incluso en los valores de la superficie específica están dentro del error experimental de la técnica (± 20 m2/g). Sin embargo, se destaca que el área de superficie de CAC fue ~ 259 veces mayor en comparación con BCB y BPT.
Tabla 3 Caracterización fisicoquímica de las biomasas secas en polvo.
| Parámetro Fisicoquímico | Valores | ||
|---|---|---|---|
| BCB | BPT | CAC | |
| Rendimiento (%) | 78,24 | 29,5 | - |
| Área superficial BET (m2/g) | 2,30 | 2,72 | 650 |
| Volumen de poro (cm3/g) | 0,002 | 0,004 | 0,940 |
| Diámetro de poro (nm) | 5,8 | 9,0 | 41,1 |
| Punto isoeléctrico | 7,70 | 6,90 | 7,20 |
| Carboxílicos (mmol/g) | 0 | 47,0 | 0 |
| Lactónicos (mmol/g) | 0 | 656,1 | 0 |
| Fenólicos (mmol/g) | 3 775,3 | 163,7 | 359,1 |
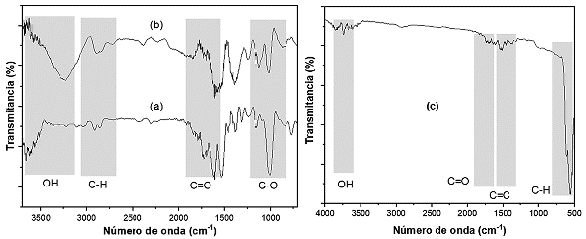
Los patrones de DRX de BCB y BPT mostrados en la Figura(2ay2b) reflejan el aspecto amorfo de los materiales debido a la hemicelulosa y la lignina de la cáscara y pseudotallo de banano [36]. Además, se identificó la presencia de picos cristalinos a 17,4°, 22,1°, 27,8° y 40° indicando la naturaleza cristalina del material celulósico los cuales concuerdan con los estudios realizados hacia este tipo de materiales [34,35]. Por su parte, en el difractograma del carbón activado comercial (Figura 2c) se detectaron dos picos en 28 igual a 26° y 54° los cuales son representativos para un carbón grafítico y comparables con lo reportado en la literatura [36].
Existen diferentes fenómenos o mecanismos que buscan explicar la forma en la cual se adhiere el adsorbato al adsorbente, entre los cuales se resalta la interacción electrostática (atracción o repulsión), el intercambio iónico, la precipitación y la adsorción física, entre otros. Esto dependerá tanto de la composición superficial del material como de la naturaleza química del adsorbato. El conocimiento del punto isoeléctrico y del tipo y cantidad de grupos funcionales presentes en el material, permite dilucidar los fenómenos más predominantes en el proceso de adsorción. De esta manera, la composición superficial de los adsorbentes se estudió por titulación de masas, método de Boehm y espectrofotometría de infrarrojo. Así, el punto isoeléctrico encontrado para los materiales fue 7,70, 6,90 y 7,20 para BCB, BPT y CAC, respectivamente, valores cercanos a la neutralidad. Estos valores se encuentran dentro de los intervalos reportados en la literatura [37,38]. A valores de pH de la solución inferiores al punto isoeléctrico, se favorece la adsorción de especies aniónicas ya que la superficie del material está cargada positivamente, sin embargo, de acuerdo con los diagramas de especiación obtenidos para los metales analizados, se observa que los mismos se encuentran predominantemente en su forma catiónica de menor valencia (Fe2+, Cu2+, Ni2+, Cr3+ y Zn2+). De acuerdo con el valor del pH del agua residual (3,65), se esperaría que hubiese un proceso de repulsión electrostática, lo que sugiere que existen otros fenómenos que prevalecen en la remoción de los metales.
De acuerdo con los resultados obtenidos por el método de Boehm (Tabla 3) y DRIFT (Tabla 4 y Figura 3), los grupos funcionales predominantes en los materiales son O-H, C=O y C-O los cuales posiblemente están asociados a los grupos carboxílicos, lactónicos y fenólicos, y son los responsables de la adsorción de los metales principalmente por intercambio iónico y complejación. En cuanto a los grupos ácidos de la superficie de los materiales, no se identificaron grupos superficiales carboxílicos y lactónicos para los materiales CAC y BCB. Por su parte, BPT presenta valores de 47,0 mmol/g, 656,1 mmol/g y 163,7 mmol/g hacia carboxílicos, lactónicos y fenólicos, respectivamente. Como se puede verificar en la Tabla 3 la cantidad de grupos fenólicos es mayor para el material BCB (3 775,3 mmol/g), seguido del CAC (359,1 mmol/g) y por último BPT (163,7 mmol/g).
Tabla 4 Bandas y grupos funcionales característicos de cada material.
| Tipo de adsorbente | Número de onda (cm-1) | Identificación | Referencia |
|---|---|---|---|
| BCB y BPT |
3 500 - 3100 3000-2700 1729 1589, 1371 y 1249 1064 |
Estiramiento O-H (Celulosa) Celulosa, pectina, agua, hemicelulosa y lignina Estiramiento carbonilo C=O Esqueleto aromático y hemicelulosa Estiramiento C- O |
[39,40] |
| CAC |
750 - 500 1700 - 1400 3750 |
Vibración enlace C-H Tensión C=C y C=O Estiramiento O-H |
[41,42] |
En la Tabla 5 se detalla el máximo porcentaje de remoción de color alcanzado con los diferentes adsorbentes. Además, también se indican los máximos porcentajes de remoción y la capacidad de adsorción para cada metal de los diferentes adsorbentes. Estos valores se alcanzaron con la mayor cantidad de adsorbente (5 mg). Es importante destacar que estos datos son valores promedios obtenidos de diferentes réplicas, para lo cual se seleccionaron algunos experimentos puntuales al azar para confirmar los resultados obtenidos, los cuales fueron similares entre sí para los metales Cu, Zn, Cr y Ni con coeficientes de varianza (CV) menores al 7 %, indicando una baja dispersión y una alta uniformidad en los datos analizados [43]. Por el contrario, los datos de porcentaje de remoción hacia el Fe muestran un CV del 51 %, dato que corrobora la variación o poca uniformidad en los porcentajes de remoción hacia cada material. En cuanto al porcentaje de remoción de color se observa que el adsorbente BCB tiene menor capacidad para la remoción del color verdadero. Por el contrario, con los adsorbentes BPT y CAC se logran porcentajes de remoción cercanos al 90 %>.
Tabla 5 Máximos porcentajes de remoción de los metales pesados.
| Remoción de color (%) | Metal | Máxima Remoción de Metal (%) | Máxima Capacidad de Adsorción (mg metal/g ads.) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| BCB | BPT | CAC | BCB | BPT | CAC | BCB | BPT | CAC | |
| Fe | 42,69 | 17,79 | 20,05 | 191,25 | 76,47 | 67,24 | |||
| Ni | 75,13 | 78,08 | 83,10 | 302,62 | 312,53 | 334,73 | |||
| 46,60 | 92,42 | 88,28 | Cu | 94,40 | 94,57 | 95,17 | 1385,79 | 1386,53 | 1397,1 |
| Zn | 81,90 | 80,20 | 80,81 | 599,88 | 600,63 | 605,43 | |||
| Cr | 89,43 | 99,75 | 99,82 | 15,51 | 17,56 | 17,57 | |||
En las Figuras 4a-4e,4f-4jy4k-4o se muestran los porcentajes de remoción para los metales con las diferentes cantidades de adsorbente en función del tiempo para los materiales BCB, BPT y CAC, respectivamente. En todas las figuras se observa que el equilibrio de adsorción se alcanzó en aproximadamente 3 min, permaneciendo constante a partir de este tiempo debido a la saturación superficial de los materiales. Los cortos tiempos de adsorción para alcanzar el equilibrio encontrados en el presente trabajo, concuerdan con los hallazgos reportados por Thokkanen y colaboradores, quienes encontraron tiempos de equilibrio a 15 min o menores en matrices con más de 2 analitos [44]. Esto se debe principalmente a los fenómenos de competencia que se pueden presentar entre los diferentes metales por sitios de adsorción de naturaleza similar.
En cuanto a los porcentajes de remoción para los diferentes metales, se observó un comportamiento similar para los materiales BCB y BPT. Esto posiblemente se deba a que las características fisicoquímicas de ambos adsorbentes son semejantes entre sí. Los tres adsorbentes mostraron una menor afinidad para la remoción del Fe, mientras que la remoción para el Cu, Ni, Cr y Zn son muy similares entre sí y cercanos al 100 %>. En este caso es claro que la cantidad de Fe adsorbido no depende específicamente del área superficial disponible en los materiales, lo que indica la posibilidad de una relación entre la naturaleza de los sitios "funcionalizados" y la interacción entre dichos sitios y el Fe. Así se puede observar que la concentración total de grupos carboxílicos, fenolícios y lactónicos para cada material es proporcional al porcentaje de remoción alcanzado para el Fe con cada material. Lo anterior permite inferir que al contener el material BCB mayor cantidad de grupos superficiales ácidos en comparación con los demás adsorbentes estudiados, los adsorbatos como el hierro presentan una mayor afinidad con este material lo cual podría ser una explicación del porcentaje de remoción hacia este elemento. También, se puede confirmar a través de los espectros IR de BCB y BPT los grupos hidroxilos presentes en los grupos fenólicos de la lignina [45]. No obstante, algunos estudios reportan valores menores a los obtenidos en esta investigación hacia los grupos fenólicos [46,47]. Igualmente, el CAC presenta valores muy por encima para los grupos fenólicos los cuales son reportados en la literatura [48,49].
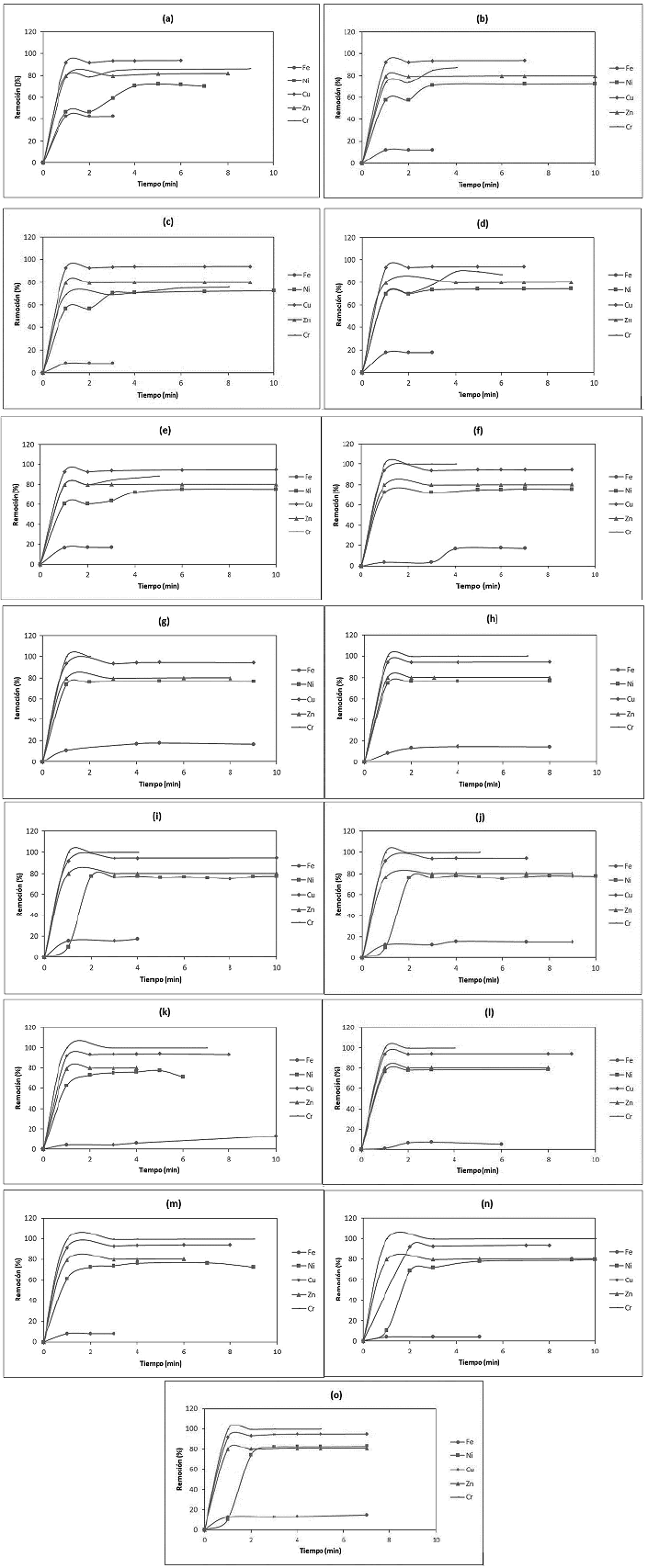
Figura 4 Adsorción de metales pesados usando BCB (a - e) (1 - 5 mg), BPT (f - j) (1 - 5 mg) y CAC (k - o) (1 - 5 mg).
Aunque existe una diferencia significativa entre el área superficial del carbón activado comercial evaluado y los dos bioadsorbentes obtenidos, se observa que los máximos porcentajes de remoción alcanzados con los diferentes adsorbentes son muy similares entre sí para la mayoría de metales, indicando que en este caso, el área superficial posiblemente no es un factor determinante en la remoción de los contaminantes evaluados [50-52]. De forma análoga, tampoco se encontró una correlación específica entre la cantidad de grupos fenólicos presentes en cada material y el porcentaje de remoción para los diferentes metales, ya que dichos valores son muy cercanos a pesar de la diferencia en la cantidad de grupos. Además, se observa una variación en los porcentajes de remoción, lo que indica que hay una competencia en la adsorción de los metales estudiados hacia los sitios activos de cada material y que generan procesos de adsorción y desorción. Igualmente, como se puede verificar en la Figura 4 el efecto del tiempo de contacto de los distintos materiales hacia cada uno de los metales pesados muestra ser una variable relevante en el proceso de adsorción en matrices complejas de aguas residuales no domésticas de la industria de galvanoplastia. Durante los tiempos de contacto cortos, la adsorción fue muy rápida para todos los metales (< 5 min se adsorbieron más del 17 % para Fe, 75 % para Ni, 94 % para Cu, 80 % para Zn y 89 % para Cr) (Tabla 5) debido a la presencia de sitios activos en la superficie de los materiales adsorbentes. Basándose en estos resultados se observa que para algunos metales, BCB presenta buenos % de remoción y para otros no, lo que posiblemente depende de la naturaleza física y química tanto del adsorbente como el adsorbato y las interacciones entre ellos.
Adicionalmente, esto sugiere que para la remoción de estos metales no es necesario incurrir en etapas extras para la síntesis de materiales con superficies modificadas o funcionalizadas, dado que se obtienen buenos resultados en matrices complejas de aguas residuales de la industria de galvanoplastia y, que comparados con otras investigaciones donde se reportan el uso de sustancias químicas como TEMPO (2,2,6,6 tetrametilpiperidina-1-il, oxi) en soluciones ideales suelen ser más costosos [16,53]. De acuerdo a estos resultados, se sugiere que a través de procesos más simples (físicos) y no químicos (sustancias reactivas ácidas o básicas fuertes) se pueden obtener adsorbentes de bajo costo como BCB y BPT con rendimientos similares y que harían atractivo el estudio hacia futuras investigaciones de este tipo de efluentes complejos y reales.
La Tabla 6 resume las investigaciones que comúnmente se reportan en la literatura en relación con el porcentaje de remoción para varios metales pesados, utilizando bioadsorbentes derivados de residuos de banano. Se evidencia que ninguno de ellos utiliza aguas residuales reales. Además, la mayoría de los estudios utilizan soluciones ideales y una baja proporción en aguas residuales industriales sintéticas con máximo dos contaminantes; por lo que se demuestra que no hay información sobre la aplicación a nivel experimental de estos adsorbentes en aguas residuales reales, lo que hace difícil la comparación entre esta investigación y lo que se reporta en la bibliografía. Es de resaltar también, que el rendimiento de los adsorbentes sintetizados en esta investigación es bueno, ya que los porcentajes de remoción son superiores o similares a los establecidos en la Tabla 4. Aunque, como se ve también en la misma tabla, el porcentaje de remoción de los adsorbentes obtenidos en esta investigación es inferior a la de otros estudios realizados con soluciones ideales que contienen sólo el metal, lo que podría ser debido a la presencia de un gran número de otros compuestos como HCl, NaOH, SO4 2-, PO4 3- que compiten con el metal por los sitios de adsorción y, por tanto, esto llevaría a obtener menores capacidades de adsorción. En consecuencia, el % de remoción depende en gran medida del tipo de matriz analizada, las propiedades fisicoquímicas del adsorbente y de las condiciones experimentales.
Tabla 6 Porcentajes de remoción de varios contaminantes utilizando bioadsorbentes derivados de residuos de banano.
| Adsorbente | Adsorbato | Tipo de matriz | Remoción (%) | Condiciones de adsorción | Referencias |
|---|---|---|---|---|---|
| Cáscara de banano | Cr (VI) | Solución acuosa | 18,87 | 300 mg/L de Cr (VI), 0,25 g de adsorbente, pH 10, temperatura ambiente. | [54] |
| AgNPs - polvo de hojas de banano | Zn (II) Fe (III) | Solución acuosa | 70 75 | 100 mg/L de Zn (II) y Fe (III), 0,1 g de adsorbente, pH 6, temperatura 30 °C. | [55] |
| Metacrilato de glicidilo - tronco de banano | Cu (II) Zn (II) | Agua sintética | 100 100 | 73,2 y 42,72 mg/L de Cu (II) y Zn (III), respectivamente, 0,05 g de adsorbente, pH 3,25, temperatura ambiente. | [56] |
| Carbón activado de hojas de banano | Cu (II) | Agua sintética | 83 | 250 mg/L de Cu (II), 0,2 g de adsorbente, pH 5, temperatura 30 °C. | [57] |
| Espuma de carbono de cáscara de banano | Cu (II) Cr (VI) | Solución acuosa | 99,84 88,02 | 5 mg/L de Cu (II), 0,2 g de adsorbente, pH 4, temperatura 30 °C. | [58] |
| Tronco de banano | Cu (II) Zn (II) | Solución acuosa | 95,80 97,24 | 5 mg/L de Cu (II), 8 g de adsorbente, pH 6, temperatura ambiente. | [59] |
| Cáscara de banano modificada con acrilonitrilo | Cr (VI) | Solución acuosa | 96 | 5 mg/L de Cu (II), 8 g de adsorbente, pH 6, temperatura ambiente. | [60] |
| Carbón activado derivado de cáscara de banano | Cu (II) Ni (II) | Solución acuosa | 40,4 54,6 | 85 y 90 mg/L de Cu (II) y Ni (II), respectivamente, 1,2 g de adsorbente, pH 6,5, temperatura ambiente. | [61] |
| Cáscara de banano | Cr (III) | Solución acuosa | 99 | 5 mg/L de Cr (III), pH 6 | [62] |
| Cáscara de banano | Cu (II) | Solución acuosa | 88 | 10 mg/L de Cu (II), 0,9 g de adsorbente, pH 9, temperatura 30 °C. | [50] |
| Corteza de banano | Cr (III) Zn (II) | Solución acuosa | 55 32 | 10 mg/L de ambos metales, 2 g de adsorbente, pH 6, temperatura 28 °C. | [63] |
| Cáscara de banano | Cr (VI) | Agua sintetíca | 89,62 | 1 000 mg/L de Cr (VI), 2 g de adsorbente, pH 4, temperatura ambiente. | [64] |
| Ceniza de cáscara de banano | Cr (VI) Fe (II) | Solución acuosa | 37,09 57,78 | 0,5 mg/L para ambos metales, 0,5 g de adsorbente, pH 5. | [65] |
| Biocarbón de pseudotallo de banano | Cr (VI) | Solución acuosa | 62,7 | 200 mg/L de Cr (VI), 50 mg de adsorbente, pH 2, temperatura 25 °C. | [66] |
Conclusiones
Los resultados de esta investigación evidencian que los adsorbentes obtenidos a partir de biomasa residual de pseudotallo y cáscara de banano son efectivos para la eliminación simultánea de uno o varios contaminantes en aguas reales, y que si bien se observa un porcentaje de remoción que haría atractiva la sustitución del carbón activado comercial por materiales de residuos agroindustriales, sería importante continuar realizando este tipo de investigaciones no solamente hacia las aguas residuales del sector de galvanoplastia sino en general, lo cual contribuiría en aspectos técnicos y económicos para la aplicación de estos adsorbentes en la descontaminación de efluentes y la contribución simultánea en la minimización de impactos ambientales del sector manufacturero. Adicionalmente, es imposible confrontar los resultados de este estudio con otras investigaciones puesto que no hay suficientes exploraciones frente a los procesos de adsorción para este tipo de efluentes reales. Además, no es posible afirmar radicalmente que los adsorbentes obtenidos son ideales para remover con las mismas eficiencias metales pesados presentes en cualquier agua residual del sector de la galvanoplastia, ya que los procesos manufactureros son cambiantes en el tiempo, por lo que las características fisicoquímicas del ARnD llegan a ser aleatorias, sin embargo, estos resultados demuestran que es posible utilizar adsorbentes económicos para la remoción eficiente y simultánea de metales pesados, sin necesidad de utilizar procesos químicos costosos, contaminantes y complejos.