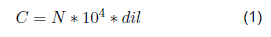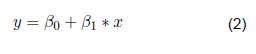Introducción
En el ámbito de la acuicultura, se reconoce la importancia de los cultivos auxiliares, como microalgas, artemias, rotíferos y cladóceros. Estos organismos desempeñan un papel fundamental como alimento vivo durante los primeros días de vida de larvas de peces, moluscos, crustáceos e incluso algunos gasterópodos, hasta sus etapas juveniles [1-4]. Las microalgas, en particular, tienen un papel destacado, ya que no solo son el principal alimento de los organismos filtradores, sino que también se pueden utilizar en la técnica conocida como "agua verde", donde se cultivan simultáneamente con las larvas de peces en tanques [5,6].
A medida que la producción acuícola aumenta, la demanda de microalgas también se incrementa, lo que implica la necesidad de lograr altas densidades en los cultivos. Por lo tanto, es crucial conocer y monitorear el crecimiento poblacional de las microalgas para tomar decisiones clave relacionadas con las condiciones del proceso de cultivo, como el control de temperatura, intensidad de luz y adición de nutrientes [5,7], así como determinar el momento óptimo para la cosecha de las microalgas [8].
En cuanto al crecimiento poblacional de las microalgas, este se divide en varias fases, que incluyen la adaptación o período lag, fase exponencial, desaceleración, fase estacionaria y muerte celular [9]. Cada fase de crecimiento de las microalgas puede ser especificada según su tasa de crecimiento, es decir, la velocidad de cambio en la densidad celular por unidad de tiempo. La tasa de crecimiento es un parámetro clave que se considera en la comparación de diferentes métodos de cultivo [8].
Existen varios métodos para determinar la densidad celular de las microalgas, siendo los más utilizados las mediciones directas tradicionales. Estos métodos implican el conteo directo de células utilizando una cámara Neubauer y un microscopio óptico, o la determinación del peso seco de las células [10,11]. Sin embargo, estos métodos requieren habilidades de laboratorio especializadas, el uso de reactivos exógenos, una gran cantidad de muestras, procesos de centrifugación, secado de muestras, entre otros procedimientos [12]. Además, son métodos que demandan mucho tiempo y no proporcionan mediciones en tiempo real, lo que a menudo se considera tedioso y lento [13-15].
Como alternativa a los métodos tradicionales, se ha desarrollado la espectrofotometría, también conocida como método de densidad óptica o absorbancia, que se utiliza ampliamente para la cuantificación celular y la determinación de biomasa. Este método requiere la construcción de curvas de calibración específicas para cada especie que se desea medir, estableciendo una correlación entre el recuento de células y la absorbancia [9]. Sin embargo, además del tamaño de las células, existen otros factores que pueden influir en la confiabilidad de las mediciones [16]. Por ejemplo, la presencia de restos celulares en el medio de cultivo o la superposición de células, causada por una alta densidad celular, pueden afectar la exactitud de las mediciones de absorbancia. Por lo tanto, al utilizar la espectrofotometría, es fundamental considerar y controlar estos factores adicionales para obtener mediciones precisas y confiables de la densidad celular y la biomasa. Bajo este contexto, el presente estudio tiene como objetivo desarrollar un modelo predictivo ajustado a la fase exponencial, que permita estimar la densidad celular a partir de la absorbancia del crecimiento de las microalgas Isochrysis galbana y Chaetoceros calcitrans. Esta fase del crecimiento es de particular importancia en la producción de alimento vivo para otros organismos, ya que durante este periodo las microalgas alcanzan su máximo contenido de biocompuestos beneficiosos para el óptimo desarrollo de las larvas de peces y zooplancton. Al desarrollar esta herramienta en el Laboratorio de Alimento Vivo, se brinda la oportunidad de estimar en tiempo real la concentración celular de las microalgas, lo que facilita la planificación de la cosecha en el momento óptimo y asegura la disponibilidad de un alimento vivo de calidad para los organismos dependientes de estas microalgas.
Metodología
Los experimentos fueron realizados en el Laboratorio de Alimento Vivo del Centro de Investigación en Acuicultura (CIA) Alexander Von Humboldt del Instituto del Mar del Perú.
Material celular
Se emplearon las siguientes cepas de microalgas: Isochrysis galbana (IMP-BG-010) y Chaetoceros calcitrans (Ch.cal), las cuales fueron proporcionadas por el Banco de Germoplasma de Organismos Acuáticos del IMARPE, a un volumen de 250 mL. Posteriormente, el escalonamiento fue realizado a 500 mL y 1 L en el Laboratorio de Alimento Vivo. El modo de cultivo fue discontinuo y el medio de cultivo empleado fue Guillard F/2 [17]. Los cultivos se mantuvieron bajo condiciones controladas de temperatura ambiental (19 ± 1 °C), iluminación constante a través de paneles LED (1000 lux/m2), salinidad de 35 ppt y aireación constante a un flujo de 0,5 L/min. El cultivo de cada especie fue realizado por separado y las condiciones de cultivo fueron las mismas para ambas especies. Se realizó el monitoreo de los cultivos hasta determinar la máxima densidad y a partir de este inóculo se realizaron diluciones para la construcción de la curva de calibración.
Determinación de la máxima absorbancia
La absorbancia máxima fue determinada para cada especie de microalga analizada. Para ello, se realizó un escaneo de muestras de los cultivos en un rango entre 400 y 900 nm, utilizando un espectrofotómetro Thermo Scientific modelo Orion AquaMate 8100. Se utilizó el valor máximo de absorbancia de cada microalga para determinar la relación entre la absorbancia y la concentración celular [14,9].
Conteo celular
Las densidades celulares fueron determinadas mediante conteo directo utilizando una cámara de Neubauer y un microscopio óptico marca LEICA. Para el conteo, se siguió la metodología descrita por Arredondo y Voltolina [9]. Las concentraciones se calcularon utilizando la Ecuación (1) y los resultados se expresaron en células por mililitro (células/mL) [18,9]. Los conteos de cada muestra fueron realizados por quintuplicado y se utilizaron micropipetas durante todas las mediciones volumétricas para garantizar la precisión de los resultados.
donde, C: concentración celular (células/mL); N: promedio de células presentes en 1 mm2 (0,1 μL); dil: factor de dilución.
Construcción de la curva de calibración
Para generar la curva de calibración, se tomó un inóculo de los cultivos en la fase exponencial, cuya concentración celular fue calculada mediante conteo directo. A partir del valor obtenido se realizaron cinco diluciones o niveles de referencias; cada dilución se replicó cinco veces. Seguidamente, se efectuaron las lecturas de absorbancia en el espectrofotómetro. Inmediatamente después de la medición, se transfirió la suspensión celular a un vial y se fijó con una gota de Lugol para luego proceder al conteo de células. Con los datos obtenidos, se graficó la absorbancia en función de la concentración celular para verificar la linealidad de los datos. También se determinó el rango de trabajo y la densidad máxima que puede alcanzar dentro del área de trabajo. Con esta información, se construyó una curva de calibración para cada especie.
La construcción de la curva de calibración permite establecer una relación cuantitativa entre la absorbancia y la concentración celular. Esto facilita la estimación precisa de la densidad celular a partir de mediciones de absorbancia en futuros experimentos. Es importante destacar que, si bien los modelos generados no se utilizaron directamente para predecir el comportamiento en una cinética de crecimiento, representan una estrategia potencial para validar el modelo predictivo en investigaciones futuras. En el caso de C. calcitrans, se abarcó un rango de concentración de 0,8 a 4,3 x 106 células/mL, empleando cinco niveles de referencia (0,8; 1,7; 2,5; 3,4 y 4,3 x 106 células/mL). Para I. galbana, se trabajó en un rango de concentración de 1,6 a 7,8 x 106 células/mL, utilizando también cinco niveles de referencia (1,6; 3,2; 4,7; 6,3 y 7,8 x 106 células/mL). No se empleó una solución patrón de microalgas debido a que las células vivas pueden presentar variaciones en la intensidad de sus pigmentos según el tiempo y las condiciones de cultivo. Por lo tanto, los resultados obtenidos son específicos para nuestro laboratorio y nuestras condiciones de cultivo, y se brindan como referencia para futuras mediciones de estas especies.
Modelo Predictivo
Para el desarrollo del modelo predictivo se realizó un análisis de regresión lineal, previamente se verificó que los datos sigan una distribución normal y tengan una correlación muy alta. Asimismo, se verificó que los datos cumplan con los cuatro supuestos de un análisis de regresión (linealidad, independencia de residuos, homocedasticidad de residuos y normalidad de los residuos). El análisis estadístico se realizó en el programa SPSS Statistics 26 y se obtuvieron los coeficientes de regresión, el coeficiente de determinación ajustado (R2 adj) y el coeficiente de correlación (r). Los modelos predictivos fueron desarrollados empleando la Ecuación (2):
donde, y: es la densidad celular estimada en células/mL, x: es el valor de la absorbancia medido, β 0: es el intercepto y β 1: es la pendiente de la recta. Ambos son los coeficientes de regresión estimados a partir del análisis de regresión lineal y representan la relación entre la variable dependiente (densidad celular estimada en células/mL) y la variable independiente (valor de la absorbancia medido).
Resultados
Absorbancia máxima
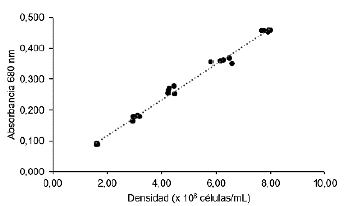
La longitud de onda fue escaneada desde 400 hasta 900 nm; se encontró que la absorbancia máxima para C. calcitrans se observó a una longitud de onda de 676 nm (Figura 1), mientras que para I. galbana se obtuvo a una longitud de onda de 680 nm (Figura 2), lo que sugiere que ambas especies presentaron perfiles de absorbancia similares, lo cual puede indicar similitudes en la composición y contenido de pigmentos fotosintéticos entre ellas.

Figura 1 Patrón de absorbancia de luz para una muestra de cultivo de Chaetoceros calcitrans escaneada entre 400 y 900 nm. La flecha oscura indica el pico de absorbancia para esta especie. nm = nanómetros.
Curva de calibración
En las Figuras 3 y 4, se aprecia que existe una relación directa entre la absorbancia de luz y la densidad celular para las dos especies de microalgas, ya que cuanto mayor es la densidad de células presentes en la muestra, mayor es la cantidad de luz absorbida, lo que se refleja en valores más altos de absorbancia. Por ejemplo, en el caso de C. calcitrans, se observó que las lecturas de absorbancia más altas, como 0,445 y 0,443, corresponden a concentraciones celulares de 4,27 y 4,13 x106 células/mL, respectivamente. Por otro lado, las lecturas de absorbancia más bajas, como 0,079 y 0,087, están asociadas con concentraciones celulares de 0,82 y 0,83 x106 células/mL, respectivamente. En el caso de I. galbana, las lecturas de absorbancia más altas fueron de 0,459 y 0,458, que correspondieron a concentraciones celulares de 7,94 y 7,99 x 106 células/mL, respectivamente. Mientras que, las lecturas de absorbancia más bajas, como 0,088 y 0,090 estuvieron asociadas con densidades de 1,61 y 1,65 x 106 células/mL, respectivamente. Estos resultados evidencian la relación proporcional entre la absorbancia y la densidad celular en un amplio rango de concentraciones, lo cual respalda la utilidad de la espectrofotometría como una herramienta confiable para estimar la concentración celular en cultivos de C. calcitrans e I. galbana. La construcción de curvas de calibración basadas en estos datos permitiría una estimación precisa de la concentración celular en futuros experimentos dentro de este rango de trabajo.
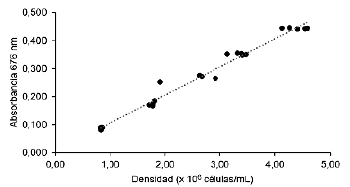
Figura 3 Relación entre la absorbancia y la densidad celular de Chaetoceros calcitrans. nm = nanómetros.
Modelos predictivos
Los modelos predictivos fueron determinados para I. galbana y C. calcitrans. En la Tabla 1, se resume los coeficientes de regresión de los modelos predictivos obtenidos. Asimismo, el coeficiente de determinación para ambas especies fue mayor a 0,98 y el coeficiente de correlación fue de 0,99 en ambas especies, lo que indica que existe una muy alta correlación entre la absorbancia de las suspensiones de microalgas y la concentración celular.
Tabla 1 Coeficientes de regresión para los modelos predictivos de Isochrysis galbana y Chaetoceros calcitrans. βo: intercepto, β 1: pendiente de la recta.
| Especie | ßo | ß1 | R2 adj | r |
|---|---|---|---|---|
| Isochrysis galbana | 0,001 | 0,058 | 0,991 | 0,996 |
| Chaetoceros calcitrans | 0,006 | 0,100 | 0,9810 | 0,990 |
Finalmente, con el análisis de ANOVA se obtuvo un p-valor <0,05 para ambas especies, lo que indica que el modelo es el adecuado para realizar la estimación. Por lo tanto, el modelo para las microalgas es el siguiente: y = 0,0004+0,0581*(Abs I. galbana ); y = 0,0065+0,1001*(Abs C. calcitrans ).
Discusión
La elección de la longitud de onda para las lecturas de absorbancia en nuestras especies de microalgas varió debido a la presencia de pigmentos fotosintéticos distintivos, como la clorofila (Chl) a, b, c y d, así como carotenoides y otros pigmentos accesorios. Mientras algunas recomendaciones respaldan el uso de 675 nm por su proximidad al pico de absorción de la Chl a [19], se reconoce la variabilidad en las sugerencias de otros autores, quienes proponen 550 nm para abordar las variaciones en el contenido de clorofila bajo diversas condiciones lumínicas y de cultivo [9]. Es crucial destacar que las clorofilas b, c y d están restringidas a ciertas especies de microalgas, como Chl b presente en Prasinophyceae, Euglenophyceae y Chlorophyceae, Chl c en Cryptophyceae, y Chl d en Rhodophyceae [19]. Este reconocimiento de la diversidad pigmentaria subraya la importancia de una selección de longitud de onda precisa para obtener mediciones confiables de absorbancia en estudios de microalgas.
En el presente estudio, la absorbancia máxima de C. calcitrans fue a 676 nm, este valor fue cercano a otros estudios, en los que se reporta que el crecimiento celular para C. calcitrans fue a 688 nm [20] y 690 nm [21]; mientras que, para C. muelleri fue a 560 nm [22] y para C. gracilis a 680 nm [21]. Para el caso de I. galbana, la absorbancia máxima fue a 680 nm, este valor coincide con lo reportado por otro investigador [23], aunque la correlación obtenida en su estudio fue baja (r=0,42). Otros estudios reportan valores similares a 682 nm [20], 686 nm [21], 664 y 650 nm [24]. Los estudios revisados muestran que ambas especies son capaces de absorber la luz roja (620 a 750 nm), aunque las diatomeas e Isochrysis sp. también son capaces de absorber la luz azul fotosintéticamente utilizable (445 nm) debido a la presencia de diferentes contenidos de pigmentos (Chl a y d) [25]. En general, para las mediciones de densidad óptica se sugiere emplear el rango entre 664 a 690 nm, debido a que estos valores están correlacionados con la absorbancia de la clorofila [26].
Considerando las variables que pueden afectar en las mediciones espectrofotométricas, abordamos los factores críticos para asegurar la precisión de nuestros resultados. Uno de estos factores fue la elección de un medio de cultivo incoloro con el fin de minimizar posibles interferencias cromáticas [20]. Aunque esta elección proporcionó una base sólida para nuestras mediciones, reconocemos la importancia de considerar otros escenarios como en los cultivos masivos donde se emplean fertilizantes foliares u otros medios con coloración.
En tales casos, se sugiere la construcción de una nueva curva de calibración adaptada a estas condiciones específicas. Otros factores que pueden afectar son la variabilidad en la morfología de las células y el tiempo de sedimentación de la muestra, especialmente en las diatomeas, dada su propensión a sedimentar debido a la falta de motilidad en comparación con las microalgas flageladas. Esta interferencia se evitó mediante una cuidadosa homogeneización previa a las lecturas y tomas de muestras, con el fin de evitar introducir variaciones en las mediciones de absorbancia. Asimismo, en nuestro laboratorio, el mantenimiento protocolizado de las condiciones de cultivo no solo fortaleció la coherencia de nuestras mediciones, sino que también desempeñó un papel crucial en la reducción del material en suspensión, contribuyendo a la fiabilidad general de nuestros resultados y permitiéndonos establecer relaciones más claras entre la absorbancia y la densidad celular en condiciones predecibles. Por lo que se refiere al coeficiente de determinación de la ecuación de la recta, los valores obtenidos en nuestros modelos (R2 h = 0,981; R2 =0,991) evidencian que los valores de la absorbancia y la densidad celular están muy relacionados entre sí, por lo tanto, la ecuación del modelo lineal permite determinar la densidad en base a la absorbancia. Estos resultados son consistentes con otros estudios, como el de Alam et al., quienes obtuvieron coeficientes de determinación de 0,998 para C. calcitrans y 0,995 para I. affinis galbana (T-Iso) [20]. Por otro lado, Nevarez et al. reportaron una correlación alta para I. galbana (0,94), aunque para C. calcitrans el valor obtenido (0,85) fue más bajo, indicando que la ecuación de la recta no sería adecuada para cuantificar la densidad celular en este caso [21].
Es importante destacar que, en muchos estudios de modelado de cinéticas de crecimiento se realiza la medición directa del crecimiento celular a lo largo del tiempo, sin necesidad de recurrir a diluciones preparadas. Estos enfoques directos permiten obtener una visión más completa y precisa del comportamiento de las células durante su ciclo de crecimiento. Sin embargo, en este estudio optamos por utilizar diluciones y técnicas de espectrofotometría para establecer una relación cuantitativa entre la absorbancia y la concentración celular, con el objetivo de desarrollar un modelo predictivo de densidad celular. Esta elección nos permitió obtener resultados satisfactorios y construir curvas de calibración para las especies estudiadas. No obstante, reconocemos que la validación y comparación de nuestro modelo en una cinética de crecimiento real sería un enfoque interesante para futuras investigaciones, que nos permitiría evaluar aún más su desempeño en condiciones dinámicas y garantizar su aplicabilidad en situaciones más complejas y cercanas a la realidad.
Finalmente, es importante considerar que el método espectrofotométrico es una medida indirecta y puede verse afectado por varios factores, siendo la concentración celular y el grado de pigmentación, las que dependen principalmente de las condiciones de cultivo, por lo que una variación puede generar cambio en el contenido del pigmento y, por ende, causar un error significativo en el cálculo de la densidad [27], por tal motivo se sugiere que las condiciones de cultivo para cada especie se encuentren protocolizadas con el fin de evitar errores en los modelos predictivos desarrollados. Además, la cuantificación se realiza en muestras vivas, sin adición de preservantes que suelen interferir en la coloración de los cultivos, lo que favorece en las lecturas en tiempo real.
Conclusiones
Este estudio ha demostrado una fuerte correlación entre la absorbancia y la densidad celular en los cultivos de las microalgas C. calcitrans e I. galbana. Los coeficientes de determinación obtenidos en nuestros modelos (R2 chc=0,981; R2 iso=0,991) indicaron una relación estrecha entre ambas variables, lo que permite determinar la densidad celular en base a las lecturas espectrofotométricas. Sin embargo, es importante considerar que el método espectrofotométrico es una medida indirecta que puede verse afectada por varios factores por lo que es importante tenerlos en cuenta para minimizar los errores en las mediciones.
Para futuras investigaciones, se recomienda validar y comparar el modelo desarrollado en una cinética de crecimiento de cultivos masivos, considerando factores adicionales como tipos de medio utilizado. Esto permitirá evaluar aún más el desempeño del modelo en condiciones dinámicas y mejorar su aplicabilidad en el monitoreo de cultivos microalgales.