Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Medica Colombiana
Print version ISSN 0120-2448
Acta Med Colomb vol.31 no.4 Bogotá Oct./Dec. 2006
Dr. Martín Alonso Gómez Zuleta: Internista Gastroenterólogo. Profesor de Gastroenterología Universidad Nacional, Hospital el Tunal;
Dr. Luis Fernando Pineda Ovalle: Internista Gastroenterólogo y Epidemiólogo, Centro de Enfermedades Digestivas, Hospital El Tunal;
Dr. Milciadez Ibáñez: Estadístico, Matemático. Profesor de Bioestadística Universidad El Bosque, Universidad del Rosario;
Dr. William Otero: Internista Gastroenterólogo y Epidemiólogo. Jefe de la Unidad de Gastroenterología de la Universidad Nacional de Colombia;
Dr. Víctor Humberto Arbeláez Méndez: Internista Gastroenterólogo, Centro de Enfermedades Digestivas, Hospital El Tunal. Bogotá, D.C.
Correspondencia: al Dr. Martín Gómez, Tels. 6217603 Bogotá. E-mail: espolon@tutopia.com.
Recibido: 31/07/06 Aprobado: 01/11/06
Resumen
La determinación de variables clínicas que permitan predecir cuáles pacientes con hemorragia digestiva alta (HVDA) tienen sangrado activo es muy importante, porque identificarían a los que necesitan endoscopia digestiva urgente (dentro de las primeras 12 horas de ingreso) o si el procedimiento se puede diferir para hacerlo dentro de las primeras 24 horas. Además de lo anterior, una escala predictiva sería muy útil para los servicios de urgencias de hospitales y centros de salud porque facilita optimizar los recursos y más aún en Colombia donde son insuficientes y muy pocos hospitales prestan un servicio de endoscopia las 24 horas del día. El propósito de este trabajo fue evaluar, en nuestro medio, la utilidad de los hallazgos clínicos y de laboratorio para identificar aquellos pacientes con HVDA que al momento del ingreso están presentando sangrado activo, para construir con ellos una escala original, que posteriormente fue validada de manera prospectiva en un grupo diferente de pacientes.
Objetivo: definir las variables clínicas y de laboratorio, en pacientes con hemorragia digestiva alta, que puedan ser usadas para realizar una escala que permita identificar aquéllos con sangrado activo al momento del ingreso y que necesitan endoscopia urgente.
Pacientes y métodos: es un estudio observacional analítico, de tipo transversal en el que se tomó la información de pacientes que ingresaron al servicio de urgencias de un hospital de tercer nivel. Los hallazgos clínicos al ingreso de los pacientes fueron tomados como variables de predicción y la presencia o ausencia de sangrado activo durante la endoscopia realizada en las primeras 12 horas fueron tomadas como variables de desenlace. La muestra la constituyen dos cohortes prospectivas de pacientes que fueron seleccionados en forma consecutiva. La primera cohorte fue reclutada desde enero de 2004 hasta agosto de 2005 para la validación interna de la escala y la segunda cohorte, otro grupo independiente, reclutada desde septiembre de 2005 a junio de 2006. Los criterios de inclusión fueron pacientes mayores de 18 años con diagnóstico clínico de HVDA. Utilizando las variables que fueron identificadas como predictoras de sangrado activo en el análisis multivariado, se construyó la escala.
Resultados: en la primera corte, incluimos 109 pacientes con HVDA (edad media = 59,3 años ± 19,1 fueron hombres en 69.7%). El principal síntoma de presentación fue melenas en el 73.4% y el principal hallazgo endoscópico fue úlcera péptica en 58.7%. Seis variables (lipotimia, inestabilidad hemodinámica, hemoglobina menor de 8, leucocitos mayores de 12000, sangre en la sonda nasogástrica (SNG) y edad > 65 años), fueron identificadas como predictores independientes de sangrado activo en la endoscopia de vías digestivas altas (EVDA) urgente y fueron utilizadas para realizar la siguiente escala:
Escala de sangrado = 5 x (sangre en la SNG) + 4 x (hemoglobina < 8)+4 x(lipotimia)+2x(leucocitos > 12.000/mm3)+2x(Edad > 65 años)+1x(inestabilidad hemodinámica). Los valores de la escala variaron entre 0 y 18 y se utilizó la curva de características operativas del receptor (ROC) en la determinación del punto de corte donde se hace máxima la sensibilidad y especificidad y se evaluó la capacidad de predicción de la escala, encontrando que ese punto era 7 de tal forma que si el paciente tiene menos de 7 puntos significa ausencia de sangrado activo y por lo tanto no necesita EVDA urgente. Si tiene 7 o más puntos hay sangrado activo y necesita la EVDA urgente. Esta escala fue validada externamente en el otro grupo independiente constituido finalmente por 98 pacientes (edad media = 56.2 años ± 16, fueron hombres en 62.2%), de los cuales el 15.6% tenían sangrado activo. Al aplicar la escala con el punto de corte establecido se encontró una sensibilidad 100%; especificidad de 83.1%; valor predictivo de 64.3%; VP negativo de 100%
Conclusiones: los hallazgos sugieren que una escala simple, de fácil memorización, construida con parámetros clínicos y de laboratorios disponibles en cualquier hospital de nuestro país, puede identificar pacientes con HVDA que necesitan una EVDA urgente de los que no la necesitan. Esta escala realizada sobre sólidas bases matemáticas puede ser utilizada en hospitales que no cuentan con un servicio de gastroenterología las 24 horas del día o como herramienta para priorizar la remisión de los pacientes desde los centros que no tengan disponibilidad de EVDA. Los resultados de este estudio nos permiten recomendar la aplicación clínica de esta escala original porque en la validación externa tuvo un excelente rendimiento sobre todo para descartar sangrado activo y demostró ser consistente y de alto valor discriminativo cuando se evaluó en dos grupos independientes de pacientes.
Palabras clave: hemorragia digestiva alta, endoscopia, escala de predicción.
Abstract
Determination of clinical variables that allow to predict which patients with upper gastrointestinal tract bleeding (UGTB) present active bleeding is very important because it would help to identify those who need en emergency endoscopy (within the first 12 hours after admission to the hospital) or if the procedure may be delayed to do it within the next 24 hours. Besides the above, a predictive scale would be very useful for the hospitals' and health centers' emergency services because it facilitates the optimization of resources, and further more in Colombia where there are not enough or very few hospitals that provide endoscopy services 24 hours a day. The purpose of this work was to assess the usefulness of the clinical and laboratory findings to identify those patients with UGTB with active bleeding at admission and who need emergency endoscopy, to build an original scale that later on was validated in a prospective way in a different group of patients.
Objective: to define clinical and laboratory variables in patients with UGTB, that can be used to make a scale that allows the identification of those with active bleeding at admission and who need emergency endoscopy.
Patients and methods: it is an analytical observational cross over study taking the information from those patients that were admitted in the emergency service of a third level hospital. The clinical findings at admission were taken as prediction variables and the presence or absence of active bleeding during the endoscopy within the first 12 hours ware taken as outcome variables. The sample is made up of two prospective patients' cohorts who were consecutively selected. The first cohort was recruited from January 2004 until August 2005 for internal validation of the scale, and the second cohort, another independent group, was recruited from September 2005 to June 2006. The inclusion criteria were patients older than 18 years with a clinical diagnosis of UGTB. The 97 scale was built using the variables that were identified as predictors of active bleeding in the multivariance analysis.
Results: in the first cohort we included 109 patients with UGTB (age X = 59.3 +/-19.1, men 69.7%). The main symptom for presentation was melena in 73.4% and the main endoscopic finding was peptic ulcer (58.7%). Six variables (lypotimia, hemodinamic instability hemoglobine less than 8, white cells higher than 12000, blood in the SNG, and age >65) were identified as independent predictors of active bleeding in emergency UGTE and were used to do the following scale:
Bleeding scale = 5 x (Blood in the SNG) +4 (hemoglobin <8) + 4x (lipotimia) + 2x (white cells> 12.000) + 2x (age > 65) + 1x (homodynamic instability. The scale values ranged between 0 and 18 and the operative characteristics curve was used (ROC) in the determination of the cut off point where the highest sensitivity and specificity are shown and the predictions capacity of the scale was assessed, finding that the point was 7 in such a way that if the patient has less than 7 points it means absence of active bleeding and does not need an emergency UGTE. However, if the patient has 7 or more points there is active bleeding and needs emergency UGTE. This scale was externally validated in the other independent group with 98 patients (age X = 56.2 ± 16, men 62.2%), of which 15.6% had active bleeding. Using the scale with the established cut off point, a sensitivity of 100% was found, specificity of 83.1%; predictive value of 64.3%; negative PV of 100%.
Conclusions: the findings suggest that a simple scale, easy to remember, built with the clinical and laboratory parameters available in any hospital in our country, may identify patients with UGTB that need an emergency UGTE as well as those that do not need it. This scale with solid mathematical basis may be used in those hospitals that do not have gastroenterology services 24 hours a day or as a tool to establish priorities in terms of patients' remission from the centers that do not have UGTE services available. The results of this study allow us to recommend the clinical application of this original scale because it had en excellent performance in the external validation, especially to rule out active bleeding and was consistent with high discriminative value when assessed in two independent patients' groups.
Key words: upper gastrointestinal tract bleeding, endoscopy, prediction scale.
Introducción
La hemorragia digestiva alta (HVDA) es la principal emergencia en gastroenterología. A pesar de los avances en el diagnóstico y el tratamiento, la mortalidad se ha mantenido estable entre 5% a 10% durante las dos últimas décadas, cuando se incluyen todos los pacientes con HVDA, pero se reduce hasta en 60%, cuando se analizan los pacientes que ameritan tratamiento endoscópico (1). Esto se debe fundamentalmente al envejecimiento progresivo de la población y al aumento de la proporción de pacientes de edad avanzada con enfermedades asociadas, en los que se concentra la mortalidad (1). La HVDA constituye la causa más común de interconsulta al gastroenterólogo en los servicios de urgencias (1, 2). Los pacientes que la presentan ingresan al hospital en condiciones clínicas muy variables que van desde la simple presencia de melenas, sin compromiso hemodinámico, hasta una condición grave con sangrado masivo y shock hipovolémico que pone en riesgo la vida (2). La endoscopia digestiva superior es la piedra angular para el manejo de estos pacientes porque permite establecer la causa de la hemorragia, definir el pronóstico y brindar tratamiento para detener el sangrado y prevenir su recurrencia (1-3). Con frecuencia estos pacientes son motivo de alarma por parte de los médicos que los atienden, y lleva a que se soliciten en forma indiscriminada numerosas endoscopias inmediatas o urgentes. En muchos casos el endoscopista encuentra que el paciente no presenta sangrado activo o no tiene ninguna lesión que amerite una intervención endoscópica. Esta alta demanda de endoscopias urgentes e innecesarias genera altos costos en términos de disponibilidad de servicios de endoscopia y de especialistas durante las 24 horas (incluso las madrugadas) y los siete días de la semana (incluyendo los domingos). Por esta razón es de gran importancia determinar cuáles pacientes con HVDA están presentando sangrado activo al momento del ingreso y requieren de manera urgente o inmediata una endoscopia y cuáles pacientes ya no tienen sangrado activo y por lo tanto pueden esperar para que el procedimiento se les realice de manera diferida sin correr el riesgo de sufrir complicaciones serias por la demora del procedimiento. La discriminación de estos dos grupos es fundamental porque los pacientes que tienen sangrado activo son los que tienen peor pronóstico en términos de morbimortalidad y es en ellos en donde la endoscopia realizada antes de 12 horas tiene gran impacto al poder realizar hemostasia con los diferentes métodos actualmente disponibles y de esta manera disminuir la mortalidad (1-3).
La identificación de variables clínicas que permitan identificar estos dos tipos de pacientes, sería una herramienta fundamental, que hasta el momento no ha sido establecida y de lograrse, tendría inmensa utilidad para los servicios de urgencias de los hospitales y centros de salud de Colombia, porque facilitaría la optimización de sus ya deteriorados recursos al permitir seleccionar cuáles pacientes van a EVDA inmediata (requieren una remisión) y a cuáles se les puede diferir su endoscopia (dentro de las 24 horas y en su hospital de origen).
Hasta el momento la investigación a nivel mundial se ha concentrado en la construcción de diversas escalas numéricas para predecir si un paciente con HVDA puede resangrar o para establecer el riesgo de mortalidad o la necesidad de hospitalización, se han creado escalas como el índice Cedars-Sinai (1990), Baylor (1993), BLEED system (1995), Rockall (1996) y Blacthford (2000) entre otras, además se han realizado múltiples estudios para validar estas escalas (4-14). Sin embargo, hasta el momento no se han realizado suficientes estudios para establecer escalas que discriminen si un paciente tiene sangrado activo o continuo para justificar una endoscopia inmediata. Teniendo en cuenta la carencia de un instrumento de esta naturaleza, el propósito de este trabajo es evaluar, en nuestro medio, la utilidad de los hallazgos clínicos y de laboratorio para identificar aquellos pacientes con HVDA que al momento del ingreso están presentando sangrado activo.
Justificación
La justificación de este estudio se fundamenta en el hecho de que a la fecha, no encontramos en la literatura universal y tampoco en Colombia, ninguna publicación sobre un instrumento validado que tenga utilidad para pre decir el sangrado activo en pacientes con HVDA que ingresan a los servicios de urgencias y la decisión de realizar o no endoscopias urgentes se basa en criterios empíricos o de utilidad incierta, que en la práctica llevan a la realización injustificada de miles de EVDA con la consecuente pérdida de recursos si se tiene en cuenta que la mayoría de pacientes son remitidos, y pocas instituciones por ciudad disponen de un servicio de EVDA las 24 horas del día.
Objetivos
Objetivo general
Definir las variables clínicas y de laboratorio en pacientes con hemorragia digestiva alta, que puedan ser usadas para crear una escala que identifique aquéllos con sangrado activo al momento del ingreso y que necesitan endoscopia urgente.
Objetivos específicos
Construir una escala numérica con las variables clínicas relacionadas con sangrado activo y evaluar su capacidad para discriminar estos pacientes.
Validar externamente esta escala en una cohorte diferente de pacientes.
Determinar la prevalencia de lesiones causales de HVDA en la muestra de pacientes estudiados.
Definir las variables sociodemográficas de los adultos que ingresan al servicio de urgencias por HVDA.
Evaluar los diferentes signos y síntomas de presentación de HVDA en la muestra de pacientes estudiados.
Evaluar los diferentes factores de riesgo relacionados con HVDA en los pacientes atendidos en nuestro hospital con ese diagnóstico.
Hipótesis conceptual
En los pacientes con hemorragia de vías digestivas altas, la aplicación de una escala construida con variables clínicas específicas es útil para determinar la presencia de sangrado activo y permite identificar los pacientes que necesitan endoscopia inmediata.
Pacientes y métodos
Definición del método
Es un estudio observacional analítico de tipo transversal en el que se tomó la información de manera prospectiva en una cohorte de pacientes seleccionados en forma consecutiva que ingresaron al servicio de urgencias de un hospital de tercer nivel. Los hallazgos clínicos al ingreso de los pacientes fueron tomados como variables de predicción y la presencia o ausencia de sangrado activo durante la endoscopia realizada en las primeras 12 horas (urgente) fueron tomadas como variables de desenlace.
Población y muestra
Población. La población corresponde a los pacientes que son atendidos en el servicio de urgencias de nuestra institución, que es un hospital colombiano de tercer nivel que atiende pacientes de los estratos socioeconómicos 1 a 4 en todos los regímenes de salud existentes en la legislación colombiana.
Muestra. La muestra la constituye una cohorte prospectiva de pacientes que fueron seleccionados en forma consecutiva desde enero de 2004 hasta agosto de 2005 para la construcción de la escala (validación interna) y una segunda cohorte o muestra independiente tomada de septiembre de 2005 a junio de 2006 para la validación externa de la escala previamente establecida.
Selección de pacientes
Criterios de inclusión
Edad mayor de 18 años
Diagnóstico clínico de HVDA fundamentado en al menos uno de los siguientes criterios:
Hematemesis franca
Vómito en "cuncho de café" (melanemesis).
Melenas
Criterios de exclusión
Infarto agudo del miocardio en las últimas tres semanas
Enfermedad cerebrovascular aguda en las últimas tres semanas
Falla cardiaca congestiva severa (grado IV)
Falla respiratoria severa
Alteraciones hematológicas severas
Consumo de anticoagulantes/Anticoagulación
Sangrado intrahospitalario
Sospecha de perforación de víscera hueca
Embarazo
Definición de variables
Variables independientes
Variables demográficas
Edad: años cumplidos, variable discreta
Género: masculino =1, femenino =2, variable nominal dicotómica
Antecedentes clínicos
Comorbilidad: cualquier enfermedad que requiera manejo médico a permanencia como hipertensión, enfermedad cardiovascular (IM previo, angina, ICC, claudicación, procedimientos de revascularización), diabetes, enfermedad cerebrovascular, enfermedad pulmonar obstructiva crónica (EPOC), enfermedad renal crónica (ERC), asma bronquial, etc. Variable nominal dicotómica y categórica.
Consumo de AINES: consumo de aspirina o cualquier AINE en cualquier dosis y periodicidad dentro del mes anterior. Se especificará el medicamento, dosis, vía de administración, frecuencia de consumo y el tiempo que lleva recibiéndolo
Consumo de anticoagulantes: serán admitidos y registrados igual que en el numeral anterior si cualquiera de estas drogas ha sido consumida dentro de la última semana Consumo habitual de otros medicamentos: serán anotados los medicamentos diferentes a los anteriores, que los pacientes consuman con una periodicidad mínima de una vez por semana.
Tabaquismo: se anotará en forma dicotómica si hay consumo habitual y diario.
Alcohol: se anotará como positivo si hay una periodicidad mínima de una vez por semana o si hay consumo reciente al momento del ingreso.
Hallazgos clínicos al ingreso
Hematemesis: vómito hemorrágico, de aspecto fresco y rojo brillante
Melena: deposición negra, alquitranada de olor desagradable
Palidez: decoloración de la piel y/o la mucosa
Lipotimia: mareo sin pérdida de la conciencia
Melanemesis: vómito de aspecto en cuncho de café.
Rectorragia: eliminación de sangre por el recto, de color rojo brillante o rojo oscuro, en forma de sangre pura o coágulos de sangre
Lavado gástrico positivo: material aspirado por SNG de aspecto rojo brillante o café oscuro que no aclara a pesar de la instilación de 500 cc de solución salina normal
Hemorragia gastrointestinal superior aguda (HVDA aguda). Cualquiera de los siguientes 4 criterios:
1. Hematemesis
2. Melanemesis
3. Melenas
4. Rectorragia con inestabilidad hemodinámica y endoscopia demostrativa de lesión gastrointestinal (GI) superior como fuente de sangrado o lavado gástrico positivo
Inestabilidad hemodinámica: frecuencia cardiaca mayor 100 pulsaciones por minuto y/o tensión arterial sistólica mayor a 100 mmHg y/o un incremento en la frecuencia cardiaca en más de 10 al cambiar de la posición supina a la sentada
Definiciones endoscópicas
Úlcera gástrica: solución de continuidad de la mucosa circunscrita con al menos 5 mm de diámetro y con una profundidad perceptible
Úlcera Forrest IA: evidencia de sangrado a chorro o en jet
Úlcera Forrest IB: sangrado activo en escurrimiento
Úlcera Forrest IIA: evidencia de vaso visible
Úlcera Forrest IIB: coágulo adherido a la base de la úlcera
Úlcera Forrest IIC: mancha plana sobre la base de la úlcera
Úlcera Forrest III: base sólo cubierta por fibrina
Erosión sangrante: solución de continuidad de la mucosa menor
de 5 mm de aspecto plano con presencia de sangre en el estómago o el duodenoDesgarro de Mallory Weiss: solución de continuidad lineal que compromete la unión esofagogástrica.
Sangrado de origen varicial: sangre que emana de una várice o presencia de signos de inminencia de sangrado sin otra lesión que explique el sangrado digestivo alto
Lesión de Dieulafoy: lesión que cumpla las siguientes características:
Sangrado a chorro proveniente de un defecto mucoso de máximo 3 mm y con mucosa adyacente de aspecto normal
Visualización de un vaso protruido con o sin sangrado activo dentro de un defecto mucoso menor a 3 cm o mucosa periférica normal.
Coágulo fresco adherido a través de una estrecha base a defecto de la mucosa menor de 3 mm o mucosa de aspecto normal
Ectasia vascular antral: presencia de parches o manchas rojas arreglados de manera difusa o lineal en el antro gástrico
HVDA con endoscopia negativa para lesiones sangrantes: procedimiento endoscópico en el cual a pesar de evidencia de sangrado activo o reciente no se encuentra la lesión causante de la hemorragia.
Variables dependientes
Sangrado activo: cualquier lesión endoscópica que presente sangrado a chorro o escurrimiento en capa.
Sangrado no activo: cualquier lesión endoscópica que se considere fuente de sangrado o tenga estigmas pero que no presente hemorragia activa al momento de la endoscopia.
Técnicas de recolección y procedimientos
El protocolo y el consentimiento informado fueron aprobados por el comité de ética e investigaciones del hospital. Todos los pacientes con diagnóstico clínico de HVDA fueron considerados elegibles para el estudio y se incluyeron aquellos que cumplieron los criterios de inclusión y que firmaron y aceptaron el consentimiento informado.
El estudio tiene dos fases. En la primera (validación interna) se investigaron las variables clínicas relacionadas con sangrado activo en una cohorte de pacientes con HVDA y con estas variables se construyó una escala numérica de predicción. En la segunda fase se hizo una validación externa de esta escala, aplicándola en un grupo independiente de pacientes con HVDA, distinto al anterior para evaluar la utilidad de este instrumento.
Validación interna. A todos los pacientes se les realizó una valoración inicial que incluyó registro de signos vitales, colocación de dos accesos venosos y obtención de muestras de sangre para pruebas de laboratorio que incluyeron como mínimo cuadro hemático, tiempo de protrombina, tiempo parcial de tromboplastina, nitrogenados, transaminasas y hemoclasificación. Fueron estabilizados con cristaloides, coloides o transfusión de acuerdo con la condición de severidad de cada caso. Como parte del estudio, a todos los pacientes se les colocó una SNG y se observó si en su drenaje espontáneo había o no sangre.
Un formulario estandarizado fue diligenciado por el médico de urgencias o el residente que valoró a cada paciente a su ingreso.
Dentro de las primeras 12 horas de ingreso se realizó una endoscopia por un especialista del servicio, que desconocía la historia clínica del paciente o los resultados del formulario correspondiente. Todas las endoscopias fueron realizadas por un solo gastroenterólogo, el cual tiene una gran experiencia en endoscopia digestiva de pacientes con HVDA, con más de 25.000 procedimientos realizados.
El equipo de endoscopia que utilizamos fue un videoendoscopio (Olympus Exera), no se realizó lavado gástrico previo al procedimiento a menos que la EVDA fuera incompleta. Las úlceras con estigmas de sangrado fueron irrigadas con agua para una mejor evaluación y clasificación.
Los pacientes con úlceras Forrest IA, IB, o lesión de Dieulafoy fueron consideradas con sangrado activo y se realizó escleroterapia con adrenalina 1/10000; los pacientes con Forrest IIA (vaso visible) o Forrest IIB (coágulo adherido), no fueron considerados con sangrado activo pero se les realizó escleroterapia con adrenalina 1/10000 por el alto riesgo de resangrado. Los pacientes con sangrado varicoso fueron tratados con la colocación de bandas de ligadura.
Todos los pacientes sin una lesión que indicara sangrado activo, riesgo de resangrado o con una úlcera Forrest IIC o III que estuvieran estables hemodinámicamente fueron dados de alta con sus respetivas indicaciones. Los otros pacientes con estigmas de sangrado fueron hospitalizados.
Otros investigadores del grupo compararon los resultados del formulario con los hallazgos de la endoscopia.
Validación externa.Los pacientes fueron manejados con la misma metodología que en el estudio de validación interna. Para la validación externa de la escala que se creó, se construyó otro formulario que contenía además de los parámetros demográficos de cada paciente, sólo las variables clínicas que permitían calcular la escala y que era diligenciado por el médico de urgencias o el residente que recibía al paciente que desconocía los resultados de la endoscopia.
La endoscopia fue realizada también en las primeras 12 horas de ingreso del paciente al servicio de urgencias por el mismo endoscopista que realizó las endoscopias en el estudio de validación externa y que desconocía los resultados del formulario que se llenó a cada paciente.
Control de errores y sesgos
Las endoscopias fueron realizadas por un solo gastroenterólogo para evitar el sesgo interobservador.
Los datos del formulario de recolección no fueron conocidos por el endoscopista en ninguna de las dos fases del estudio.
Todos los datos de los formularios de recolección fueron verificados en forma independiente con la historia clínica para controlar errores de registro.
En los métodos estadísticos se empleó la regresión logística para controlar las variables de confusión.
Análisis estadístico
Validación interna. En el análisis bivariable se evaluaron las asociaciones entre las variables independientes categóricas: género, grupos de edad, lipotimia, leucocitosis, etc., con la variable dependiente sangrado activo, mediante la prueba asintótica chi-cuadrado de Pearson (valores esperados > 5) o la prueba exacta de Fisher (valores esperados <= 5); la fuerza de asociación entre estos factores se evaluó con el odds ratio (OR) y se determinó la asociación con el intervalo de confianza del 95%. El modelo utilizado en la explicación de sangrado activo ajustado por las variables de confusión fue el de regresión logística incondicional binaria; las variables que se incluyeron en el modelo fueron las significativas en el análisis bivariante y las de valores de significancia con p<0.20. Se incluyeron en el modelo final las que aportaron mayor fuerza de asociación con OR>= 2. Se construyó una escala teniendo en cuenta la asociación mediante los coeficientes del modelo (bi) que se dividieron por 0.5 para mostrar el aporte de cada variable de la escala de sangrado activo. Esta escala fue aplicada como instrumento de predicción en las dos fases del estudio. Los valores de la escala variaron entre 0 y 18 y se utilizó la curva de características operativas (ROC) en la determinación del punto de corte donde se hace máxima la sensibilidad y especificidad y se evaluó la capacidad predictora de la escala mediante la prueba del área bajo la curva (área> 0.50). Las pruebas se evaluaron a un nivel de significancia del 5%.
Resultados
Validación interna
Durante un periodo de 18 meses 109 pacientes consecutivos con HVDA fueron incluidos en la muestra, el promedio de edad fue de 59.3 años (DS+ 19.1; rango18-99) y 76 de ellos (69.7%) fueron del sexo masculino. La Tabla 1 muestra las características demográficas y los hallazgos clínicos de todos los pacientes al momento de su ingreso. Las melenas fueron la forma de presentación más frecuente (73.4%) y la úlcera péptica el hallazgo endoscópico más prevalente (58.7%), seguidos por várices esofágicas (6.4%) y síndrome de Mallory Weiss (6.4%). El 71% (15 pacientes) de los 23 pacientes con sangrado activo tuvieron como causa la úlcera péptica. La descripción de los hallazgos endoscópicos se presenta en la Tabla 2. Durante la hospitalización seis (5.5%) pacientes presentaron resangrado de los cuales uno (0.9%) falleció y en los cinco restantes una nueva terapia endoscópica logró controlar la hemorragia, sin recidiva.


El análisis univariado de las 22 variables exploradas encontró que las siguientes nueve fueron significativas (P< 0.05): hematemesis como signo de presentación, historia de lipotimia al inicio del cuadro, shock, palidez, inestabilidad hemodinámica, hemoglobina (Hb) < 8 gr/dL, leucocitos > 12.000 /mm3, sangre positiva en el aspirado nasogástrico y edad mayor de 65 años (Tabla 3).
Con estas variables se realizó un análisis de regresión logística con la intención de identificar aquellas que tuvieran correlación con la presencia de sangrado activo. El modelo de regresión identificó seis variables fuertemente relacionadas con la presencia de sangrado: lipotimia, Hb < 8, leucocitos > 12.000/mm3, sangre presente en el aspirado gástrico, inestabilidad hemodinámica y edad mayor de 60 años (Tabla 4).

Estas seis variables fueron tomadas como base para la predicción de sangrado activo al momento de la endoscopia inicial, como lo muestra la Tabla 5, hay una tendencia a tener mayor probabilidad de sangrado en la medida en que se tengan más variables así: sólo 4.8% de los pacientes con una variable presente están sangrando al momento de la endoscopia mientras que 75% de los que presenten cinco y el 100% de los que presenten seis variables están con sangrado activo.

Los coeficientes de las seis variables fueron divididos por cinco y redondeados al número entero más cercano para diseñar así una escala integrada que permitiera dar un valor a cada variable de acuerdo con el peso que cada una de ellos tuviera con la variable de desenlace (sangrado activo). La escala se presenta en la Tabla 6.

En la Tabla 7 se observa que esta escala tiene una adecuada capacidad de discriminación entre los pacientes con y sin sangrado activo. De acuerdo con esta clasificación sólo uno (1.6%) con puntuación 0 a 3, considerados de bajo riesgo, tuvieron sangrado activo. En contraste ocho (80%) de los diez pacientes con puntuación de 11 a 18 presentaban sangrado al momento de la endoscopia.
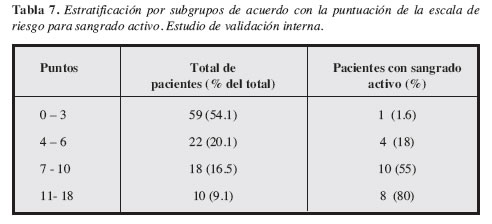
Validación externa
La escala de predicción calculada en el estudio inicial se aplicó en un grupo independiente de 98 pacientes que ingresaron al servicio de urgencias de septiembre de 2005 a junio de 2006, con diagnóstico de HVDA aguda (61 hombres, 37 mujeres, edad promedio 56.2 ± 16 años). Los síntomas más frecuentes fueron melenas (82.7%), hematemesis (60.2%) y lipotimia (26.5%). La úlcera péptica gástrica o duodenal constituyeron la lesión más frecuente (59.2%) y el sangrado activo se encontró en 15 pacientes (15.6%). Durante su hospitalización 25 pacientes recibieron tratamiento endoscópico con terapia de inyección y ninguno de ellos presentó complicación derivada de este procedimiento. La terapia endoscópica fue exitosa en detener el sangrado inicial en todos los pacientes y no hubo mortalidad relacionada con la hemorragia. Las seis variables contenidas en el modelo encontraron mayor proporción en los pacientes con sangrado activo, y de ellas la lipotimia (14/26; 53% Vs 1/72;1.4%), la Hb < 8 (9/30; 30% Vs 6/68; 8.8%) y el sangrado por SNG (14/19; 73.7% Vs 1/79; 1.3%) alcanzaron diferencia estadísticamente significativa (p< 0.01).
Al aplicar la escala de predicción para sangrado activo en este grupo, se encontró que en 88 pacientes con una puntuación menor de 7 ninguno de ellos presentaba sangrado activo al momento de la endoscopia. En contraste, el sangrado activo fue encontrado en la endoscopia temprana en el 26.7% de los pacientes con 7 a 10 puntos y en el 73.3% de los pacientes con 11 o más puntos. Se observó claramente que el 100% de los pacientes con sangrado activo presentaron una puntuación igual o superior a 7, la mayoría de ellos con una mayor a 11 (Tabla 8).
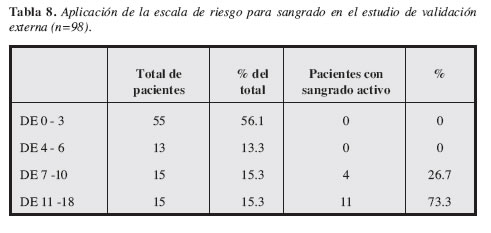
Para identificar el punto más alto de relación entre sensibilidad y especificidad de la escala para pacientes con sangrado activo, se construyó una curva ROC (curva de características operativas para el receptor) en la cual se encontró que el punto de corte en donde existía un mayor equilibrio entre sensibilidad y especificidad de la escala fue de 7. La sensibilidad, especificidad y valores predictivos de la escala, tomando como base el número como punto de corte son presentados en la Tabla 9.

Discusión
No obstante los diversos avances en el manejo médico y quirúrgico, la HVDA sigue siendo una emergencia médica con una significativa morbimortalidad (1, 2) y además es la primera causa de consulta a los gastroenterólogos que realizan turnos en urgencias, para que realicen una EVDA urgente temprana (lo más pronto posible) con fines diagnósticos y terapéuticos (3). La Asociación Americana de Endoscopia considera que el tiempo ideal para realizar una endoscopia urgente temprana es dentro de las primeras 12 horas de ingreso del paciente (15, 16); algunos autores sugieren que se realice incluso en la sala de urgencias (17); sin embargo, la adaptación en nuestro medio a estas recomendaciones es muy difícil porque implicaría servicios de endoscopia digestiva abiertos las 24 horas a la espera de estos pacientes, con toda la infraestructura física y humana que ello implica (18).
La evaluación de los factores de riesgo cuando se presenta una HVDA ha sido motivo de de investigación en las últimas dos décadas y el propósito generalmente ha sido estratificar los pacientes en grupos de bajo o alto riesgo para resangrado, necesidad de transfusión, cirugía o muerte (19-21), con el fin de investigar diferentes protocolos de manejo, necesidad de remisión a una unidad de cuidados intensivos, así como una mejor utilización de los recursos. Para ello se han diseñado múltiples escalas numéricas en múltiples estudios científicos (4-14) y se han presentado en innumerables congresos científicos. Sin embargo, no se ha hecho énfasis en buscar escalas para predecir sangrado activo y sólo se ha publicado un estudio a nivel mundial (22) que busca predecir si el paciente tiene o no sangrado activo en el momento de la endoscopia.
En este trabajo original encontramos en la primera fase, en un grupo de 109 pacientes que ingresaron al servicio de urgencias de nuestro hospital con HVDA, que nueve factores (lipotimia, shock, inestabilidad hemodinámica, hemoglobina menor de 8, leucocitos mayores de 12.000, sangre en el aspirado nasogástrico, hematemesis y edad > 65 años) tuvieron significancia estadística en el análisis univariado cuando se comparó el grupo de pacientes con sangrado activo (n=23) con los que no estaban sangrando (n=86). Cuando se realizó el análisis multivariado, seis factores (lipotimia, inestabilidad hemodinámica, hemoglobina menor de 8, leucocitos mayores de 12.000, sangre en el aspirado nasogástrico, y edad > 65 años), todos fáciles de identificar al ingreso del paciente en urgencias, fueron asociados con el riesgo de sangrado activo durante la EVDA urgente temprana. Con base en estos seis factores se construyó la siguiente escala que se puede expresar como una fórmula matemática así:
"UNAL": la escala se denominó UNAL, en honor a la Universidad Nacional de Colombia, centro donde se creó esta escala.
Escala "UNAL" de sangrado = 5 x (Sangre en la SNG)+4 x (Hemoglobina < 8)+4 x(Lipotimia) + 2x(leucocitos > 12.000) + 2x(Edad > 65 años) + 1x(Inestabilidad hemodinámica)
Máximo puntaje = 18
Mínimo puntaje =0
Para propósitos del cálculo matemático la presencia de cada uno de los factores es igual a uno y su ausencia es igual a cero.
Esta escala es una herramienta muy simple que puede ser útil para predecir sangrado activo e identificar grupos que requieren EVDA urgente como lo demostró nuestro estudio tanto en el grupo de validación interna como en el de validación externa.
Es muy importante aclarar que los seis factores identificados en esta escala original son factores de riesgo de sangrado activo y no deben ser considerados como factores pronósticos de resultados postendoscópicos como lo es la escala de Rockall y otras (7) cuyas variables de desenlace o "end points" son el riesgo de resangrado, cirugía o mortalidad.
Nuestros resultados difieren de los del estudio de Bobrowski y col (23), quienes no encontraron utilidad en ninguno de los parámetros rutinarios que se registran en urgencias para determinar la urgencia de la EVDA, pero ese trabajo fue retrospectivo, tuvo un tamaño de muestra pequeño y fue publicado en resumen y por lo tanto no hay información sobre su validez interna incluyendo el tipo de control para evitar los sesgos.
En nuestro trabajo, la presencia de sangre fresca por la sonda nasogástrica fue el mayor signo asociado a sangrado activo 69.6 % vs 7.0% p<0.001, lo cual confirma resultados de otros estudios en los cuales se ha demostrado que es un predictor de resultados adversos (24, 25). A pesar de que en muchos centros de referencia se ha ido abandonando el uso rutinario de sonda nasogástrica, como parte del manejo de pacientes con HVDA, porque en 10-15% de pacientes con un drenaje claro puede encontrarse un sangrado activo a la endoscopia (26) y puede ocasionar daños a la mucosa que se pueden confundir con lesiones en el examen endoscópico. Es importante resaltar que en el presente estudio, la SNG fue utilizada como parte de la evaluación para determinar la necesidad de una endoscopia de urgencia. Este hallazgo resalta nuevamente que el sangrado por la SNG tiene un gran valor predictivo de sangrado activo y como recientemente fue considerado en una conferencia de consenso en Canadá, su uso como parte de la evaluación inicial, es recomendable en pacientes seleccionados (26). Otros trabajos recientes como el de Aljebreeen y cols (24) también han demostrado que el drenaje hemático por la SNG en pacientes con HVDA, se asocia de manera significativa con sangrado activo a la EVDA (OR 4.82). El hallazgo de sangrado activo en el 69.6% de los pacientes que tuvieron drenaje hemático por la SNG, es sensiblemente similar al encontrado por Adamopoulos y cols (22) que fue del 73% (37/51). La SNG se sigue utilizando en nuestro medio y nosotros consideramos que puede seguir siendo útil y así lo corrobora este trabajo.
En el articulo de Adamopoulos (22) se estableció que además del sangrado por la sonda otros factores asociados significativamente con sangrado activo en el momento de la endoscopia fueron: inestabilidad hemodinámica (OR 8.7), hemoglobina menor 8 g/dL (OR 8.1), leucocitos mayores de 12.000 (OR 5.2). En nuestro trabajo encontramos que estos factores también fueron asociados con sangrado activo de manera significativa, pero además encontramos que la presencia de lipotimia y una edad mayor a 65años fueron asociadas con sangrado en el modelo de regresión logística que permitió construir la escala.
La definición de inestabilidad hemodinámica en este trabajo no sólo implica la presencia de shock hipovolémico sino el aumento de la frecuencia por encima de 100 pulsaciones por minuto, lo cual puede reflejar la inminencia de un shock sobre todo en paciente con función cardiovascular comprometida. Este hallazgo se presentó de manera significativa, más en el grupo con sangrado activo que en el que no estaba sangrando 69.6% vs 15.1% (p < 0.005), lo cual refleja su utilidad como un indicador de sangrado activo.
La hemoglobina se prefirió al hematocrito como un parámetro más preciso de sangrado agudo, porque el hematocrito puede no alterarse en las fases iniciales del sangrado. El nivel de hemoglobina que se utilizó fue menor a 8 g/dL porque es el punto a partir del cual se indica la transfusión sanguínea en muchos centros de acuerdo con las características clínicas del paciente (16). Este indicador también se presentó de manera más significativa en el grupo que estaba sangrando 73.9% vs 17.4% p= <0.001.
La presencia de leucocitos mayores a 12.000/mm3 llama la atención como un parámetro predictivo de sangrado y este estudio no es el único que ha hecho esta referencia en la literatura porque también está en el trabajo de Amadopoulos. Los autores atribuyen este hallazgo a una reacción al estrés del sangrado agudo y aclaran que tiene muy poco valor cuando se presenta de manera aislada no confiriendo riesgo de sangrado activo en el paciente.
Cuando evaluamos el comportamiento de la presente escala en los 109 pacientes incluidos en el estudio de validación interna encontramos que hay una tendencia a tener mayor probabilidad de sangrado en la medida en que estén presentes un mayor número de las variables clínicas identificadas en la escala, de tal forma que sólo el 4.8% de los pacientes con sólo una variable presente están sangrando al momento de la endoscopia, mientras que el 75% de los que presentan cinco y el 100% de los que tienen seis variables están con sangrado activo (Tabla 5).
A través de la construcción de una curva ROC se encontró que el punto de corte donde se hace máxima la sensibilidad y especificidad de esta escala es 7, de tal forma que si la escala es menor a 7 puntos significa que el paciente no tiene sangrado activo y por lo tanto no necesita una EVDA urgente, pero si tiene 7 o más puntos sí la requiere.
Aplicando este instrumento a los 98 pacientes del estudio de validación externa encontramos que la escala tuvo un mayor poder de discriminación especialmente en descartar sangrado activo con una sensibilidad = 78.3; especificidad = 88.4; VP positivo = 64.3 ; VP negativo = 93.8. Observamos que ninguno de los pacientes con puntuación baja (menor de 7) tenía sangrado activo al momento de la EVDA inmediata, esto indica que el valor predictivo de la escala es del 100% y nos da pautas para tomar decisiones racionales para solicitar o no una EVDA inmediata sobre datos más confiables, lo cual es excelente si tenemos en cuenta que en nuestro país a la fecha no existía ninguna escala similar o una guía clínica que le permitiera al médico tratante de los pacientes con HVDA discriminar cuál grupo de pacientes tiene un sangrado activo y decidir la realización de EVDA y cuáles no.
Consideramos que esta escala tiene una gran aplicabilidad en nuestro medio, pues como hemos reiterado, existen pocos centros (en la red de la Secretaría de Salud para más de 4 millones de personas sólo existe uno) que tienen servicio de endoscopia las 24 horas, que se congestionan con pacientes remitidos porque presentaron melenas, hematemesis o melanemesis y el médico remitente desconoce si el paciente está sangrando o no y teme esperar para realizar una EVDA. Nuestra escala le está dando una herramienta sólida validada interna y externamente en dos grupos independientes de pacientes, para que este médico tenga otra herramienta que le permita decidir si deja en observación al paciente y espera más de 12 horas para la EVDA (cuando el endoscopista esté en su horario regular) o por el contrario, para que tenga más argumentos y remita inmediatamente al paciente a otro centro para EVDA de urgencias. La escala también puede ser útil para los endoscopistas que hacen turnos de disponibilidad (no presenciales) porque telefónicamente podrían discutir con el médico de urgencias y conocer la puntuación de la escala y si el puntaje del paciente es menor de 7 puntos puede optar por realizar la EVDA al día siguiente, pero si tiene 7 o más puntos debería realizar la EVDA en forma inmediata.
Conclusión
En conclusión hemos realizado un trabajo en el cual se ha encontrado que una escala simple fácil de memorizar, construida con parámetros clínicos y de laboratorios disponibles en cualquier hospital, puede identificar pacientes con HVDA y sangrado activo, que ameritan una EVDA urgente, así como los pacientes que no necesitan ese procedimiento de manera inmediata.
Esta escala, realizada sobre sólidas bases matemáticas puede ser utilizada en hospitales que no cuentan con un servicio de gastroenterología las 24 horas del día o como herramienta para priorizar la remisión de los pacientes en centros donde no haya EVDA disponible. Nosotros recomendamos la aplicación clínica de nuestra escala porque en el estudio de validación externa tuvo un excelente comportamiento sobre todo para descartar sangrado activo, demostró ser consistente y de alto valor discriminativo cuando se evaluó en dos grupos independientes de pacientes.
Referencias
1. Laine L, Peterson WL. Bleeding peptic ulcer. N Engl J Med 1994; 331: 717-27 [ Links ]
2. Lee JG, Turnipseed S, Romano PS, Vigil H, Azari R, Melnikoff N, et al. Endoscopy-based triage significantly reduces hospitalization rates and costs of treating upper GI bleeding: a randomized controlled trial. Gastrointest Endosc 1999; 50: 755-61 [ Links ]
3. Longstreth GF, Feitelberg SP. Successful outpatient management of acute upper gastrointestinal hemorrhage: use of practice guidelines in a large patient series. Gastrointest Endosc 1998; 47: 219-21 [ Links ]
4. Pimpl W, Boeckl O, Waclawiczek HW, Heinerman M. Estimation of the mortality rate of patients with severe gastroduodenal hemorrhage with the aid of a new scoring system. Endoscopy 1987; 19: 101-6 [ Links ]
5. Bordley DR, Mushlin AI, Dolan JG, Richardson WS, Barry M, Polio J, et al. Early clinical signs identify low-risk patients with acute upper gastrointestinal hemorrhage. JAMA 1985; 253: 3282-5 [ Links ]
6. Corley DA, Stefan AM, Wolf M, Cook EF, Lee TH. Early indicators of prognosis in upper gastrointestinal hemorrhage. Am J Gastroenterol 1998; 93: 336-40 [ Links ]
7. Rockall TA, Logan RF, Devlin HB, Northfield TC. Risk assessment after acute upper gastrointestinal haemorrhage. Gut 1996; 38: 316-21 [ Links ]
8. Saeed ZA, Winchester CB, Michaletz PA, Woods KL, Graham DY. A scoring system to predict rebleeding after endoscopic therapy of nonvariceal upper gastrointestinal hemorrhage, with a comparison of heat probe and ethanol injection. Am J Gastroenterol 1993; 88: 1842-9 [ Links ]
9. Hay JA, Lyubashevsky E, Elashoff J, Maldonado L, Weingarten SR, Ellrodt AG. Upper gastrointestinal hemorrhage clinical guideline: determining the optimal hospital length of stay. Am J Med 1996; 100: 313-22 [ Links ]
10. Blatchford O, Murray WR, Blatchford MA. A risk score to predict need for treatment for upper-gastrointestinal haemorrhage. Lancet 2000; 356: 1318-21 [ Links ]
11. Kollef MH, Canfield DA, Zuckerman GR. Triage considerations for patients with acute gastrointestinal hemorrhage admitted to a medical intensive care unit. Crit Care Med 1995; 23: 1048-54 [ Links ]
12. Kollef MH, O rquote Brien JD, Zuckerman GR, Shannon W. BLEED: a classification tool to predict outcomes in patients with acute upper and lower gastrointestinal hemorrhage. Crit Care Med 1997; 25: 1125-32 [ Links ]
13. Provenzale D, Sandler RS, Wood DR, Levinson SL, Frakes JT, Sartor RB, et al. Development of a scoring system to predict mortality from upper gastrointestinal bleeding. Am J Med Sci 1987; 294: 26-32 [ Links ]
14. Cameron EA, Pratap JN, Sims TJ, Inman S, Boyd D, Ward M, et al. Three-year prospective validation of a pre-endoscopic risk stratification in patients with acute upper-gastrointestinal haemorrhage. Eur J Gastroenterol Hepatol 2002; 14: 497-501 [ Links ]
15. Adler DG, Leighton JA, Davila RE, Hirota WK, Jacobson BC, Qureshi WA. ASGE guideline: the role of endoscopy in acute non-variceal upper-GI hemorrhage. Gastrointest Endosc 2004; 60: 497-504 [ Links ]
16. Eisen GM, Dominitz JA, Faigel DO, Goldstein JL, Kalloo AN,Petersen BT, et al. An annotated algorithmic approach to upper gastrointestinal bleeding. Gastrointest Endosc 2001; 53: 853-8 [ Links ]
17. Cook DJ, Guyatt GH, Salena BJ, Laine LA. Endoscopic therapy for acute nonvariceal upper gastrointestinal hemorrhage: a meta-analysis. Gastroenterology 1992; 102: 139-48 [ Links ]
18. Jensen DM, Kovacs TO, Jutabha R, Machicado GA, Gralnek IM, Savides TJ, Smith J, et al. Randomized trial of medical or endoscopic therapy to prevent recurrent ulcer hemorrhage in patients with adherent clots. Gastroenterology 2002;123: 407-13 [ Links ]
19. Rockall TA, Logan RFA, Devlin HB, Northfield TC. Selection of patients for early discharge or outpatient care after acute upper gastrointestinal haemorrhage. National Audit of Acute Upper Gastrointestinal Haemorrhage. Lancet 1996;347:1138-40. [ Links ]
20. Vreeburg EM, Terwee CB, Snel P, Rauws EA, Bartelsman JF, Meulen JHP, et al. Validation of the Rockall risk scoring system in upper gastrointestinal bleeding. Gut 1999; 44: 331-5 [ Links ]
21. Cipolletta L, Bianco MA, Rotondano G, Marmo R, Piscopo R. Outpatient management for low-risk nonvariceal upper GI bleeding: a randomized controlled trial. Gastrointest Endosc 2002; 55: 1-5 [ Links ]
22. Adamopoulos AB, Baibas NM, Efstathiou SP, Tsioulos DI, Mitromaras AG, Tsami AA, et al. Differentiation between patients with acute upper gastrointestinal bleeding who need early urgent upper gastrointestinal endoscopy and those who do not. A prospective study. Eur J Gastroenterol Hepatol 2003;15: 381-7 [ Links ]
23. Bobrowski C, Ciftrioglu M, Fritscher-Ravens A, Kreyman G. Predictors of necessity of upper gastrointestinal endoscopy in an emergency ward. Endoscopy 2001; 33 (suppl 1): 310A [ Links ]
24 Aljebreen AM, Fallone CA, Barkun AN. Nasogastric aspirate predicts high-risk endoscopic lesions in patients with acute upper-GI bleeding. Gastrointest Endosc 2004; 59: 172-8 [ Links ]
25 Cuellar RE, Gavaler JS, Alexander JA, Brouillette DE, Chien MC, Yoo YK, et al. Gastrointestinal tract hemorrhage. The value of a nasogastric aspirate. Arch Intern Med 1990; 150: 1381-4 [ Links ]
26. Barkun AN, Chiba N, Enns R, Marshall J, Armstrong D, Sabbah S, et al. Use of a national endoscopic database to determine the adoption of emerging pharmacological and endoscopic technologies in the everyday care of patients with upper GI bleeding: the RUGBE initiative. Am J Gastroenterol. 2001; 96: S261. [ Links ]














