Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.57 no.3 Palmira July/Sept. 2008
RESUMEN
El estudio se llevó a cabo en recolectas de Rhoeo spathacea realizadas en Veracruz, Chiapas, Tabasco, Yucatán, Quintana Roo y Michoacán, México. Las plantas presentaron número diploide de cromosomas (2n=12) en mitosis. En meiosis los individuos formaron anillo y/o cadenas en metafase I, con excepción de varios mutantes desinápticos-RSD (separación de cromosomas apareados). En meiosis de Rhoeo no se observan bivalentes ni hay posibilidades de entrecruzamiento, y consecuentemente no habrá quiasmas ya que no hay cuatro cromátidas de las cuales dos deberían ser no-hermanas. Sin embargo, en anafase I hay disyunción altamente regular 6:6 que se presentan como "anillos o donas" con los brazos cortos hacia el interior de esas figuras. De la autofecundación de un mutante desináptico-RSD (GAVA 1.1) se obtuvo una progenie F2 de 123 individuos: 90 diploides-formadores de anillos y 1 acrotrisómico (2n=13). Esto es, 91 individuos "revirtieron" el comportamiento y 29 fueron diploandróginos tetraploides desinápticos (2n=24) y 3 hipertetraploides (2n=25 desinápticos). Este comportamiento diferente entre hermanos confirma que Rhoeo es dicarión: los diploides- con anillo tendrán el subgenoma A, y los tetraploides el B, que incluyen cromatidas hermanas en la restitución en segunda división (2n).
Palabras claves: Meiosis no ortodoxa; apareamiento no paralelo; unión telomero-atelomero
ABSTRACT
This study was carried out with collected material of Rhoeo spathacea in the states of Veracruz, Chiapas, Tabasco, Yucatan, Quintana Roo and Michoacan, Mexico. All material exhibited a diploid chromosome number (2n =12) in mitosis. In meiosis, all individuals showedring and /or chains at metaphase I. Exceptionally several desynaptic mutants resulted desynaptic – SDR (dissociation of paired chromosomes). Therefore, in meiosis Rhoeo did not exhibit synapsis in parallel-fashion instead the chromosomes are united in end-to-end (no chiasmata-) fashion. Then, there are not bivalents, no chiasmata-achiasmata- as there are not four chromatids two of which resulted sister-chromatids. But in anaphase I, there is high regular 6:6 disyuction and observed as "Rings or donuts". In which short arms are oriented to the center of those figures. From selfed a desynaptic- SDR (GAVA 1.1) mutant, a progeny of 123 individuals resulted: 90 diploid-ring forming, 1 acrotrisomic (2n=13) equally ring-forming reverts its "meiotic behavior", but 29 diplandrogynous tetraploids (2n=24) and 3 hypertetraploids (2n=25) resulted desynaptics. The cytological behaviour is due to the fact that Rhoeo Is a dikaryon: diploids-ring forming and the trisomic also and present subgenome A, but polyploids present subgenome B which includes a desynaptic gene in both sister chromatids as result of restitution at second division(2n).
Key words: No orthodox meiosis; no parallel pairing; telomere-to-telomere attachment.
Rhoeo spathacea (Swartz) Stearn es el ejemplo clásico de los complejos de translocaciones múltiples que presentan anillos y/o cadenas de los doce cromosomas. Rhoeo exhibe un sistema peculiar en meiosis en donde el apareamiento cromosómico está restringido a regiones terminales y en donde no hay sinapsis; los quiasmas se forman terminalmente (Stack y Soulliere, 1984; García, 1991 y 1995).
Esta especie monotípica originaria de América tropical se utiliza ampliamente como ornamental. Se reconocen tres morfotipos: R. spathacea var. Spathacea, forma típica con hojas bicoloredas, verde oscuro en el envés; R. spathacea var. con color con hojas verdes (Baker y Mertens, 1975; Verma y Ohri, 1979); y R. spathacea var. variegata, de hojas con rayas amarillentas longitudinales en el haz y alternas con rayas verde oscuro. Las dos primeras variedades crecen silvestres y en forma simpátrica en Veracruz, Chiapas, Tabasco, Campeche, Yucatán y Quintana Roo; la variedad variegata no se ha localizado creciendo en forma silvestre, únicamente como quimera en la var. spathacea.
Estudios meióticos en Rhoeo incluyen triploides espontáneos (Lin et al., 1984) y tetraploides (Walters y Gerstel, 1948; García, 1991 y 1994). Plantas que forman únicamente bivalentes en meiosis fueron descubiertos por Wimber (1968). García (1991 y 1994) observó mutantes desinápticos en MI, restitución cromosómica en segunda división (RSD), colapso de tetradas, presencia de mixoploides (en número cromosómico y comportamiento meiótico), presencia de cromosoma acrocéntrico y aneuploides (2n+ 1 y 2n= 4x+1). Además de estos cambios se ha observado formación de anillos u orientación en Anafase I 6:6 (García, 1995).
La meiosis permanece como una de las áreas problemáticas en biología con poca información sobre mecanismos y tiempo de eventos importantes como el reconocimiento de cromosomas homólogos, sinapsis y recombinación. El proceso presenta variaciones genéticas en apareamiento cromosómico, formación y orientación de quiasmas.
La investigación describió el comportamiento meiótico y el cariotipo de progenies derivadas de un individuo diploide (2n=12) formador de anillos en meiosis y del cual se desarrollaron diploides formadores de anillos y un desináptico y con restitución cromosómica en segunda división en F1.
Se utilizó una planta diploide (2n=12) formadora de anillos y/o cadenas en meiosis y de progenies F1, F2 y F3 obtenidas por autofecundación. En F1 se obtuvo un mutante desináptico-SDR (García, 1991), identificado como GAVA 1.1, del cual se obtuvieron F2 y F3, igualmente por autofecundación espontánea. Estas plantas se mantienen en invernadero.
Para el conteo del número cromosómico se tomaron ápices radicales, se trataron por 5h con solución acuosa de 8-Hidroxiquinolina 0.002M (0.29 g/L a 16°C), por 24 h con etanol, ácido acético glacial (3: 1). Se hidrolizaron durante 8 minutos en HCl 1N a 60 °C, se colorearon por 8 minutos en reactivo de Schiff a 60°C, se maceraron 2h en citasa (jugo gástrico de caracol de jardín, Helix sp.) y se aplastaron en orceina propiónica 1.8% (P/v).
Para el análisis del comportamiento meiótico se seleccionaron por tamaño yemas florales, se disectaron las anteras y se aplastaron directamente en orceina propiónica; el comportamiento cromosómico se observó en células madres del polen en metafase I y fases subsecuentes.
Se obtuvieron dibujos y fotografías de los cromosomas dispersos utilizando un aditamento de dibujo a X3200 y película Kodalith en un microscopio FOMI III con lentes X100 plan apocromáticas y neuflunar de inmersión.
En profase I de meiosis se observaron miles de células madres del polen (C.M.P.) de más de cien plantas; la unión de los cromosomas presentó la forma de telómero-con-telómero (end-to-end, en inglés) (Figura 1 A y B). Esta forma de asociación cromosómica de Rhoeo difiere del cigoteno común en donde la sinapsis paralela entre homólogos origina bivalentes en organismos diploides (Rieger et al., 1976). Los telómeros se han implicado como estructuras clave de los cromosomas meióticos en el proceso de apareamiento, independientemente del arreglo cromosómico premeiótico (Scherthan, 1997). Entonces la unión que presentan los cromosomas de Rhoeo en profase I concuerda con la función de los telómeros, y seguramente serán telómeros homólogos.
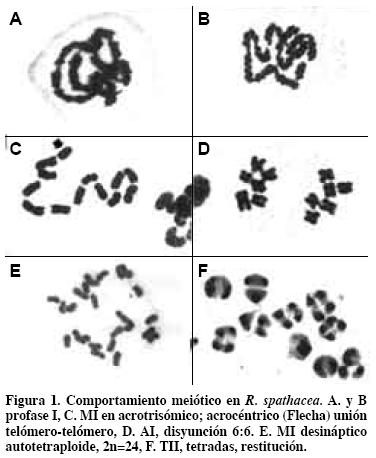
En 2884 C.M.P. de 10 individuos diploides (2n=12) el porcentaje de anillos se redujo de 100% a 17.4%, y el de cadenas a 26.5% (García, 2000). Siempre se observó la unión telómero a telómero, pero no la presencia de bivalentes. Por tal razón no hay cuatro cromátidas por bivalentes; no hay quiasmas y no se observó entrecruzamiento (Figura 1 C).
Los quiasmas, característica central de la meiosis en la mayoría de los organismos, constituyen la evidencia citológica del cruzamiento entre cromátidas no-hermanas (Creighton y McClintock, 1931). Los quiasmas se caracterizan por: i) ocurrir en la etapa de cuatro cromátidas, cuando los homólogos constan de dos cromátidas; ii) únicamente dos de las cuatro cromátidas de un bivalente participan en un entrecruzamiento, y estas son no-hermanas; iii) con raras excepciones, en el intercambio se originan productos recíprocos (John y Lewis, 1975). Estos puntos no ocurren en la profase I de Rhoeo, en donde no se presentan bivalentes, ni cromátidas, ni entrecruzamientos. García (1995) obtuvo un individuo acrotrisómico en la F2 de un mutante desináptico- SDR. El cariotipo de Rhoeo es bimodal, con cromosomas metacéntricos y submetacéntricos (Natarajan y Natarajan, 1972) y no tienen dos cromosomas totalmente homólogos (García, 1995). El brazo corto del cromosoma acrocéntrico es muy pequeño y el largo es de mayor tamaño que cualquier otro brazo largo; ello evidencia que en la meiosis del progenitor del acrocéntrico (GAVA 1.1) ocurrió intercambio cromosómico. Los cromosomas presentan en el trisómico una relación de brazos r=12, en el acrocéntrico cuando los cromosomas meta o sub-meta presentan r=1.0 a 3.1 (García, 1995). En MI del acrotrísomico el cromosoma ACRO- se une por el brazo largo (Figura 1 C, flecha) o se mantiene como univalente. Entonces puede decirse que este cromosoma tiene un telómero en el brazo largo que se une a otro largo, lo que no ocurre en el brazo corto.
El mutante GAVA 1.1 (Figura 3) desináptico-SDR (García, 1991) dio lugar al cromosoma acrocéntrico en la unión telómero con telómero (García, 1995). Este mutante con 12I en MI y AI altamente regular 6:6 (Figura 2 A y B) presenta, además, una ordenación circular o "dona" en cada núcleo, con los brazos cortos hacia el centro. Las cromátidas se conservaron unidas durante la primera meiosis.

Como resultado de la autofecundación del mutante GAVA 1.1 se tuvieron 123 individuos. Citológicamente se observaron dos comportamientos: los diploides (90) y el acrotrisómico presentaron en MI anillos y cadenas (García, 1995 y 2000). Los individuos poliploides (2n=24 y 2n=25, con 29 y 3 individuos, respectivamente) (Figura 1E) mostraron MI con univalentes: 24 o 25 dispersos en el citoplasma. Koduro y Rao (1981) señalan que la desinapsis es un carácter monogénico recesivo, por lo que se esperaría que toda la F2 fuera desináptica en MI. Por este comportamiento diferente en diploides y acrotrisómico (2n= 12 y 2n=13) y los poliploides se puede inferir que existen dos subgenomas, y el A no es portador del gene desináptico.
García (1991 y 2000) observó que los autotetraploides resultan de la fusión de gametos 2n producidos por restitución en segunda división en ambos sexos y necesariamente llamados diploandróginos autotetraploides. Los gametos restituidos resultan de falla en la citocinesis reduccional y ecuacional. Por el comportamiento observado en AI del mutante GAVA 1.1 puede suponerse que los subgenomas A y B se distribuyen en polos opuestos, por tanto en TII la restitución cromosómica incluirá cromátidas hermanas; en consecuencia serán genéticamente desinápticos. El otro subgenoma no es portador del gen desináptico y además no produce restitución, y los individuos producto de fusión de estos gametos (n) serán diploides y formarán anillo y/o cadenas en MI.
Este comportamiento en Rhoeo confirma que es un organismo dicarióntico.
Como se observa en los datos obtenidos en AI de Rhoeo por varios autores (Tabla 1) en diploides, trisómico y poliploides, 2n=12, 2n=13 y 2n=24, respectivamente, la disyunción es altamente regular. Se producen diferentes grados de esterilidad, posiblemente originada por desbalance genético.
Rhoeo puede ser modelo para conocer más sobre la meiosis, que permanece como una de las áreas de mayor problemática de la biología; con poco conocimiento de los mecanismos de eventos importantes para el reconocimiento de homólogos, sinapsis y recombinación.
La meiosis en Rhoeo no es el ejemplo de translocaciones heterocigóticas.
No presenta las fases de profase I de meiosis ortodoxa en donde se tiene sinapsis paralela entre cromosomas homólogos, no hay quiasmas que indican la recombinación entre homólogos.
La meiosis en Rhoeo presenta unión cromosómica telómero-a-telómero, hay un dicarión que se evidenció con la presentación de un gene desináptico y de restitución cromosómica en segunda división.
En anafase I los cromosomas segregan regularmente 6:6 y se presentan "donas" en cada genoma.
A la doctora Creuci Maria Caetano y a la Universidad Nacional de Colombia, sede Palmira, por invitarme a participar en el II SLACE (15-18 de agosto de 2007); y al doctor Hernando Ramírez y a los editores anónimos, por las correcciones del artículo.
1. Baker, R. F.; Mertens, T. R. 1975. Meiosis in variegated and anthocyaninless varieties of Rhoeo. J Hered 66: 381-383. [ Links ]
2. Creighton, H. B.; McClintock, B. 1931. A correlation of cytological and genetical crossing over in Zea mays. Proc Natl Acad Sci (U.S.A.) 17(8): 492-497. [ Links ]
3. García, V. A. 1991. Cytogenetical studies in Rhoeo spathacea (Commelinaceae). I A desynaptic and second division restitution mutant. Genome 34: 895-899. [ Links ]
4. García, V. A. 1995. Cytogenetical studies in Rhoeo spathacea (Commelinaceae). II. Characterization of an acrotrisomic plant. Cytologia 60: 319-327. [ Links ]
5. García, V. A: 1994. A desynaptic mutant in Rhoeo spathacea (Commelinaceae). Cytologia 59:399-404. [ Links ]
6. García, V. A. 1999. Cytologentical studies in Rhoeo spathacea (Commelinaceae). III. Mixoploid derived from a desynaptic plant. Cytologia 64: 45-49. [ Links ]
7. García, V. A: 2000. Cytogenetical studies in Rhoeo spathacea (Commelinaceae). IV. Ring-forming diploid and desynaptic tetraploid sibs. Cytologia 65:179-197. [ Links ]
8. John, B.; Lewis. K. R. 1975. Chromosome hierarchy. Oxford: Clarendon Press. [ Links ]
9. Koduro, F.R., Rao, M. K. 1981. Cytogenetics of synaptic mutants in higher plants. Theor. Appl. Genet. 59: 197-214. [ Links ]
10. Mertens, T. R. 1973. Meiotic chromosome behavior in Rhoeo spathacea L. Heredity 64:365-368. [ Links ]
11. Natarajan, A. T.; Natarajan, S. 1972. The Heterochromatin of Roheo discolor. Hereditas 72: 323-330. [ Links ]
12. Rieger, A.; Micahelio, M. ;Green, M. 1976. Glossary of Genetics and Cytogenetics. Berlín: Springer-Verlag. [ Links ]
13. Scherthan, H. 1997. Chromosome behavior in earliest meiotic prophase. p. 217-248. In: Enriques Gil, N.; Parker, J. S. ; Puertas, M. J. (eds.) Chromosome Today. London: Champman and Hall. V 12. [ Links ]
14. Stack, S. M.; Soulliere, D. L. 1984. The relation between synapsis and chiasma formation. Chromosoma 90: 72-83. [ Links ]
15. Verma, S. C.; Ohri, D. 1979. Breakdown of the classical meiotic system in Rhoeo spathace (Commelinaceae). Cytologia 44:91-102. [ Links ]
16. Walters, M. S.; Gerstel D. V. A. 1948. Cytological investigations of a tetraploid Rhoeo discolor. Am J Bot 35: 141-150. [ Links ]
17. Wimber, D. E. 1968. The nuclear cytology of bivalente and ring forming Rhoeo and their hybrids. Am J Bot 55:572-574. [ Links ]














