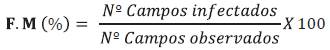Introducción
La relación simbiótica que se establece entre los hongos micorrícicos arbusculares (HMA) y las raíces promueve un mayor crecimiento y desarrollo de las plantas. Los hongos se benefician con el suministro de carbohidratos provenientes de la planta y ésta, a su vez, desarrolla una mayor capacidad de absorción de nutrientes del suelo a través de las raíces. lo que promueve su crecimiento y desarrollo (Martín et al., 2010). Los HMA constituyen vías alternativas para la nutrición de las plantas con efectos positivos sobre los rendimientos de los cultivos (Terry et al., 2006). Estos hongos forman simbiosis con las raíces de las plantas de manera natural y se encuentran en 95% de las especies vegetales (Miransari, Baharami, Rejali y Malakouti, 2009).
El micelio de los HMA funciona como un sistema radicular complementario de las plantas (Hernández et al., 2008) que se extiende más allá de la zona de reserva de nutrientes cercana a la raíz (Bucher, 2006), además cumplen funciones en la búsqueda, absorción y transporte de nutrientes para la planta, especialmente aquellos de lenta difusión en la solución del suelo como fósforo, zinc, cobre y amonio, con capacidad para absorber hasta 40 veces más que un pelo radicular gracias a su amplia exploración extra-radicular (Peña-Venegas y Cardona, 2010).
El café es considerado como un cultivo micótrofo obligatorio, con una alta dependencia micorrícica según la especie y la etapa de crecimiento (Fernández et al., 2005), siendo la etapa de vivero la más adecuada para la inoculación con hongos micorrícicos (Trejo et al., 1998).
Según Morton y Benny (1990)) y Del Águila et al., (2018) el sistema de hifas que se desarrolla fuera de la raíz permite una mayor exploración de los suelos incrementando, de esta manera, la captura y absorción por la planta de nutrientes de baja disponibilidad como el fósforo, cobre y zinc.
En la provincia de Rodríguez de Mendoza, Amazonas, Perú, el cultivo de café es un renglón importante dentro de la actividad agrícola y económica, alcanzando en 2015 una producción de 6914 t de café pergamino. Según el Ministerio de Agricultura y Riego (MINAGRI, 2015), en 2014 las provincias con mayor producción de café en la región de Amazonas fueron Utcubamba, Luya y Rodríguez de Mendoza.
Con base en lo anterior, el presente trabajo tuvo por objetivo evaluar la efectividad de 12 fuentes de inóculos de HMA-Nativos sobre la altura de planta, la producción de MS radicular y la parte aérea y el área foliar en plantas clonadas de café variedad Caturra en los ambientes del invernadero en la provincia Rodríguez de Mendoza, Región Amazonas-Perú.
Materiales y métodos
Área de estudio y localización de las fincas
El estudio se realizó en la provincia Rodríguez de Mendoza, región Amazonas-Perú, entre las coordenadas 6°18'57"S y 77°32'17"O, a 1295 m.s.n.m. El clima es cálido y húmedo y la región corresponde al ecosistema Ceja de Selva. La época más lluviosa ocurre entre noviembre y marzo, y la temperatura es variable entre 12 y 30 °C. Para el estudio fueron seleccionadas 12 fincas cafetaleras (Tabla 1) de las variedades Típica y Caturra, localizadas en los distritos Cochamal, Huambo, Mariscal Benavides, Omia y San Nicolás, cultivados con una tecnología intermedia tradicional en la región.
Diseño experimental
Los tratamientos fueron dispuestos en un Diseño Completamente Aleatorizado (DCA), con 13 tratamientos (12 consorcios de HMA-Nativos más un testigo), con tres repeticiones y cuatro plantas por repetición, para un total de 39 unidades experimentales.
Recolección y multiplicación de HMA- Nativos
La recolección se hizo en suelo rizosférico en 12 fincas cafetaleras a 30 cm a partir de la base del tallo principal de la planta de café y 30 cm de profundidad, de acuerdo con la recomendación de Montilla et al., (2005)). Las muestras fueron llevada a laboratorio, donde se dividieron en dos submuestras, una de ellas para realizar el conteo inicial de esporas y la otra fue llevada a los ambientes del invernadero para multiplicar las esporas, utilizando maíz (Zea mays L.) como planta nodriza (Sieverding, 1991). Después de 60 días, se suspendió la aplicación de riego a estas plantas y 20 días más tarde fueron cosechadas a ras de suelo (Del Águila et al., 2018).
Se preparó una mezcla de suelo esterilizado en horno a 200 °C y arena de río desinfectado en agua hervida 100 °C, en proporción (2:1 v/v). El contenido de P en la mezcla fue de 13 mg/ kg considerado como medio. Los clones de café variedad Caturra enraizados en micro túneles fueron inoculados individualmente con 1500 esporas de cada consorcio micorrícico obtenido en las plantas nodriza.
Clonación de plantas de café
Se seleccionaron 60 plantas de café de la variedad Caturra con alta productividad y tolerancia a roya, con un promedio de edad entre 6 y 8 años. Entre 60 y 90 días después de la inducción, proceso que consiste en agobiar las plantas de cafeto con dirección al suelo formando un ángulo de 45° y poda de ramas laterales para la activación de auxinas en las yemas axilares, generando brotes ortotrópicos. Estos brotes fueron cosechados y conducidos a laboratorio para su acondicionamiento, estandarizando el tamaño a 5 cm, con dos hojas y 50% de área foliar. Con el fin de prevenir la presencia de hongos, los brotes fueron desinfectados con Antracol 70% PM a una concentración de 3 g/l de agua durante 10 min. A continuación, la parte basal del brote fue introducida en una solución de hormona de ácido indol-butírico (AIB) a 2000 ppm aplicado a cada brote mediante el método de inmersión rápida, posteriormente fueron establecidos en cámara húmeda. Para mantener la humedad relativa en rangos mayores que 80%, cada hora durante 3 min se aplicó riego nebulizado en el interior del microtúnel durante el proceso de propagación clonal. Las plántulas de café clonadas fueron colocadas en un vivero con sombra al 80% por un periodo de 15 días y después fueron transferidos a otro vivero que tenía sombra al 50% por 15 días más completando así el proceso de aclimatación (Vallejos-Torres et al., 2019).
Parámetros evaluados
Los efectos de los consorcios micorrícicos (tratamientos) aplicados fueron evaluados tanto en las características morfológicas de las plántulas de café como en las variables fúngicas. Entre las características de la planta se incluyeron:
Altura de plántula (H)
La medición se realizó con una regla métrica desde la base del tallo hasta el ápice de la planta. Después de cada medición, el material utilizado fue desinfectado con alcohol al 96%, para evitar la contaminación entre los consorcios en estudio (Del Águila et al., 2018).
Área foliar (AF)
Para esta medición, se colocaron todas las hojas de las plantas de cafeto en una superficie oscura y fueron fotografiadas claramente para determinar el área foliar. La medición se hizo con el software ASSES, que permite calcular el área foliar mediante colores de contraste tomando como referencia un objeto calibrador con área conocida (Del Águila et al., 2018).
Materia seca radicular (MSR)
La determinación de materia seca radicular se hizo por secado de las raíces lavadas de las plantas de cafeto, en estufa a 60 °C por 72 h y el pesaje en una balanza analítica (Del Águila et al., 2018). Como características fúngicas se determinaron:
Porcentaje de colonización (PC).
Para esta determinación se hizo tinción de raíces siguiendo la metodología de Phillips y Hayman (1970) con azul de Trypano, vinagre y agua oxigenada antes de colocarlas en baño maría. Luego de la tinción fueron cortadas en trozos de 1 cm para obtener en total 30 fragmentos que fueron colocados en láminas portaobjetos y observadas en microscopio compuesto con aumento de los objetivos a 100X. Para el cálculo del porcentaje de colonización de hifas interna o frecuencia micorrícica (F.M.) se utilizó la fórmula de Sieverding (1983) (Ecuación 1) y para la evaluación de la intensidad micorrícica (I.M.) se aplicó fórmula de Trouvelot y Kough (1986)) (Ecuación 2).
Donde, N: Número total de raíces evaluadas y n: Número de fragmentos clasificados.
Longitud de micelio extra-radicular (LMER)
Para esta medición se pesó una muestra de 1 g de suelo la cual fue sometida al proceso de tinción de micelio extra-radicular propuesta por Robles (2009)), antes de ser colocada en placas Petri con cuadrantes de 0.5 cm2 en la base. Para la evaluación se utilizó un estereoscopio con aumentos de 3x y 4.5x, contando la intersección hifa/línea (Robles, 2009). El número de intersecciones obtenidas se reemplazó en la fórmula de determinación de longitud de micelio extra-radicular (cm) propuesta por Newman (1966)).
Análisis estadísticos
Los datos de altura, materia seca, área foliar y longitud de micelio fueron transformados por Vx+1 (Padrón, 1996); mientras que para los datos de intensidad y frecuencia micorrícica se utilizó la transformación angular arcsen Vx% (Box y Hunter, 1988). Con los datos obtenidos se realizó el análisis de variancia y para la comparación de las medias se utilizó la prueba de Tukey con nivel de significancia a = 0.05.
Resultados y discusión
Efecto de fuentes de inóculos de HMA nativos
El análisis de varianza (Tabla 2) para los diferentes tratamientos mostró diferencias (P < 0.05) para altura de planta-H, materia seca radicular - MSR, área foliar AF, intensidad micorrícica-IM, frecuencia micorrícica-FM, longitud de micelio-LM, sugiriendo que las variables evaluadas dependen, entre otras condiciones, de las fuentes de inóculos de HMA nativos.
Tabla 2 Cuadrados medios para el efecto del porcentaje de colonización de HMA nativos en características de planta de café (Coffea arabica), 120 días después del comienzo de la evaluación. Amazonas, Perú.

* = Significativo (P < 0.05). H: altura; MSR: materia seca radicular; AF: área foliar; IM: intensidad micorrícica; FM: frecuencia micorrícica; LM: longitud de micelio; SCM: suma de cuadrados medios, C.V.: coeficiente de varia ción; R2: coeficiente de determinación
La prueba de Tukey (Tabla 3) para los diferentes tratamientos mostró que los consorcios más eficientes en las variables morfológicas y fúngicas fueron el consorcio procedente de las fincas Omia-V (T10), San Nicolás-I (T1) y Omia- VI (T11), mostrando diferencias significativas (P < 0.05) respecto al testigo sin inoculación micorrícica.
Tabla 3 Efecto de los HMA nativos en el porcentaje de inoculación y características de plantas de café (Coffea arabica). Amazonas, Perú.
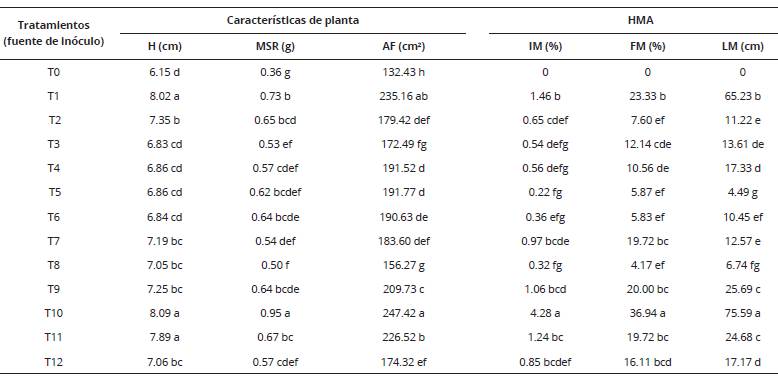
H: altura; MSR: materia seca radicular; AF: área foliar; IM: intensidad micorrícica; FM: frecuencia micorrícica; LM: longitud de micelio. * P < 0.05
El testigo presentó la menor tasa de crecimiento (altura) con 6.15 cm; mientras que la mayor altura se observó con el T10 Omia-V en la variedad Típica. Entre los tratamientos con inoculación micorrícica se encontraron valores desde 6.83 hasta 8.09 cm, con una tasa de incremento desde 6% a 25% respecto al testigo; resultado similar encontraron Del Águila et al., (2018) en condiciones de vivero encontrando incrementos entre 35% y 40% respecto al testigo. Mientras que Trejo et al., (2011)) en estudios realizados con inoculaciones de HMA a nivel de invernadero encontraron incrementos de altura de plantas de cafeto de 91% en comparación con el testigo siendo estos incrementos mayores que los encontrados en la presente investigación.
Para el área foliar se encontró una tendencia similar a la de la altura de planta; siendo nuevamente mayor con el T10, seguido de los tratamientos T1 y T11, consorcios micorrícicos procedentes de Omia-V, San Nicolás-I y Omia-VI. Al respecto Augé (2001)) indica que la asociación de hongo-planta genera incrementos de las tasas fotosintéticas, por tanto, lo que favorece el crecimiento y desarrollo de la planta.
La intensidad (4.28%) y frecuencia de colonización (36.94%) micorrícica por HMA-N fueron más altas en el T10 (Tabla 3). Las diferencias en condiciones ambientales y el tipo de suelo influyen en los resultados de la baja colonización, así, los HMA de un suelo se comportan diferente a los de otros suelos (Hart y Reader, 2002). Por su parte, Sieverding (1991)) encontró que la presencia de sombra en la simbiosis hongo-planta igualmente reduce la colonización micorrícica y la propagación de las esporas, lo que inhibe la colonización.
En la Figura 1 y 2 aparecen las correlaciones entre altura de planta con frecuencia e intensidad micorrícica en la variedad Caturra. Los resultados indican que el crecimiento y desarrollo de las plantas clonales de cafeto dependen de la longitud de micelio extra-radicular, siendo todos los consorcios de HMA-N efectivos en todos los tratamientos inoculados, en comparación con el testigo sin inóculo de HMA-N. En la Tabla 4 se observa que las correlaciones entre la longitud de micelio extra-radicular con las variables morfológicas de planta clonal fueron siempre altas y positivas, con valores entre 0.70 y 0.78, lo que concuerda con los resultados de Evans y Miller (1988)).

Figura 1 Correlación entre la frecuencia e intensidad Micorrícica y la altura de plantón de café variedad Caturra. Amazonas, Perú.
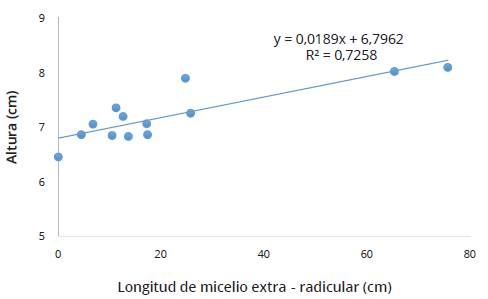
Figura 2 Correlación lineal entre la altura de planta de café y la longitud de micelio extra-radicular (LMER). Amazonas, Perú.
Tabla 4 Análisis de correlación lineal de Pearson entre variables morfológicas de clones de café y longitud de micelio extra-radicular (LMER). Amazonas, Perú.

Los mejores consorcios de HMA-N con mayor longitud de micelio extra-radicular fueron aquéllos procedentes de las localidades Omia-V, San Nicolás-I, Omia-IV y Omia-VI los cuales, a su vez, presentaron los mayores valores de altura de planta, área foliar y materia seca radicular, con valores promedios de micelio extra-radicular de 75.59 cm, 65.23 cm, 25.69 cm y 24.68 cm. Estos valores que el valor de 148.72 cm encontrado por del Águila et al., (2018). Esta diferencia es debida, entre otras causas, a la procedencia de los consorcios micorrícicos y a las condiciones particulares de los suelos (Hart y Reader, 2002). Las especies HMA encontradas en este estudio fueron: Acaulospora rugosa, A. foveata, A. mellea, A. tuberculata, A. rhemii, Acaulospora sp., Glomus geosporum, G. sinuosum, Glomus sp1., Glomus sp2. y Ambispora appendicula.
Conclusiones
El estudio demostró la importancia que tienen los consorcios de hongos HMA-N debido a su efecto positivo sobre el crecimiento en altura, área foliar y materia seca radicular de clones de café variedad Caturra, así mismo una buena capacidad colonizadora y longitud de micelio extra-radicular. La efectividad varió según la proveniencia de los consorcios micorrícicos, siendo los más eficientes aquellos recolectados en las localidades Omia-V, San Nicolás-I y Omia-VI, situados en dos distritos de Omia y San Nicolás, de la provincia de Rodríguez de Mendoza.