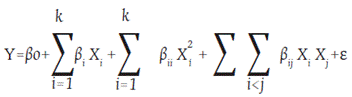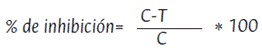Introducción
Los problemas fitosanitarios son los principales causantes de pérdidas productivas y, por tanto, económicas del cultivo de cacao a nivel mundial. Múltiples autores mencionan que el cultivo puede verse afectado hasta en un 100 % de la plantación, lo cual es reflejo de diversos problemas productivos relacionados con la moniliasis del cacao (Correa, Castro y Coy, 2014; Ramírez, 2017; Anzules et al., 2019; Antolinez et al., 2020). Por ello, desde los años 1950, se han registrado los primeros estudios acerca de cómo controlar M. roreri en Colombia. Estas investigaciones se centraron en estrategias culturales, como la realización de podas y el control de la humedad relativa; sin embargo, y a pesar de los esfuerzos, la severidad de la enfermedad en ese país se mantuvo hasta afectar más de 4000 hectáreas sembradas de cacao en la zona de Urabá, lo que generó pérdidas económicas a los pequeños y medianos productores, al punto de desestimular la inversión en este cultivo y generar transición hacia otras actividades económicas (Aranzazu y Jaimes, 2010; Compañía Nacional de Chocolates, 2019).
Aunque las actividades de control químico de la enfermedad han logrado tener un grado de eficacia, traen consecuencias negativas asociadas a las trazas en el producto final, su uso excesivo e indiscriminado, efectos nocivos en la salud y el medio ambiente, resistencia del patógeno, y elevados costos para los pequeños agricultores, entre otros (Gutiérrez, 2015; Ortiz, Torres y Hernández, 2015; Cárdenas, Aquiles y Rodríguez, 2017; Antolinez et al., 2020; Ugarte, 2020).
Por otro lado, existen regulaciones internacionales frente a pesticidas de síntesis química, que protegen la salud de los consumidores y limitan en gran parte las exportaciones del país (Fountain y Huetz, 2020). Por lo anterior, se han establecido medidas de control orientadas principalmente a inhibir la germinación de esporas que afectan directamente los frutos de cacao y evitan su propagación, empleando métodos alternativos biológicos para el control de la moniliasis del cacao, como bacterias fototróficas que presentan mejor comportamiento que los fungicidas químicos (Cruz y Davila, 2021), los uso de extractos vegetales con efectos inhibidores a nivel de laboratorio (Guerrero y Risco, 2019; Ugarte, 2020), y los cuales se presentan como una prometedora opción para control de M. roreri, tanto por su efecto inhibitorio agudo, como por su potencial efecto a exposiciones prolongadas (Tirado, Lopera y Ríos, 2016). Entre las especies utilizadas para la obtención de los extractos vegetales de control, se tiene la planta de ají (Capsicum spp.), sus extractos han despertado el interés en la industria agrícola por sus propiedades antioxidantes y antimicrobianas, con componentes activos, como capsaicinoides (capsaicina y la dihidrocapsaicina encontrados en mayor proporción), que son un gran grupo de sustancias responsables del sabor característico de los ají y de la sensación de pungencia al consumirlos (Cruz et al., 2007; Morán et al., 2008; Blanco et al., 2013; Leos et al., 2022).
Por ello, la presente investigación pretendió evidenciar el efecto antifúngico de extractos etanólicos de Capsicum spp., de modo que permitan brindar al agricultor una opción mucho más sana, viable económica y ambientalmente amigable para reemplazar a los plaguicidas químicos sintéticos, en los cultivos de cacao.
Materiales y métodos
Aislamiento y purificación del patógeno Moniliophthora roreri
Se procedió al aislamiento de M. roreri tomado de frutos de cacao en etapas iniciales de necrosis externa, junto con otras manifestaciones sintomáticas (CNC, 2019), que son distintivas de la infección por moniliasis. Estos frutos fueron recolectados de fincas productoras representativas en los municipios del sur del Huila. Posteriormente, se transportaron al laboratorio de biotecnología ubicado en el Centro de Gestión y Desarrollo Sostenible Surcolombiano, Sede Yamboró. Los frutos se sometieron a un proceso de desinfestación que involucró agua destilada, hipoclorito de sodio al 1.5 % y etanol al 70 %. Luego, se sembraron cortes de tejido desinfestado en medios de cultivo agar papa dextrosa (PDA) contenidos en placas Petri de 10 cm. Las placas Petri fueron incubadas a una temperatura constante de 28 ºC durante 7 días.
Para obtener morfotipos purificados, se realizaron transferencias de estructuras, cada 8 días, hacia los medios de cultivo que mostraron un mayor crecimiento de las colonias descritas, tanto macroscópicas como microscópicas, por Evans et al. (1978). Una vez obtenida la cepa madre con las típicas características y estructuras reproductivas, se llevaron a cabo réplicas en placas Petri incubadas en oscuridad, para su posterior uso en los experimentos de inhibición.
Colección de materia prima para preparación de extractos
Se colectaron frutos de Capsicum frutescens, verificando la especie con los datos almacenados en el Herbario Amazónico Colombiano - SINCHI (Cárdenas, Sua y Castaño, 2022); se transportaron al laboratorio de biotecnología del Centro de Gestión y Desarrollo Sostenible Surcolombiano Sede Yamboró, donde se desinfectaron y secaron a temperatura constante de 40 °C por 36 h en un horno de vacío (Tecnal TR395). Después, se llevaron a calentamiento con temperatura controlada y reflujo para evitar pérdidas por evaporación, con un tiempo y agitación de extracción constante de 60 min y 300 rpm respectivamente. Se estableció una relación de 2/20 (masa/volumen) y se evaluaron como factores continuos 3 temperaturas de extracción 30, 63 y 96 °C, y 3 soluciones en proporción 30, 60 y 96 % v/v preparadas con agua destilada y solventes que fueron evaluados como 2 factores categóricos A (acetato de etilo al 96 %) y E (etanol al 96 %); Posteriormente, las soluciones resultantes se sometieron a un procedimiento de eliminación del solvente mediante un rotoevaporador (Halthen modelo MMRE 04). Por último, los extractos se preservaron en recipientes de vidrio ámbar, estériles, a una temperatura de 14 °C.
Optimización del proceso de extracción de compuestos antifúngicos
Con el propósito de identificar las condiciones más efectivas en la extracción de compuestos que maximizan las propiedades antifúngicas de C. frutescens, se empleó el método de superficie de respuesta (MSR). Para garantizar la adecuada distribución de los datos, se aplicó la prueba de normalidad de Kolmogórov-Smirnov, con valores de p mayores a 0.05, a través del software estadístico Minitab 21.4. Este programa permitió la creación de gráficos tridimensionales para un modelo completo de dos factores continuos, a través de la evaluación del efecto de las variables temperatura en grados Celsius (°C) y el porcentaje de solución como concentración (v/v) sobre la variable de respuesta: el porcentaje de inhibición del crecimiento micelial de M. roreri.
Los modelos se originaron calculado un análisis de varianza (ANOVA) y los valores de p, y posterior a ello se hizo un análisis de regresión basado en el método de mínimos cuadrados, con un nivel de significancia del 95 % para determinar el coeficiente de regresión (R2). El diseño global del experimento consistió en 27 experimentos realizados por triplicado de manera completamente aleatoria. Los promedios obtenidos de los datos se ajustaron al modelo cuadrático (Ecuación 1):
Donde y es la variable respuesta, βo es el coeficiente de interacción, βij Xi y Xj son las variables independientes, βi βii βij son los coeficientes respectivamente para términos lineales, cuadráticos y su combinación, mientras que ε representa el error experimental aleatorio.
Determinación de inhibición de crecimiento micelial
La actividad antifúngica de los extractos se evaluó mediante el análisis del crecimiento del micelio en placas Petri. Los extractos, libres de solvente, se introdujeron al medio de cultivo PDA en una concentración de 1000 ppm. Se llevaron a cabo tres repeticiones para cada muestra. Tras la solidificación del medio, se colocaron discos de micelio del patógeno con un diámetro de 2 mm en el centro de los pozos (obtenidos de un cultivo previamente incubado de 10 días). Se observó un crecimiento macroscópico del hongo después de 3 días de la siembra, por tanto, se inició la monitorización desde ese día, midiendo el crecimiento radial del micelio.
En el caso de control, se usó agua destilada estéril en lugar de los extractos diluidos en el medio. De esta manera, el porcentaje de inhibición, que se tomó como la medida para determinar la actividad de los extractos en el crecimiento del micelio, se calculó comparando el diámetro de las colonias tratadas con las del grupo de control, mediante la siguiente fórmula (Ecuación 2):
Donde C es el crecimiento diametral del hongo en el control (sin tratamiento) y T es el crecimiento diametral del hongo con el tratamiento.
Resultados y discusión
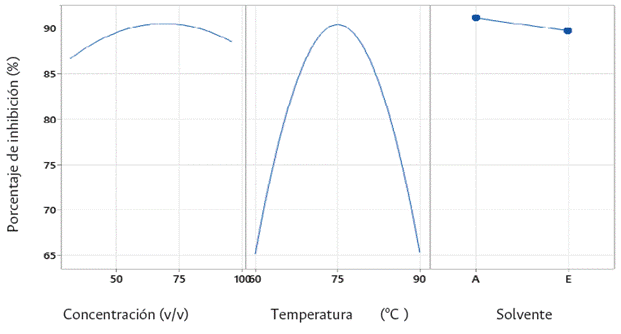
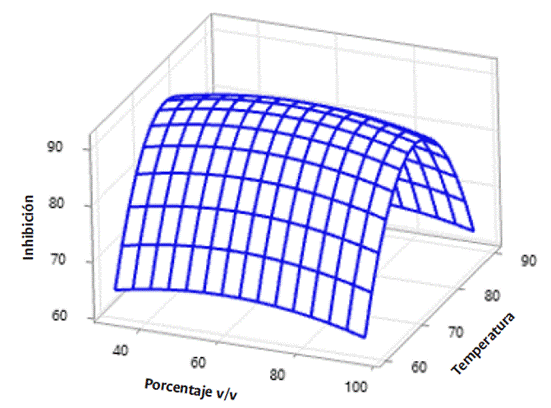
El resultado de la optimización del proceso de extracción mostró alta variación en el porcentaje de inhibición del patógeno, pues presentó valores mínimos cercanos al 60 % y máximos superiores al 90 % con respecto a los factores de temperatura, concentración y tipo de solvente (Figura 1). Se considera que las variaciones son producto del efecto de las variables propias del proceso sobre el sistema de extracción (calentamiento con temperatura controlada, agitación constante y reflujo). Un estudio similar de Flores et al., (2016) indica que los compuestos obtenidos, varían como consecuencia de la interacción de los factores del proceso de extracción con la naturaleza de los compuestos bioactivos (difusión, estabilidad o degradación, inactivación, solubilización, polaridad y otros) que determinan su concentración final.
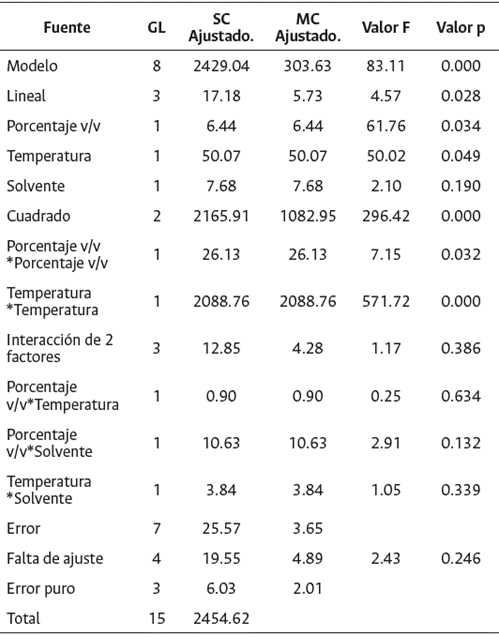
El análisis de varianza con p < 0.05 (Tabla 1) mostró que las variables que influyen sobre la superficie de respuesta del MSR, corresponden a la temperatura (p. 0.049) y concentración (p. 0.034); por lo tanto, se puede inferir que la variación en las temperaturas a las que se exponen los solventes contribuyen al aumento de la solubilidad, las tasas de difusión y el arrastre de los compuestos que inhiben el patógeno. Rodríguez et al. (2014) mencionan que los tratamientos térmicos en los procesos de extracción pueden generar una mejor permeabilidad y plasticidad de los materiales, debido a la expansión y ruptura de estructuras celulares. Así mismo, las variaciones en la concentración del solvente influyen en la velocidad y rendimiento de la extracción como resultado de la fuerza de transferencia de masas por conducción, por lo que se encuentra que, a mayor concentración del disolvente, mayor fuerza motriz y, por tanto, mayor extracción de compuestos afines con el disolvente (Rodríguez et al., 2014).
Tabla 1 Análisis de varianza de superficie de respuesta: inhibición vs. porcentaje v/v; temperatura; solvente
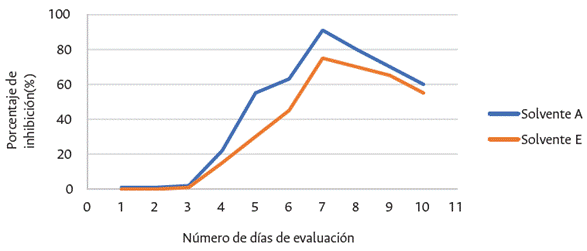
Por otro lado, aunque no se presentaron valores significativos con respecto al solvente, sí se obtuvo mayor eficiencia con los extractos obtenidos con el solvente acetato de etilo sobre el crecimiento del patógeno a nivel in vitro (Figura 2 y 3). Durante el seguimiento visual y la toma de datos continua de las placas para analizar la respuesta del hongo frente al tratamiento optimizado, se observaron diámetros de 8 mm que variaron ligeramente en un rango de 3 mm, lo cuales fueron valores más favorables a los registrados por el etanol, que estuvieron entre 12 y 20 mm (Figura 2).
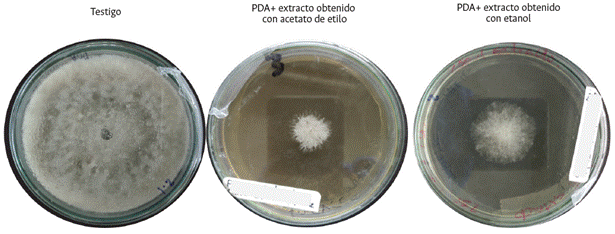
Figura 2 Diámetro de colonia de M. roreri en medio de cultivo PDA+ tratamientos inhibitorios en los primeros 7 días de evaluación.
Lo anterior nos permite inferir que el acetato de etilo presenta mayor afinidad con los compuestos antifúngicos de C. frutescens, como lo reportó Arteaga (2019) para el género Capsicum, donde el acetato de etilo presentó valores superiores en cuanto a la concentración de capsaicina en las oleorresinas si se comparan con los resultados del etanol y bencina de petróleo, evaluados como solventes con el método Soxhlet. Así mismo, Restrepo, Llanos y Fonseca (2007) evidenciaron que el acetato de etilo presentó valores más favorables que el hexano en la extracción de oleorresinas de dos especies de ají pungente al determinar la capsaicina y la dihidrocapsaicina por HPLC. Sin embargo, es importante resaltar que el fruto de ají presenta múltiples metabolitos que de igual manera son transportados en el proceso de extracción y pueden complementarse para ejercer su acción antifúngica.
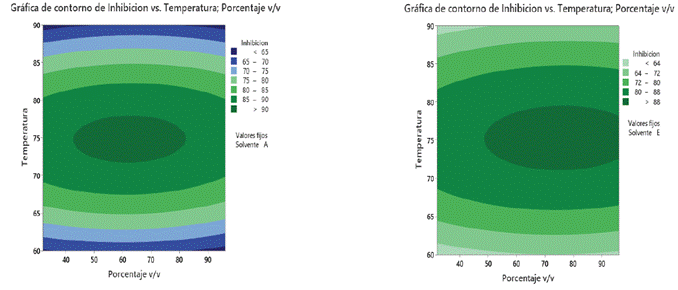
Las gráficas de contornos (Figura 3) permiten observar el efecto de la concentración de los solventes y la temperatura. Se puede evidenciar que el porcentaje de inhibición para ambos solventes presenta comportamientos similares en relación con rangos de temperatura entre 70 y 80 °C; la mejor fue de 75 °C. Beltrán et al. (2013) indican que a medida que la temperatura se eleva sin superar excesos, es posible mejorar la velocidad de extracción, lo que simplifica la transferencia de los compuestos desde la estructura vegetal hacia el solvente. Respecto a la concentración, se evidencia que para el solvente acetato de etilo el rango óptimo es de 62 v/v y para el caso del solvente etanol, estos valores difieren entre 50 a >90 v/v. El etanol y el agua destilada forman un complejo de solventes polares en los cuales pueden disolverse diversos solutos polares e iónicos, incluyendo proteínas, carbohidratos y sales minerales. Por su parte, solventes dipolares como el acetato de etilo presentan una polaridad intermedia y pueden solubilizar solutos de polaridad relativa similar (Beltrán et al., 2013).
Sin embargo, el género Capsicum ha sido reportado por múltiples autores debido a la producción de metabolitos secundarios extraídos mediante la variación de condiciones de concentración, temperatura, tamaños de partículas y tipos de solventes; tales autores usualmente discuten sobre los metabolitos como protección contra fitopatógenos en los cultivos, dado que contienen principios activos pungentes y otros compuestos de interés, como los orgánicos volátiles con múltiples polaridades: vitaminas C, E y A, oleorresinas, tiamina, compuestos fenólicos, carotenoides y antioxidantes que contrarrestan la oxidación de los lípidos mediante la captación de radicales libres y tienen su acción en el control de plagas y enfermedades (Jeong et al., 2011; Bosland et al., 2012; Meckelmann et al., 2013; Shi et al., 2019).
El análisis de regresión generó la Ecuación 3 y la gráfica de superficie de respuesta (Figura 4), que corresponden al modelo optimizado para las variables temperatura y concentración sobre la variable categórica tipo de solvente. Esta ecuación es un modelo cuadrático que se ajustan bien al considerar el diseño experimental aplicado al solvente acetato de etilo por presentar mejores rendimientos. Este solvente en particular mostró un excelente coeficiente de determinación (R2) del 98.96 %, acompañado por una R2 ajustada del 97.77 % y un R2 de predicción del 92.54 %. Además, las pruebas de falta de ajuste realizadas en los modelos cuadráticos no resultaron ser significativas (p > 0.05), lo que indica que los datos se representan de manera adecuada en relación con el diseño experimental utilizado.
A nivel de laboratorio, después de la siembra del patógeno, se observó que el efecto inhibitorio de los extractos de C. frutescens se redujo al séptimo día de evaluación (Figura 5); por lo que se realizaron réplicas de M. roreri cada 7 días en PDA con el mismo tratamiento, tomando las cepas que previamente habían sido sometidas al tratamiento. Al cabo de 28 días se observó pérdida de capacidad de crecimiento y multiplicación. A nivel microscópico, en la estructura micelial (Figura 6A), se evidenció que a los 7 días del tratamiento las estructuras reproductoras de M. roreri se vieron afectadas dado que los conidióforos de las hifas perdieron la capacidad de alargarse para formar los conidios (Figura 6B). A los 14 días de evaluación, se notó rotura de la membrana y de la pared celular del fitopatógeno, lo que generó pérdida del protoplasma, malformación de las hifas y ausencia de conidiósporas (Figura 6C). Lo anterior permite establecer que, en caso in vitro, el efecto inhibitorio del extracto obtenido con el solvente acetato de etilo requiere de una aplicación cada 7 días por mínimo 21 días para lograr su máxima eficacia.
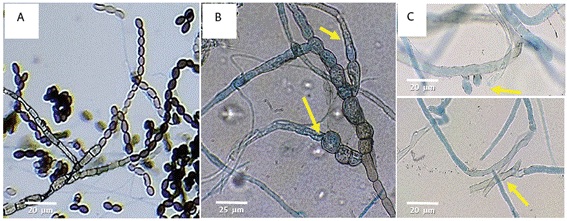
Figura 6 Microscopía de colonia de M. roreri, (A) 20x previo a los tratamientos; (B y C) 40x posterior al tratamiento.
Algunos autores mencionan que el posible efecto inhibitorio se debe a que el ají posee una mezcla de amidas con propiedades antifúngicas (Langenheim, 2003; Elad et al., 2007; Sánchez y Garcés, 2012; Mejía, 2013; Li et al., 2020). Estas son sustancias nitrogenadas de naturaleza lipídica, que se clasifican como alcaloides y actúan a nivel celular interfiriendo en la replicación del DNA de los microorganismos, específicamente impidiendo el intercambio catiónico en la membrana, lo cual altera las respuestas del microorganismo a los estímulos externos, y a su vez le impide la excreción de sustratos desde el citoplasma, además de la inhibición de enzimas y la disminución de la capacidad de modular el funcionamiento de los quimiorreceptores y nociceptores; ello genera señales y estímulos de irritación que afectan los mecanismos de defensa e inducen el estrés y deterioro celular.
Conclusiones
El uso del método de superficie de respuesta (MSR) es eficiente para la optimización de procesos de extracción de metabolitos con diversos usos o aplicaciones, ya que permite predecir comportamientos reales de las variables de respuesta a nivel de laboratorio, maximizando el uso de recursos.
Fue posible mejorar el efecto de los extractos de ají con propiedades antifúngicas para el control in vitro de M. roreri a través de la optimización de la acción de los compuestos obtenidos a partir de un adecuado proceso de extracción. Con ello, se logró inhibir el crecimiento micelial más del 90 %, mediante los extractos que fueron obtenidos con solvente acetato de etilo al 62 %, a una temperatura de 75 °C; por lo que se consideran como materia prima potencial para la producción de biofungicidas. Esto tiene implicaciones beneficiosas en la creación de productos que tengan un impacto reducido en el entorno y en la salud de agricultores y consumidores.