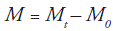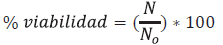INTRODUCCIÓN
En el mundo cada año miles de personas se enferman a causa de la bacteria Escherichia coli de serotipo patógeno, con cuadros diarreicos y complicaciones bastante serias. Los distintos brotes en el mundo han ocasionado que se considere la E. coli O157:H7 como un problema de salud pública (CFSPH 2010). Con el fin de controlar el efecto de este tipo de bacterias y evitar el uso de antibióticos, existen investigaciones que ciertos microorganismos como inhibidores de bacterias patógenas. En este sentido, los géneros Lactobacillus han sido asociados con varios efectos benéficos en la salud humana y animal. Algunos estudios han demostrado la acción bactericida de Lactobacillus plantarum frente a Escherichia coli y destacan que su acción se debe a la reducción del pH, producción de ácidos orgánicos, producción de bacteriocinas y buena capacidad de adherencia a la mucosa intestinal que le permite competir por espacio (Oyetayo y Oyetayo 2005; Jurado et al. 2015). Por otra parte, para que una bacteria pueda manifestarse debe sobrevivir al paso a través del tracto gastrointestinal y resistir además diferentes condiciones ambientales propias de los sistemas alimentarios; por tanto, la protección de bacterias probióticas del género Lactobacillus es de interés para su aplicación en tales sistemas (Ribeiro et al. 2014; González et al. 2015). En este sentido, una técnica para mejorar la viabilidad es la microencapsulación de las bacterias, ya que la cápsula formada permite proteger al microorganismo de las condiciones gastrointestinales, además de proporcionar elementos prebióticos (nutrientes) que facilitan el desarrollo de la bacteria (Jurado et al. 2015). Por lo tanto, el objetivo principal de esta investigación fue evaluar el efecto de la microencapsulación, mediante la técnica de Spray Drying, sobre el potencial de L. plantarum en la inhibición de E. coli O157: H7 bajo condiciones gastrointestinales simuladas.
MATERIALES Y MÉTODOS
La investigación se realizó en el laboratorio del grupo de investigación Fise-Probiotec y en los laboratorios especializados de la Universidad de Nariño ubicados en el Municipio de Pasto, Departamento de Nariño (Colombia).
Se usaron las cepas Lactobacillus plantarum ATCC 8014® y Escherichia coli O157:H7 ATCC 43888®. La reconstitución de cada cepa se efectuó de acuerdo con las instrucciones del fabricante y su conservación se realizó mediante repiques en medio sólido y líquido cada 5 y 8 días.
Para ajustar el inóculo de L. plantarum se incubó la cepa en 40 ml de caldos MRS por 24 h, luego, se tomaron 4 ml y se depositaron en otros 40 ml de caldo MRS y se llevó a incubación por 24 h. A continuación, se tomaron 10 ml del caldo y se transfirieron a 90 ml de caldo MRS para una nueva incubación; terminada la incubación se agregó 1 ml del preparado, se diluyó con 9 ml de agua peptonada y se realizó lectura mediante espectrofotometría (625 nm) en espectrofotómetro Genesys 10S UV-VIS Spectronic. En los casos donde la población fue mayor a la establecida se adicionó caldo estéril (Crueger y Crueger 1993).
Inhibición de L. plantarum frente a E. coli y evaluación de susceptibilidad de ambas cepas frente a antibiótico
Se evaluó el efecto de inhibición de L. plantarum sobre E. Coli mediante la metodología propuesta por Tagg y McGiven (1971), ajustada y descrita por Jurado et al. (2013), para ello, se evaluaron tres metodologías: 1) Discos Método Pads, 2) Difusión en cilindro plástico y 3) Difusión en cilindro plástico doble capa bajo las condiciones de filtrado y sin filtrado a 80°C y a temperatura ambiente. De igual manera, se determinó la susceptibilidad de L. plantarum y E. coli O157:H7 frente a los antibióticos cefotaxima (CTX 30 µg), penicilina (P 10 IU), gentamicina (GN 10 µg) dicloxacilina (DCX 1 µg), ciprofloxacina (CIP 5 µg) y cefalotina (KF 30 µg) mediante la metodología de Bauer et al. (1966).
Cinética de fermentación
Los parámetros cinéticos de L. plantarum se evaluaron en medio MRS comercial.
La cepa láctica con inóculo ajustado fue incubada durante 24 h, tiempo durante el cual se tomaron muestras cada 3 h para determinar conteo de microorganismos viables en placa (UFC/150 pl), azúcar consumida (mg/l), proteína producida (mg/l), pH y porcentaje de ácido láctico (%) (Lanara 1981). Para la determinación del consumo de azúcar se prepararon diferentes concentraciones de glucosa, las cuales fueron observadas a una densidad óptica de 525 nm y permitieron la construcción de una curva patrón y obtener así la fórmula de la línea recta. Finalmente, se determinaron los valores de densidad óptica de las muestras durante la incubación con ayuda de la fórmula obtenida en el paso anterior para establecer la cantidad de azúcar presente en las muestras (Dubois et al. 1956).
Para la determinación de producción de proteína se siguió el procedimiento descrito para el consumo de azúcar, con la diferencia de que la curva patrón se estableció con seroalbúmina bovina a 625 nm (método de Lowry et al. 1951 modificado). El pH se midió con un potenciómetro digital (Jenco® Vision-Plus) y la determinación de producción de ácido láctico se realizó por titulación con hidróxido de sodio (0,1 N).
La determinación de la velocidad específica de crecimiento (v max), tiempo de duplicación, tiempo de generación y cosecha máxima de L. plantarum se realizó de acuerdo con lo establecido por Gamazo et al. (2005), modificado a las condiciones del laboratorio. Los datos de crecimiento desde la fase inicial hasta la exponencial se incluyeron en un modelo de regresión lineal simple con el crecimiento (Ln UFC/150 pl) como variable independiente y el tiempo como variable dependiente. De la fórmula obtenida se sacaron los valores para determinar el parámetro v max:
Donde m es la pendiente y representa v max.
El tiempo de duplicación celular (td), se determinó teniendo en cuenta la siguiente ecuación:
El tiempo que tarda en duplicarse la población ó tiempo de generación (g) se calculó por la fórmula:
La cosecha máxima fue calculada mediante la siguiente expresión:
Siendo Mt el crecimiento bacteriano en la fase estacionaria y M0 el crecimiento al inicio de la cinética de fermentación expresado en Ln UFC.
Identificación de péptidosy aminoácidos presentes en el sobrenadante de L. plantarum y E. coli 0157: H 7
Se tomó una muestra de los sobrenadantes de L. plantarum y E. coli 0157:H7 y por HPLC-DAD se determinó el contenido de péptidos y aminoácidos. Para su análisis se tomó 1 mi de muestra y se pasó por filtros de jeringa de Polifluoruro de Vinilideno (PVDF) de 0,25 µm. Posteriormente, se adicionó HC1 y se centrifugó durante 15 minutos a 9000 rpm. Las muestras se llevaron a sequedad con corriente de nitrógeno y se derivatizaron. La identificación se realizó empleando un estándar de aminoácidos en HC10,1N (Pickering, aminoácidos neutros) bajo las condiciones operacional es desarrolladas en el Laboratorio de Cromatografía de la Universidad de Nariño, utilizando las siguientes especificaciones: equipo Cromatógrafo HPLC (Waters), Bomba binaria 1525, columna C18 300Á (Júpiter®, Phenomenex 150 mm x 4.6 mm), detector PDA 2998 a 214 y 280nm Scan (200-350nm) é Inyector Rheodyne Loop 20 µl.
Resistencia de L. plantarum a diferentes temperaturas
Según metodología de Cai et al. (1999) se evaluó el crecimiento de L. plantarum a diferentes temperaturas (37y45°C); para ello, se sembró la cepa en caldo MRS por 24 h y se realizó el recuento de colonias en placa, se seleccionaron cajas de Petri con viabilidades de 30 y 300 UFC/150µl iguales o superiores a 109 UFC/ml.
Microencapsulación de L. plantarum por Spray Drying (Secado por Aspersión)
Para llevar a cabo la microencapsulación se realizó de manera previa la obtención de la biomasa bacteriana de acuerdo con la metodología de Crueger y Crueger (1993). Posteriormente, siguiendo lo establecido por Rodríguez et al. (2016a), se preparó una suspensión del 15% p/v de cada material microencapsulante en 280 mi de inoculo (60 g de Maltodextrina y 60 g de Inulina en 280 mi de inoculo bacteriano ajustado), una relación de prebiótico:inoculo de 1:1 (p/v) con una concentración final de microorganismos de 1,5x109/ml, se llevó a microencapsular al secador Spray Bilon 6000s® con una temperatura de entrada y de salida de 170°C y 65°C, respectivamente. El material microencapsulado se almacenó en recipientes plásticos oscuros a temperatura ambiente (20 ± 2 °C).
Exposición del microencapsulado de L. plantarum a condiciones gastrointestinales simuladas
Se evaluó el crecimiento de L. plantarum microencapsulado a pH 3,0 y a concentraciones de 0,3 y 1% de sales biliares bovinas y a 0,5 % de bilis bovina a pH de 5,5- Para ello, se agregaron 2 g del microencapsulado en 18 ml de caldo MRS mezclado con el porcentaje de bilis y sales biliares ajustados al pH correspondiente; posteriormente, se incubó a 37°C por 48 h para la liberación y establecimiento del material microencapsulado. Se realizó la prueba de viabilidad bajo la metodología de Cai et al. (1999).
Estudio de supervivencia y estabilidad de L plantarum encapsulado y caracterización del microencapsulado
Se emplearon como criterios de supervivencia y estabilidad del microencapsulado las variables viabilidad y la eficiencia, respectivamente.
Para la variable viabilidad se tomó 1 g de material microencapsulado el cual fue rehidratado a temperatura ambiente en 9 mi de agua peptonada tamponada al 0,1 % p/v (pH 7,2 ± 2), esto fue homogenizado en vortex y se dejó reposar durante 30 min; después, se tomó 150ul de la dilución y se sembró sobre agar MRS con azules de anilina (380 µl azul de anilina/100 mi agua destilada) y se llevó a incubación en condiciones aerobias a 37°C por un periodo de 48 h. Finalmente, los recuentos se realizaron por duplicado en UFC/g en base seca (Rodríguez et al. 2016a). Los valores encontrados fueron utilizados en la siguiente fórmula para determinar el porcentaje de viabilidad:
Dónde:
N0: número de bacterias por 150 µl de solución antes del proceso.
N: número de bacterias por 150 µl de solución después de la etapa de secado.
Para la variable eficiencia se usó la metodología descrita por Gonzales et al. (2015). Se tomaron 2 g de material microencapsulado y se diluyeron en 18 mi de agua destilada, luego la mezcla se centrifugó a 5000 rpm por 15 min y se tomó el sobrenadante para los análisis. En este último se determinó la concentración bacteriana y se calculó la eficiencia mediante la siguiente fórmula:
Dónde:
A: concentración bacteriana antes de la microencapsulación.
B: concentración bacteriana en el sobrenadante después de la microencapsulación
Las propiedades físicas del microencapsulado se determinaron mediante las variables actividad de agua, humedad relativa, solubilidad y humectabilidad con la metodología propuesta por Rodríguez et al. (2016b). Además, se determinó la estructura del microencapsulado mediante su morfología y tamaño utilizando microscopio electrónico de barrido FEG (Fiel Emission Gun) QUANTA™ 650 FEG (Thermo Fisher Scientific™, Estados Unidos) en el laboratorio del Centro de Microscopía y Microanálisis (Bogotá, Colombia).
Resistencia a lisozima
Se evaluó la resistencia de L. plantarum a lisozima de acuerdo con lo descrito por Rodríguez-González (2009), así, se sometió la cepa a dos preparaciones de lisozima
(i) 0,6 ul de cultivo y 0,65 µg de lisozima y
(ii) 0,6 ul de cultivo y 115 µg de lisozima.
Las preparaciones se incubaron durante 24 h a 37°C, trascurrido este tiempo se tomó una asada y se inoculó en cajas Petri con agar MRS. Se tomó como criterio de resistencia los crecimientos superiores o iguales a 300 UFC/150 µl.
Verificación producción de exopolisacáridos (EPS)
Para ello se incubó a L. plantarum en caldo MRS y sacarosa (5 %) y en caldo MRS sin sacarosa por 24 h a 37°C. Posteriormente, de acuerdo con lo descrito por Elinalva et al. (2012), se utilizaron discos de papel de filtro estéril (5 mm) impregnados con 5 ul de cultivo láctico en placas de petri con agar MRS para observar la producción de EPS (Guimarães etal., 1999). El ensayo se realizó bajo las siguientes condiciones: nivel de pH de 6,5 ± 0,2; temperatura 29 ± 2°C, 37 ± 2°C y se llevó a incubación durante 6 días y 48 horas con las temperaturas respectivas. Después de la incubación, la producción de EPS se evaluó con base a la formación de una colonia mucoide alrededor de los discos. La producción de este biopolímero por los aislados se confirmó mezclando una porción de la sustancia mucoide en 2 ml de alcohol absoluto donde la precipitación de esta porción confirmó la presencia del EPS.
Análisis estadístico
Para determinar el comportamiento de las variables azúcar, proteína, acidez y pH durante la cinética de fermentación se utilizó regresión lineal con el fin de obtener la cantidad o porcentaje de incremento o disminución del parámetro a través del tiempo.
Se evaluó el crecimiento de L. plantarum bajo las diferentes concentraciones de sales biliares mediante un diseño completamente aleatorizado con dos tratamientos y ocho réplicas por tratamiento, las diferencias fueron determinadas mediante la prueba de Tukey. Todos los análisis estadísticos se realizaron a una significancia de 95% (p 0,05). Los halos de inhibición se representaron mediante un diagrama de radar.
RESULTADOS Y DISCUSIÓN
Inhibición de L. plantarum sobre E. coli O157:H7
Los resultados de la inhibición se pueden observar en la Figura 1. En las tres metodologías se observaron halos de inhibición iguales o superiores a 2 mm, lo que indicó que la cepa patógena fue sensible a L. plantarum (Estrada et al. 2005). Sin embargo, se obtuvo un mayor halo con el sobrenadante a 80°C en cilindro plástico doble capa a una concentración de 120µl. Al respecto, Vegas et al. (2013) reportaron inhibición de BAL sobre E. coli, lo que corrobora los resultados obtenidos. En este sentido, Martínez et al. (2014) mencionaron que la presencia de péptidos en el sobrenadante puede estar relacionado con su actividad bactericida, este tipo de compuestos orgánicos tienen características especiales que atacan diversos mecanismos vitales para el desarrollo de las bacterias, evitando su proliferación y ayudando a conservar la salud del huésped, lo que puede explicar los resultados obtenidos.

FIGURA 1 Grafico de radar para los halos de inhibicion bajo tres metodos de evaluacion, dos condiciones de filtrado y dos temperaturas.
Los resultados frente a los antibióticos mostraron que L. plantarum resultó resistente a cefotaxima, gentamicina y ciprofloxacina y mostró sensibilidad a los demás antibióticos. Esto concuerda con algunos resultados reportados por Martínez et al. (2014) donde L. plantarum fue sensible a ciprofloxacina y gentamicina. Por otra parte, E. coli fue sensible a cefotaxima, gentamicina, ciprofloxacina y cefalotina, con resistencia a dicloxacilina y penicilina. De acuerdo con Junquera et al. (2005) la resistencia de los microorganismos a los antibióticos es un problema de salud pública, dado que este tipo de bacterias no pueden ser manejadas de manera adecuada por los métodos tradicionales y la dosis terapéutica para su control es muy alta y en muchos casos inviable. Este fenómeno se observa por el uso indiscriminado de los antibióticos en humanos y animales, lo que desencadena una selección de cepas resistentes a este tipo de productos.
El crecimiento de L. plantarum expresado en Ln UFC/150µl, a través del tiempo, se puede observar en la Tabla 1. Se identifica el aumento desde el tiempo 1 hasta el 5, con valores que van desde 21 a 30,3 Ln UFC/150µl, respectivamente. Esto es importante porque nos permite determinar la fase exponencial de crecimiento de la cepa, lo que se puede traducir en el tiempo adecuado para obtener el mayor inóculo de la cepa láctica para posteriores estudios y el tiempo más adecuado para su producción en forma industrial (Jurado et al. 2015).
TABLA 1 Efecto de la biomasa Ln (UFC/150µl) sobre el tiempo del medio del cultivo Lactobacillus plantarum.

Los resultados de la modelación del comportamiento en el tiempo de las variables pH, consumo de azúcares, producción de proteína y porcentaje de ácido láctico se pueden observar en la Tabla 2. Se encontró un consumo de azúcar de 0,918 mg/l, una producción de proteína de 5,97 mg/l, una reducción del pH de 0,094 y un aumento de la acidez de 0,011%, para un periodo de tres horas. Lo anterior demuestra que L. plantarum presenta varias características como candidata para inhibir otros microorganismos dado que reduce el pH del medio como resultado de un incremento en la producción de ácido láctico; la producción de proteína y el consumo de carbohidratos en el medio de cultivo están relacionados con la producción de bacteriocinas, lo que evidencia un activo crecimiento microbiano.
Cinética de fermentación
Los resultados se observan en la Tabla 3. La fase logarítmica de L. plantarum que se alcanzó a las 12 h coincide con lo obtenido por Martínez et al. (2014)), Jurado et al. (2013)) y Jurado et al. (2015). Se debe señalar que los nutrientes presentes en el medio determinan el ritmo de crecimiento bacteriano (Madigan et al. 2004). En este sentido se comprende la importancia de establecer los parámetros cinéticos, ya que a partir de estos resultados se puede determinar las mejores condiciones pare el proceso de producción. Se encontró una velocidad específica de crecimiento de 3,105 µ.h-1, el tiempo de duplicación fue de 13,39 min, que generó 4,48 generaciones por hora. Al respecto, Jurado et al. (2009) obtuvieron un tiempo de duplicación de 42,42 min en medio MRS, esto indica que la bacteria usada para el presente estudio obtuvo un mayor crecimiento (13,39) y número de generaciones por hora.
Péptidos y aminoácidos en el sobrenadante de L. plantarum y E. coli O157:H7
Para ambas cepas se obtuvo una secuencia de cadena Valina-Tirosina-Valina. Martínez et al. (2014) y Jurado et al. (2015) encontraron el mismo resultado en L. plantarum. Los resultados para aminoácidos se presentan en la Tabla 4, se observa un mayor porcentaje de tirosina con 51,6% para L. plantarum y 50,7% para E. coli O157:H7. De acuerdo con Asyikin et al. (2013) las bacteriocinas producidas por las bacterias ácido lácticas son de naturaleza peptídica y la presencia de estas cadenas y aminoácidos son un indicativo de su presencia en el sobrenadante (Mondragón et al. 2013).
Resistencia a diferentes niveles de temperatura
Los resultados obtenidos para temperatura indican mayor crecimiento a 45°C con 3,0 x 1012 UFC/150µl y crecimiento significativo a 37°C con 4,2 x 109 UFC/150µl. Para Estela et al. (2007 ) el género Lactobacillus tiene un rango óptimo de crecimiento entre 30 y 40°C, lo que indica su capacidad de sobrevivir a la temperatura corporal y su viabilidad bajo procesos tecnológicos como la elaboración de alimentos balanceados.
Exposición del microencapsulado de L. plantarum a condiciones gastrointestinales simuladas
Los resultados arrojados en esta determinación pueden observarse en la Tabla 5. No se encontraron diferencias significativas (p > 0.05) entre los tratamientos. Por lo cual, es posible afirmar que la cepa láctica microencapsulada, al ser sometida a dos concentraciones de sales biliares, no presentó cambios ni afectaciones significativas sobre su crecimiento y los materiales de la pared pueden conferirle un efecto protector. Según Gutiérrez-Ramírez (2016), una condición importante para que un microorganismo sea considerado probiótico es que resista las condiciones gastrointestinales, entre las que se incluye tolerancia a pH ácidos y sales biliares del 0,3%. Pérez-Leonard et al. (2013) afirman que la viabilidad de un microorganismo depende también del material en el que se encapsule, ya que este debe garantizar una alta estabilidad a través del tracto gastrointestinal. De esta manera, las células encapsuladas presentan mayor resistencia a los jugos gástricos que cuando se encuentran en estado libre. En este sentido, la cepa láctica evaluada resistió a un pH de 3,0, que simuló el ambiente estomacal, demostrando que el microencapsulado tiene potencial para conservar la cepa.
TABLA 5 Viabilidad de L. plantarum frente a condiciones gastrointestinales simuladas durante 24 horas.
| Condición | Concentración | UFC/150|il |
|---|---|---|
| Sales biliares pH 5,5 | 0,3% a 1% | 3,0 x 108 9,7 x 108 |
| Bilis bovina pH 5,5 | 0.5% | 3,0 x 109 |
| pH 3,0 | 6,4 x 108 |
Estudio de supervivencia y estabilidad de L. plantarum encapsulado
Se encontró en la humectabilidad (1 min, 56 s), eficiencia del microencapsulado (88,4%) y viabilidad (58%). El porcentaje de humedad relativa de L. plantarum microencapsulado es importante ya que puede influir en la conservación de los microorganismos vivos según Montes-Ramírez (2013) quien en su estudio además reportó valores de humedad de 6,33 y 6,86% con la misma técnica y materiales microencapsulantes. En este orden de ideas la humedad relativa es cercana a los valores adecuados y se reflejó en su importante viabilidad y crecimiento a través del tiempo. A su vez, en el material microencapsulado no se evidenció contaminación por agentes extraños como bacterias, hongos, entre otros. Los valores de Aw se pueden considerar aceptables, lo cual beneficia la viabilidad del microencapsulado. Según Valero-Cases y Frutos (2015), valores de Aw por encima de los 0,60 tienen susceptibilidad a contaminarse con bacterias, mohos y levaduras. Por tanto, L. plantarum microencapsulado se encuentra entre los rangos óptimos para conservarse adecuadamente.
Por su parte, Montes-Ramírez (2013) obtuvo un porcentaje de solubilidad de 85,95% cercana a la obtenida en éste estudio. De acuerdo con Rajam y Anandharamakrishnan (2015) la alta solubilidad está estrechamente vinculada con las características químicas y estructurales relacionadas con el número de azúcares libres y el grado de polimerización (GP). El tiempo de humectabilidad obtenido es relativamente bajo comparado con los valores obtenidos en un estudio para bacterias del género Lactobacillus microencapsulados con inulina como material prebiótico y maltodextrina como material pared con el mismo método de encapsulación en comparación con los reportados por Montes-Ramírez (2013), con tiempos entre 6 min, 33 s y 4 min, 52 s. Además, el mismo autor enfatiza que una lenta rehidratación dada en escenarios controlados demuestra mejor viabilidad y maximiza la recuperación celular en comparación con la rehidratación inmediata. Por lo tanto, tiempos cortos de humectabilidad, como los obtenidos, pueden influenciar en la viabilidad y recuperación de los probióticos; este corto tiempo de humectabilidad puede deberse al valor de humedad del microencapsulado, ya que este porcentaje de los polvos contribuyen en la humectación, debido a que el líquido penetra en los poros con mayor facilidad según sea el grado de humedad.
Por su parte, la viabilidad fue de 86,96%. Además, entre la bacteria microencapsulada y sin microencapsular no se presentaron diferencias estadísticas significativas (p > 0.05), es decir que la bacteria no fue afectada ni antes ni después de ser sometida al proceso de microencapsulación. Montes-Ramírez (2013) resaltó que la viabilidad puede ser afectada por la entrada y salida de aire durante el secado por aspersión, la cepa bacteriana y demás condiciones del proceso. Por su parte, De Araujo (2016) reportó supervivencia de 72-70% en microencapsulación de microrganismos pro-bióticos con secado por aspersión.
El tamaño del microencapsulado y su morfología se encuentran en la Figura 2. Los tamaños reportados en éste estudio estuvieron en el rango de 15,18 a 5,68 um. Existen reportes de microencapsulado de 53,99 um utilizando otros materiales microencapsulantes mediante liofilización obtenidos por Rajam y Anandharamakrishnan (2015). Según lo citado por Villena et al. (2009) el tamaño de partícula ideal debe estar entre los 15-100 µm, con valores inferiores a 15 µm puede que no exista una protección adecuada para la bacteria microencapsulada y por el contrario, si es mayor a 100 µm es susceptible a ser atacada por agentes externos como bacterias, hongos, entre otros. Lo anterior indica que el tamaño de la partícula es correcto para llevar a cabo su función protectora y estabilidad del microencapsulado. Por su parte, Esquivel et al. (2015) mencionaron que la morfología de la microcápsula es adecuada cuando tiene forma de esfera y no presenta una superficie irregular. De Araujo (2016) reporta forma circular y tamaños de 7-15 µm con la utilización de otros probióticos y la misma técnica microencapsulante. Por lo tanto, es posible afirmar que el microorganismo microencapsulado posee tamaño adecuado y forma apropiada para su estabilidad y conservación.
Resistencia a lisozima
Se obtuvieron crecimientos en la preparación (i) entre 2,7 x 109 y 3,0 x 10 12 UFC/150 µl y en la preparación (ii) entre 2,2 x 109 y 3,0 x 10 11 UFC/150 µl. De acuerdo con García-Ruiz et al. (2014) en la selección de microorganismos potencialmente probióticos un punto importante es la evaluación de su resistencia a las condiciones extremas del tracto gastrointestinal. La primera barrera que deben superar es la boca, con una alta concentración de lisozima en la saliva humana, seguido del estómago, con bajo pH y presencia de enzimas digestivas (i.e., pepsina) y el intestino, que contiene bilis. Este resultado confirma la elevada resistencia de la cepa a la lisozima, lo que corrobora los resultados de autores como Zago et al. (2011) y Turchi et al. (2013) en estudios similares. Lo anterior constituye un punto importante para continuar con la evaluación de esta cepa en su aplicación en condiciones in vivo y en la industria alimentaria.
Verificación de producción de exopolisacáridos
Se observó la presencia de un material translúcido o cremoso que involucra una colonia mucoide, lo cual es indicativo del potencial de producción de EPS; de esta manera, se encontró que se obtuvo una mejor formación mucoide en el medio MRS más sacarosa, con respecto al medio MRS sin sacarosa en ambas temperaturas, así como también se evidenció la precipitación de las muestras en alcohol absoluto. Al respecto, Freitas et al. (2011) mencionan que la composición y la cantidad de EPS producida por una bacteria están sujetos a rasgos determinados genéticamente; sin embargo, están altamente influenciados por los componentes de los medios y las condiciones de cultivo. La síntesis de EPS generalmente se ve favorecida por la presencia de una fuente de carbono en exceso, concomitante con la limitación de otro nutriente (por ejemplo, nitrógeno u oxígeno). Adicionalmente, según Vallejo et al. (2018), la producción de EPS desempeña un factor de interés industrial o un rasgo negativo por evaluar, junto con otros factores de virulencia, según el origen y género de las BAL productoras. La producción de EPS juega un papel clave en la elaboración de quesos y yogures.
CONCLUSIÓN
Lactobacillus plantarum microencapsulado mostró adecuado crecimiento bajo pH ácido y en condiciones de bilis y sales biliares simuladas. Los parámetros del microencapsulado demostraron ser efectivos para la viabilidad de la cepa y L. plantarum fue capaz de inhibir el crecimiento de E. coli O157:H7.