INTRODUCCIÓN
La aplicación de la tecnología biofloc en piscicultura se establece como un sistema intensivo de cultivo con menores impactos, con lo cual se logra mantener los parámetros de calidad de agua dentro de rangos adecuados para el cultivo a partir del reciclaje de nutrientes, en especial los compuestos nitrogenados (en especial del NH3 y NO2 -) a través de la asimilación y oxidación del N por microorganismos aerobios con actividades autotróficas y heterotróficas (Ebeling et al. 2006), a una alta relación C/N y oxigenación en saturación, lo que resuelve los problemas de exceso de nutrientes en la producción (Collazos-Lasso y Arias-Castellanos 2015; Avnimelech 2015), siendo un sistema que incorpora conocimientos disimiles, multidisciplinarios y constituye una forma diferente de la producción en confinamiento de especies acuícolas.
El inicio y estabilización del sistema es esencial, pues de esto depende el éxito del cultivo, los conceptos de diferentes autores de manera general son similares (Crab et al. 2010; Ekasari et al. 2015; Fauji et al. 2018; García-Ríos et al. 2019; Li et al. 2018), aportes de N al agua (De Schryver et al. 2008), de C (Avnimelech 2009), condiciones de calidad de agua (Emerenciano et al. 2017) en medio aerobio y adición de inóculo (Martins et al. 2020; Crab et al. 2010).
No obstante, surgen singularidades en cada proceso, por ejemplo, Crab et al. (2010) reportan una concentración de 25 mg/L de NAT para dar inicio al sistema a una relación C/N de 10; otros estudios presentan NH4Cl como aporte de N para el inicio biofloc a una concentración de 2 mg/L, usando como fuente de carbono harina de tapioca a una relación C/N de 10 (Gomes Vilani et al. 2016; Fauji et al. 2018).
Otro factor es el inóculo con el que dan inicio al sistema, esta condición básicamente puede referirse al uso de microrganismos comerciales, o a potencializar los microorganismos presentes en el agua proveniente de otro sistema de cultivo (sistemas de recirculación en acuicultura -RAS-, estanques en tierra, filtros, biofloc, entre otros). En este sentido, Crab et al. (2010) reportaron el lodo de un filtro de tambor como inóculo para el inicio de un cultivo en biofloc.
Fauji et al. (2018) adicionan probióticos comerciales que contienen Bacillus subtillis y Bacillus licheniformis; otros autores reportan inóculo con agua de cultivo de diatomeas Chaetoceros muelleri (Gomes Vilani et al. 2016); Martins et al. (2020) evalúan el uso como inóculo de agua proveniente de sistemas biofloc maduros con procesos de nitrificación establecidos. En esta dirección, Miranda-Baeza et al. (2019) sugieren que los conglomerados provenientes de biofloc contienen comunidades bacterianas bien establecidas, lo cual hace difícil que sean modificadas por la adición de probióticos.
La dominancia de microorganismos en el biofloc es asociada a las relaciones C/N, lo cual sugiere que una alta proporción da condiciones de mayor biodisponibilidad de carbono orgánico, promoviendo la remoción de N por microorganismos y vías heterótrofas (Avnimelech 2009). Dado que los procesos de oxidación del N pueden estar asociados a menores relaciones C/N con la participación de microorganismos autótrofos (Ebeling et al. 2006), estudios realizados por Bakar et al. (2015) establecen la reducción del N a diferentes relaciones C/N de 10, 15, 20, 25 y 30/1, siendo que, a mayor C/N, menores fueron los procesos de nitrificación.
Por otra parte, las relaciones C/N presentan diferencias en la conformación orgánica del biofloc, estando relacionadas proporcionalmente con un mayor aporte de carbono orgánico al sistema (Martins et al. 2020). De esta manera, las vías heterótrofas tienen como producto una mayor producción de sólidos en suspensión volátiles (SSV) (Ebeling et al. 2006; Xu et al. 2016), generando condiciones particulares en la conformación de los eslabones superiores (organismos del zooplancton) de la red trófica (Hernández et al. 2017; Ray et al. 2010), donde se reportan organismos como: microalgas, protistas (ciliados), rotíferos, cladóceros y copépodos (Ayazo-Genes et al. 2019; Betancur Gonzales et al. 2016; Castro-Mejía et al. 2017; Monroy-Dosta et al. 2013; Lima 2017).
Teniendo en cuenta lo anterior, el objetivo de esta investigación fue establecer la secuencia de remoción de N, el perfil de sólidos y la caracterización del zooplancton durante el establecimiento del biofloc a tres relaciones C/N.
METODOLOGÍA
Los experimentos de estabilización de biofloc a tres relaciones C/N se realizaron en la unidad de experimentación con BFT del Instituto de Acuicultura y Pesca de los Llanos, adscrito a la Facultad de Ciencias Agropecuarias y Recursos Naturales de la Universidad de los Llanos, Colombia (4°04'30"N 73°35'07"O).
Comité de ética
La investigación contó con el concepto técnico favorable del comité de bioética (acta 07 de 2019) de la Dirección General de Investigaciones de la Universidad de los Llanos. Todos los procedimientos se llevaron a cabo de acuerdo con la "Guía para el cuidado y uso de animales de laboratorio" del Consejo Nacional de Investigación de Estados Unidos y la "Política sobre el cuidado y uso humanitarios de animales de laboratorio" del Servicio de Salud Pública de Estados Unidos.
Establecimiento del biofloc
Se utilizaron tres tanques circulares de 3 m de diámetro con un volumen útil de 7.000 L, recubiertos con una bolsa de geomembrana HDPE, protegidos por un domo o cúpula en polietileno de baja densidad con transparencia del 90% para regular temperatura, entrada de luz y agua lluvia, la incorporación de oxígeno al agua se hizo a través de un aireador tipo soplador (1 HP), usando como difusor manguera microperforada.
Cada tanque se llenó con 7.000 L de agua dulce, regulando los parámetros de calidad de agua bajo las siguientes restricciones experimentales: temperatura T = 26 - 28° C; oxígeno disuelto (OD) > 5 mg/L, saturación de oxígeno (SO) > 60%, pH = 7,5 - 8,5 y alcalinidad total (AT) = 80 - 130 mg CaCO3/L; posteriormente se procedió al establecimiento y estabilización del biofloc, teniendo en cuenta los planteamientos descritos por De Schryver et al. (2008) y Avnimelech (2009), manejando tres relaciones C/N, así: tanque 1 a una relación C/N=10/1; tanque 2 de 15/1 y tanque 3 de 20/1, como fuente de N se utilizó alimento balanceado con un nivel de proteína del 32% (humedad del 13 %), como fuente de carbono melaza (33,65% de carbono orgánico total), como fuente alcalinizante: bicarbonato de sodio (NaHCO3), del cual el 98,59% del tamaño de partícula es menor a 0,355 mm.
La cantidad de alimento que se adicionó en los tres tratamientos para incrementar teóricamente la concentración del nitrógeno amoniacal total (NAT) se determinó a partir de la siguiente ecuación:
Donde, A: cantidad de alimento (g); NAT: nitrógeno amoniacal total (deseado); Vol= volumen de agua (L); % PB: % de proteína bruta del alimento; 0,155: % de nitrógeno presente en la PB (Avnimelech 2015); 0,87: % de materia seca del alimento; * no se tuvo en cuenta el 0,75 planteado en De Schryver et al. (2008) correspondiente al porcentaje de excreción de amonio (NH3) porque no hay peces.
Para calcular la cantidad de carbono orgánico (melaza), se tuvo en cuenta la relación C/N propia del alimento, la relación C/N correspondiente a cada tratamiento y el % de carbono orgánico total de la fuente, como se describe a continuación: C/NAT ↔ (A x 0,5x 0,87) / (A x PB x 0,155x 0,87); donde:
C: cantidad de carbono en el alimento y 0,5: el % de carbono en el alimento (Avnimelech 2009)
Teniendo en cuenta lo anterior, para el primer día se incrementó teóricamente el NAT a 2 mg/L según lo reportado por Fauji et al. (2018) y Gomes Vilani et al. (2016), para lo cual se adicionó 324 g de alimento con el 32% PB a cada tanque (7.000 L), y para regular la relación C/N de los tres tratamientos, se adicionó melaza en las siguientes cantidades; T1 (10/1) = 0 g, T2 (15/1) = 205 g y T3 (20/1) = 413 g a cada tanque (7.000 L).
Al segundo día, como inóculo, se adicionó a cada tanque 10 litros de agua proveniente de un estanque de cultivo de cachama blanca en tierra; al sexto y décimo día se adicionó, nuevamente, alimento y melaza en las cantidades necesarias para subir teóricamente el NAT a 4 mg/L, conservando las relaciones C/N de cada tratamiento y manteniendo la alcalinidad en los rangos establecidos; y desde el día doce hasta el día sesenta (fin de experimento) se adicionó alimento calculado para incrementar de manera teórica 1 mg/L de NAT, conservando las relaciones C/N de los tratamientos; el tiempo de evaluación se determinó cuando los compuestos nitrogenados NH4 + + NH3, NO2 - y NO3 - presentes en el agua estuvieron dentro de rangos no tóxicos para especies ícticas de agua dulce (Jiménez-Ojeda et al. 2018) y se observaron comunidades asociadas al plancton.
Seguimiento de los parámetros de calidad de agua
Durante el establecimiento y la estabilización del biofloc, se registraron mediciones y registros de la calidad del agua en los tres tanques de biofloc bajo las siguientes consideraciones: una vez al día se determinaron las concentraciones de nitrógeno amoniacal total NAT = (NH4 + + NH3 mg/L), nitrito (NO2 - mg/L), nitrato (NO3 - mg/L) y alcalinidad total (AT mg CaCO3/L) con fotómetro YSI Yellow Spring Instrument™ Ref 9500 Exactitud ± 0,5% a 4% transmitancia; ± 0,005 a 0,3 AU Resolución 0,001 AU, y sólidos sedimentables (SS ml/L) con conos Imhoff conforme a la metodología da APHA (1998), adaptada por Avnimelech (2007). Dos veces al día, pH, temperatura (T °C) y oxígeno (O2 mg/L y %) fueron determinados con sonda multiparamétrica HANNA HI98196.
Al final del establecimiento, se tomaron muestras del agua del biofloc en los tres tanques y, por triplicado, los sólidos totales (ST), volátiles (SV) y fijos (SF) para cada tratamiento; los ST, SF y SV se midieron por el método gravimétrico siguiendo la metodología da APHA (2017) (2540B y 2005-2540E, respectivamente).
Toma de muestras y caracterización del zooplancton
Los muestreos se realizaron cada dos días durante los últimos 14 días de experimentación. La recolección de las muestras de zooplancton se efectuó en los tres tratamientos, se tomaron cinco réplicas en diferentes puntos dentro de cada uno de los tanques sobre la parte superficial del cuerpo de agua. Dichas muestras se recogieron en frascos plásticos con un volumen de 50 ml, se fijaron con solución de Transeau (agua destilada, alcohol al 70% y Formol al 40% mezclados en proporción 6:3:1) (Arcos-Pulido y Gómez Prieto 2006), protegidos de la luz.
Para la observación e identificación del zooplancton, se tomaron las muestras de cada tratamiento y luego se observaron en la cámara de conteo Sedgwick-Rafter con marco de acrílico rectangular con una capacidad volumétrica de 1 ml.
Asimismo, se tomó 1 ml de cada una de las cinco muestras por relación C:N, estas se dejaron reposar por cinco minutos para que el zooplancton se deposite en el fondo de la cámara y examinar a una magnificación inicial de 10X y luego 20X con un microscopio óptico modelo NiKon-ECLIPSE Ti. Antes de iniciar el recuento de los 30 puntos al azar dentro de la cámara, se observó detenidamente toda la extensión de la cámara para identificar las principales especies presentes en la muestra y se tomaron fotografías, de tal modo que estudios han demostrado que en un recuento de 30 puntos se puede determinar entre el 90% o el 95% de las especies presentes en las muestras (Moreno et al. 2012).
Por otra parte, la identificación del zooplancton se realizó con ayuda de claves taxonómicas, entre ellas la de Rieradevall (1987); Korovchinsky (1992); Elmoor- Loureiro (1997); Glime (2017); Fontaneto y De Smet (2014); Aboal et al (2012); Rogers y Thorp (2019).
La abundancia de microorganismos por grupo identificado se determinó por la fórmula: Abundancia = ((Vcf)(Ni))/(Vti)*Vc; donde Vcf: volumen de la concentración; Ni: número de individuos contados; Vti: volumen total inicial; Vc: volumen de la muestra contado. La abundancia fue expresada en número de individuos/mL. La relación entre el número de especies y su abundancia relativa en tiempo y espacio se interpretó a través de los conteos de los 14 días de muestreo realizados por cada tratamiento planteada por Ayazo-Genes et al. (2019).
Análisis estadístico
Se empleó un diseño completamente alea-torizado efecto fijo balanceado de tipo longitudinal con interacción en el tiempo, incorporando la técnica MANOVA, para determinar la dimensionalidad por medio de la función de máxima verosimilitud, mediante la transformación de datos por medio de la técnica BOX-COX. Las comparaciones unidimensionales se realizaron por medio de la prueba de Tukey, teniendo en cuenta un nivel de significancia del 5%. Se utilizó el paquete estadístico SAS University.
RESULTADOS
Parámetros físicos y químicos del agua
Se encontraron diferencias estadísticas entre T1 respecto a T3 para los parámetros potencial de óxido reducción (ORP, mV) y SO; para el OD la diferencia se presentó entre el tratamiento 1 respecto a los demás. En cuanto a la temperatura, existe diferencia estadística entre todos los tratamientos; el análisis multivariado de la varianza permitió analizar de manera simultánea las variables: PH, ORP (mV), SO, OD, temperatura, detectando diferencia estadística entre los tratamientos. La prueba canónica permitió evidenciar la diferencia entre los tratamientos T1, T2 respecto a T3, como se observa en la tabla 1.
TABLA 1 Análisis comparativo de los parámetros pH, potencial de oxidorreducción (ORP, mV), saturación de oxígeno (SO), oxígeno disuelto (OD) y temperatura (T°C) del agua durante el establecimiento del biofloc a tres relaciones carbono / nitrógeno

Datos presentados como media ± desviación estándar. Letras distintas indican diferencia significativa (p < 0,05).
Fuente: elaboración propia.
Para la variable NO2 - la diferencia se dio entre el tratamiento T2 respecto a T3; al evaluar el NO3 - la divergencia se dio entre T1, T2 respecto a T3; para las variables NAT y AT no se detectó diferencia estadística (p>0,05). El análisis multivariado de la varianza, al evaluar de manera simultánea el NO2 -, NO3 -, NAT y AT, detectó diferencia entre tratamientos, la prueba canónica permitió evidenciar la diferencia entre los tratamientos T1, T2 respecto a T3 (tabla 2).
TABLA 2 Análisis comparativo de los parámetros: Nitrógeno Amoniacal Total (NAT= NH4+ + NH3); nitrito (NO2- ), nitrato (NO3-) y alcalinidad total (AT) del agua durante el establecimiento del biofloc a tres relaciones C/N

Datos presentados como media ± desviación estándar. Letras distintas indican diferencia significativa (p < 0,05).
Fuente: elaboración propia.
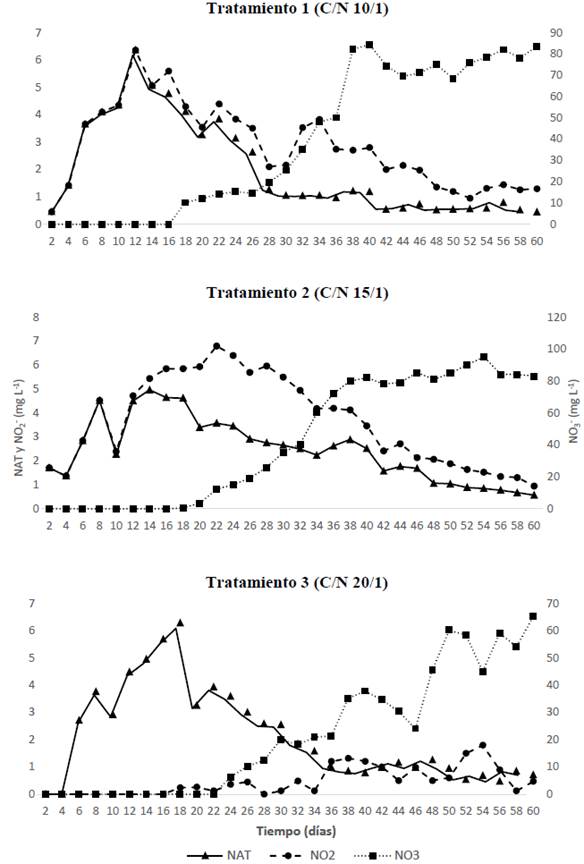
Teniendo en cuenta que durante la estabilización del biofloc se presentan y registran en el tiempo las concentraciones de los compuestos nitrogenados (NH4 + + NH3, NO2 - y NO3 -), en la figura 1 se presentan los comportamientos en los procesos de nitrificación para los tres tratamientos.
Perfil de sólidos
En cuanto a los sólidos sedimentables (SS), no presentaron diferencia estadística entre tratamientos, para los totales (ST) la diferencia estuvo entre T2, T3 respecto a T1. Para los volátiles y fijos (SV, SF), existen diferencias significativas entre todos los tratamientos (p < 0,05). El análisis canónico indica que, al evaluar de manera conjunta el perfil de sólidos, existen diferencias entre los tratamientos T2, T3 respecto a T1 (tabla 3).
TABLA 3 Análisis comparativo de sólidos sedimentables (SS), sólidos totales (ST), sólidos volátiles (SV) y sólidos fijos (SF) del agua durante el establecimiento del biofloc a tres relaciones carbono/nitrógeno

Datos presentados como media ± desviación estándar. Letras distintas indican diferencia significativa (p<0.05).
Fuente: elaboración propia.
Abundancia y riqueza del zooplancton
Durante los últimos 14 días de la estabilización del sistema biofloc a tres diferentes relaciones carbono/nitrógeno, se identificaron 9 grupos de zooplancton, distribuidos en 17 familias, 17 géneros, 22 especies y 2 morfo especies (tabla 4). La mayor riqueza se observó en la relación 15/1 (T1).
TABLA 4 Registro taxonómico del zooplancton (grupos, familias, géneros y especies) registrado en la estabilización de biofloc a tres relaciones C/N

Fuente: elaboración propia.
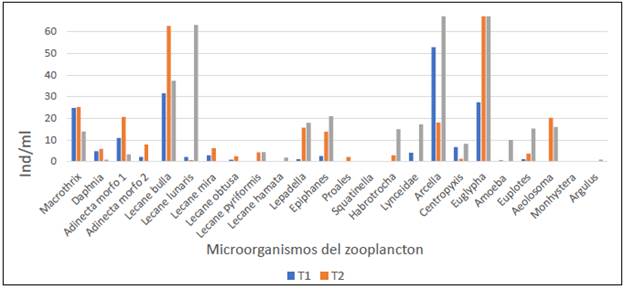
En la figura 2, se presenta la abundancia de los organismos del zooplancton en los tres tratamientos registrada durante los últimos 14 días de la estabilización del biofloc, y en la figura 3 y 4 se presenta la abundancia por organismos del zooplancton por especie durante el periodo evaluado (14 días).

Fuente: elaboración propia.
FIGURA 2 Abundancia de microorganismos del zooplancton (individuos/ml) en biofloc a tres diferentes relaciones C/N durante los últimos 14 días de estabilización.
Fuente: elaboración propia.
FIGURA 3 Abundancia de microorganismos del zooplancton por especie (ind/ml) en biofloc a tres diferentes relaciones C/N durante los últimos 14 días de estabilización.

Fuente: elaboración propia.
FIGURA 4 Cladóceros, nematodos, anélidos, ciliados, rizópodos (amebas), ácaros observados en el cultivo de biofloc a tres relaciones C/N, a. Macrothrix, b. Monhystera, c. Arcella, d. Aeolosoma, e. Euglypha, f. Centropyxis, g. Argulus, h. Lynceidae morfo 1 i. Lynceidae j.Daphnia, k. Euplotes, l. Amoeba.
DISCUSIÓN
Los reportes de investigaciones en biofloc presentan en su mayoría las restricciones de los experimentos como: relaciones C/N, niveles de proteína del alimento, fuentes de carbono orgánico e inorgánico, rangos de parámetros de calidad de agua etc., (Bakhshi et al. 2018; Brú-Cordero et al. 2017; Crab et al. 2010; Ekasari et al. 2014; Ekasari et al. 2015; Fauji et al. 2018; García-Ríos et al. 2019; Poli et al. 2015; Li et al. 2018), al igual que las fórmulas / ecuaciones donde describen de manera teórica los cálculos para las adiciones, regulaciones o correcciones del sistema (Ekasari et al. 2015; Ekasari et al. 2016; Hernández et al. 2017; Zapata et al. 2017), siendo los planteamientos de mayor relevancia y citación los reportados por De Schryver et al. (2008), Avnimelech (2009) y Timmons et al. (2002).
No obstante lo anterior, son pocas las publicaciones que describen con detalle las actividades, procedimientos y consideraciones para el establecimiento del biofloc en general y para larvicultura en particular (Gomes Vilani et al. 2016; Hargreaves 2013). A continuación se presenta la discusión de los resultados obtenidos en los experimentos de estabilización del biofloc sustentados en la calidad del agua y la producción de alimento vivo (zooplancton).
De la calidad del agua
Las mediciones y los resultados de la calidad del agua durante los experimentos evidencian el efecto buffer en la estabilidad del pH del agua para los tres tratamientos (sin diferencia significativa), manteniéndose en valores medios cercanos a 8, atribuibles a la adición de bicarbonato de sodio (NaHCO3) con el que se reguló la AT, estos aportes de sales de materiales básicos como el Na+ en conjunto con aniones como el HCO3 - generan ese efecto en la neutralización de ácidos (H+) y/o bases (OH-) (Manrique y Peláez 2013; Kubitza 2017). De esta manera, los valores de la AT estuvieron entre 87,3 - 132,5 mg CaCO3 /L, sin diferencia entre tratamientos; estos valores de pH y AT están dentro de los rangos reportados para el cultivo de larvas y alevinos de peces en biofloc (Ekasari et al. 2015; Ekasari et al. 2016; Emerenciano et al. 2017; García-Ríos et al. 2019; Poli et al. 2015; Li et al. 2018; Zapata et al. 2017).
La saturación de oxígeno fue diferente entre los tratamientos 1 y 2, en tanto que el oxígeno disuelto presentó diferencia entre los tres tratamientos, la cual fue a la vez inversa a la relación C/N, cuanto menor la relación, mayor fue el oxígeno disuelto (mg/L). Este comportamiento puede ser explicado por la mayor cantidad de melaza que se adicionó a los tratamientos (macrocosmos) con mayores relaciones C/N (T2 = 15/1 y T3 = 20/1), contrario al T1, al cual no se adicionó melaza (alimento con 32% de PB ≈ C/N →10/1), por consiguiente es posible generar dominancia en los procesos de inmovilización de nitrógeno y nitrificación al variar el nivel de adición de carbohidratos, pudiéndose controlar la relación entre estas dos variables (Avnimelech 2015), así también la mayor adición de melaza en el T2 y T3 generó procesos heterótrofos con mayor consumo de oxígeno y mayor generación de sólidos, teniendo en cuenta el balance estequiométrico presentado por Ebeling et al. (2006), con todo, el oxígeno se mantuvo en rangos confortables para el establecimiento del biofloc, teniendo en cuenta lo definido por Avnimelch (2009).
La disponibilidad de C (orgánico e inorgánico), bajo condiciones de saturación de oxígeno, alcalinidades mayores a 87,3 mg CaCO3 L-1, temperaturas mayores a 26.02 °C registradas para los tres tratamientos, sumada a la continua adición de alimento con 32% de PB, dio condiciones para el establecimiento relativamente rápido de microrganismos quimiautótrofos, los cuales obtienen su energía a partir de la oxidación de compuestos inorgánicos como el amonio, el cual sufre la oxidación biológica a NO2 - y posteriormente a NO3 - mediante el proceso de nitrificación (Jiménez-Ojeda et al. 2018).
Para todos los casos, el incremento del NAT se presentó a partir del segundo día, esto puede ser atribuido a las condiciones propias del inóculo empleado para el arranque de los tanques, los valores máximos de TAN para el T1 y T2 en el día 14 (5,1 y 4,97 mg/L, respectivamente) y para el T3 de 6,28 mg/L a los 18 días, coincidiendo con lo expuesto por Ray y Lotz (2014), los máximos niveles en un sistema heterotrófico se presentaron a los 28 días con un nivel de proteína del 35%, para relaciones 10 y 15/1 las máximas concentraciones de NAT se dan en menores tiempo que en procesos heterótrofos, acorde con lo reportado por Zapata et al. (2017) y Martins et al. (2017), presentando curvas descendentes hasta llegar a rangos no letales del amonio no ionizado (NH3) siendo este dependiente del pH y la temperatura (Emerson et al. 1975); estos comportamientos del NAT durante el establecimiento del biofloc están reportados por Avnimelech (2015), por lo cual se requiere de 30 a 40 días para llegar a niveles no tóxicos para especies de peces (Jiménez-Ojeda et al. 2018), datos similares a los encontrados en el presente experimento y en rangos no letales para especies del género Piaractus (Barbieri y Vigliar Bondioli 2015).
Consecuentemente con las condiciones de calidad de agua y la disponibilidad de carbono (orgánico e inorgánico), se evidencian los procesos de nitrificación cuando aparecen y aumentan las concentraciones de NO2 - con picos para el T1 desde el día 12 y para T2 desde el día 22, los que fueron más rápidos a los establecidos por Zapata et al. (2017) en relaciones C/N similares que fueron entre 28 y 32 días para relaciones similares; el T3 nunca presentó concentraciones por encima de 1,8 mg/L durante los 60 días en los que se vigiló el inicio del biofloc, siendo que Azim et al. (2008) reportan un incremento de NO2 - con valores cercanos a 1,5 mg/L para el día 21, similar a los datos reportados para el presente estudio. Las menores concentraciones de NO2 - en T3, como se ha dicho, pudieron deberse a la mayor adición de carbono orgánico que se realizó en este tratamiento, las cuales dieron origen a condiciones heterotróficas más pronunciadas, lo que se hace evidente cuando en T3 las concentraciones de NAT se sitúan por debajo de 1 mg/L a partir del día 36.
La concentración de NO3 - para los 3 macrocosmos durante los 60 días iniciales de establecimiento de los bioflocs presentaron diferencias significativas entre el T3 y T1 y T2, siendo inversa a la relación C/N, lo cual puede ser atribuido al mayor aporte de carbono orgánico que requieren las mayores relaciones y su dependencia con el nivel de proteína del alimento suministrado, como lo plantean Azim et al. (2008) al encontrar diferencias en la concentración de nitratos cuando varía el nivel de proteína.
Por otra parte, autores como De Schryver et al. (2008), Hargreaves (2013), Ray y Lotz (2014) y Avnimelech (2015) plantean el favorecimiento a microorganismos heterótrofos en el biofloc mediante relaciones C/N 20:1, pues logran remover el NAT con la adición de carbohidratos, siendo esta una ruta rápida, tratando de restringir en alguna medida la formación y acumulación de NO2- y NO3 - (Avnimelech 2015); no obstante, para las tres relaciones C:N se presentaron procesos de nitrificación como una de las principales vías del ciclo del nitrógeno (Stein y Klotz 2016) en los sistemas de cultivo con biofloc (Avnimelech 2015) y concentraciones de NAT y NO2 - inferiores a 1 mg/L y NO3 - superiores a 60 mg/L al día 60, dando condiciones de establecimiento a comunidades bacterianas asociadas con la remoción de los compuestos nitrogenados generados continuamente por la adición de alimento diario.
Del perfil de sólidos y conformación del zooplancton
No se encontró diferencia en los SS entre tratamientos, estando al final del experimento en valores medios cercanos a los 14 ml/L, estando en el rango de concentraciones recomendado para alevinaje de tilapia (5 - 20 ml/L) medidos en conos imhoff, sugiriendo que mayores concentraciones pueden consumir más oxígeno por las comunidades heterotróficas y oclusión en las branquias de los peces (Emerenciano et al. 2017).
Para los sólidos volátiles, entendidos como la carga orgánica de los sólidos totales (Boyd 2015), se encontraron diferencias estadísticas significativas entre tratamientos, siendo la mayor concentración para T3 (290,2 ± 43,2 mg/L) > que T2 (218,0 ± 14,2 mg/L) y > que T1 (141,1 ± 5,8 mg/L), el mayor valor de T3 ocurrió similar a lo reportado por Azim et al. (2008), quienes obtuvieron valores cercanos a los 300 mg/L de SSV, que, como se ha propuesto, puede atribuirse a la mayor adición de melaza de tal tratamiento utilizada para mantener la relación teórica de C/N en 20/1, lo que removió el N a partir de favorecer una dominancia de comunidades heterotróficas con la consecuente producción de SSV, como lo plantean Ebeling et al. (2006). Todo lo anterior, la fuente de carbono y cantidad adicionada, se puede considerar que afectó la composición orgánica del biofloc reflejada en los sólidos volátiles registrados, lo cual cambia la biodisponibilidad de nutrientes y sus relaciones, que a su vez afecta la conformación de la microfauna, como lo plantean Crab et al. (2012).
Hernández et al. (2017) consideran fundamental la transferencia de materia y energía desde la red trófica a niveles superiores, en este sentido, bajo las condiciones de inicio y establecimiento, regulación y mantenimiento de la calidad del agua y perfiles de sólidos del biofloc reportados para este trabajo, los tres tratamientos (macrocosmos) a diferentes relaciones C/N presentaron organismos del zooplancton, como lo reportan diferentes autores (Ray et al. 2010; Monroy-Dosta et al. 2013; Hernández et al. 2017; Ayazo-Genes et al. 2019).
Se resalta que la conformación del zooplancton es fundamental para el cultivo de larvas de peces nativos al inicio de la alimentación exógena (Atencio 2001; David-Ruales et al. 2018) como la cachama blanca por su tendencia alimenticia de zooplancton durante etapas tempranas (Machado-Allison 1992).
El tratamiento que presentó mayor abundancia del zooplancton fue el T2. No obstante, los rotíferos fueron los grupos de mayor abundancia en todos los tratamientos, con los géneros Lecane, similar a lo reportado en la caracterización del plancton en biofloc por Ayazo-Genes et al. (2019), Betancur Gonzáles et al. (2016) y Castro-Mejía et al. (2017).
Se destaca la presencia de otros organismos como las Macrothrix y Dhapnias para los tratamientos T1 y T2, de importancia en la larvicultura de peces, en concordancia con organismos como Cladóceros y Copépodos reportados por Ayazo-Genes et al. (2019).
CONCLUSIÓN
Bajo las condiciones expuestas, la estabilización del biofloc en las tres relaciones de C/N evaluadas se mostraron adecuadas en términos de la calidad de agua y producción de alimento vivo, siendo que la relación C/N = 15/1 presentó las mayores riqueza y abundancia de microorganismos del zooplancton.