Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.43 no.3 Bogotá July/Sept. 2015
http://dx.doi.org/10.1016/j.rca.2015.03.007
Investigación científica y tecnológica
Lactato de Ringer versus solución salina normal para trasplante renal. Revisión sistemática y metaanálisis
Lactated Ringer's vs. normal saline solution for renal transplantation: Systematic review and meta-analysis
Jorge Alejandro Trujillo-Zeaa, Natalia Aristizábal-Henaob y Nelson Fonseca-Ruizc,*
a Anestesiólogo, Universidad Pontificia Bolivariana, Medellín, Colombia
b Médica Internista, Universidad Pontificia Bolivariana, Medellín, Colombia
c Anestesiólogo Intensivista, Epidemiólogo, Universidad Pontificia Bolivariana, Medellín, Colombia
* Autor para correspondencia: Calle 36 AA sur No. 25B-99 1129, Medellín, Colombia.
Correo electrónico: ñfonseca@une.ñet.co (N. Fonseca-Ruiz).
Información del artículo
Historia del artículo: Recibido el 19 de marzo de 2014 Aceptado el 8 de marzo de 2015 On-line el 21 de mayo de 2015
Resumen
Antecedentes: La administración de soluciones con potasio puede causar hiperpotasemia durante la cirugía; la solución salina normal (SSN), usada tradicionalmente en trasplante renal, puede generar acidosis hiperclorémica.
Objetivo: Comparar la seguridad del lactato de Ringer (LR) con SSN en el trasplante renal.
Estrategia de búsqueda: Se realizó una revisión sistemática en el Registro Cochrane Central de ensayos controlados, Medline, Lilacs, EBSCO y Embase, en artículos de revisión y contactando clínicos expertos. No hubo restricción de idioma.
Criterios de selección: Se incluyeron ensayos controlados aleatorizados en pacientes adultos sometidos a trasplante renal.
Recogida y análisis de datos: De forma independiente se realizó selección de estudios, evaluación de la calidad y extracción de datos. Se calculó la diferencia de medias con su intervalo de confianza del 95% (IC 95%). Se evaluó la heterogeneidad con el estadístico I-cuadrado (I2). Se usaron los modelos de efectos fijos y aleatorios.
Resultados: Se incluyeron 4 estudios con un total de 237 pacientes. Al final de cirugía la diferencia de potasio no fue significativa (diferencia de medias [DM]: -0,26 mEq/l; IC95%: -0,58 a 0,05; p = 0,10; I2: 75%), el pH fue menor en el grupo de SSN (DM: 0,06; IC95%: 0,05 a 0,08; p < 0,001; I2: 17%). No hubo diferencia en la creatinina al tercer día postoperatorio (DM: -0,05; IC95%: -0,59 a 0,48; p = 0,85; I2: 0%).
Conclusiones: El uso de LR comparado con SSN en el perioperatorio de trasplante renal genera menores niveles de potasio y cloro y mayor pH, sin cambios significativos en la creatinina.
Palabras clave: Trasplante de Riñon, Acidosis, Hiperpotasemia, Cloruro de Sodio, Periodo Perioperatorio.
Abstract
Rationale: Administration of solutions with potassium can produce hyperkalemia during surgery, so normal saline (NS) is used in kidney transplantation, but it is known to cause hypercloremic acidosis.
Objective: To compare the safety of Lactated Ringer's Solution (LR) with NS in kidney transplantation.
Search strategy: For this updated review we searched Cochrane Central Register of Controlled Trials Medline (1966 to 2013), Lilacs (1982 to 2013), EBSCO and Embase (1980 to 2013), review articles and clinical experts. There was no language restriction.
Selection criteria: We included randomized controlled trials (RCTs) in adults undergoing kidney transplantation.
Data collection and analysis: We independently performed study selection, risk of bias assessment and data extraction. We estimated mean difference with the confidence intervals of 95% (95% CI). We measured statistical heterogeneity using the I2 statistic. We used a random-effects and fixed models.
Mean results: We included a total of four RCTs involving 237 participants. At the end of surgery potassium level was lower in LR group (mean difference [MD]: -0.26 mEq/L; 95% CI: -0.58 to 0.05; P = .10; I2: 75%), pH was lower in NS group (MD: 0.06; 95% CI: 0.05 to 0.08; P < .001; I2: 17%). There was no difference in creatinine on the third post-operatory day (MD: -0.05; 95%CI: -0.59 to 0.48; P = .85; I2: 0%).
Conclusions: Use of LR produces lower potassium and chloride levels and higher pH, without changes in creatinine compared with NS in the perioperative period of kidney transplantation.
Keywords: Kidney Transplantation, Acidosis, Hyperkalemia, Sodium Chloride, Perioperative Period.
Introducción
La fluidoterapia en el intraoperatorio de trasplante renal se ha realizado tradicionalmente con solución salina normal (SSN), pues la administración de grandes volúmenes en pacientes quirúrgicos de soluciones con potasio, como lactato de Ringer (LR), puede causar hiperpotasemia1. Se han publicados diversos trabajos sobre el tema, los cuales muestran que la administración de SSN en grandes volúmenes, como ocurre frecuentemente en los pacientes sometidos a trasplante renal, está asociada con acidosis metabólica hiperclorémica1-4.
Se sabe, basados en la teoría de Stewart, que los líquidos comúnmente administrados en cirugía pueden alterar el equilibrio ácido-base predisponiendo a acidosis metabólica por aumento del nivel de cloro5,6. Dicha acidosis puede generar hiperpotasemia por un movimiento transcelular de iones potasio hacia el exterior1-3,7. La hipercloremia a su vez puede causar vasoconstricción de la arteriola aferente causando daño al injerto renal2,3. Otras complicaciones derivadas de la acidosis pueden ser cambios en el estado mental y molestias abdominales por alteración en la vasculatura esplácnica7, e incluso se ha asociado a mayor mortalidad en pacientes quirúrgicos8.
El renal es el trasplante más frecuente en nuestro país y en el mundo9. Los resultados del trasplante renal han mejorado con el avance de las técnicas quirúrgicas, inmunosupresoras y de anestesia. La presencia de hiperpotasemia asociada a acidosis metabólica hiperclorémica puede ayudar a producir disfunción del injerto, por lo cual se deben evitar en estos pacientes10.
Se han publicado varios estudios que comparan el uso de LR con la SSN, pero incluyen pocos pacientes2,3,11-14. Realizamos un metaanálisis para evaluar los efectos de LR comparado con SSN en la incidencia de acidosis metabólica hiperclorémica, hiperpotasemia, volumen de líquidos infundidos y disfunción del injerto renal en los pacientes sometidos a trasplante renal.
Metodología
Esta revisión sistemática se realizó con la metodología recomendada por la Colaboración Cochrane14. Este protocolo no ha sido publicado y no fue registrado.
Criterios de elegibilidad
La búsqueda incluyó ensayos clínicos controlados con asignación aleatorizada (ECA) sin restricción de lenguaje, fecha o estado de publicación, que compararan el uso de LR con SSN, como fluidoterapia en pacientes intervenidos para trasplante renal, mayores de 18 años y que evaluaran como desenlaces el valor sérico de potasio, bicarbonato, cloro, creatinina y el pH en el postoperatorio. La fecha límite de publicación establecida para la búsqueda fue el 8 de julio de 2013.
Estrategias de búsqueda
De manera independiente, los 3 autores realizaron una búsqueda en bases de datos electrónicas, contactando clínicos expertos y buscando artículos de revisión. No se aplicaron restricciones por idioma, ni por fecha de publicación.
Las bases de datos consultadas fueron el Registro Cochrane Central de Ensayos Controlados, Medline (1966-2013), Lilacs (1982-2013), EBSCO y Embase (1980-2013).
Los términos de búsqueda fueron «trasplante renal», «acidosis», «acidemia», «hiperpotasemia», «disfunción de injerto», «lactato Ringer» y «solución salina».
Selección y evaluación de los estudios
Dos de los autores revisaron de forma independiente todos los títulos y resúmenes identificados en la búsqueda bibliográfica y excluyeron los ensayos que no eran pertinentes. Se evaluaron los ensayos restantes en texto completo. Los desacuerdos se resolvieron con el tercer autor.
La validez de los estudios elegidos se evaluó independientemente por los 3 investigadores de acuerdo a la guía de la Colaboración Cochrane15, se valoró la generación de la secuencia aleatorizada, el ocultamiento de la secuencia, cegamiento, recogida de la información, pérdidas de seguimiento en el estudio, presencia de datos incompletos, informe selectivo de resultados y otros sesgos. Basados en esta metodología, se clasificaron los riesgos de sesgos como alto, incierto y bajo.
Recogida de datos
Para el análisis de la información extraída de los estudios incluidos se usó una tabla de extracción de información, basada en las recomendaciones de Cochrane Consumers and Communication Review Group's data extraction témplate14. Los datos requeridos que no se encontraron a partir de la lectura directa de los artículos se solicitaron directamente a los autores. Del artículo que contenía la mayor muestra solo se pudo obtener el resumen en inglés, pero la versión completa estaba en idioma persa13. Se intentó contactar a los autores para obtener los datos completos, pero no fue posible. La información fue extraída de los estudios por un investigador, apegado a la tabla desarrollada, y la información obtenida fue revisada por un segundo investigador, garantizando certeza de los datos.
Resultados analizados
Los resultados analizados fueron promedio de potasio sérico en mEq/l en el postoperatorio, creatinina sérica en mg/dl al tercer día postoperatorio, pH después de cirugía, volumen en litros de solución infundida y bicarbonato y cloro en mEq/l en sangre arterial después de la cirugía.
Análisis estadístico
En el presente metaanálisis se calculó la diferencia de medias con su respectivo intervalo de confianza del 95% (IC95%) para las variables consideradas. Usando el software Review Manager versión 5.1. se realizó un análisis por el modelo de efectos fijos o aleatorios de acuerdo a la presencia de heterogeneidad estadística. La presencia de heterogeneidad estadística se evaluó por la prueba Q de Cochrane y el estadístico I2.SielI2 fue menor de 40%, nosotros usamos el modelo de efectos fijos, y si el I2 fue mayor de 40%, se usó el modelo de efectos aleatorios. Se realizó análisis de sensibilidad según la calidad metodológica de los estudios, retirando estudios y reanalizando los datos. Igualmente se realizó análisis de subgrupos según las características de los pacientes y forma de la intervención administrada.
Resultados
Proceso de selección de estudios
En la búsqueda inicial se identificaron 187 artículos; de estos fueron excluidos 182 por no cumplir los criterios de elegibilidad (fig. 1).
Características de los estudios incluidos
Se identificaron 4 ECA, con 237 participantes, que cumplieron los criterios de inclusión. Todos los estudios fueron a doble ciego. Las principales características de estos estudios se presentan en la tabla 1. Se tomó como intervención «experimental» el LR y como «control» la SSN. Los tiempos de observación y seguimiento posterior al trasplante renal fueron variables en los diferentes estudios, por lo cual se tomaron los resultados de las mediciones a intervalos similares para hacerlos comparables.
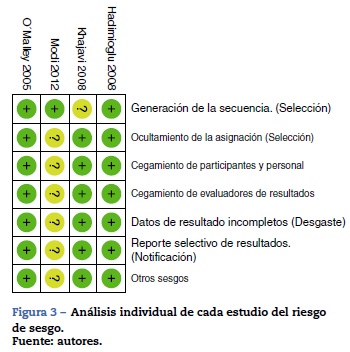
Al evaluar los riesgos de sesgos de los artículos incluidos se encontró que la mayoría usó programas de computador para generar la asignación aleatoria. Solo en el estudio de Kha-javi et al.3 no está claro cómo se hizo. Todos usaron sobres opacos para ocultar la asignación y en todos hubo un adecuado método de enmascaramiento. El estudio de Modi et al.12 fue calificado con «riesgo incierto», pues no tiene suficiente información para descartar sesgos de detección, desgaste y notificación. El riesgo de sesgo de los estudios se muestra en las figuras 2 y 3.
Los resultados considerados para el análisis incluyeron las mediciones de laboratorio durante el perioperatorio calificadas como más importantes por los autores. Al final de cirugía la diferencia de potasio no fue significativa (diferencia de medias [DM]: -0,26 mEq/l; IC95%: -0,58 a 0,05; p = 0,10; I2: 75%), aunque cuando se hizo por efectos fijos se encuentra menor valor en el LR (fig. 4).
Los resultados secundarios considerados muestran que no hay diferencia en el valor de creatinina en mg/dl al tercer día del postoperatorio (DM: -0,05; IC 95%: 0,59 a 0,48; p = 0,85; I2: 0%) (fig. 5).
Respecto al estado ácido-base hay mayor acidosis en el grupo de SSN, se encontró que el pH fue mayor en el grupo de LR (DM: 0,06; IC95%: 0,05 a 0,08; p< 0,001; I2:17%) (fig. 6) así como el bicarbonato fue mayor en el grupo de LR (DM: 2,72; IC95%: 1,74 a 3,69; p<0,001; I2: 0%) (fig. 7) y el valor de cloro fue menor en el postoperatorio, aunque por el método de análisis aleatorizado no alcanza diferencia estadística (DM: 10,06; IC95%: -20,37 a 0,25; p = 0,06; I2: 99%) (fig. 8).
No hubo diferencia significativa en el volumen infundido de líquidos en litros (DM: -0,01; IC95%: -0,31 a 0,29; p = 0,95; I2: 56%), aunque por métodos fijos se muestra que es mayor en el grupo de LR (fig. 9).
Discusión
El trasplante renal se ha convertido hoy en día en una alternativa más en el tratamiento de la enfermedad renal crónica15. La supervivencia a 5 años es del 70% mientras que los pacientes que continúan con diálisis solo sobreviven el 30%9,15-18. Los pacientes que son sometidos a trasplante renal tienen múltiples comorbilidades, como las cardiovasculares18, hipertensión, dislipidemia, hiperfosfatemia e hiperhomo-cisteinemia19-22, e hipertensión pulmonar23. Esto genera un reto anestésico para el periodo perioperatorio24. El trasplante renal en Colombia, de acuerdo con datos del gobierno, en 2008 fueron 2.693 pacientes y en 2010 fueron 3.691 trasplantes; esto indica un número creciente de este tipo de procedimientos en el país25,26. Actualmente la anestesia general es la técnica de elección; sin embargo, técnicas regionales han mostrado beneficio principalmente en cuanto a dolor postoperatorio27,28. Es importante un conocimiento de las diferentes fases de la cirugía para optimizar las condiciones quirúrgicas29-31.
En el intraoperatorio se ha descrito clásicamente la utilización de grandes volúmenes de fluidos que se ha asociado con mejoría en función del injerto10,24,31-39.
La fluidoterapia hace parte importante del manejo intraoperatorio del paciente llevado a trasplante renal10,40, especialmente porque las múltiples variables fisiológicas y patológicas lo hacen complejo41. Clásicamente la administración de grandes volúmenes de soluciones con potasio, como el LR, puede causar hiperpotasemia, y tradicionalmente se ha utilizado entonces la SSN1, y diversos estudios muestran que la SSN sigue siendo la elección para este procedimiento2. Sin embargo, estudios recientes sugieren que soluciones más balanceadas, como el LR, podrían evitar la acidosis metabólica hiperclorémica3-5; no sucede así con el uso de grandes volúmenes de SSN, que, como ha sido demostrado en otro tipo de pacientes, sí la produce4,8,42-45.
Existe controversia sobre qué tipo de cristaloides es la mejor opción en el paciente sometido a trasplante renal46-48. La utilización de coloides en estos pacientes es limitada34,48, y en la actualidad no se recomienda por sus efectos adversos, que incluyen insuficiencia renal49-52.
Este metaanálisis mostró que la administración del LR puede ser una alternativa para el manejo de la terapia hídrica en el trasplante renal, dado que contrariamente a la creencia anterior, esta solución no demostró mayor hiperpotasemia ni mayor disfunción del injerto evidenciado, por que no se encontraron diferencias en el valor de creatinina al tercer día postoperatorio. Al final de la cirugía la diferencia de potasio no fue significativa, aunque cuando se hizo por efectos fijos se encuentra menor valor en el LR (fig. 4). Al analizar más en detalle esta variable observamos que aunque existe una importante heterogeneidad en el resultado, esta se reduce cuando se retira el estudio de Khajavi et al.3, y esto pudiera estar explicado por la diferencia en el tiempo de isquemia renal, que fue mayor en el grupo de SSN. La presencia de hiperpotasemia en el grupo de SSN se explicaría principalmente porque el potasio actúa como tampón ante la presencia de acidosis y, como se mencionó con anterioridad, la administración de grandes volúmenes de SSN genera acidosis metabólica hiperclorémica4,8,42-45.
El metaanálisis confirma que la SSN genera acidosis metabólica, posiblemente por hipercloremia, como se demuestra en las figuras 6-8. Los pacientes que recibieron SSN tuvieron menores valores de pH y valores más bajos de bicarbonato sérico, con datos que no tuvieron heterogeneidad entre los estudios. El cloro sérico fue mayor en el grupo de SSN, al compararlos con los pacientes que recibían LR, aunque existe heterogeneidad significativa en esta variable en particular. Es importante mencionar que otros aniones como sulfatos, fosfatos, entre otros, se pueden acumular en pacientes con enfermedad renal crónica. Sin embargo, los cristaloides no afectan su concentración, y sería el cloro el principal determinante en el desarrollo de acidosis metabólica52.A la fecha, varios estudios muestran que la hipercloremia per se puede ser causa de evolución desfavorable en la función renal44,45,52-54. El éxito de la prevención de las complicaciones en el perioperatorio incluye la identificación y optimización de los pacientes, teniendo un plan anestésico que integre las diferentes variables que afectan el curso del trasplante renal55. Es de destacar que cuando se analiza la cantidad de solución infundida en los 3 estudios analizados no se encuentra diferencia significativa entre los 2 grupos; esto se debe considerar, dado que clásicamente la acidosis metabólica hiperclorémica se ha asociado con la infusión de grandes volúmenes. Sin embargo, se requieren más estudios con la inclusión de un número mayor de pacientes con un seguimiento a largo plazo para conocer mejor las implicaciones clínicas que se tienen con la acidosis metabólica hiperclorémica.
El resultado clínico importante, creatinina al tercer día, no mostró diferencias entre los 2 grupos, lo que demuestra que la administración de LR es segura para el paciente que recibe un trasplante renal. La heterogeneidad entre los estudios en esta variable es baja, lo que fortalece el resultado. No se describieron en ninguno de los estudios los eventos adversos con la terapia con LR, por lo cual no se pueden dar conclusiones sobre el tema.
Este metaanálisis tiene varias limitaciones, dentro de las que destaca el número bajo de estudios incluidos con un número pequeño de pacientes, además con diferencias en los tiempos de seguimiento y en las variables evaluadas. Los tiempos de observación y seguimiento posterior al trasplante renal variaron entre los diferentes estudios, pero se tomaron los resultados de las mediciones a intervalos similares para hacerlos comparables. En el desenlace que valora la función renal por medio de la creatinina al tercer día postoperatorio, solo 3 estudios la reportaron. Esto limita la interpretación de esta variable, puesto que el número de pacientes se ve reducido. La heterogeneidad en algunas de las variables fue importante; sin embargo, la ausencia de heterogeneidad en este tipo de estudio es imposible, considerando las diferencias de las poblaciones evaluadas, sus protocolos de tratamiento y la duración de los mismos. No se incluyó el estudio de Nuraei et al.13, el cual está en idioma persa y no se obtuvo respuesta por parte de los autores a pesar de que se les contactó en varias oportunidades. Los criterios de exclusión fueron estrictos en los estudios y pueden quedar por fuera los pacientes con complicaciones cardiovasculares, lo cual impide dar una conclusión certera en este subgrupo de enfermos.
A pesar de lo anterior, este trabajo puede ser la mejor evidencia disponible para enfocar el problema de la búsqueda de la mejor estrategia de fluidoterapia para los pacientes llevados a trasplante renal.
Conclusión
El uso de LR en el perioperatorio de trasplante renal genera niveles similares de potasio en el postoperatorio, mayores valores de pH y bicarbonato y menor nivel de cloro, sin generar cambios significativos en la creatinina del tercer día postoperatorio, a pesar de usar similar volumen infundido cuando se compara con la SSN.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Referencias
1. O'Malley CM, Frumento RJ, Bennett-Guerrero E. Intravenous fluid therapy in renal transplant recipients: results of a US survey. Transplant Proc. 2002;34:3142-5. [ Links ]
2. O'Malley CM, Frumento RJ, Hardy MA, Benvenisty AI, Brentjens TE, Mercer JS, et al. A randomized, double-blind comparison of Lactated Ringer's solution and 0.9% NaCl during renal transplantation. Anesth Analg. 2005;100:1518-24. [ Links ]
3. Khajavi MR, Etezadi F, Moharari RS, Imani F, Meysamie AP, Khashayar P, et al. Effects of normal saline vs. Lactated Ringer's during renal transplantation. Ren Fail. 2008;30:535-9. [ Links ]
4. Scheingraber S, Rehm M, Sehmisch C, Finsterer U. Rapid saline infusion produces hyperchloremic acidosis in patients undergoing gynecologic surgery. Anesthesiology. 1999;90:1265-70. [ Links ]
5. Prough DS, Bidani A. Hyperchloremic metabolic acidosis is a predictable consequence of intraoperative infusion of 0.9% saline. Anesthesiology. 1999;90:1247-9. [ Links ]
6. Yunos NM, Bellomo R, Story D, Kellum J. Bench-to-bedside review: chloride in critical illness. Crit Care. 2010;14:226. [ Links ]
7. Kaufman D, Kitching AJ, Kellum JA. Acid-base balance. In: Principles of critical care. 3rd edition New York: Gregory & Hall, McGraw-Hill; 2005. p. 1201-8. [ Links ]
8. Williams EL, Hildebrand KL, McCormick SA, Bedel MJ. The effect of intravenous Lactated Ringer's solution versus 0.9% sodium chloride solution on serum osmolality in human volunteers. Anesth Analg. 1999;88:999-1003. [ Links ]
9. Meier-Kriesche HU, Port FK, Ojo AO, Rudich SM, Hanson JA, Cibrik DM, et al. Effect of waiting time on renal transplant outcome. Kidney Int. 2000;58:1311-7. [ Links ]
10. Lemmens HJ. Kidney transplantation: recent developments and recommendations for anesthetic management. Anesthesiol Clin North Am. 2004;22:651-62. [ Links ]
11. Hadimioglu N, Saadawy I, Saglam T, Ertug Z, Dinckan A. The effect of different crystalloid solutions on acid-base balance and early kidney function after kidney transplantation. Anesth Analg. 2008;107:264-9. [ Links ]
12. Modi MP, Vora KS, Parikh GP, Shah VR. A comparative study of impact of infusion of Ringer's Lactate solution versus normal saline on acid-base balance and serum electrolytes during live related renal transplantation. Saudi J Kidney Dis Transpl. 2012;23:135-7. [ Links ]
13. Nuraei N, Khajenouri R, Soleimani M, Dabbagh A. The effects of intraoperative normal saline versus Lactated Ringer solution on clinical outcomes and laboratory findings in renal transplant patients. Tehran Univ Med J. 2010;68:872-7. [ Links ]
14. Higgins J, Green S. Cochrane handbook for systematic reviews of interventions 5.1.0. The Cochrane collaboration 2011. Available from: http://handbook.cochrane.org/ [Citado 06.02.14] [ Links ].
15. Wolfe RA, Ashby VB, Milford EL, Ojo AO, Ettenger RE, Agodoa LY, et al. Comparison of mortality in all patients on dialysis, patients on dialysis awaiting transplantation, and recipients of a first cadaveric transplant. N Engl J Med. 1999;341:1725-30. [ Links ]
16. Rabbat CG, Thorpe KE, Russell JD, Churchill DN. Comparison of mortality risk for dialysis patients and cadaveric first renal transplant recipients in Ontario, Canada. J Am Soc Nephrol. 2000;11:917-22. [ Links ]
17. Ojo AO, Hanson JA, Meier-Kriesche H, Okechukwu CN, Wolfe RA, Leichtman AB, et al. Survival in recipients of marginal cadaveric donor kidneys compared with other recipients and wait-listed transplant candidates. J Am Soc Nephrol. 2001;12:589-97. [ Links ]
18. Brunkhorst R, Lufft V, Dannenberg B, Kliem V, Tusch G, Pichlmayr R. Improved survival in patients with type 1 diabetes mellitus after renal transplantation compared with hemodialysis: a case-control study. Transplantation. 2003;76:115-9. [ Links ]
19. U.S. Renal Data System. USRDS 2013 annual data report: Atlas of chronic kidney disease and end-stage renal disease in the United States, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD; 2013. Available from: http://www.usrds.org/adr.aspx [Citado 06.02.14] [ Links ].
20. Locatelli F, Bommer J, London GM, Martín-Malo A, Wanner C, Yaqoob M, et al. Cardiovascular disease determinants in chronic renal failure: clinical approach and treatment. Nephrol Dial Transplant. 2001;16:459-68. [ Links ]
21. Arici M, Walls J. End-stage renal disease, atherosclerosis, and cardiovascular mortality: is C-reactive protein the missing link? Kidney Int. 2001;59:407-14. [ Links ]
22. Lagrand WK, Visser CA, Hermens WT, Niessen HW, Verheugt FW, Wolbink GJ, et al. C-reactive protein as a cardiovascular risk factor: more than an epiphenomenon? Circulation. 1999;100:96-102. [ Links ]
23. Yigla M, Nakhoul F, Sabag A, Tov N, Gorevich B, Abassi Z, et al. Pulmonary hypertension in patients with end-stage renal disease. Chest. 2003;123:1577-82. [ Links ]
24. Rivera D, Tejada JH, Medina A, Martinez E, Nieto N. Anesthesia complications in renal transplantation. Rev Colomb Anestesiol. 2011;39:30-7. [ Links ]
25. Social MdP. Informe de pacientes trasplantados por departamento y EPS en Colombia; 2008-2010. Available from: http://www.cuentadealtocosto.org/byblos/Docs/Informe_de-trasplante_renal_enXolombia_segun_Departamento_2011.pdf [Citado 06 02 14] [ Links ].
26. Cubillos J, Sandoval CL, Andrade E, Hermida NH. Causas que contribuyen a la pérdida del trasplante renal de donante cadaverico en la fundación Surcolombiana de Trasplantes. Febrero 2007 a noviembre 2012, Neiva, Colombia. Rev Colomb Anestesiol. 2014;42:83-9. [ Links ]
27. Hirata ES, Baghin MF, Pereira RI, Alves Filho G, Udelsmann A. Influence of the anesthetic technique on the hemodynamic changes in renal transplantation: a retrospective study. Rev Bras Anestesiol. 2009;59:166-76. [ Links ]
28. Bhosale G, Shah V. Combined spinal-epidural anesthesia for renal transplantation. Transplant Proc. 2008;40:1122-1. [ Links ]
29. Humar A, Kerr SR, Ramcharan T, Gillingham KJ, Matas AJ. Peri-operative cardiac morbidity in kidney transplant recipients: incidence and risk factors. Clin Transplant. 2001;15:154-8. [ Links ]
30. Flechner SM. Current status of renal transplantation patient selection, results, and immunosuppression. Urol Clin North Am. 1994;21:265-82. [ Links ]
31. Luciani J, Frantz P, Thibault P, Ghesquièrre F, Conseiller C, Cousin MT, et al. Early anuria prevention in human kidney transplantation Advantage of fluid load under pulmonary arterial pressure monitoring during surgical period. Transplantation. 1979;28:308-12. [ Links ]
32. Carlier M, Squifflet JP, Pirson Y, Gribomont B, Alexandre GP. Maximal hydration during anesthesia increases pulmonary arterial pressures and improves early function of human renal transplants. Transplantation. 1982;34:201-4. [ Links ]
33. Thomsen HS, L0kkegaard H, Munck O. Influence of normal central venous pressure on onset of function in renal allografts. Scand J Urol Nephrol. 1987;21:143-5. [ Links ]
34. Dawidson IJ, Ar'Rajab A. Perioperative fluid and drug therapy during cadaver kidney transplantation. Clin Transpl. 1992:267-84. [ Links ]
35. Niemann CU, Eilers H. Abdominal organ transplantation. Minerva Anestesiol. 2010;76:266-75. [ Links ]
36. Marik PE, Baram M, Vahid B. Does central venous pressure predict fluid responsiveness? A systematic review of the literature and the tale of seven mares. Chest. 2008;134: 172-8. [ Links ]
37. Ferris RL, Kittur DS, Wilasrusmee C, Shah G, Krause E, Ratner L. Early hemodynamic changes after renal transplantation: determinants of low central venous pressure in the recipients and correlation with acute renal dysfunction. Med Sci Monit. 2003;9:CR61-6. [ Links ]
38. De Wilde RB, Schreuder JJ, van den Berg PC, Jansen JR. An evaluation of cardiac output by five arterial pulse contour techniques during cardiac surgery. Anaesthesia. 2007;62:760-8. [ Links ]
39. Feltracco P, Ori C. Anesthetic management of living transplantation. Minerva Anestesiol. 2010;76:525-33. [ Links ]
40. Brandstrup B. Fluid therapy for the surgical patient. Best Pract Res Clin Anaesthesiol. 2006;20:265-83. [ Links ]
41. McFarlane C, Lee A. A comparison of Plasmalyte 148 and 0.9% saline for intra-operative fluid replacement. Anaesthesia. 1994;49:779-81. [ Links ]
42. Waters JH, Gottlieb A, Schoenwald P, Popovich MJ, Sprung J, Nelson DR. Normal saline versus Lactated Ringer's solution for intraoperative fluid management in patients undergoing abdominal aortic aneurysm repair: an outcome study. Anesth Analg. 2001;93:817-22. [ Links ]
43. Gan TJ, Bennett-Guerrero E, Phillips-Bute B, Wakeling H, Moskowitz DM, Olufolabi Y, et al. Hextend, a physiologically balanced plasma expander for large volume use in major surgery: a randomized phase III clinical trial. Hextend Study Group. Anesth Analg. 1999;88:992-8. [ Links ]
44. Wilcox CS. Regulation of renal blood flow by plasma chloride. J Clin Invest. 1983;71:726-35. [ Links ]
45. Ricaurte L, Vargas J, Lozano E, Diaz L, Organ Transplant Group. Anesthesia and kidney transplantation. Transplant Proc. 2013;45:1386-91. [ Links ]
46. Schmid S, Jungwirth B. Anaesthesia for renal transplant surgery: an update. Eur J Anaesthesiol. 2012;29: 552-8. [ Links ]
47. Dawidson I, Peters P, Sagalowsky A, Abshier D, Coorpender L. 51. The effect of intraoperative fluid management on the incidence of acute tubular necrosis. Transplant Proc. 1987;19:2056-7. 52. [ Links ]
48. Willms CD, Dawidson IJ, Dickerman R, Drake D, Sandor ZF, Trevino G. Intraoperative blood volume expansion induces primary function after renal transplantation: a study of 96 paired cadaver kidneys. Transplant Proc. 1991;23:1338-9. 53. [ Links ]
49. Bunn F, Alderson P, Hawkins V. Colloid solutions for fluid resuscitation. Cochrane Database Syst Rev. 2003;1:CD001319. Review. Update in: Cochrane Database Syst Rev. 2008;1:CD001319. [ Links ]
50. Laxenaire MC, Charpentier C, Feldman L. Anaphylactoid 54. reactions to colloid plasma substitutes: incidence, risk factors, mechanisms. A French multicenter prospective study. Ann Fr Anesth Reanim. 1994;13:301-10. [ Links ]
51. Wilcox CS, Peart WS. Release of renin and angiotensin II into plasma and lymph during hyperchloremia. Am J Physiol. 1987;253:F734-41. [ Links ]
52. Etezadi F, Pourfakhr P, Mojtahedzade M, Najafi A, Moharari RS, Yarandi KK, et al. Effects of tight versus non tight control of metabolic acidosis on early renal function after kidney transplantation. Daru. 2012;20:36. [ Links ]
53. McCluskey SA, Karkouti K, Wijeysundera D, Minkovich L, Tait G, Beattie WS. Hyperchloremia after noncardiac surgery is independently associated with increased morbidity and mortality: a propensity-matched cohort study. Anesth Analg. 2013;117:412-21. [ Links ]
54. González VH, Vargas GJ, Echeverri JE, Díaz SM, Mena Y. Valoración preanestésica en el paciente con enfermedad renal crónica (énfasis en riesgo cardiovascular). Rev Colomb Anestesiol. 2013;41:139-45. [ Links ]











 text in
text in