Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 no.2 Bogotá Apr./June 2014
https://doi.org/10.7705/biomedica.v34i2.2078
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i2.2078
1 Instituto de Investigaciones Biomédicas "Dr. Francisco J. Triana-Alonso", Universidad de Carabobo, sede Aragua, Maracay, Venezuela
2 Departamento Clínico Integral, Facultad de Ciencias de la Salud, Universidad de Carabobo, sede Aragua, Maracay, Venezuela
3 Centro de Investigaciones en Enfermedades Tropicales, Facultad de Ciencias de la Salud, Universidad de Carabobo, San Carlos, Venezuela
4 Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Universidad Central de Venezuela, Caracas, Venezuela
5 Departamento de Parasitología, Facultad de Ciencias de la Salud, Universidad de Carabobo, sede Aragua, Maracay, Venezuela
Contribución de los autores:
Yenny Alviarez: responsable de los experimentos, del análisis de los resultados y de la escritura del artículo
María Lares: responsable del cultivo, recolección, conteo, fijación y conservación de parásitos epimastigotes de T. cruzi
Mercedes Viettri: realización de la prueba de HAI con las muestras de los sueros de control
Cruz Manuel Aguilar y Leidi Herrera: responsables de los proyectos que financiaron la presente investigación y de la toma de muestras de los sueros de control
Elizabeth Ferrer: participación en la formulación y dirección del trabajo, y en la corrección del manuscrito
Recibido: 23/08/13; aceptado: 13/03/14
Introducción. La enfermedad de Chagas es causada por el parásito Trypanosoma cruzi y su diagnóstico inmunológico se basa principalmente en la detección de anticuerpos contra T. cruzi mediante pruebas tales como ELISA, inmunofluorescencia indirecta (IFI) y hemaglutinación indirecta (HAI). Esta última tiene el inconveniente de requerir la preparación de eritrocitos de carnero, difíciles de obtener y de poca duración. Sin embargo, existen pruebas alternativas, como la técnica de aglutinación directa.
Objetivo. Estandarizar la técnica de aglutinación directa para el diagnóstico de la enfermedad de Chagas.
Materiales y métodos. Se prepararon parásitos epimastigotes de T. cruzi mediante dos protocolos, con tratamiento con tripsina y sin él. Los parásitos se colorearon, y se determinaron las condiciones óptimas de concentración parasitaria y diluciones de suero. Se utilizaron sueros de pacientes con enfermedad de Chagas, de individuos sanos y con otras parasitosis.
Resultados. La concentración parasitaria óptima fue de 500 x10 6 parásitos/ml, utilizando parásitos coloreados y sin tratamiento con tripsina. Las diluciones de suero óptimas fueron de 1/25, 1/50 y1/100, y el punto de corte, la dilución de 1/50. La técnica estandarizada mostró índices diagnósticos de sensibilidad de 94,3 % (IC 95% 79,5-99,0) y de especificidad de 96,3 % (IC 95% 88,8-99,0); se encontró reacción cruzada en tres sueros de individuos con leishmaniasis visceral, con valores pronósticos positivo y negativo de 91,7 % (IC 95% 76,4-97,8) y de 97,5 % (IC 95% 90,4-99,6), respectivamente. Se compararon los resultados con los obtenidos por HAI, ELISA e IFI y la concordancia fue de 96 % con un índice kappa de 0,90 (IC 95% 0,81-0,99).
Conclusión. La técnica de aglutinación directa estandarizada podría ser útil para el inmunodiagnóstico de la enfermedad de Chagas.
Palabras clave: enfermedad de Chagas, Trypanosoma cruzi , pruebas inmunológicas, parásitos, anticuerpos.
doi: http://dx.doi.org/10.7705/biomedica.v34i2.2078
Standardization of a direct agglutination test for the immunodiagnosis of Chagas disease
Introduction: Chagas´ disease is caused by the parasite Trypanosoma cruzi and its immunological diagnosis is mainly based on the detection of antibodies against T. cruzi using tests such as the ELISA, the indirect fluorescence antibody test (IFAT) and the indirect hemagglutination test (IHAT). The main disadvantage of the IHAT is the need to prepare sheep erythrocytes, whose availability is limited and they have a short duration once prepared. However, there are alternative tests, such as the direct agglutination test (DAT).
Objective: To standardize the direct agglutination test for the diagnosis of Chagas disease.
Materials and methods: Trypanosoma cruzi epimastigotes were prepared using two protocols, with and without trypsin treatment. The parasites were stained and optimal conditions for parasitic concentration and serum dilutions were determined. We evaluated the technique using sera from patients with Chagas disease, from healthy individuals and from individuals with other parasitic diseases.
Results: The optimal parasitic concentration was 500 x 10 6 parasites/ml using stained parasites without trypsin treatment. The optimal serum dilutions were 1/25, 1/50 y 1/100 and the cut-off point was the 1/50 dilution. The diagnostic indices for the standardized technique were as follows: Sensitivity, 94.3% (95% CI: 79.5-99.0) and specificity, 96.3% (95% CI: 88.8-99.0), with positive and negative predictive values ?? of 91.7% (95% CI: 76.4-97.8) and 97.5% (95% CI: 90.4-99.6), respectively. Cross-reaction was observed only in three sera from individuals with visceral leishmaniasis. The results were compared with those obtained by IHA, ELISA, and IFA, and the concordance rate was 96% and the kappa index, 0.90 (95% CI: 0.81-0.99).
Conclusion: The standardized direct agglutination test could be useful for immunodiagnosis of Chagas disease.
Key words: Chagas disease, Trypanosoma cruzi, immunologic tests, parasites, antibodies.
doi: http://dx.doi.org/10.7705/biomedica.v34i2.2078
La enfermedad de Chagas es causada por el parásito protozoario Trypanosoma cruzi y transmitida por insectos hematófagos de la subfamilia Triatominae (triatominos). En el ser humano, la infección también puede transmitirse por otras vías tales como la transplacentaria, la transfusión sanguínea, los trasplantes de órganos y, con menor frecuencia, la vía oral (1).
La enfermedad se clasifica en aguda (sintomática y asintomática) y crónica (con enfermedad demos trada y sin ella) (2). De los individuos infectados, aproximadamente, entre 20 y 30 % desarrolla daños cardíacos irreversibles o megavísceras digestivas (megaesófago y megacolon), por lo que es un problema de salud pública que tiene impacto social y económico (3).
La patogénesis de la enfermedad chagásica crónica no está completamente esclarecida (4), aunque se han postulado como posibles mecanismos el daño progresivo por la persistencia del parásito (5-7) y las anomalías específicas producidas por la respuesta inmunitaria del huésped (8).
Esta enfermedad es reconocida por la Organización Mundial de la Salud (OMS) como una de las trece enfermedades tropicales desatendidas (9) con amplia distribución en América Latina, aunque en las últimas décadas se han reportado con mayor frecuencia casos en los Estados Unidos y Canadá, así como en algunos países europeos y del Pacífico occidental, lo que obedece sobre todo a la movilidad de la población. A nivel mundial, se calcula que, aproximadamente, 10 millones de personas están infectadas, principalmente en América Latina, y más de 25 millones están en riesgo de adquirir la enfermedad (10).
En una época, los esfuerzos para controlar la enfermedad de Chagas fueron exitosos en varios países, Venezuela, entre ellos (11). Sin embargo, su control no se alcanzó por completo y actualmente deben enfrentarse nuevos retos, ya que del 2008 al 2011 se reportaron prevalencias que fluctuaban entre 7,2 y 16,3 %, con una prevalencia de 8,3 % en niños menores de 10 años de edad, lo que sugiere la reaparición de la enfermedad y de la transmisión activa (12-14). Cabe resaltar que durante los últimos años se han presentado brotes epidémicos de la enfermedad de Chagas por transmisión oral en zonas urbanas del país, tales como los ocurridos en el municipio de Chacao del Distrito Capital y de Chichiriviche de la Costa en el estado Vargas, donde se detectaron casos de miocarditis y varias muertes (15-17).
El diagnóstico de la enfermedad de Chagas en la fase crónica se basa en la detección de anticuerpos específicos contra T. cruzi , el cual se hace mediante pruebas inmunológicas, dado que en esta etapa la parasitemia es baja y se produce la activación policlonal de linfocitos T y B con altos niveles de anticuerpos anti- T. cruzi (18,19). Es imprescindible la debida confirmación de los resultados de estas pruebas para evitar un diagnóstico errado, ya que el diagnóstico inmunológico puede presentar reacciones cruzadas, principalmente con infecciones por Leishmania spp. y T. rangeli (20,21). Eventualmente, también pueden observarse algunas reacciones cruzadas con infecciones por Plasmodium spp. y Toxoplasma gondii . La reacción cruzada se debe a la presencia de epítopos semejantes a los de T. cruzi , lo que posibilita que los anticuerpos presentes en pacientes que padecen estas infecciones reaccionen con los antígenos no purificados del parásito (22,23). Además, la mayoría de las zonas de la enfermedad de Chagas también son endémicas para leishmaniasis y rangeliosis, lo que complica aún más el diagnóstico (21,24). Es por esto que, para considerar a un paciente como infectado con T. cruzi, la OMS recomienda el uso de tres técnicas inmunológicas basadas en diferentes principios, de las cuales al menos dos deben ser positivas (25). En la actualidad, existen tres pruebas convencionales muy usadas: la hemaglutinación indirecta (HAI), la inmunofluorescencia indirecta (IFI) y la prueba ELISA indirecta, las cuales ofrecen gran sensibilidad y especificidad (26).
Sin embargo, estas técnicas presentan algunas limitaciones, entre las que se destacan la necesidad de tener microscopio de fluorescencia para la IFI, un costoso equipo de lectura automatizado para el ELISA, y para la HAI, el uso de eritrocitos de carnero, cuya obtención, transporte y conservación son complicados (3).
Una prueba inmunológica alternativa para el diagnóstico de la enfermedad de Chagas es la técnica de aglutinación directa, que es sencilla, económica y no requiere de equipos ni de materiales especializados. Además, se ha observado buena sensibilidad y especificidad cuando se utiliza conjuntamente con otras técnicas inmunológicas y parasitológicas (27-29), y, dado que esta reacción detecta anticuerpos dirigidos contra antígenos de superficie del protozoo, brinda resultados positivos más precozmente que otras técnicas inmunológicas que identifican anticuerpos contra antígenos citoplásmicos (29). Debido a las amplias ventajas reportadas con el uso de esta técnica y al hecho de no ser invasiva, se ha empleado para el diagnóstico de la enfermedad de Chagas, la leishmaniasis visceral y el "mal de cadera" de equinos causado por T. evansi (28-31).
En el presente estudio nos propusimos estandarizar la técnica de aglutinación directa para la detección de anticuerpos anti- T. cruzi . Se evaluaron dos protocolos (28,32), los cuales se modificaron con el propósito de hacerlos más sencillos. Se compa-raron los protocolos evaluados con los resultados obtenidos mediante las pruebas de referencia HAI, ELISA e IFI, midiendo la concordancia y la determinación de los índices diagnósticos.
Materiales y métodos
Muestras biológicas
Se hizo un estudio seudorretrospectivo de acuerdo con lo reportado por Orozco y Camargo en 1997 (33), empleando muestras de control tanto positivas como negativas para la enfermedad de Chagas. Las muestras de suero se seleccionaron de manera intencional, tomando en cuenta los resultados de las pruebas de inmunodiagnóstico practicadas previamente con ELISA, HAI e IFI.
Se estudiaron 35 sueros de individuos con enfermedad de Chagas provenientes de zonas endémicas con resultados positivos en las tres técnicas de inmunodiagnóstico antes mencionadas (controles positivos). Se analizaron 35 sueros de individuos sanos con resultados negativos en las técnicas inmunológicas y que no presentaban síntomas ni historia de contacto con la enfermedad (controles negativos). Además, se evaluaron 46 sueros de individuos con otras parasitosis, así: nueve con leishmaniasis visceral, 22 con toxoplasmosis, cuatro con cisticercosis, tres con himenolepiasis, dos con esquistosomiasis, y uno con cada una de las que siguen: toxocariasis, hidatidosis, oncocercosis, larva migrans cutánea, criptosporidiosis y rangeliosis, diagnosticadas por técnicas inmunológicas y parasitológicas (controles heterólogos). La mayoría de las muestras de suero provenía del banco de sueros de la Sección de Parasitología Molecular del Instituto de Investigaciones Biomédicas "Dr. Francisco J. Triana- Alonso"-(BIOMED) y las demás, del Departamento de Parasitología de la Facultad de Ciencias de la Salud, sede Carabobo, Universidad de Carabobo, y del Laboratorio Clínico Flor-Lab. Es importante resaltar que las muestras utilizadas en este estudio provenían de individuos que habían formado parte de otros estudios aprobados por el comité de bioética del BIOMED y que, mediante la firma del consentimiento informado, indicaron que los remanentes de sus muestras podrían utilizarse en otros estudios de investigación, siempre y cuando no fuera revelada su identidad.
Cultivo, preparación y concentración óptima de Trypanosoma cruzi
Los epimastigotes de T. cruzi Dm28c DTU TcI (34,35) conservados a -80 °C se cultivaron bajo condiciones de esterilidad en medio LIT con suplemento de suero bovino fetal al 10 % y antibiótico (gentamicina, 80 mg/L). Estos cultivos se hicieron en matraces volumétricos con tapa de 100, 250 y 1.000 ml a 27 °C hasta llegar a la fase logarítmica de crecimiento en un período de siete días.
La preparación de los epimastigotes de T. cruzi se hizo de acuerdo con la técnica de De los Ríos, et al. (28), con modificaciones. Para ello, se ensayaron los siguientes dos protocolos.
Tratamiento enzimático con tripsina. Al recolectar los parásitos en tubos de centrifugación de 15 ml, se ajustó la concentración utilizando 50 x 10 6 , 100 x 10 6 , 250 x 10 6 y 500 x 10 6 parásitos/ml; luego se transvasaron a viales de 1,5 ml, y se lavaron tres veces con solución tampón de fosfato salino (PBS) 0,15 M (pH 7,2) mediante centrifugación a 13.000 rpm (microcentrífuga, Spectrafuge 16M) durante cinco minutos. Seguidamente, se hizo un tratamiento enzimático de los epimastigotes de T. cruzi . Para ello, se le agregó a un volumen del paquete de parásitos 20 veces el volumen de solución de tripsina al 0,4 % en PBS 0,15 M (pH 7,7) y se incubó durante 45 minutos a 37 °C. Al cumplirse el tiempo de incubación, se lavaron los parásitos cinco veces con PBS 0,15M (pH 7,2) mediante centrifugación a 13.000 rpm durante cinco minutos. Por último, los parásitos tratados se fijaron con solución de formaldehído al 2 % en PBS 0,15 M (pH 7,2) durante un tiempo mínimo de 20 horas a 4 °C.
Sin tratamiento enzimático. Se ajustaron las concentraciones de parásitos al igual que en el protocolo anterior (tratamiento enzimático con tripsina), luego se transvasaron a viales de 1,5 ml y se lavaron del mismo modo ya descrito en el primer protocolo. Finalmente, se fijaron con solución de formaldehído al 2 % en PBS 0,15 M (pH 7,2) durante un tiempo mínimo de 20 horas a 4 °C.
Coloración y estabilidad de los epimastigotes de Trypanosoma cruzi
Después de aplicar cada protocolo, los parásitos se lavaron tres veces con PBS 0,15 M (pH 7,2) para luego ser separados en dos porciones, una de ellas se suspendió de nuevo directamente en formaldehído al 2 % en PBS 0,15 M (pH 7,2) y se mantuvo a 4 °C hasta su uso, y la otra se coloreó con una solución fría de citrato de sodio al 1 % (34 mM) más azul brillante de Comassie al 0,02 % disuelta en PBS 0,15 M (pH 7,2) durante 120 minutos. Finalmente, se descartó el colorante mediante centrifugación a 13.000 rpm durante cinco minutos, se suspendió de nuevo el paquete de parásitos en solución de formaldehído al 2 % en PBS 0,15 M (pH 7,2) y se mantuvo en dicha solución a 4 °C. Para determinar la estabilidad de los epimastigotes de T. cruzi fijados en formaldehído al 2 % en PBS 0,15 M (pH 7,2) y conservados a 4 °C, se usaron quincenalmente estas preparaciones parasitarias en la técnica de aglutinación directa durante un periodo de tres meses.
Diluciones óptimas de suero y punto de corte
La técnica de aglutinación directa se hizo de acuerdo con lo reportado por Vattuone y Yanovsky (27), y De los Ríos, et al. (28). Las muestras de suero se diluyeron en PBS 0,15 M (pH 7,2) y se colocaron en placas de 96 pozos con fondo en "U", y se hicieron diluciones seriadas (1/25, 1/50,1/100) para cada muestra (100 µ l/pozo), al igual que en la prueba de HAI reportada por Briceño, et al. (36). A las muestras de suero se les adicionaron las diferentes concentraciones de parásitos coloreados, mantenidos en solución de formaldehído al 2 % en PBS 0,15M (pH 7,2) en un volumen de 100 µ l/pozo. Luego se incubaron durante 18 a 24 horas a temperatura ambiente para, posteriormente, hacer la lectura visualmente. El título de anticuerpos se estableció como la dilución del último pozo donde se detectó aglutinación. El punto de corte correspondió al título de anticuerpos que permite discriminar sueros positivos de negativos, según las especificaciones de la OMS (25).
Índices diagnósticos y prueba de concordancia
Con los resultados de 35 sueros de control positivos, los 78 sueros de control negativos y los 46 sueros de individuos con otras parasitosis, se determinaron los índices diagnósticos (37,38) de sensibilidad, especificidad, valor pronóstico positivo (VPP), valor pronóstico (VPN) e índice kappa con respecto a los resultados de las tres técnicas de inmunodiagnóstico (ELISA, HAI e IFI) e intervalos de confianza de 95 % calculados mediante un software simple (cálculos Excel) (39,40).
Resultados
Estandarización de la concentración de parásitos
Se emplearon diferentes concentraciones de pará-sitos T. cruzi (50 x 10 6 , 100 x 10 6 , 250 x 10 6 y 500 x 10 6 parásitos/ml). Las concentraciones parasitarias de 50, 100 y 250 x 10 6 parásitos/ml no permitieron discriminar entre sueros de control positivos y sueros de control negativos para la enfermedad de Chagas, ya que no se pudo observar aglutinación. Cuando se probó la más alta concentración de parásitos ensayada, correspondiente a 500 x 10 6 parásitos/ml, se obtuvo una adecuada aglutinación y se pudo discriminar entre 12 sueros de control positivos y los negativos con diluciones arbitrarias de 1/25 y 1/50 haciendo repeticiones entre ensayos, por lo cual se decidió usar esta última concentración para continuar con la estandarización de la técnica de aglutinación directa.
Tratamiento y coloración de los parásitos
Tratamiento con tripsina. Se demostró que los parásitos tratados y no tratados con tripsina se comportaron de manera idéntica, ya que en ambas preparaciones se observó adecuada discriminación entre los 12 sueros de control positivos y los negativos para enfermedad de Chagas con diluciones arbitrarias de 1/25 y 1/50 y haciendo repeticiones entre ensayos. Debido a este resultado, se decidió usar los parásitos no tratados enzimáticamente con tripsina.
Coloración de los parásitos. Al usar parásitos no coloreados fue difícil visualizar las formas de aglutinación y, por lo tanto, discriminar entre los sueros de control positivos y los negativos para enfermedad de Chagas. El uso de los parásitos coloreados con solución de citrato de sodio al 1 % (34 mM) más azul brillante de Comassie al 0,02 % disueltos en PBS 0,15 M (pH 7,2) resultó en una mejor imagen, ya que el colorante permitió visualizar las formas de aglutinación y así discriminar mejor entre los 12 sueros de control positivos y los negativos con diluciones arbitrarias de 1/25 y 1/50.
Estabilidad de las preparaciones parasitarias
Las preparaciones parasitarias de los epimastigotes de T. cruzi sin tratamiento enzimático almacenados a 4 °C en solución de formaldehido al 2 % en PBS (pH 7,2) permanecieron estables durante tres meses, lo que pudo constatarse al utilizarlas en los diferentes ensayos con excelente aglutinación y discriminación entre controles positivos y negativos.
Diluciones de suero empleadas y punto de corte de la técnica de aglutinación directa
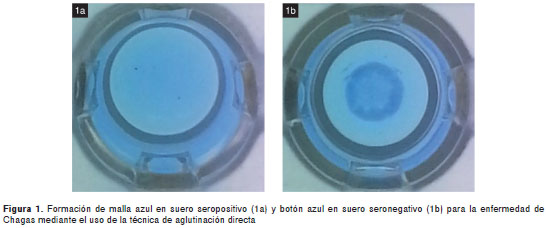
Las diluciones de suero empleadas en la técnica de aglutinación directa estandarizada fueron desde 1/25 hasta 1/100; dichas diluciones demostraron ser apropiadas, ya que su uso permitió discriminar entre 35 sueros positivos y 78 negativos para la enfermedad de Chagas. El punto de corte para determinar la sueros positivos se estableció a partir de la dilución 1/50. Se hizo una lectura visual de los resultados al cabo de un periodo de incubación de 18 horas, debido a que en el caso de los controles positivos se observó un manto azul en los pozos de la placa (figura 1a) y, en el caso de los controles negativos, un botón compacto azul (figura 1b).
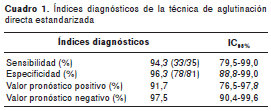
Índices diagnósticos de la técnica de aglutinación directa estandarizada
De acuerdo con los resultados obtenidos con la técnica de aglutinación directa estandarizada, se determinó que 33/35 sueros positivos y 78/81 sueros negativos coincidieron con los de las tres pruebas de inmunodiagnóstico convencionales (ELISA, HAI e IFI). Con este muestreo seudorretrospectivo, útil únicamente en la etapa de estandarización de pruebas diagnósticas (33), se obtuvieron índices diagnósticos con valores adecuados de sensibilidad, especificidad, VPP y VPN. Estos valores, con sus intervalos de confianza de 95 %, se presentan en el cuadro 1.
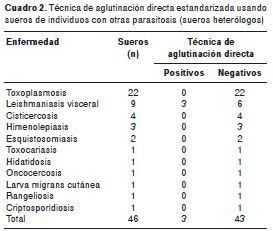
Los resultados obtenidos al ensayar la técnica de aglutinación directa con sueros positivos para otras enfermedades (sueros heterólogos), se presentan en el cuadro 2. De los 46 sueros de individuos con otras enfermedades parasitarias, solo tres, que correspondían a individuos con leishmaniasis visceral, resultaron positivos con la técnica de aglutinación directa.
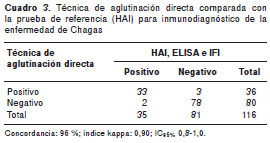
Concordancia de la técnica de aglutinación directa con respecto a las pruebas de referencia HAI, ELISA e IFI
La comparación de los resultados obtenidos en la técnica de aglutinación directa con respecto a las pruebas de referencia (HAI, ELISA e IFI) se presenta en el cuadro 3; la concordancia obtenida fue mayor de 90 % y el índice kappa determinó una fuerza de concordancia muy buena de acuerdo con los criterios establecidos (41) en un intervalo de confianza de 95 %. Por otro lado, la prueba estandarizada demostró su excelente reproducibilidad, pues en cada experimento se hicieron repeticiones.
Discusión
Se ha demostrado la importancia del uso de las pruebas inmunológicas para el diagnóstico de la enfermedad de Chagas, principalmente en la fase crónica, en la cual los métodos parasitológicos no son útiles debido a la baja parasitemia. Según los criterios de la OMS, dicho diagnóstico se confirma con la detección de anticuerpos anti- T. cruzi cuando, al menos, dos de las tres pruebas convencionales de inmunodiagnóstico dan resultado positivo. Las técnicas empleadas en inmunodiagnóstico deben estar debidamente estandarizadas y validadas, y tener alta sensibilidad y especificidad. Una de las tres técnicas más usadas para el diagnóstico de la enfermedad de Chagas es la HAI, la cual se basa en la aglutinación de los antígenos del parásito con los anticuerpos presentes en el suero del individuo con enfermedad de Chagas. Este es el mismo principio de la técnica de aglutinación directa; la diferencia entre ambas es que la HAI usa como soporte de los antígenos de T. cruzi los eritrocitos de carnero y, la técnica de aglutinación directa, el parásito como tal (25,27).
Debido a la posibilidad de incorporar la técnica de aglutinación directa como otra prueba diagnóstica para la enfermedad de Chagas, se decidió estandarizarla titulando sus diferentes componentes y adaptando sus condiciones a las del laboratorio.
Al hacerlo se obtuvo una concentración de parásitos óptima de 500 x 10 6 por ml, la cual fue similar a la de un estudio anterior en el que se usó una concentración de 600 x 10 6 parásitos por ml (27). Sin embargo, otros autores reportan el ajuste de la concentración de parásitos midiendo su absorbancia a 550 nm (32). En este estudio se prefirió hacer el conteo de los parásitos porque así se puede verificar su integridad y movilidad al momento de la recolección.
Es importante señalar que la técnica de aglutinación directa es una prueba útil y sencilla, aunque algunos autores señalan como problema el que se puede presentar un proceso de aglutinación espontánea de los parásitos, eventualidad que disminuye con el tratamiento con tripsina (27,28,42). No obstante, a diferencia de lo reportado previamente, en este estudio se demostró que si se hace un buen proceso de lavado de los parásitos con PBS 0,15 M (pH 7,2) se pueden eliminar completamente las sustancias del medio de cultivo y otras partículas que favorecen la mencionada aglutinación espon tánea. En consecuencia, además del ahorro de tiempo y costos, el protocolo utilizado en la estandarización de la técnica de aglutinación directa permitió simplificar la técnica.
Por otra parte, en el presente estudio se utilizaron formas parasitarias de T. cruzi sin colorear y coloreadas, con lo que se pudo demostrar que la principal desventaja del uso de parásitos sin teñir fue la dificultad en la visualización de las formas de aglutinación (mantos o botones), ya que eran opalescentes o blanquecinas, coincidiendo con lo observado en un estudio anterior (43). Este inconveniente se pudo mitigar coloreando los parásitos con una solución de azul brillante de Comassie, tal como se reportó en el estudio llevado a cabo por De los Ríos, et al. (28).
Se demostró, igualmente, la conservación y estabilidad de los parásitos al mantenerlos en formaldehído al 2 % durante un periodo de tres meses, coincidiendo también con un estudio del 2010 (28), lo cual representa una gran ventaja, pues ello significa que se pueden mantener durante meses en refrigeración, fijados y listos para su uso, a diferencia de los glóbulos rojos de carnero empleados en la HAI, que duran menos tiempo.
Por otra parte, en el proceso de estandarización de la técnica de aglutinación directa se pudo comprobar que las diluciones de suero empleadas fueron adecuadas (1/25, 1/50 y 1/100) para la discriminación entre sueros positivos y negativos en el diagnóstico de la enfermedad de Chagas, estableciéndose el punto de corte con un título de 1/50 (25). Estas diluciones y el punto de corte son iguales a los reportados por Briceño, et al. (35) para la técnica de HAI. Por otra parte, en el 2009, Romero (32) empleó la técnica de aglutinación directa para el diagnóstico de la enfermedad de Chagas y reportó diluciones de suero desde 1/2 hasta 1/4.096, con un punto de corte de 1/64, similar al obtenido en este estudio. En este sentido, en el presente estudio se ahorró un volumen considerable de suero partiendo de una dilución más alta, así como de un número mayor de pocillos en la placa de microtitulación y, en consecuencia, un mayor número de muestras por placa.
Es importante señalar que con las diluciones estandarizadas en este estudio, se podría discri minar entre sueros positivos y negativos para la enfermedad de Chagas, aunque si se quiere conocer el título de anticuerpos presentes en las muestras seropositivas, se recomienda hacer un mayor número de diluciones. De todas maneras, al no ensayar muchas diluciones con los sueros negativos, se ahorrarían reactivos.
En cuanto al tiempo de incubación para visualizar el resultado, se probaron diferentes lapsos, desde 18 hasta 24 horas, para, finalmente, determinar un resultado óptimo a las 18 horas, similar a lo reportado en el estudio del 2010 (28). Esto significa tener resultados en menor tiempo del establecido en otros estudios en los que los resultados se han visualizado a las 24 horas (32).
Es importante mencionar que, aunque se trata de un estudio preliminar de estandarización de la técnica, se observó una adecuada especificidad con el muestreo seudorretrospectivo (33). En este sentido cabe anotar que se obtuvieron unas pocas reacciones cruzadas con sueros de individuos con leishmaniasis visceral, lo cual ya ha sido descrito en otros estudios en los cuales se destaca que T. cruzi comparte antígenos con las diferentes especies de Leishmania spp. y T. rangeli , debido a que pertenecen a la misma familia, Trypanosomatidae (24,25,30,44). Sin embargo, el único suero con rangeliosis que se probó en este estudio no presentó reacción cruzada, que, como se sabe, hace que la especificidad de las pruebas de inmunodiagnóstico disminuya, ya que se incrementa el número de falsos positivos (45).
La sensibilidad de la prueba estandarizada fue de 94,3 % y la especificidad de 96,3 %, lo que representa índices diagnósticos adecuados, así como un VPP de 91,7 %) y un VPN de 97,5 %, muy cercanos a 100 %. Aunque se trata de un estudio preliminar, estos resultados son similares a los reportados en un estudio realizado por Peralta, et al. (46), quienes en una prueba de técnica de aglutinación directa para diagnóstico de la enfermedad de Chagas, obtuvieron una sensibilidad de 98,1 % y una especificidad de 99,4 %, semejantes a las reportadas en el estudio de estandarización de una técnica de aglutinación directa para inmunodiagnóstico de leishmanisis (28) en el que se obtuvo una sensibilidad de 100 % y una especificidad de 98,8%.
En este estudio, la técnica de aglutinación directa mostró una concordancia de 96 %, con un índice kappa de 0,90 con respecto a las pruebas de referencia (HAI, ELISA e IFI), observándose una elevada proporción de resultados coincidentes, semejante a lo observado en un estudio del 2002 (47) llevado a cabo para estandarizar una técnica de HAI, en el cual se obtuvo una concordancia de 99 %, con un índice kappa de 0,98 con respecto a las pruebas de los laboratorios de referencia.
En un estudio para valorar las pruebas de inmuno- diagnóstico de la enfermedad de Chagas, se hizo un análisis comparativo de la relación costo-beneficio entre las diferentes pruebas (ELISA, IFI, HAI y técnica de aglutinación directa) y se determinó que uno de los métodos con menores requisitos en equipos, personal e infraestructura era la técnica de aglutinación directa (30). Dadas estas ventajas, además de la simplificación de la técnica aquí estandarizada (30,48), puede sugerirse su validación utilizando, por ejemplo, un muestreo transversal en el que se tome una muestra representativa de una población para, de esta manera, controlar los sesgos (33). Puesto que tiene potencial para su uso como prueba de rutina, la técnica de aglutinación directa aquí estandarizada puede emplearse en áreas rurales y urbanas donde no se cuente con la infraestructura adecuada ni con los equipos requeridos, tales como el microscopio de fluorescencia o el lector de ELISA, o no se disponga o se tenga poco acceso a eritrocitos de carnero para ejecutar los protocolos de la mayoría de las técnicas empleadas en la tamización de la enfermedad de Chagas.
Agradecemos a Víctor Contreras y a Diana Graterol de BIOMOLP-UC por la cepa de los parásitos Dm28c; a la profesora Carolina Cannova, del Departamento de Parasitología, Universidad de Carabobo-Valencia, y a las licenciadas María Gabriela Rivera y Johanny Ruiz, del Laboratorio Clínico Flor-Lab, por donar algunas de las muestras de los sueros de control.
Los autores declaramos que no tenemos ningún conflicto de intereses.
Este trabajo fue financiado por el proyecto "Reservorios, vectores y participación ciudadana en las estrategias de prevención y control de la enfermedad de Chagas en áreas endémicas de Venezuela", Proyecto en Red Nº 2008000911-6, Misión Ciencia, Ministerio de Ciencia y Tecnología, FONACIT, y por el Proyecto "Evaluación y mejoramiento de viviendas rurales y suburbanas con participación comunitaria para el control y la prevención de la enfermedad de Chagas en Venezuela", Proyecto Estratégico MPPS, UCV-UC-UDO FONACIT Nº 2011000470.
Correspondencia: Yenny Alviarez, Instituto de Investigaciones Biomédicas "Dr. Francisco J. Triana-Alonso", Calle Cecilio Acosta, Urbanización La Rinconada, Las Delicias, Maracay, estado Aragua, Venezuela
Teléfono: (58-0243) 242 5822; fax: (58-0243) 242 5333 yenalvi@gmail.com
1. Feliciangeli D. Control de la enfermedad de Chagas en Venezuela. Logros pasados y retos presentes. Interciencia. 2009;34:393-9. [ Links ]
2. Mordini O, Núñez F, Beloscar J, Mitelman J, Giménez L, Auteri M, et al . Clasificación de la enfermedad de Chagas. Consenso Internacional Buenos Aires 2010. Argentina: Federación Argentina de Cardiología; 2010. Fecha de consulta: 3 de junio de 2012. Disponible en: http://www.fac.org.ar/1/revista/11v40n3/consenso/chagas/mordini.php. [ Links ]
3. Organización Mundial de la Salud. Reporte del grupo de trabajo cientifico sobre la enfermedad de Chagas. Buenos Aires: TDR; 2007. Fecha de consulta: 9 de abril de 2012. Disponible en: http://whqlibdoc.who.int/hq/2007/TDR_SWG_09_spa.pdf [ Links ]
4. Marin-Neto J, Cunha-Neto E, Maciel B, Simões M. Pathogenesis of chronic Chagas heart disease. Circulation. 2007;115:1109-23. http://dx.doi.org/10.1161/CIRCULATIONAHA.106.624296 [ Links ]
5. Ouaissi A, Da Silva A, Guevara A, Borges M, Guilvard E. Trypanosoma cruzi -induced host immune system dysfunction: A rationale for parasite immunosuppressive factor (s) encoding gene targeting. J Biomed Biotechnol. 2001;1:11-17. http://dx.doi.org/10.1155/S1110724301000055 [ Links ]
6. Jones E, Colley D, Tostes S, Lopes E, Vnencak-Jones C, McCurley T. Amplification of a Trypanosoma cruzi DNA sequence from inflammatory lesions in human chagasic cardiomyopathy. Am J Trop Med Hyg. 1993;48:348. [ Links ]
7. Schijman A, Vigliano C, Viotti R, Burgos J, Brandariz S, Lococo B, et al . Trypanosoma cruzi DNA in cardiac lesions of Argentinean patients with end-stage chronic Chagas heart disease. Am J Trop Med Hyg. 2004;70:210-20. [ Links ]
8. Andrade Z. Immunopathology of Chagas disease. Mem Inst Oswaldo Cruz . 1999;94:71-80. http://dx.doi.org/10.1590/S0074-02761999000700007 [ Links ]
9. Hotez P, Molyneux D, Fenwick A, Kumaresan J, Sachs S, Sachs J, et al . Control of neglected tropical diseases. N Engl J Med . 2007;357:1018-27. http://dx.doi.org/10.1056/NEJMra064142 [ Links ]
10. Organización Mundial de la Salud. La enfermedad de Chagas (tripanosomiasis americana). Nota descriptiva N° 340. 2012. Fecha de consulta: 1 de octubre de 2012. Disponible en: http://www.who.int/mediacentre/factsheets/fs340/es/index.html [ Links ]
11. Aché A, Matos A. Interrupting Chagas disease transmission in Venezuela. Rev Inst Med Trop Sao Paulo . 2001;43:37-43. http://dx.doi.org/10.1590/S0036-46652001000100008 [ Links ]
12. Rojas M, Várquez P, Villarreal M, Velandia C, Vergara L, Morán-Borges Y, et al . An entomological and seroepidemiological study of Chagas´ disease in an area in central-western Venezuela infested with Triatoma maculata (Erichson 1848). Cad Saúde Pública . 2008;24:2323-33. http://dx.doi.org/10.1590/S0102-311X2008001000013 [ Links ]
13. Bonfante-Cabarcas R, Rodríguez-Bonfante C, Vielma B, García D, Saldivia A, Aldana E, et al . Seroprevalencia de la infección por Trypanosoma cruzi y factores asociados en un área endémica de Venezuela. Cad Saúde Pública. 2011;27:1917-29. http://dx.doi.org/10.1590/S0102-311X2011001000005 [ Links ]
14. Añez N, Crisante G, Rojas A. Update on Chagas disease in Venezuela: A review. Mem Inst Oswaldo Cruz . 2004;99:781-7. http://dx.doi.org/10.1590/S0074-02762004000800001 [ Links ]
15. De Noya BA, Díaz-Bello Z, Colmenares C, Ruiz-Guevara R, Mauriello L, Zavala-Jaspe R, et al . Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela. J Infect Dis . 2010;201:1308-15. http://dx.doi.org/10.1086/651608 [ Links ]
16. Rísquez A. Mortalidad por enfermedad de Chagas: a propósito de los brotes de Chagas agudo como enfermedad reemergente de transmisión alimentaria. Gac Med Caracas. 2009;117:319-21. [ Links ]
17. Red de Sociedades Científicas Médicas de Venezuela . Enfermedad de Chagas a 100 años de su descripción y descubrimiento del Trypanosoma cruzi . Noticias epide-miologicas 2; 2009. Fecha de consulta: 12 de julio de 2012. Disponible en: http://www.rscmv.org.ve/pdf/noticias_epidemiologicas2.pdf [ Links ]
18. Añez N, Carrasco H, Parada H, Crisante G, Rojas A, González N, et al . Acute Chagas´ disease in western Venezuela: A clinical, seroparasitologic and epidemiologic study. Am J Trop Med Hyg.1999;60:215-22. [ Links ]
19. Brener Z, Gazzinelli R. Immnunological Control of Trypanosoma cruzi infection and pathogenesis of Chagas´ disease. Int Arch Allergy Immunol. 1997;114:103-10. http://dx.doi.org/10.1159/000237653 [ Links ]
20. Saldaña A, Sousa O. Trypanosoma rangeli and Trypanosoma cruzi : Cross-reaction among their immunogenic components. Mem Inst Oswaldo Cruz . 1996;91:81-2. http://dx.doi.org/10.1590/S0074-02761996000100013 [ Links ]
21. Vexenat AC, Santana JM, Teixeira ARL. Cross-reactivity of antibodies in human infections by the kinetoplastid protozoa Trypanosoma cruzi , Leishmania chagasi and Leishmania (Viannia) braziliensis . Rev Inst Med Trop Sao Paulo . 1996;38:177-85. http://dx.doi.org/10.1590/S0036-46651996000300003 [ Links ]
22. Suárez EL, De Freitas HA, Hannaoui EJ. Prevalencia de enfermedades infecciosas de transmisión sanguínea en donantes que asisten al Banco de Sangre del Hospital Universitario "Antonio Patricio de Alcalá", Cumaná, Estado Sucre. Kasmera. 2007;35:56-64. [ Links ]
23. Malan AK, Avelar E, Litwin SE, Hill HR, Litwin CM. Serological diagnosis of Trypanosoma cruzi : Evaluation of three enzyme immunoassays and an indirect immuno- fluorescent assay. J Med Microbiol. 2006;55:171-8. http://dx.doi.org/10.1099/jmm.0.46149-0 [ Links ]
24. Campos Y, Briceño L, Reina K, Figarella K, Pérez JL, Mosca W. Serological diagnosis of Chagas disease: Evaluation and characterisation of a low cost antigen with high sensitivity and specificity. Mem Inst Oswaldo Cruz . 2009;104:914-7. http://dx.doi.org/10.1590/S0074-02762009000600016 [ Links ]
25. Organización Mundial de la Salud. Control de la enfermedad de Chagas. Ginebra: Serie de informes técnicos Nº 811; 1991. Fecha de consulta: 10 de agosto de 2012. Disponible en: http://apps.who.int/iris/bitstream/10665/38610/1/924320811_spa.pdf. [ Links ]
26. Organización Mundial de la Salud. Control de la enfermedad de Chagas. Ginebra: Serie de Informes Tecnicos Nº 905; 2002. Fecha de consulta: 10 de agosto de 2012. Disponible en: http://whqlibdoc.who.int/trs/WHO_TRS_905_spa.pdf. [ Links ]
27. Vattuone NH, Yanovsky JF. Trypanosoma cruzi : Agglutination activity of enzyme-treated epimastigotes. Exp Parasitol. 1971;30:349-55. http://dx.doi.org/10.1016/0014-4894(71)90098-1 [ Links ]
28. De los Ríos A, Mercedes M, Terán-Ángel G, Silva-Basanta R. Estandarización de la prueba aglutinación directa empleando antígenos autóctonos para el diagnóstico de la leishmaniasis visceral en zonas endémicas de Venezuela. Bol Mal Salud Amb. 2010;50:53-63. [ Links ]
29. Mendicino DA, Streiger ML, del Barco ML, Fabbro DL, Bizai ML, Martínez R. Utilidad de la técnica de aglutinación directa en el diagnóstico de la infección chagásica. Rev Patol Trop. 2011;40:35-45. http://dx.doi.org/10.5216/rpt.v40i1.13913 [ Links ]
30. Añez N, Romero M, Crisante G. Valoración comparativa de pruebas serodiagnósticas utilizadas para detectar enfermedad de Chagas en Venezuela. Bol Mal Salud Amb. 2010;50:17-27. [ Links ]
31. Monzón CM, Jara GA, Hoyos CB. Evaluación de la prueba de aglutinacion directa en el diagnostico del mal de caderas en equinos. Rev Inst Med Trop Sao Paulo. 1994;36:211-5. [ Links ]
32. Romero M. Valoración metodológica comparativa en el despistaje serológico de la enfermedad de Chagas en Venezuela. 2009. Fecha de consulta: 14 de abril de 2012. Disponible en: http://tesis.ula.ve/pregrado/tde_busca/arquivo.php?codArquivo=2267. [ Links ]
33. Orozco L, Camargo D. Evaluación de tecnologías diagnósticas y tipos de muestreos. Biomédica. 1997;17:321-41. [ Links ]
34. Contreras VT, Araújo-Jorge TC, Bonaldo MC, Thomaz N, Barbosa HS, Meirelles MN, et al . Biological aspects of the DM28c clone of Trypanosoma cruzi after metacylogenesis in chemically defined media. Mem Inst Oswaldo Cruz . 1988;83:123-33. http://dx.doi.org/10.1590/S0074-02761988000100016 [ Links ]
35. Zingales B, Andrade S, Briones M, CampbeIl D, Chiari E, Fernandes O, et al. A new consensus for Trypanosoma cruzi intraspecific nomenclature: Second revision meeting recommends TcI to TcVI. Mem Inst Oswaldo Cruz 2009; 104: 1051-4. http://dx.doi.org/10.1590/S0074-02762009000700021 [ Links ]
36. Briceño D, Caballero G, Lares M, Viettri M, Medina M, Ferrer E. Diagnóstico inmunologico de la enfermedad de Chagas a partir de muestras colectadas en papel de filtro. Salus. 2012;16:43-52. [ Links ]
37. Lumbreras B, Hernández I. Estudios sobre pruebas diagnósticas. En: Hernández I, Gil A, Delgado M, Bolúmar F, Benavides F, Porta M, et al ., editores. Manual de epidemiología y salud pública. Segunda edición. Madrid: Editorial Médica Panamericana; 2011. p. 87-91. [ Links ]
38. Cerda LJ, Villarroel del PL. Evaluación de la concordancia inter-observador en investigación pediátrica: coeficiente de Kappa. Rev Chil Pediatr. 2008;79:54-8. http://dx.doi.org/10.4067/S0370-41062008000100008 [ Links ]
39. Pita-Fernández S, Pértegas-Díaz S. Pruebas diagnósticas: sensibilidad y especificidad. Cad Aten Primaria. 2003;10: 120-4. Fecha de consulta: 23 de noviembre de 2012. Disponible en: http://www.fisterra.com/mbe/investiga/pruebas_diagnosticas/pruebas_diagnosticas.asp. [ Links ]
40. López de Ullibarri I, Pita Fernández S. Medidas de concordancia: el índice Kappa. Cad Aten Primaria. 1999;6:169-71. Fecha de consulta: 23 de noviembre de 2012. Disponible en: http://www.fisterra.com/mbe/investiga/kappa/kappa.asp. [ Links ]
41. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics. 1977;33:159-74. [ Links ]
42. Schmunis GA, Szarfman A, Vattuone N. Direct agglu-tination test in the detection of anti- Trypanosoma cruzi antibodies in mice. J Parasitol. 1972;58:1006. [ Links ]
43. Luquetti A. Use of Trypanosoma cruzi defined proteins for diagnosis multicentre trial serological and technical aspects. Mem Inst Oswaldo Cruz . 1990;85:497-505. http://dx.doi.org/10.1590/S0074-02761990000400021 [ Links ]
44. Nakazawa M, Rosa DS, Pereira VRA, Moura MO, Furtado VC, Souza WV, et al . Excretory-secretory antigens of Trypanosoma cruzi are potentially useful for serodiagnosis of chronic Chagas´ disease. Clin Diagn Lab Immunol. 2001;8:1024-7. http://dx.doi.org/10.1128/CDLI.8.5.1024-1027.2001 [ Links ]
45. De Lima A, Arévalo P, Bastidas V, Bolívar M, Navarro M, Contreras V. Efecto de las condiciones de mantenimiento de Trypanosoma cruzi sobre la calidad de los antígenos para el diagnóstico serológico de la enfermedad de Chagas. Salus. 2007;11:20-6. [ Links ]
46. Peralta JM, Magalhães TC, Abreu L, Manigot DA, Luquetti A, Dias JC. The direct agglutination test for chronic Chagas´s disease. The effect of pre-treatment of test samples with 2-mercaptoethanol. Trans R Soc Trop Med Hyg. 1981;75:695-8. http://dx.doi.org/10.1016/0035-9203(81)90152-8 [ Links ]
47. Cannova D, Aguilar C, Pacheco M, Simons M, Medina M. Validación del inmuno ensayo enzimático (ELISA) y hemoaglutinación indirecta (HAI) para el serodiagnóstico de la enfermedad de Chagas. Salus. 2002;6:4-9. [ Links ]
48. Wendel S, Gonzaga A. Chagas´ disease and blood transfusion: A New World problem? Vox Sang. 1993;64:1-12. http://dx.doi.org/10.1111/j.1423-0410.1993.tb02507.x [ Links ]













