El veneno de escorpión es una mezcla de enzimas, proteínas, nucleótidos, sales, aminoácidos y péptidos (Ayerbe S, Guerrero-Vargas JA, Rivas-Pava MP. Introducción a la toxicología, importancia en la conservación de especies consideradas peligrosas por ser venenosas. En: Polanco-Ochoa R, editor. Manejo de fauna silvestre en Amazonía y Latinoamérica: selección de trabajos del V Congreso Internacional. Bogotá: CITES-Fundación Natura. 2003. p. 381-5), que poseen características farmacológicas, fisiológicas y bioquímicas, las cuales se han determinado y caracterizado estructural y funcionalmente mediante técnicas bioquímicas, como la cromatografía de exclusión (filtración en gel) 1, el intercambio iónico 2 y la cromatografía de alta resolución (HPLC), entre otras 3,4. La determinación de la secuencia de aminoácidos se hace mediante la degradación de Edman o la espectrometría de masas 5; otras técnicas incluyen ensayos de clonación molecular 6-8.
Los péptidos estudiados hasta la fecha se han clasificado en dos grupos: aquellos unidos por medio de puentes disulfuro (disulfide-bridged peptides, DBP) 9-11, y aquellos sin puentes disulfuro (non-disulfide-bridged peptides, NDBP) 12,13. Los DBP poseen entre 30 y 70 residuos de aminoácidos y tres o cuatro puentes disulfuro, con un peso molecular entre 4 y 7 kDa, y se caracterizan por tener una estructura alfa-hélice anfipática, similar a otras moléculas con actividad antimicrobiana 10,11. En este grupo se encuentran las neurotoxinas, las cuales actúan principalmente en los canales iónicos de sodio (Na+v), potasio (K+v), cloro (Cl-) o calcio (Ca2+v) del sistema nervioso, bloqueándolos o activándolos, y son las responsables de los síntomas que produce la picadura de escorpión en los mamíferos e insectos 9-11.
Estos venenos también han servido para el desarrollo de nuevos fármacos contra enfermedades, como las canalopatías, o de herramientas para estudios electrofisiológicos 11-13. Por ejemplo, el péptido TsNP, purificado a partir del veneno de Tityus serrulaus, con 21 residuos de aminoácidos, una masa molecular de 2,19 kDa y con un puente disulfuro, se ha propuesto para el tratamiento de enfermedades cardiovasculares 4.
Los NDBP, por su parte, son de interés por sus características estructurales y funcionales, entre las cuales se han determinado sus actividades citolítica, inmunomoduladora, potenciadora de bradicinina, antimicrobiana y anticancerígena 13-16. Pocos péptidos anticancerígenos se han reportado; sin embargo, en el veneno de T. discrepans se detectaron las toxinas neopladina 1 y 2, capaces de afectar células de carcinoma de seno humano (SKBR3), uniéndose a su superficie e induciendo la expresión de FasL y BcL-2 17. Otro ejemplo son los péptidos TsAP 1 y 2, los cuales han demostrado ser citotóxicos en diversas líneas celulares de cáncer 18.
Esta actividad se ha observado tanto en el veneno de escorpión como en sus péptidos. En general, estas sustancias inhiben el crecimiento celular y la síntesis de ADN, e inducen la apoptosis en células tumorales 16-18. Por ejemplo, el veneno del escorpión Rhopalurus junceus es un agente antitumoral en células epiteliales 19,20; el veneno de Heterometrus bengalensis induce la apoptosis y posee efectos antiproliferativos en líneas celulares de leucemia humana 21, y los venenos de Buthus martensii y Leirus quinquestriatus actúan como inhibidores del crecimiento de tumores cerebrales primarios y gliomas, respectivamente 22,23.
En este contexto, en el presente estudio se purificaron parcialmente los péptidos presentes en el veneno del escorpión T. macrochirus (Pocock, 1897) (figura 1) y se evaluó su capacidad citotóxica en diferentes líneas celulares provenientes de tumores. La hipótesis del trabajo planteaba que la actividad citotóxica del veneno de T. macrochirus depende principalmente de aquellos péptidos con un rango de peso molecular entre 3 y 10 kDa. Este es el primer estudio bioquímico del veneno de T. macrochirus, especie endémica de Colombia (figura 2).

Figura 1 Tityus macrochirus, macho adulto de la vereda Placitas del municipio de Fosca, Cundinamarca. Pertenece a la familia Buthidae, género Tityus; el género es el más abundante en Colombia y causa el mayor número de casos de escorpionismo en el país.

Figura 2 Telsón ubicado en el último segmento del metasoma en donde se encuentra el par de glándulas apocrinas productoras del veneno; termina en un aguijón que es una espina hueca característica de los escorpiones de esta familia.
Materiales y métodos
Obtención del veneno
Se recolectaron 13 escorpiones de la especie T. macrochirus24 en el municipio de Choachí, Cundinamarca, bajo el permiso otorgado en el marco de recolección de especímenes de especies silvestres de la diversidad biológica con fines de investigación científica no comercial, estipulado en el Decreto 1376 de 2013 de la Autoridad Nacional de Licencias Ambientales, ANLA, del Ministerio de Ambiente y Desarrollo Sostenible.
El Comité de Ética de la Facultad de Ciencias de la Universidad Nacional de Colombia avaló la realización de este proyecto en el acta 06 del 22 de junio de 2015, en la cual se autorizó la recolección de los animales, su manejo en el laboratorio y la extracción del veneno, así como la manipulación de las líneas celulares en un ambiente de bioseguridad de nivel II.
El veneno se obtuvo por estimulación eléctrica con 10 a 20 voltios en la parte dorsal y en la glándula productora de veneno de los escorpiones 25 (figura 3). La muestra de veneno se recolectó en tubos Eppendorf, se diluyó con agua desionizada y se almacenó a -20 °C (figura 4).
Cuantificación de los pesos moleculares del contenido proteico del veneno
La proteína total del veneno y la de las fracciones de péptidos purificados se cuantificaron con el método de ácido bicinconínico usando albúmina sérica bovina como referencia, según el procedimiento descrito por Smith, et al.26. En la cuantificación se empleó, asimismo, el método de absorción en la siguiente relación: [Proteína mg/ml]= (1,56 x Abs 280 nm) - (0,76 x Abs 260 nm) 27. Sin embargo, debido a la poca cantidad del veneno total y de las fracciones parcialmente purificadas, el método de ácido bicinconínico no fue adecuado, pues no permitió recuperar la muestra para ensayos posteriores. El método de absorción se escogió como el más apropiado, ya que se encontró una buena correlación entre este y el uso de ácido bicinconínico y, además, permitió reutilizar cada una de las muestras en los ensayos posteriores. Por otra parte, las muestras evaluadas eran traslúcidas y no se observaron interferencias en la región de 220 a 280 nm.
La determinación y estimación de los pesos moleculares de los péptidos del veneno de T. macrochirus se hicieron mediante electroforesis en gel de poliacrilamida con dodecilsulfato sódico (Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis, SDS-PAGE), en condiciones desnaturalizadas, usando geles con 15 % de concentración de acrilamida (T) 28. La tinción se hizo con Instant Blue®, y los geles se analizaron usando el programa Quantity One 4.6.7.

Figura 3 Forma de manipulación del escorpión para la extracción del veneno por medio de estimulación eléctrica. La pinza ayuda a no lastimar al escorpión y a evitar accidentes en su manipulación.
Purificación parcial de los péptidos presentes en el veneno
Teniendo en cuenta los pesos moleculares de algunos péptidos 1,2,4,29, inicialmente se analizó en gel de Bio-Gel P-30®, empleando 12,5 ml de soporte en una columna de 1,0 cm x 2,6 cm. La elución se hizo con solución tampón fosfato salino (PBS) 1X, manteniendo un flujo de 0,3 ml/minuto. El seguimiento de la purificación se hizo mediante lecturas de absorbancia a 220 y 280 nm. De acuerdo con los perfiles obtenidos, se recolectaron las diferentes fracciones y se les determinó la concentración de proteína 26, y se evaluaron por SDS-PAGE 27 y RP-HPLC 1,2,4,29. También se hicieron ensayos de cromatografía de intercambio iónico con DEAE-Sepharosa 1,2. La elución se realizó en forma discontinua, empleando un gradiente de cloruro de sodio (NaCl) a partir de 150 mM y hasta 550 mM en PBS 1X.
Los péptidos también se purificaron parcialmente por ultrafiltración, empleando el sistema de Amicon® Ultra-0,5 y membranas con un tamaño de poro de 10 y 3 kDa. La muestra de veneno total se centrifugó a 12.000 rpm durante 40 minutos en el Amicon® Ultra-0,5 de 10 kDa, el difusato se pasó al Amicon® Ultra-0,5 de 3 kDa y se centrifugó a 12.000 rpm durante 80 minutos. Posteriormente, se determinó la concentración de proteína de cada una de las fracciones obtenidas (difusatos y retentatos) mediante el método de absorción 27, y se evaluaron con RP-HPLC 1,2,4,29.
Se empleó la RP-HPLC en el veneno total y en las fracciones obtenidas con los métodos cromatográficos y de ultrafiltración con Amicon®. Se empleó una columna C18 con dimensiones de 4,6 x 150 mm, un gradiente lineal del solvente B (TFA al 0,05 % en acetonitrilo) de 5 a 50 % en solvente A (ácido trifluoroacético, TFA, al 0,05 % en agua) durante 50 minutos 1-3,5,14,17,29,30.
Actividad biológica del veneno total y los péptidos parcialmente purificados
Con el veneno total se evaluó el grado de citotoxicidad frente a líneas celulares provenientes de células tumorales de colon (HT-29, obtenidas de tejido de colon humano, con morfología epitelial, de propiedades adherentes, y adenocarcinoma colorrectal) 31; de cuello uterino (SiHA, obtenidas de tejido de cuello uterino humano, con morfología epitelial, de propiedades adherentes, y carcinoma de células escamosas grado II; HeLa, obtenidas de tejido de cuello uterino humano, con morfología epitelial, de propiedades adherentes y adenocarcinoma) 31; de seno (MDA-MB231, obtenidas de tejido de glándula mamaria derivado del lugar de la metástasis, con derrame pleural, morfología epitelial, de propiedades adherentes, y adenocarcinoma) 31; de próstata (PC3, obtenidas de tejido de próstata derivado del sitio de metástasis en hueso de humano, con morfología epitelial, de propiedades adherentes, y adenocarcinoma de grado IV) 31, y de pulmón (A549, obtenidas de tejido de pulmón de humano, con morfología epitelial, de propiedades adherentes y carcinoma) 31. Como control, se empleó una línea celular normal de pulmón con células adherentes del tipo de fibroblastos (MRC-5) 31. El cultivo celular se realizó en medio de Eagle modificado por Dulbecco (DMEM), con 10 % de suero fetal bovino y 1 % de antibiótico-antifúngico a 37 °C y 5 % de CO217,32.
Se hicieron ensayos por triplicado sembrando 10.000 células por pozo y dejándolas sincronizar durante 24 horas. La muestra de veneno se sembró en un rango de concentración de 100 a 0 µg/m. Además, la línea celular HeLa se trató con el veneno total en un rango de concentraciones de 50 a 1 µg/ml; también, se evaluó la fracción de péptidos parcialmente purificados en un rango de 56 a 2,8 µg/ml. En cada línea celular evaluada, se empleó un control con el mismo tratamiento descrito, pero empleando DMEM en lugar de veneno o fracciones en el paso correspondiente (células sin estímulo).
Las células tratadas con estímulo y sin este, se incubaron durante 24 horas a 37 °C y 5 % de CO2, y posteriormente se determinó el porcentaje de viabilidad celular usando el método MTT. Se emplearon 20 µl de la solución de MTT con una concentración de 0,5 mg/ml y se adicionaron 200 µl de DMEM en cada pozo. Las placas se incubaron durante tres horas a 37 °C, 5 % de CO2 y 95 % de humedad. Una vez transcurrido este tiempo, se retiró la solución y se agregaron 200 µl de dimetilsulfóxido (DMSO) a cada pozo, se incubó cada placa a 37 °C durante 15 minutos para disolver los cristales formados y se leyó la absorbancia a 540 nm 32.
Como control, se emplearon células sin el veneno ni la fracción de péptidos para determinar el 100 % de viabilidad celular. Los datos se analizaron por regresión y análisis de varianza de un factor mediante ANOVA en cada línea celular, con el paquete estadístico de SPSS® de IBM, considerando un nivel de significación de 0,01.
Resultados
Pesos moleculares del contenido proteico del veneno
Se recolectaron 200 µl de veneno diluido en agua desionizada proveniente de 13 individuos de T. macrochirus después de seis extracciones y un promedio de 3 µl por extracción y por individuo (figura 5), con una concentración de proteína total de 1,75 mg/ml determinada con el método del ácido bicinconínico y 1,87 mg/ml con el método espectrofotométrico. Teniendo en cuenta la proximidad de estos dos valores y dada la poca cantidad de la muestra, se decidió continuar la cuantificación con el método espectrofotométrico y se partió de un valor inicial de muestra de 1,81 mg/ml, correspondiente a la media de las concentraciones obtenidas mediante los dos métodos evaluados; la cantidad inicial de proteína total fue de 360 µg.
Figura 5 Recolección del veneno en una caja de Petri estéril. El volumen aproximado después de cada estímulo es de 3 a 5 μl.
Aplicando el método de electroforesis al veneno total, se observaron proteínas con un peso molecular entre 100 y 27 kDa, y péptidos entre 10 y 3 kDa; en este último rango, se pudieron observar seis bandas correspondientes a pesos moleculares comprendidos entre los 10,5 y los 4,6 kDa, dependiendo de la movilidad electroforética comparada con el patrón de peso molecular (figura 6).
Purificación parcial de los péptidos presentes en el veneno
Considerando los pesos estimados por electroforesis y los resultados reportados por Possani, et al.1, y Pimenta, et al.28, la filtración se hizo en gel Bio-Gel P30. Se sembraron 90 µg de proteína total del veneno y se obtuvieron tres fracciones (figura 7A), de las cuales la primera correspondió al volumen muerto de la columna (3 ml) y, las otras dos, al rango de inclusión de esta: a los 5 ml con una concentración de 0,52 mg/ml y a los 13 ml con una concentración de 0,069 mg/ml. El análisis de cada una de las fracciones con SDS-PAGE y RP-HPLC no evidenció bandas ni señales específicas que permitieran determinar la presencia de péptidos en ninguna de ellas (no se muestran los datos).

Figura 6 Electroforesis SDS-PAGE (tris-tricina) de la muestra de veneno total de T. macrochirus. Se observa la presencia de polipéptidos y péptidos en el veneno total; los pesos de interés corresponden a péptidos con un rango de 10 a 3 kDa. Carriles 1, 2 y 3: muestras de veneno total con concentración de 18, 1,2 y 0,61 μg, respectivamente. MP: patrón de peso molecular. Las letras a a f representan las bandas de posibles péptidos de interés.
De forma similar, en la cromatografía de intercambio iónico, se sembraron 170 µg de proteína total y se obtuvieron 13 fracciones (figura 7B), aunque solo dos de ellas presentaron una absorbancia significativa (fracciones obtenidas con 150 mM y 250 mM de NaCl en una concentración de 0,62 mg/ml y 0,47 mg/ml, respectivamente).
Por otra parte, al centrifugar 572,48 µg de veneno total en Amicon Ultra-0,5® (Bio-Rad), con un tamaño de exclusión de 10 kDa, se obtuvo un difusato con una concentración de proteína de 0,101 mg/ml; este difusato se trató con Amicon Ultra-0,5® (Bio-Rad), con un tamaño de exclusión de 3 kDa, y se centrifugó, con lo cual se obtuvieron un retentato con concentración de proteína de 0,28 mg/ml y un difusato de 0,020 mg/ml. Estas fracciones se evaluaron mediante RP-HPLC y se observaron varias señales con el retentato en Amicon Ultra-0,5 ® (Bio-Rad), y con un tamaño de exclusión de 3 kDa, fracción que se denominó VTnP (péptidos del veneno de T. macrochirus); 12,5 µg de la fracción VTnP permitieron detectar al menos siete componentes con tiempos de retención de 16,04, 16,83, 16,99, 17,75, 20,46, 21,67 y 22,28 minutos (figura 8), mientras que, con 18 µg de veneno total, se observaron 19 componentes (figura 9).
En conclusión, los péptidos presentes en el veneno del escorpión se encontraron en el rango completo de tiempos de retención y no en una zona del perfil cromatográfico obtenido con el veneno total (figuras 8 y 9). Especialmente interesante resultó observar las fracciones obtenidas en los tiempos de retención de 16, 04, 20, 46 y 22, 28 minutos del perfil cromatográfico de la fracción VTnP.
Actividad biológica del veneno total y los péptidos parcialmente purificados
A las 24 horas se observó una disminución en la viabilidad de todas las líneas celulares empleadas, con un mayor efecto en la línea PC3, cuya viabilidad disminuyó a 28 % con 50 µg/ml de veneno total comparada con la de control. En cuanto a la HT-29, su viabilidad con la misma concentración de veneno fue cercana al 50 %. En las otras líneas celulares no se logró un valor de viabilidad igual o menor al 50 % con esta concentración; específicamente para la A549, dicho valor fue cercano a 62 %, seguido de la MDA-MB231 y la SiHa, las cuales presentaron una viabilidad de 73 y 89 % con esta misma concentración de veneno, respectivamente (figura 10).

Figura 7 Perfil cromatográfico de una muestra de veneno total de T. macrochirus en columna abierta. A. Perfil cromatográfico de filtración en gel con soporte de Bio-Gel P30, la línea azul corresponde a la absorbancia de 220 nm y, la verde, a la de 280 nm. B. Perfil cromatográfico de intercambio iónico con soporte de DEAE-Sepharosa, la línea azul corresponde a la absorbancia de 220 nm y, la roja, a la de 280 nm. Los valores de 250 mM a 550 mM corresponden a la concentración de NaCl empleada durante la cromatografía.
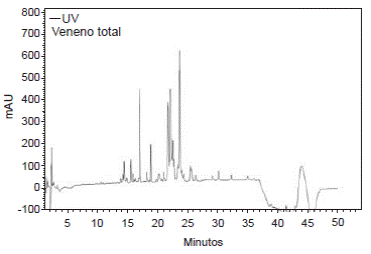
Figura 8 Perfil cromatográfico con RP-HPLC del veneno total de T. macrochirus. Se emplearon 0,018 mg de proteína total del veneno en un método lineal en fase inversa a partir de 5 % y hasta 50 % de ACN-0,05 % TFA durante 50 minutos, con detección a 210 nm-UV.
En ensayos previos, se había obtenido una disminución de 20 % en la viabilidad de la línea celular HeLa (80 % de viabilidad) con una concentración de 50 µg/ml de veneno total (no se muestran los datos), en tanto que con 56 µg/ml de la fracción VTnP, la viabilidad celular fue de 60 %; en este último caso, la disminución de la viabilidad tuvo una variación lineal con respecto a la concentración de la fracción VTnP utilizada (figura 11).
En el caso de la MRC-5, una línea celular de fibroblastos, la viabilidad se mantuvo por encima del 85 % en las concentraciones usadas, lo cual indicaba que el veneno podría tener efecto sobre células transformadas y no sobre células normales (figura 10). A pesar de existir una diferencia entre el porcentaje de viabilidad obtenido en esta línea celular y los controles de todas las líneas celulares usadas, dicha diferencia no fue significativa (cuadro 1), por lo que se consideró que el veneno no tenía efecto sobre dicha línea celular.
Según el análisis estadístico (cuadro 1), los resultados presentados en la figura 10 evidenciaron una diferencia estadísticamente significativa en todas las concentraciones del veneno usadas en las líneas celulares PC3 y HT29, lo cual indica que incluso la concentración más baja utilizada (10 µg/ml) afectó su viabilidad celular. En el caso de las líneas MDA-MB31 y A549, la concentración más baja no tuvo un efecto significativo sobre la viabilidad celular, pero al usar 25 µg/ml y concentraciones más altas, se encontraron diferencias significativas indicativas del efecto tóxico del veneno en cada una de estas líneas. Un efecto menor se observó sobre la SiHa, en la cual solamente la concentración más alta (100 µg/ml) tuvo un efecto significativo sobre la viabilidad celular.
Estos resultados se observaron al comparar el valor obtenido de las líneas celulares de control (sin estímulo) con el de las líneas celulares sometidas al estímulo (cada una de las concentraciones del veneno), partiendo de la hipótesis nula de que el estímulo no tenía efecto sobre la viabilidad de las líneas celulares comparadas con las líneas de control, con un valor de p<0,01 para rechazar la hipótesis.

Figura 9 Perfil cromatográfico con RP-HPLC de la fracción VTnP o retentato obtenido de la ultrafiltración con Amicon Ultra- 0,5, con una membrana NMWL de 3 kDa. Se emplearon 0,0125 mg de proteína total con un método lineal en fase inversa a partir de 5 % y hasta 50 % de ANC-0,05 % TFA durante 50 minutos, con detección a 210 nm.

Figura 10 Comparación del porcentaje de viabilidad celular de cada línea celular con respecto a la concentración de veneno total de T. macrochirus (el análisis estadístico se presenta en la cuadro 1).

Figura 11 Efecto de la variación de la concentración de la fracción del péptido parcialmente purificado (VTnP) del veneno de escorpión T. macrochirus en la viabilidad de la línea celular HeLa
Cuadro 1 Determinación de la significación estadística de los resultados obtenidos en las pruebas de actividad biológica del veneno de T. macrochirus. Análisis de varianza de un factor en el cual los valores de p<0,01 determinaban el efecto del veneno en la viabilidad celular de las líneas ensayadas

Discusión
El método de extracción utilizado demostró ser más eficiente que los métodos manuales usados preliminarmente, ya que permitió obtener mayor cantidad de veneno, disminuir el tiempo de manipulación del animal, realizar las extracciones de veneno varias veces en cada individuo y disminuir la posibilidad de contaminación de la muestra obtenida 25. Asimismo, con este método se obtuvo un veneno con un perfil electroforético bien definido (figura 6) y similar a lo reportado para otras especies de escorpiones (1,2,25,29,33).
Los pesos moleculares de los péptidos de interés presentes en el veneno de T. macrochirus fluctuaron entre 3,5 y 10 kDa (figura 6), lo cual es característico de otros venenos de escorpiones pertenecientes al mismo género. En general, se ha encontrado que los venenos de escorpiones tienen péptidos con pesos moleculares en un rango de 2 a 14 kDa, y que estos poseen gran similitud entre sus secuencias de aminoácidos 33-35.
Dada la variabilidad reportada previamente de los pesos moleculares y los puntos isoeléctricos de los componentes del veneno de diferentes especies del género Tityus, para la purificación de sus péptidos se han usado métodos cromatográficos como la filtración en gel y el intercambio iónico 1,2,29,33, por lo que fueron estos los métodos inicialmente empleados en este estudio. Sin embargo, a pesar de que en los resultados obtenidos se muestran fracciones con una absorbancia significativa (figura 7 A y B), no se lograron detectar péptidos por electroforesis. Es importante mencionar que la cantidad de veneno total usada fue muy poca (90 µg) y que, si se considera la dilución que sufrió la muestra de veneno durante la elución en las cromatografías en columna abierta, se obtuvo muy poca cantidad de cada una de las fracciones separadas, por lo que muy seguramente se logró un valor menor a la sensibilidad de la tinción empleada (InstantBlue™, 5 ng de proteína).
El método de centrifugación con Amicon Ultra-0,5® se seleccionó debido a su capacidad de separación y concentración dependiendo del tamaño de la biomolécula, el cual viene dado por el tamaño del poro de la membrana utilizada. En este caso, dado que el objetivo era obtener fracciones de péptidos de un tamaño menor de 10 kDa, se usaron dos membranas con un límite de separación entre 3 y 10 kDa. Los resultados obtenidos en el retentato y el difusato con la membrana de 3 kDa (0,448 mg y 0,11 mg, respectivamente), permiten asegurar que el rango de peso molecular de la mayoría de los péptidos encontrados en este veneno fluctuaba entre 3 y 10 kDa.
La RP-HPLC del veneno total (figura 8) presentó señales similares a las obtenidas para otros venenos de escorpiones de la misma familia, las cuales difirieron principalmente en su cantidad, ya que en el presente estudio se detectaron claramente 19 señales y en otros se han reportado más de 20 señales 3,29,34,35. Sin embargo, las señales encontradas entre los 21 y los 25 minutos de retención (figura 8), cuya resolución no fue muy buena, fueron similares a las reportadas con actividad antimicrobiana 35 y anticancerígena 17 en venenos provenientes de escorpiones de la misma familia. Esto podría indicar que algunos péptidos del veneno de T. macrochirus tienen un comportamiento similar en la HPLC al de otros ya reportados con actividad biológica.
En cuanto a la fracción VTnP, se obtuvo un perfil cromatográfico (figura 9) similar al del veneno total (figura 8), aunque se evidenció una disminución en el número de señales (siete en total), lo que claramente indica la separación de varios de los componentes del veneno total. Asimismo, en este perfil se observó una mejor separación de algunos de los componentes presentes en el rango de 21 a 25 minutos de retención, lo cual lo relacionaría aún más con péptidos reportados previamente con actividad antimicrobiana o anticancerígena 3,19,29,34,35.
Los resultados evidencian, asimismo, que el método de ultrafiltración con Amicon fue eficiente y selectivo para la purificación parcial de los péptidos del veneno de T. macrochirus. También, puede señalarse que los componentes proteicos del veneno de diferentes géneros y especies de escorpión varían en cuanto a la cantidad de péptidos o proteínas, pero mantienen su similitud estructural 3,5,7,11,28,33-36, lo cual sugeriría una actividad biológica específica en los péptidos del veneno de T. macrochirus.
Por último, los ensayos de citotoxicidad se hicieron en líneas celulares provenientes de tumores y en una línea celular sana como control, con el fin de comprobar el efecto del veneno en tumores y su selectividad frente a células de tumor o sanas.
El veneno total de T. macrochirus redujo la viabilidad de las cinco líneas celulares provenientes de tumores, con un nivel de significación de p<0,01, y las más afectadas fueron las líneas PC3 y HT-29 (figura 10). Resultados similares se han obtenido con el veneno de T. serrelatus, con efecto citotóxico comprobado en líneas celulares de cáncer de próstata, pulmón, seno y glioblastomas 18. En este sentido, Guo, et al.18, sintetizaron dos péptidos (TsAP-1 y TsAP-2) presentes en el veneno de T. serrelatus y evidenciaron que el primero de ellos tenía mayor citotoxicidad en células de carcinoma de pulmón, en tanto que el segundo tenía mayor efecto en células de cáncer de próstata.
Con base en ello, podría inferirse que en el veneno de T. macrochirus podría haber un péptido similar al TsAP-2 de T. serrelatus. Estos resultados también tendrían relación con los componentes peptídicos del veneno de T. discrepans17, ya que el veneno de T. macrochirus no disminuyó la viabilidad celular en la línea MRC-5, pero sí en las derivadas de carcinoma (figura 10, cuadro 1).
Así, podría predecirse que los componentes peptídicos del veneno de T. macrochirus actúan por tres vías diferentes: 1) por bloqueo de un canal específico 37; 2) por inhibición del crecimiento de la célula cancerígena en la unión a un sitio específico diferente al del canal iónico 38, y 3) por activación intracelular de las vías que inducen la apoptosis 39.
Con base en los resultados del presente estudio, el veneno de T. macrochirus puede ser selectivo y poseer citotoxicidad diferencial, pues se requirió una concentración diferente de proteína para generar un efecto citotóxico determinado (figura 10). Según lo descrito por otros investigadores, esta es una característica general de diferentes venenos de escorpión: por ejemplo, se ha determinado que el veneno de Rhopalurus junceus es selectivo frente a células cancerosas de pulmón 40; la clorotoxina, purificada del veneno de Leiurus quinquestriatus41, es específica para células de glioma 42 y se la ha propuesto como una alternativa para el reconocimiento de otro tipo de células cancerosas con base en ensayos con nanopartículas que permitieron reconocer ganglios positivos para linfoma de cáncer de mama, próstata y testículo 43,44; el veneno de Androctonus crassiacauda, por su parte, resultó selectivo para la línea celular BC3H1 45 13,17-23,29,45.
Al observar que el veneno de T. macrochirus redujo la viabilidad de las células de tumores de cuello uterino (SiHa) en un 50 %, se hizo un nuevo ensayo con otra línea de tumor de cuello uterino (HeLa) (no se muestran los datos), cuyos resultados se asemejan a la actividad del veneno total de R. junceus40, y reafirmarían que el veneno de T. macrochirus es selectivo frente a líneas celulares de tumor específicas. Sin embargo, al evaluar el efecto de la fracción peptídica obtenida por la purificación (VTnP) en estas líneas celulares, se encontró que una concentración mayor incrementaba su efecto citotóxico en la línea HeLa (figura 11), lo cual sugiere que la eliminación de ciertos componentes presentes en el veneno total potenciaría el efecto de algunos de los péptidos de la fracción VTnP.
Con base en los resultados descritos, es posible concluir que el componente peptídico del veneno de T. macrochirus tuvo actividad citotóxica en las líneas celulares evaluadas, lo cual se ha observado también en péptidos purificados y sintetizados a partir de otros venenos de escorpión, por lo cual se han empezado a considerar como una alternativa para el diseño y la elaboración de nuevos agentes terapéuticos 13,16,18,43-51. De ahí la necesidad de separar completamente algunos de los péptidos de este veneno y evaluar el efecto que cada uno de ellos produce en las diferentes líneas celulares evaluadas para determinar plenamente el responsable de cada uno de los efectos observados.















