Trypanosoma cruzi es un protozoario parásito intracelular obligado, causante de la tripanosomiasis americana o enfermedad de Chagas, padecimiento endémico en distintos países de Latinoamérica 1.
En el sureste mexicano -incluido el Estado de Yucatán-, T. cruzi se transmite principalmente por las heces y la picadura del insecto vector Triatoma dimidiata; sin embargo, otros triatominos, como Panstrongylus rufotuberculatus, Eratyrus cuspidatus, Triatoma nitida y Triatoma hegneri, pueden participar en el ciclo de transmisión 2.
El contagio en humanos también puede ocurrir por la exposición a sangre contaminada durante el periodo perinatal, por transfusiones sanguíneas, en accidentes de laboratorio o por ingestión de alimentos contaminados 3. Una vez infectado el huésped o reservorio, T. cruzi afecta gran variedad de células y tejidos, incluidos macrófagos, músculo liso, músculo estriado, músculo cardiaco, fibroblastos y células de Schwann 4.
Las manifestaciones de la tripanosomiasis americana incluyen desde casos asintomáticos hasta cuadros clínicos crónicos atípicos, lo cual resulta en la fluctuación de las tasas de mortalidad 5. La fase parasitémica aguda se caracteriza por fiebre de 38° C y, después de dos a tres semanas de infección, puede presentarse edema facial, de piernas y pies, así como hepatoesplenomegalia y linfadenopatía axilar e inguinal moderadas 6. El periodo crónico se manifiesta al cabo de diez años o más de la primoinfección y se desarrolla en el 30 % de los pacientes con signos cardiacos graves como cardiomegalia y alteraciones histológicas como necrosis celular, infiltrados inflamatorios intersticiales (focales o difusos), edema y fibrosis intersticial 7. Asimismo, T. cruzi coloniza ampliamente las fibras cardiacas para desarrollarse y multiplicarse en los denominados nidos con formas de amastigotes, dando origen al ‘corazón chagásico’ 8,9.
La infección natural con T. cruzi en roedores sinantrópicos (comensales) o silvestres se ha descrito en diversos estudios serológicos y moleculares 10-13 mediante los cuales se ha establecido que Mus musculus y Rattus rattus son algunos de los principales reservorios del parásito y participan en los ciclos de transmisión domésticos, peridomésticos y silvestres 12-14. Específicamente en Yucatán, México, la infección natural con T. cruzi se ha identificado en M. musculus (ratón común) y R. rattus (rata negra), lo que ha puesto en evidencia su probable participación en el ciclo de transmisión en la región 15,16. Estos hallazgos resultan relevantes debido a la cercanía y la amplia presencia de estos animales en asentamientos urbanos del Estado 17.
El diagnóstico de la enfermedad de Chagas puede hacerse mediante pruebas serológicas y moleculares dependiendo del mecanismo de transmisión, la etapa evolutiva del padecimiento y la sensibilidad y especificidad de las pruebas 18. No obstante, el estudio histopatológico de los tejidos u órganos infectados (principalmente el músculo cardiaco) representan una alternativa complementaria para el diagnóstico y también ayudan en la interpretación de la fisiopatología de la enfermedad en los casos fatales 9,19.
Los hallazgos histopatológicos de los diversos estudios a nivel mundial se han descrito solo brevemente y se registran poco en roedores sinantrópicos y en otros reservorios o huéspedes naturalmente infectados con T. cruzi20,21. En este contexto, el objetivo del presente estudio fue describir los tipos y la frecuencia de las lesiones histológicas presentes en el tejido cardiaco de M. musculus y R. rattus naturalmente infectados con T. cruzi, capturados en los barrios suburbanos de Mérida, Yucatán, México.
Materiales y métodos
Sitio de estudio
El presente estudio se llevó a cabo en los barrios Plan de Ayala Sur II (20° 90’ 18,2’’ N, 89° 62’ 08,4’’ E) y San José Tecoh (20° 55’ 15,4’’ N, 89° 37’ 35,6’’ E), ubicados al sur de la ciudad de Mérida, la cual es el mayor centro urbano del sureste del país. Ambos barrios están separados por una distancia menor de 3 km. El clima predominante en los dos sitios es cálido subhúmedo con lluvias en verano (AW’ 0). La temperatura media anual es de 26° C (36° C, máxima y 18° C, mínima), con dos estaciones climáticas bien marcadas: de lluvia (mayo a octubre) y seca (noviembre a abril) 22.
El barrio Plan de Ayala Sur II se encuentra fuera de la periferia de Mérida, dentro de la Reserva Ecológica Cuxtal. La vegetación original de este sitio era la selva baja caducifolia. Actualmente, el suelo tiene diferentes usos, principalmente para asentamientos humanos y, en menor grado, para ganadería y agricultura.
Por su parte, San José Tecoh está dentro de la periferia de la ciudad. Actualmente, la zona se encuentra completamente urbanizada. La vegetación original era selva baja caducifolia, pero ha sido substituida por plantas domesticadas u ornamentales 23.
En ambas localidades pueden observarse abundantes desperdicios orgánicos e inorgánicos, y numerosos perros y gatos sin dueño. Además, algunas calles carecen de servicios básicos como drenaje, luz eléctrica y recolección de basura.
Captura de roedores y toma de muestras biológicas
Para la captura de los roedores se consideraron 30 manzanas por barrio (60 en total), en las cuales se seleccionó por conveniencia una vivienda. Se colocaron seis trampas Sherman (8 x 23 x 9 cm; HB Sherman Traps Inc.™, Tallahasse, Florida, USA) en cada una de ellas y se mantuvieron activas durante tres noches consecutivas, previa autorización de los habitantes. Los muestreos se alternaron semanalmente por barrio (dos semanas por mes), en el periodo comprendido entre mayo y octubre de 2013.
Las trampas se situaron en lugares con potencial de refugio o alimentación para los roedores y se cebaron con hojuelas de avena y saborizante artificial de vainilla. Se revisaron durante las mañanas y aquellas con captura se reemplazaron por otras colocadas en el mismo lugar. Todas las trampas se retiraron al cuarto día de muestreo.
Los roedores capturados se trasladaron y se procesaron en las instalaciones del Laboratorio de Zoología y del Laboratorio de Parasitología, Unidad de Diagnóstico, Campus de Ciencias Biológicas y Agropecuarias de la Universidad Autónoma de Yucatán. Se determinaron las especies y se recolectaron datos morfométricos, pesos y edades. Los criterios empleados para establecer la edad fueron los propuestos por Hernández-Betancourt, et al. 24.
Los roedores capturados se anestesiaron con pentobarbital sódico (dosis de 60 mg/kg) por vía intraperitoneal 25 y se les practicó la eutanasia por dislocación cervical (método que no ocasiona lesiones microscópicas en el corazón), según los lineamientos de la American Veterinary Medical Association26 y la normatividad nacional vigente de especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio (NOM- 033-ZOO-1995; NOM-062-1999). Durante el transporte y la eutanasia, los animales recibieron un trato humanitario, protegiendo su salud y minimizando el dolor o el estrés generado.
La captura de los animales se llevó a cabo con la autorización de la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación de México (registro de acta: SGPA/DGVS/02528/13). En todos los procedimientos se usó equipo de protección personal para prevenir la exposición a excreciones (es decir, orina, heces y saliva) de los animales. En el sitio de procesamiento, se emplearon guantes dobles de látex, mascarilla desechable, bata y zapatos cerrados.
Después de la eutanasia, se practicó una necropsia con la finalidad de observar lesiones macroscópicas indicativas de la enfermedad de Chagas y para recolectar las secciones de corazón empleadas en el presente estudio. Para ello, la mitad inferior del corazón (ventrículos) se conservó en casetes para histología y se embebieron en formol amortiguado al 10 % (pH 7,4), en una proporción de una parte de tejido por diez de fijador, por lo menos, durante 24 horas. No fue posible aprovechar otros tejidos u órganos, ya que se destinaron a objetivos de investigación distintos al del presente estudio. Por otra parte, las aurículas cardiacas se conservaron a -80 °C y se utilizaron en el diagnóstico molecular de T. cruzi16, análisis que no formaba parte de los objetivos de la investigación de la cual se desprendió el presente trabajo.
Las muestras biológicas se etiquetaron con claves que contenían el número consecutivo del individuo capturado, la especie (Mm: M. musculus y Rr: R. rattus), el sitio (nombre del barrio) y la fecha de captura.
Estudio histopatológico
Las secciones de corazón (aurículas) reservadas para el estudio histopatológico se procesaron en el Laboratorio de Patología Acuática del Centro de Investigación y de Estudios Avanzados, Unidad Mérida, y en el Laboratorio de Docencia del Campus de Ciencias Biológicas y Agropecuarias de la Universidad Autónoma de Yucatán.
La técnica que se utilizó para procesarlas fue la descrita por el Armed Forces Institute of Pathology para la inclusión de tejidos y la formación de bloques en parafina 27: se hicieron cortes de 6 µm de grosor y se tiñeron con la técnica habitual de hematoxilina y eosina.
Los tejidos se observaron con ayuda de un microscopio óptico convencional usando los objetivos 5X, 10X, 40X y 100X (Eclipse E100, Nikon™, Tokio, Japón). Las lesiones detectadas se caracterizaron según los criterios de Torres-Castro, et al. 21,28 y Trigo, et al.29. Cada lesión se describió y se registró de forma individual, pues en ocasiones se presentó más de un tipo de lesión en una sola muestra de tejido cardiaco.
Identificación molecular de Trypanosoma cruzi
La identificación molecular de T. cruzi se hizo en el Centro de Investigaciones Regionales “Dr. Hideyo Noguchi” (CIR)-UADY. La descripción de la metodología y los resultados en extenso se encuentran en Panti-May, et al. 16. En resumen, con ayuda de un proceso estandarizado, se extrajo ADN total de las aurículas recolectadas, el cual fue utilizado en una reacción en cadena de la polimerasa (PCR) convencional para amplificar un fragmento específico de ADN nuclear de T. cruzi con un tamaño de 188 pares de bases (pb). En esta reacción, se emplearon los cebadores desarrollados por Moser, et al. (30): TCZ-1 (3’-CGAGCTCTTGCCCACACGGGTGCT-5’) y TCZ-2 (3’-CCTCCAAGCAGCGGATAGTTCAGG -5’).
Para validar todas las reacciones, se incluyeron controles negativos (agua estéril) y positivos (ADN de T. cruzi correspondiente al linaje I). Vale la pena mencionar que, debido a la gran sensibilidad y especificidad de los cebadores utilizados en la reacción, no fue necesaria la secuenciación de los fragmentos positivos para confirmar los resultados.
Resultados
Se capturaron 278 roedores: 165 (59,4 %) M. musculus y 113 (40,6 %) R. rattus. Del total, 15 (5,4 %) muestras de tejido cardiaco resultaron inicialmente positivas para la infección con T. cruzi determinada mediante PCR (punto final): ocho (4,9 %; 8/165) de M. musculus y siete (6,2 %; 7/113) de R. rattus.
En la necropsia ninguno de los roedores presentó lesiones macroscópicas concordantes con la enfermedad de Chagas en corazón o en algún otro de los órganos explorados (esófago, intestino grueso o delgado, etc.).
Se detectaron nidos con formas parasitarias (amastigotes) en 7 de las 15 muestras positivas: en 3 de las 8 de M. musculus y en 4 de las 7 de R. rattus (figura 1). En ambas especies, se encontraron infiltrados inflamatorios, compuestos principalmente por histiocitos y linfocitos, en todas las muestras positivas de miocardio (figura 2). Otras lesiones significativas fueron degeneración de las fibras cardiacas (8/15) (figura 3), congestión de los vasos sanguíneos (6/15) (figura 1) y necrosis celular (5/15) (figura 4).

Figura 1 Nido parasitario con amastigotes (A) y congestión de vasos sanguíneos (B) en tejido cardiaco de Rattus rattus naturalmente infectado con Trypanosoma cruzi, capturado en un ambiente suburbano de Mérida, Yucatán, México. Hematoxilina y eosina, 100X

Figura 2 Infiltrado inflamatorio linfocitario multifocal moderado crónico, compuesto por linfocitos e histiocitos en tejido cardiaco de Mus musculus naturalmente infectado con Trypanosoma cruzi, capturado en un ambiente suburbano de Mérida, Yucatán, México. Hematoxilina y eosina, 40X
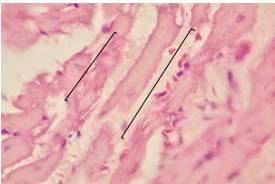
Figura 3 Fibras cardiacas (corchetes) con degeneración celular en tejido cardiaco de Rattus rattus naturalmente infectado con Trypanosoma cruzi, capturado en un ambiente suburbano de Mérida, Yucatán, México. Hematoxilina y eosina, 100X

Figura 4 Necrosis por coagulación (A, flecha) en tejido cardiaco de Rattus rattus naturalmente infectado con Trypanosoma cruzi, capturado en un ambiente suburbano de Mérida, Yucatán, México. Nótese la diferencia con la parte de tejido sin daño (B). Hematoxilina y eosina, 100X
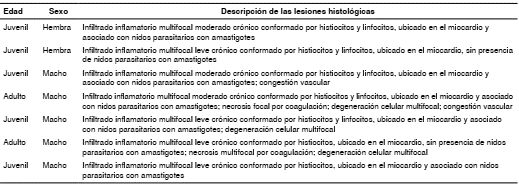
Las lesiones microscópicas observadas en los tejidos cardiacos de M. musculus se especifican en el cuadro 1 y las de R. rattus se presentan en el cuadro 2, los cuales también incluyen la edad y el sexo de los roedores positivos para la infección con T. cruzi.
En el cuadro 3, se presentan las frecuencias totales para cada una de las lesiones microscópicas detectadas en los tejidos cardiacos positivos para la infección con T. cruzi en los ejemplares de M. musculus y R. rattus capturados en Mérida.
Cuadro 1 Descripción de las lesiones histológicas observadas en cada una de las muestras de tejido cardiaco positivas para la infección con Trypanosoma cruzi en Mus musculus

Cuadro 2 Descripción de las lesiones histológicas observadas en cada una de las muestras de tejido cardiaco positivas para la infección con Trypanosoma cruzi en Rattus rattus
Discusión
El objetivo del presente trabajo fue describir y reportar los tipos y la frecuencia de las distintas lesiones microscópicas encontradas en el tejido cardiaco de roedores sinantrópicos naturalmente infectados con T. cruzi capturados en los barrios suburbanos de Mérida, Yucatán, México. Los estudios histopatológicos en roedores u otros animales en condiciones de laboratorio (infectados experimentalmente) son numerosos y variados 31-37, pero no sucede lo mismo con los realizados en reservorios o huéspedes naturalmente infectados 20,21,38.
En diversos estudios se ha concluido que T. cruzi es una especie heterogénea y que tanto el parasitismo intracelular como el desarrollo de las numerosas lesiones en el miocardio y en otros órganos colonizados, dependen en gran medida de la presencia y el número de nidos parasitarios con amastigotes 8,39,40, los cuales también son indicativos de que, después de instalarse y reconocer los diferentes tejidos blanco, T. cruzi se reproduce intensamente a nivel intracelular dando como resultado un mayor número de parásitos en el torrente sanguíneo después de diferenciarse en tripomastigotes 33. Estos nidos parasitarios se observaron en los tejidos cardiacos de los ejemplares de M. musculus y R. rattus estudiados (figura 1), lo cual concuerda con reportes previos 21 para ambos roedores sinantrópicos capturados en Molas, Yucatán, México, población con características climatológicas y sociales similares a los sitios de estudio considerados en el actual trabajo.
En este estudio los nidos con formas de amastigotes que contenían el clásico complejo núcleo-cinetoplasto, se encontraron en 8 de las 15 muestras de tejido cardiaco positivas en la PCR convencional para la infección con T. cruzi (figura 1).
Este menor número podría explicarse con base en los hallazgos de Pizzi, et al. 39, quienes sugieren que la distribución de los nidos parasitarios es mayor en el miocardio de las aurículas, secciones del corazón con las que, infortunadamente, no se contó en este caso. Asimismo, Araujo-Carreira, et al. 38 describieron la presencia de nidos parasitarios en cuatro de diez corazones de zarigüeyas (Didelphis marsupiales) naturalmente infectadas, lo que indicaría que la localización de los nidos no es homogénea en los animales reservorios. En el estudio de Acosta-Viana, et al. 20, los autores tampoco encontraron los nidos en un perro positivo por PCR para la infección con T. cruzi.
Por otro lado, Rossi, et al. 40, señalan que la observación de los nidos con formas de amastigotes se dificulta, incluso en la etapa crónica o indefinida de la enfermedad, y que su ubicación depende en gran medida de los signos o síntomas clínicos. No obstante, en estudios experimentales como el de Castro-Sesquen, et al. 36, los nidos con formas de amastigotes se presentaron a los 25 días de la inoculación de los parásitos adultos en el tejido cardiaco de 18 cuyos (Cavia porcellus) infectados, específicamente en aquellos animales que se encontraban en la etapa crónica de la enfermedad.
Otro aspecto que pudo influir en el porcentaje de detección de nidos con formas de amastigotes en los roedores positivos por PCR, se refiere al hecho de que en el presente estudio no se empleó músculo esquelético, tejido que puede verse ampliamente afectado y ocupado por T. cruzi, sobre todo en infecciones crónicas, lo que restringió su distribución a otro órganos o tejidos 36,41. Asimismo, en modelos de ratón se ha observado que es posible que T. cruzi no persista en el tejido cardiaco previamente afectado 34,42, lo cual reduce la probabilidad de detectarlo en la observación histopatológica.
Otro hallazgo del análisis microscópico del presente estudio fue que los nidos parasitarios se presentaron tanto en roedores machos como en hembras, lo cual concuerda con hallazgos previos 21. En este sentido, León, et al. 37, tampoco encontraron diferencias en la distribución de los nidos según el sexo de los animales empleados en tres modelos distintos de ratón.
Las lesiones más frecuentes (15/15) en el tejido cardiaco de los roedores positivos para la infección con T. cruzi fueron los infiltrados inflamatorios, conformados principalmente por linfocitos e histiocitos (figura 2), aunque con diferente grado de gravedad y distribución. Esta lesión se ha descrito en el 100 % de los corazones de los pacientes humanos con enfermedad de Chagas 41,43 y se relaciona con otros daños cardiacos de las fases crónica o indeterminada de la enfermedad 44,45, por lo que es probable que los animales utilizados en este trabajo se encontraran en dichas etapas y pudieran estar predispuestos a la infección, o no estarlo 37; sin embargo, esta hipótesis debe demostrarse con base en estudios experimentales posteriores. Asimismo, los infiltrados inflamatorios se han descrito en estudios en modelos de ratón directamente vinculados con la carga parasitaria y no con el genotipo o linaje del parásito infeccioso 32,37,39,46, lo que tampoco pudo determinarse en el presente estudio.
Por otra parte, este tipo de lesiones se han asociado con el desarrollo de necrosis (figura 4) de las fibras cardiacas afectadas y con la mortalidad subsiguiente 40,43.
Se han determinado diversos factores como detonantes de la formación y presentación de infiltrados inflamatorios celulares en los individuos con infecciones crónicas, entre los que pueden mencionarse la patogenia del genotipo de T. cruzi infeccioso, el tiempo de evolución de la enfermedad y la presencia de infección concomitante con otros parásitos (poliparasitismo) 47, así como la interacción del genoma del parásito con el del huésped infectado, la edad, el sexo y la presencia de infecciones previas 48.
Otras lesiones detectadas en el presente estudio fueron necrosis por coagulación (figura 4), degeneración celular (figura 3) y congestión vascular (figura 1), todas las cuales fueron también reportadas por Torres-Castro, et al. 21 en M. musculus y R. rattus, y han sido identificadas en modelos de ratón 49,50, en zarigüeyas de cola corta (Monodelphis domestica) 51, y en humanos con enfermedad crónica y con compromiso del sistema circulatorio 40,52.
Aunque algunas de las lesiones encontradas en el presente estudio histopatológico pueden ser ocasionadas por otros agentes infecciosos circulantes en los roedores empleados (por haber sido capturados en un ambiente periurbano) 28, los resultados de Panti-May, et al. 16 y los de este estudio permiten concluir que los roedores M. musculus y R. rattus son reservorios de T. cruzi y que, probablemente, están involucrados en el ciclo de infección de la tripanosomiasis americana en la región. Se recomienda adelantar estudios que permitan conocer cuáles son los distintos linajes de T. cruzi circulantes en las poblaciones de roedores y otros reservorios animales de Yucatán, México.
Después de revisar la literatura consultada, puede señalarse que este es el primer estudio sistemático que reporta y describe los distintos tipos de lesiones histopatológicas del tejido cardiaco de roedores sinantrópicos naturalmente infectados con T. cruzi capturados en Yucatán, México.















