INTRODUCCIÓN
Las enfermedades causadas por hongos en plantas son una de las preocupaciones de mayor consideración en la producción agrícola. Los fungicidas empleados actualmente para el control de estas enfermedades son responsables de un gran número de efectos tóxicos para el ser humano, pueden generar consecuencias negativas en el medio ambiente (Orlandini et al., 2015; Regueiro et al., 2015) y afectan la comercialización de los productos agrícolas. La resistencia asociada a un uso erróneo y excesivo de los mismos ha motivado la búsqueda de opciones ambiental y económicamente racionales, que permitan reemplazar o combinar el uso de productos químicos sintéticos en la agricultura (Hoyos, 2012). Algunas de estas alternativas están enmarcadas en el término "regulación biológica" y se refieren al uso de microorganismos vivos, nativos o introducidos, naturales o modificados genéticamente, para el control de patógenos de plantas (Hoyos, 2012). Estos organismos, denominados biocontroladores, ejercen su acción por mecanismos como depredación, parasitismo, hipovirulencia, inhibición, competencia o favorecimiento de la planta (Ghorbanpour et al., 2017).
Entre los organismos que han sido reportados como biocontroladores se encuentran bacterias, levaduras, cepas no patogénicas, cepas hipovirulentas y hongos micro y macromicetos (Ghorbanpour et al., 2017). Estos últimos pueden ser una fuente potencial de compuestos bioactivos, generalmente metabolitos secundarios con actividad antifúngica, los cuales podrían ser empleados a escala comercial (Morath et al., 2012). Dichos metabolitos secundarios presentan una distribución taxonómica restringida y su biosíntesis está condicionada por factores físicos, químicos y ambientales (Ramadan et al., 2015). En principio, estos compuestos no son esenciales para la vida del hongo pero contribuyen a su supervivencia y se producen con frecuencia durante la fase estacionaria de crecimiento (Ali et al., 2013 ; Hwang et al., 2014). Otros compuestos como péptidos, enzimas líticas (quitinasas, lacasas, celulasas, hemicelulasas, proteasas, peroxidasas, entre otras) y polisacáridos con actividad antifúngica, antibacteriana y nematicida, han sido reportados en macrohongos de los géneros Xylaria (Pongcharoen et al., 2008; Silva et al., 2010; Richardson et al., 2014; Wu et al., 2014), Agrocybe (Ngai et al., 2005), Psilocybe (Keay y Brown, 1989) y Stereum (Cateni et al., 2007; Li et al., 2014; Aqueveque et al., 2016; Aqueveque et al., 2017; Yao et al., 2017).
Colombia posee una gran diversidad de ecosistemas que presentan nichos únicos para el crecimiento de hongos, lo que lo posiciona como un sitio promisorio para la búsqueda de estas especies y de sus componentes bioactivos (Castiblanco et al., 2015). Sin embargo, son muy pocos los estudios sobre diversidad fúngica y sus posibles aplicaciones. El objetivo de esta investigación fue evaluar la actividad biocontroladora in vitro de cuatro macromicetos nativos pertenecientes a los géneros Xylaria, Agrocybe, Psilocybe y Stereum sobre siete aislamientos de hongos fitopatógenos de interés agrícola correspondientes a Fusarium oxysporum, F. solani, Monilinia sp., Moniliophthora roreri, Sclerotinia sclerotiorum, Rhizoctonia sp., y Colletotrichum sp. Para ello, i) se determinó la curva de crecimiento de los hongos macromicetos en dos fuentes de carbono; ii) se caracterizaron las interacciones yla capacidad de inhibición in vitro de los macromicetos sobre los hongos fitopatógenos; iii) se realizó la extracción y caracterización preliminar de los metabolitos secundarios a partir de la biomasa y el medio de cultivo de los hongos que presentaron mayor capacidad de inhibición y iv) se evaluó la actividad antifúngica in vitro de los extractos seleccionados sobre aislados de Fusarium oxysporum, Colletotrichum sp. y Moniliophthora roreri.
MATERIALES Y MÉTODOS
Material fúngico
Se seleccionaron cuatro hongos macromicetos de los géneros Xylaria sp. CH3, Psilocybe sp. UPB6, Agrocybe sp. UPB1 y Stereum sp. CH84 colectados a partir de madera en descomposición, en el bosque alto andino ubicado en el Parque Natural Chicaque (Cundinamarca) y en plantaciones de palma de aceite de la empresa UNIPALMA S.A. en los llanos orientales de Colombia (Crespo et al., 2014; Castaño et al., 2019). Los hongos fitopatógenos Fusarium oxysporum, F. solani, Monilinia sp., Moniliophthora roreri, Sclerotinia sclerotiorum, Rhizoctonia sp. y Colletotrichum sp. se obtuvieron de la clínica de plantas de la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombia y de la Federación Nacional de Cacaoteros, Fedecacao. Las cepas se conservaron en cajas de Petri en agar papa dextrosa a 4 °C y se repicaron cada tres meses en el mismo medio.
Medios de cultivo
Se empleó caldo papa dextrosa (PDB) con la siguiente formulación (g.L-1): papa (200) y glucosa (18); el salvado de trigo (ST) con solución Mandels modificado (Moya y Torres, 2012) tuvo la siguiente formulación (g.L-1): salvado de trigo (50), KNO3 (1,4), KH2PO4 (2), CaCl2.2H2O (0,4), MgSO4.7H2O (0,3), FeSO4.7H2O (0,005), MnSO4.H2O (0,00118), ZnSO4.7H2O (0,0014), CoCl2.6H2O (0,0026), CuSO4 (0,01) y agar nutritivo (28) para agar salvado de trigo y PDA (agar papa dextrosa).
Cinética de crecimiento
Se determinó la curva de crecimiento de los hongos macromicetos en dos fuentes de carbono (FC), una convencional en Papa Dextrosa (PDB) y otra no convencional en Salvado de trigo (ST). Esta se realizó mediante una fermentación en estado líquido (FEL) en Erlenmeyer de 100 ml con 30 ml de medio PDB o ST. Estos medios de cultivo se inocularon con tres discos de 0,5 cm de diámetro tomados de la periferia del hongo crecido en cajas con PDA de nueve días de incubación (Castaño y Torres, 2015) y se incubaron a 27 ± 2 °C con agitación orbital de 150 rpm (MaxQ™ 4000 Benchtop Orbital Shaker) por 15 - 18 días en oscuridad. La cuantificación de biomasa seca (48 h - 40 oC) se realizó por triplicado con muestras tomadas cada tres días.
Clasificación y caracterización de las interacciones in vitro
Las interacciones se determinaron mediante cultivo dual en los medios PDA y ST. Se tomaron discos de 8 mm del micelio de cada uno de los hongos y se sembraron en los extremos opuestos de una caja Petri, con incubación a 27 ± 2 °C en oscuridad durante 18 a 21 días posteriores a la inoculación del hongo fitopatógeno. Las interacciones se clasificaron en cinco categorías: entremezcla mutua (MI), entremezcla parcial (PMI), inhibición al punto de contacto (TPI), inhibición a la distancia (DI) y reemplazo (RPL) (Molla et al., 2001). Para cada uno de los aislamientos se calculó además el índice de antagonismo (IA) (Badalyan et al., 2004). Para ello, se asignó a cada tipo de interacción un puntaje: MI = 0, TPI = 1, DI = 2, PMI = 3, RPLTPI = 4, RPLDI = 5 y se calculó según la fórmula: IA = MI (0xn) + TPI (1xn) + DI (2xn) + PMI (3xn) + RPLTPI (4xn) + RPLDI (5xn), donde n es la frecuencia de cada tipo de interacción. Adicionalmente, se clasificó la actividad antagonista como fuertemente activo (IA > 30), activo (IA 20 - 30), moderadamente activo (IA 11 - 20) y débilmente activo (IA 1 - 10) (Pandey, 2012). La inhibición in vitro se determinó solamente en las interacciones clasificadas como DI y RPL. Se realizó una medición manual de los diámetros de ambas colonias cada tres días, durante 15 días. El porcentaje de inhibición se determinó como la reducción de la colonia del fitopatógeno en comparación con la colonia control multiplicado por 100 según la fórmula PI = 100 x (C1 - C2) /C1, donde C1 es el diámetro de la colonia en ausencia del macromiceto y C2 en presencia del mismo (Abdel-Motaal et al., 2010).
Obtención de extractos
La extracción de los metabolitos secundarios de baja y mediana polaridad se realizó sobre la biomasa (BM), el medio de cultivo agotado (MC) y el homogenizado (EC) en la fase estacionaria de crecimiento de los hongos macromicetos que evidenciaron mayor índice de antagonismo y mayor capacidad de inhibición in vitro sobre los hongos fitopatógenos. El producto de la FEL obtenido en la fase estacionaria de crecimiento se filtró separando el micelio del medio agotado. El medio de cultivo liofilizado fue solubilizado en metanol mientras que la biomasa seca (40 °C - 48 h) fue sometida a extracciones discontinuas con MeOH asistidas por ultrasonido hasta obtener un peso constante. Los extractos se desecaron con Na2SO4 anhidro y se llevaron a sequedad en un evaporador rotatorio a 120 rpm y 35 oC. Para la obtención del EC, el producto obtenido de la FEL durante la fase estacionaria de crecimiento fue homogenizado en vórtex y centrifugado a 5000 rpm por 20 min; posteriormente el sobrenadante se filtró empleando una membrana de 0,22 µm MILLEX®GV, Millipore.
Caracterización preliminar de los extractos
La caracterización preliminar de la clase de metabolitos presentes en los extractos se efectuó mediante la realización de ensayos cualitativos de coloración en Cromatografía en Capa Delgada CCD (MeOH:EtOAc 98:2 y MeOH:EtOAc 50:50), utilizando el cromatograma que evidenció el mayor número de componentes y empleando los siguientes reveladores específicos: tricloruro férrico para compuestos fenólicos, Lieberman-Burchard para esteroles y/o terpenoides, Molisch para azúcares, Benedict para cumarinas y Fluoresceína para lípidos (Merck, 1980). Para la detección de los esteroles se empleó además como reveladores específicos solución de vainillina-ácido sulfúrico 10 % en etanol y ZnCl2 al 25 % en metanol y como universal, luz ultravioleta (254 nm y 366 nm). En cuanto a la caracterización de los compuestos de la fracción grasa se realizó por Cromatografía de Gases acoplada a Espectrometría de Masas (CG-EM) en un cromatógrafo GC-17A Shimadzu, con las siguientes características: columna capilar HP-5MS 30 m, 0,250 mm de diámetro interno y 0,25 µm de espesor; gas de arrastre Helio 4,5 a 1 ml.min-1; modo Split 1:10; temperatura desde 90 °C hasta 300 °C a 5 °C.min-1; temperatura de inyector y de interfase de 250 °C. Este cromatógrafo está acoplado a un espectrómetro de masas CGMS QP5050A. Se inyectaron 1 µL de soluciones de 3 mg.ml-1 del extracto a analizar disueltos en CH2Cl2.
Ensayos antifúngicos cuantitativos
Se empleó el porcentaje de inhibición de crecimiento micelial (PICM). Los extractos filtrados BM y MC se adicionaron por separado a medio PDA en concentraciones de 9, 18, 90 y 180 µg.ml-1 y en concentraciones de 1; 2,5; 5; 10 y 50 % para el EC. Se tomaron discos de 3 mm del micelio de tres hongos fitopatógenos de ocho días de cultivo y se inocularon en el centro de las cajas de Petri de 5 cm con el medio PDA que contenía las concentraciones de los extractos por separado. Como control se inocularon discos de micelio en medio PDA. Todos los hongos se incubaron a 28 oC por 6 - 11 días y se tomaron lecturas diarias de los diámetros de las colonias. La actividad inhibitoria se determinó midiendo el diámetro radial de las colonias en presencia del extracto (R2) y el diámetro radial de la colonia control (R1). Estas dos medidas se utilizaron para calcular el PICM (Skidmore AM, Dickinson CH. Interactions between germinating spores of Septoria nodorum and phyloplane fungi. Trans. Brit. Mycol. Soci. 1976;66, 45-56.) según la fórmula:
Diseño experimental
Se utilizó un diseño completamente al azar y todos los experimentos se realizaron por triplicado. Una vez comprobados los supuestos del análisis de varianza, los datos experimentales se analizaron mediante ANOVA y prueba de comparación de medias (Test de Tukey) a una p < 0,05 para determinar la presencia de diferencias significativas entre los tratamientos. Los datos se analizaron en el programa estadístico SAS 9.1.3®.
RESULTADOS
Caracterización de las cinéticas de crecimiento
La cantidad de biomasa seca en función del tiempo varió con respecto a los aislamientos y a la fuente de carbono (Anexo 1). Para los aislamientos Xylaria sp. CH3, Agrocybe sp. UPB1 y Psilocybe sp. UPB6 el rendimiento de biomasa fue mayor en medio PDB que en medio ST y se evidenciaron las diferentes fases de crecimiento de cada uno de estos aislamientos (Anexo 1A). Xylaria sp. CH3 presentó la mayor producción de biomasa de todos los aislamientos en medio PDB con 9,91 ± 0,70 g.L-1 en el día 15, mientras que Stereum sp. CH84 evidenció la menor en medio PDB con 3,73 ± 0,28 g.L-1 en el mismo periodo de tiempo (Anexo 1A). Sin embargo, en medio ST la producción de biomasa de Stereum sp. CH84 aumentó en 1,5 veces (5,71 ± 0,57 g.L-1) y se lograron distinguir las diferentes fases de crecimiento. En general para el medio ST, el rango de mayor producción de biomasa se encontró entre 4,5 y 5,54 g.L-1 y fue menor a lo encontrado en medio PDB (6,9 - 10,9 g.L-1) para todos los aislamientos, con excepción de Stereum sp. CH84. El aislamiento Agrocybe sp. UPB1 fue el único que presentó un crecimiento diaúxico en el tiempo evaluado.
Existen reportes que demuestran que la biosíntesis de los metabolitos secundarios inicia durante la fase estacionaria del crecimiento del hongo, cuando este entra en estado de estrés debido a la disminución de nutrientes. Se considera que estos compuestos no son esenciales para la vida del hongo pero contribuyen a su supervivencia (Shaikh et al., 2009; Ali et al., 2013; Hwang et al., 2014). Con base en los resultados obtenidos, para la extracción de los metabolitos secundarios presentes en la biomasa, en el sobrenadante y en el homogenizado total de los aislamientos seleccionados, se empleó la biomasa obtenida en el medio de cultivo en PDB, utilizando la muestra correspondiente a la fase estacionaria del cultivo.
Clasificación y caracterización de las interacciones in vitro
Se clasificaron un total de 56 interacciones fúngicas. El tipo de interacción varió con los aislamientos y la fuente de carbono empleada (Tabla 1, Fig. 1). En medio PDA la mayoría de las interacciones de Xylaria sp. CH3 se clasificaron como RPL. Agrocybe sp. UPB1 presentó la mayor diversidad de interacciones fúngicas, lo cual pone en evidencia su capacidad de respuesta a diferentes patógenos. Para los aislamientos Psilocybe sp. UPB6 y Stereum sp. CH84 se presentaron con mayor frecuencia interacciones del tipo DI.
Tabla 1 Interacciones entre macromicetos y hongos fitopatógenos.

aPMI, Entremezcla parcial mutua; DI, Inhibición a la distancia; TPI, Inhibición al punto de contacto; RPLDI, Remplazo después de inhibición a la distancia; RPLTPI, Reemplazo después de inhibición al punto de contacto.
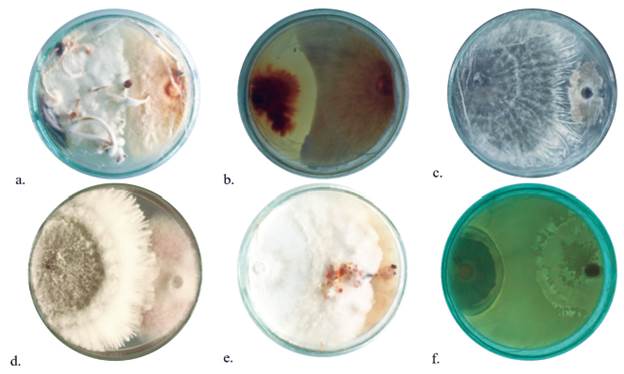
Fig 1 Interacciones entre macromicetos (izquierda) y hongos fitopatógenos (derecha). a. Inhibición al punto de contacto (TPI) entre Psilocybe sp. UPB6 y Moniliophthora roreri en PDA; b. Inhibición a la distancia (DI) entre Stereum sp. y Moniliophthora roreri CH84 en ST; c. Reemplazo después de inhibición a la distancia (RPLDI) entre Xylaria sp. CH3 and Monilinia sp. en PDA; d. Reemplazo después de inhibición al punto de contacto (RPLTPI) entre Xylaria sp. CH3 y Fusarium oxysporum en PDA; e. Entremezcla parcial mutua (PMI) entre Agrocybe sp. UPB1 y Rhizoctonia sp. en PDA; f. Reemplazo después de inhibición a la distancia (RPLDI) entre Agrocybe sp. UPB1 y Rhizoctonia sp. en ST donde el hongo fitopatógeno crece sobre el macromiceto. Las figuras son representativas de todas las repeticiones del experimento.
En este estudio se calculó un total de 22 índices de antagonismo para cada uno de los aislamientos en los dos medios de cultivo (Tabla 1), con valores mayores o iguales en medio PDA que en ST, con excepción del aislamiento CH84. Con base en esta clasificación, Xylaria sp. CH3 y Agrocybe sp. UPB1 presentaron un antagonismo activo, y Psilocybe sp. UPB6 junto con Stereum sp. CH84 un antagonismo moderadamente activo en medio PDA. En medio ST, Xylaria sp. CH3 fue el único aislamiento con antagonismo activo, Psilocybe sp. UPB6 y Stereum sp. CH84 presentan un antagonismo moderadamente activo y Agrocybe sp. UPB1 un antagonismo débil. Con base en estos resultados se determinó la capacidad de inhibición in vitro (PICM) únicamente en las interacciones clasificadas como RPL o DI las cuales están relacionadas principalmente con la producción de compuestos antifúngicos.
Determinación de la capacidad de inhibición in vitro (PICM)
Los resultados muestran que los PCIM dependen tanto del medio de cultivo como de las cepas utilizadas en la interacción (Fig. 2). En general se alcanzaron los mayores PCIM en medio PDA con todos los macromicetos evaluados, en donde se destaca el aislamiento Xylaria sp. CH3 para la mayoría de los hongos fitopatógenos con valores de PICM entre 52 y 68 %, y Agrocybe sp. UPB1 para F. oxysporum que alcanzó un valor de 72 % (Fig. 2a). En medio ST los PICM variaron con respecto a PDA (Fig. 2b). Xylaria sp. CH3 presentó un mayor PICM para Colletotrichum sp. y Rhizoctonia sp. con valores de 73 % y 62 %, respectivamente. Aunque Stereum sp. CH84 mostró PICM en cuatro de los siete fitopatógenos, los valores de inhibición oscilaron entre el 1 y el 33 %. Con base en estos resultados se realizó la extracción de los metabolitos secundarios presentes en los aislamientos con mayor actividad antagonista correspondientes a Xylaria sp. CH3, Agrocybe sp. UPB1 y Stereum sp. CH84 en medio PDB.

Fig 2 Porcentaje de inhibición del crecimiento micelial (PICM) de hongo fitopatógenos 15 días después de inoculación en presencia de Xylaria sp. CH3, Agrocybe sp. UPB1, Psilocybe sp. UPB6 y Stereum sp.CH84 en dos fuentes de carbono diferentes. a. PICM en PDA. b. PICM en ST. Las columnas de cada fitopatógeno con la misma letra no son significativamente diferentes según la prueba de Tukey (a = 0,05). Las barras en las columnas representan la desviación estándar de la media (n = 3).
Caracterización preliminar de metabolitos secundarios por CCD, ensayos colorimétricos y CG-EM
Caracterización por CCD
La visualización de los cromatogramas con el revelador universal estableció que los extractos metanólicos estuvieron constituidos por compuestos de baja y mediana polaridad. En los correspondientes a la biomasa de Xylaria sp. CH3 se detectaron compuestos con valores Rf de 0,34, 0,89 y 0,98; para Agrocybe sp. UPB1 de 0,83, 0,88 y 0,92; y para Stereum sp. CH84 de 0,88 y 0,95, lo que permitió ver la similitud de composición de los extractos (Anexo 4). Solamente para el aislamiento Xylaria sp. CH3, y como resultado del empleo en CCD de los reveladores específicos para los diferentes tipos de metabolitos que conforman cada uno de los extractos analizados (BM, MC y EC), se determinó la presencia de compuestos fenólicos, ácidos grasos, azúcares y compuestos triterpenoidales (Tabla 2).
Tabla 2 Caracterización preliminar de metabolitos secundarios por ensayos colorimétricos en CCD presentes en Xylaria sp. CH3. BM, extracto metanólico de biomasa; MC, extracto metanólico del medio de cultivo; EC, homogeneizado de la biomasa y el medio de cultivo.

+++ Positivo; ++ Intermedio, + No concluyente, - Negativo
Análisis por CG-EM
Con base en el hecho de que los ácidos grasos exhiben actividad antifúngica y dado que Xylaria sp. exhibió el mayor índice de antagonismo, se determinó la composición química de la fracción grasa, correspondiente al extracto en Diclorometano (DCM) de la biomasa de Xylaria sp. mediante CG-EM. Los compuestos fueron identificados por la librería del equipo y el análisis de sus espectros de masas (Anexo 2), dando como resultado la presencia de los ácidos palmítico, linoléico y oleico. Todos ellos presentan en sus espectros de masa los picos correspondientes a [M-agua]+, [M-OH]+, [M-CO2H]+ y los iones en m.z-1 60, correspondientes al rearreglo de McLafferty, así como las pérdidas sucesivas de 14 unidades de masa, debidas a la fragmentación de la cadena hidrocarbonada.
Ensayos antifúngicos cuantitativos
Se evaluó la actividad antifúngica de dos extractos metanólicos obtenidos a partir de la BM y el MC de Xylaria sp. a concentraciones de 0, 9, 18, 90 y 180 µg.ml-1 sobre el crecimiento radial de tres hongos fitopatógenos: F. oxysporum, Colletotrichum sp. y M. roreri. (Fig. 3a). Los extractos de BM evidenciaron actividad antifúngica en los tres fitopatógenos evaluados desde 90 µg.ml-1. El extracto del MC no evidenció actividad antifúngica en F. oxysporum ni en Colletotrichum sp., pero si una leve inhibición en M. roreri a una concentración de 180 µg.ml-1. Con respecto a la actividad antifúngica del EC, ésta se evidenció para los tres fitopatógenos, siendo mayor para Colletotrichum sp. y M. roreri desde el 1 % (Fig. 3b).

Fig. 3 Crecimiento radial de hongos fitopatógenos en presencia de extractos de Xylaria sp. CH3. a. Fusarium oxysporum - BM; b. Colletotrichum sp. - BM; c. Moniliophthora roreri - BM; d. Fusarium oxysporum - MC; e. Colletotrichum sp.- MC; f. Moniliophthora roreri - MC; g. F. oxysporum - EC; h. Colletotrichum sp.- EC; i. Moniliophthora roreri - EC. Las diferencias significativas entre tratamientos se indican con letras diferentes en cada variable de acuerdo con la prueba de Tukey (a = 0,05).
Se calcularon en total 45 PICM de los tres extractos evaluados para los tres hongos fitopatógenos en el día 15. Para todos los casos EC-50 % (homogeneizado de la biomasa y el medio de cultivo en concentración del 50 %) evidenció los mayores PICM con valores de 59,2 ± 5 %, 82,4 ± 1 % y 73,3 ± 1,7 % para F. oxysporum, Colletotrichum sp. Y M. roreri respectivamente (Anexo 3).
DISCUSIÓN
La biomasa y las diferentes fases de crecimiento que presenta un hongo dependen tanto de la composición del medio de cultivo como del hongo utilizado. En este estudio se encontraron mayores producciones de biomasa en medio PDB y en un tiempo menor de lo reportado para Xylaria sp. (1,5 g.L-1 en 40 días) por Ramesh et al. (2014) y para Agrocybe cilindracea (6 g.L1) por Kim et al. (2005). Así mismo, se ha reportado que el medio PDB, al estar suplementado con glucosa, facilita el inicio de la fase exponencial del hongo alcanzando mayores rendimientos (Ramesh et al., 2014); en la fase estacionaria y de declive, cuando se disminuye la disponibilidad de glucosa, se producen las enzimas necesarias para la degradación de moléculas más complejas (Aziza y Amrane, 2012). En contraste, en un medio ST, en el que la fuente de carbono es compleja desde el inicio, los aislamientos deberán contar con enzimas específicas para degradar el salvado de trigo, que es un sustrato compuesto de diferentes polisacáridos, e iniciar su crecimiento (Kim et al., 2005). La diferencia en las cinéticas de crecimiento para cada uno de los aislamientos estudiados en medio ST puede deberse a la actividad enzimática propia de cada aislamiento empleada para degradar este sustrato; de esta forma Stereum sp. CH84 y Agrocybe sp. UPB1 cuentan con las enzimas específicas que le permiten degradar más eficientemente este sustrato que los otros aislamientos.
En las interacciones de Stereum sp. CH84 con Rhizoctonia sp., F. solani, Sclerotinia sp. y Monilinia sp. fue posible apreciar la producción de pigmentos en la interface (Fig 1b); Peiris et al. (2008) indica que estos compuestos pueden tratarse de fenoles y quinonas asociados a enzimas extracelulares, como lacasas. Estas enzimas están implicadas en múltiples funciones presentes en las interacciones miceliales, como cambios en la hidrofobicidad de las paredes celulares de las hifas como medida de protección ante las enzimas hidrolíticas de otros organismos (Larena et al., 2005), y en la producción de algunos compuestos como las quinonas que están involucradas en la formación de melanina, la cual actúa como barrera física contra enzimas degradadoras de la pared celular (Larena et al., 2005).
En medio ST solo se encontraron tres interacciones del tipo RPL, todas pertenecientes a Xylaria sp. CH3 (Tabla 1). En general, estos tipos de interacciones se relacionan con los mecanismos de regulación biológica de patógenos (Ghorbanpour et al., 2017); de esta forma, las interacciones clasificadas como RPL indican que se trata de parasitismo, en el que el patógeno es atacado usualmente mediante la producción de enzimas líticas; las interacciones DI involucran un antagonismo indirecto mediante la producción de compuestos que inhiben el organismo patógeno; las interacciones TPI y PMI están relacionadas con la competencia, ya sea por nutrientes o por espacio, en la cual uno de los organismos reduce la disponibilidad de recursos para el otro. Las interacciones RPLDI involucran antibiosis inicial y posterior parasitismo (Badalyan et al., 2004). Boddy (2000) reporta interacciones de reemplazo completo en Armillaria gallica por parte de Xylaria hypoxylon;Pandey (2012) reporta interacciones de Xylaria del tipo RPLTPI sobre Rhizoctonia solani y F. oxysporum, reemplazo completo en Alternaria brassicae y PMI en F. solani, Colletotrichum capsici, Phytophthora nicotianae y Phoma medicaginis. Se han reportado interacciones del tipo TPI y posterior PMI para Stereum hirsutum en presencia de Coprinus micaceus y C. disseminatus (Peiris et al., 2008). También se han documentado interacciones del tipo TPI entre Psilocybe fasciata y Acremonium strictum, en las que el punto de contacto corresponde a una zona micelial escasa (He et al., 2006).
El mayor IA lo obtuvo el aislamiento Xylaria sp. CH3 en medio PDA (IA-30); este resultado es concordante con lo presentado por Pandey (2012), que reporta índices de antagonismo entre 20 y 30 para Xylaria sp. En comparación con los IA reportados para especies con alta actividad biocontroladora como Trichoderma harzianum (IA 44.5), T. pseudokoningii (IA 26) y T. viride (IA 26) en presencia de 17 especies diferentes de hongos xilófilos (Badalyan et al., 2004), el aislamiento Xylaria sp. utilizado en este estudio se posiciona como un excelente candidato para controlar hongos fitopátogenos.
Se ha demostrado que la producción de diferentes compuestos antifúngicos como proteínas, aminoácidos, compuestos esteroidales, compuestos fenólicos, lípidos y polisacáridos tipo β-glucano entre otros, puede ser elicitada por la fuente de carbono y nitrógeno utilizada en el medio de cultivo, así como por el tipo de cepas enfrentadas en el cultivo dual (Ramadan et al., 2015). Ruiz et al. (2010) indican que existe una fuerte influencia de la fuente de carbono en la formación de muchos metabolitos.
Los extractos EC y BM presentaron una mayor riqueza de compuestos con respecto a MC; además, solo en el extracto BM se detectó la presencia de lípidos (Tabla 2). Esta diferencia en la composición de los extractos radica en los niveles de concentración de estos compuestos, dados por la intensidad de coloración obtenida con los reveladores específicos. En este sentido, para el extracto BM se presentaron mayores o iguales niveles en la mayoría de los compuestos con excepción del reportado para azúcares en el extracto EC (Tabla 2). Estos resultados ponen en evidencia la variabilidad estructural de los compuestos sintetizados por este aislamiento de Xylaria, lo cual concuerda con lo reportado en diferentes estudios químicos realizados para el género Xylaria , en los que se han aislado metabolitos de diversas estructuras como citocalasinas, ácidos grasos, diterpenos glicosidados, sesquiterpenoides, esteroides y lactonas a partir de cuerpos fructíferos o medios de cultivo (Wang et al., 2014). También se detectó que estos compuestos permanecen principalmente en la biomasa del hongo y se secretan en menor cantidad al medio de cultivo. Adicionalmente, los resultados arrojados en la presente investigación, en lo referente a ácidos grasos, son similares con lo reportado por Wang et al. (2014), quienes determinaron, en extractos de cloroformo/metanol de cuerpos fructíferos de Xylaria euglosa, la presencia de compuestos de baja polaridad, como ácidos grasos de cadena larga.
Con base en el análisis anterior y la similitud del perfil cromatográfico en CCD de los extractos de los diferentes aislamientos, se puede inferir que la elevada actividad antagonista que presentó el aislamiento Xylaria sp. CH03 puede ser debida a la presencia de los ácidos grasos, ya que los ácidos palmítico, linoleico y esteárico se han reportado con actividad antimicrobiana y antifúngica (Paterson, 2006; Wang et al., 2014). Esta última, en el caso del palmítico, específicamente contra Fusarium oxysporum (Liu et al., 2008), de los ácidos linoléico y linolénico contra Rhizoctonia solani, Pythium ultimum, Pyrenophora avenae y Crinipellis perniciosa (Walters et al., 2004) y del ácido oléico contra Colletotrichum fulcatum, Fusarium oxysporum y Rhizoctonia solani (Abubacker y Devi, 2014). Sin embargo, cabe anotar que los resultados aquí presentados corresponden a una caracterización preliminar del perfil metabolómico de los aislamientos estudiados y, por lo tanto, es indispensable continuar con el estudio y la identificación inequívoca de los compuestos encontrados, así como evaluar sus diferentes actividades biológicas.
Tarman et al. (2011) indican que extractos en EtOAc de medio de cultivo de Xylaria sp. exhiben actividades citotóxicas y antibacteriales considerables, pero actividades antifúngicas bajas en concentraciones de 100 a 400 ug por punto de aplicación. Sin embargo, en el presente estudio se utilizó un extracto metánolico que presenta mayor polaridad que el acetato de etilo y por lo tanto extrae compuestos con polaridades distintas, que pueden ser estructuralmente diferentes y que, como en este caso, exhiben propiedades antifúngicas mayores. Por otro lado, Pandey (2012) reporta un PICM de 0 % para los hongos F. oxysporum y Colletotrichum capsici en presencia de medio de cultivo filtrado de Xylaria sp. a concentraciones de 50 %, lo cual no corresponde a lo reportado en el presente estudio, en el que se encontró inhibición desde el 1%, inhibición que dependió del hongo fitopatógeno evaluado. Abdel-Motaal et al. (2010) reportan mayor actividad antifúngica de los compuestos secretados al medio de hongos endófitos contra algunos fitopatógenos; sin embargo, esto es contrario a los resultados aquí presentados, donde los compuestos con actividad antifúngica se encuentran presentes principalmente en la biomasa y posiblemente corresponden a ácidos grasos. Se ha reportado que la secreción al medio de cultivo de los compuestos con actividad antifúngica es inducida por la presencia del hongo fitopatógeno (Ramadan et al., 2015) y por tanto, en ausencia del mismo, estos se mantienen en mayor proporción en la fase intracelular del organismo, como se evidenció en el presente estudio.
CONCLUSIONES
De la investigación realizada sobre hongos macromicetos nativos pertenecientes a los géneros Xylaria, Agrocybe, Psilocybe y Stereum se determinó que el crecimiento de estos hongos y su interacción con los hongos fitopatógenos depende del medio de cultivo y de las cepas utilizadas, lo que indica una variabilidad metabólica y un modo de regulación biológica propia de cada organismo. El hongo Xylaria sp. CH3 cultivado en PDB mostró tanto la mayor producción de biomasa como la mayor actividad antagonista para los fitopatógenos F. oxysporum, Colletotrichum sp. y M. roreri, acción que podría ser atribuida a la presencia, dentro de los metabolitos biosintetizados por este hongo, de los ácidos grasos, compuestos ya reportados con actividad antifúngica, posicionándolo como un potencial biocontrolador de enfermedades de cultivos de interés agrícola. Sin embargo, es necesario separar y purificar cada uno de estos compuestos y evaluar su potencial antifúngico mediante pruebas in vivo.



















