INTRODUCCIÓN
Las salinas son ecosistemas con alta importancia en conservación ya que, además de proveer muchos de los principales servicios ecosistémicos asociados a los humedales, suelen presentar una biodiversidad única y diferenciada de otros ambientes acuáticos (Sánchez-Fernández et al., 2007). Estas salinas suelen presentar valores de conductividad y salinidad elevados debido a la presencia de iones de Na+, K+, Ca+2 y Mg+2 en el agua y en el suelo, los cuales se combinan constituyendo compuestos como sulfatos, carbonatos y cloruros que suelen concentrarse producto de la evaporación, infiltración de aguas subterráneas salobres o marinas, y procesos antrópicos como la salinización (Federal Geographic Data Committee [FGDC], 2013; Herbert et al., 2015).
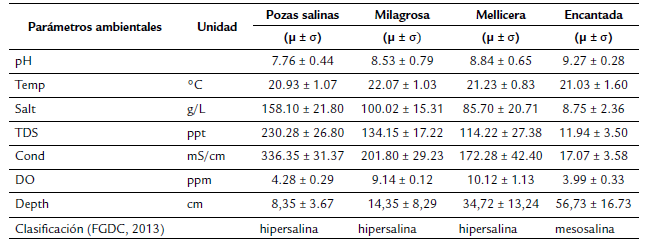
Las aguas superficiales de los ríos alimentan de manera indirecta a los humedales costeros y salinas a través del flujo subterráneo producido mayormente en épocas de verano, aunque también hay un pequeño aporte de las precipitaciones atmosféricas, del aerosol marino y en algunos casos de la agricultura extensiva que suele desarrollarse en zonas aledañas a estos ambientes acuáticos (Maldonado et al., 1943; Young, 1998; Verones et al., 2012). Cuando el caudal de los ríos decrece, la infiltración es menor disminuyendo el nivel del agua, aunque también la evaporación condiciona estas pérdidas (Chacón, 1980a). Estas distintas fuentes aluviales, eólicas, marinas y antrópicas recargan los humedales y salinas costeras de manera diferente, presentándose como resultado cuerpos de agua con parámetros fisicoquímicos y nivel del agua variable; estos sistemas lénticos costeros en el país poseen en promedio entre los 0 - 350 g/L de salinidad y un rango de pH entre 6,0 - 9,5 (Montoya et al., 1995: Aguilar y Montoya, 2001). Para caracterizar las variaciones de la salinidad en sistemas lénticos continentales, Cowardin, Carter, Golet y LaRoe propusieron un sistema de clasificación, dividiéndolas en oligosalinas (0,5 - 5 g/L), mesosalinas (5 -18 g/L), polisalinas (18 - 30 g/L), eusalinas (30 - 40 g/L) e hipersalinas (> 40 g/L), clasificación que es muy utilizada en la actualidad (FGDC, 2013).
Los humedales, lagos y lagunas suelen presentar un patrón en la comunidad de macroinvertebrados acuáticos, donde la mayoría de los taxones están incluidos dentro de los órdenes Diptera, Hemiptera, Coleoptera y Odonata, estos órdenes suelen dominar en riqueza e inclusive abundancia (Batzer, 2013; Batzer y Ruhí, 2013). En el caso específico de los ambientes lénticos salinos, la comunidad suele ser similar al patrón anterior, pero con dominancia de ciertas familias de crustáceos (Artemiidae), dípteros (principalmente Ephydridae, Chironomidae, Ceratopogonidae y Syrphidae), odonatos (Aeshnidae, Coenagrionidae, Libellulidae), hemípteros (Corixidae) y coleópteros (Hydrophilidae y Dytiscidae); las relaciones de dominancia de una familia sobre otra pueden variar conforme la salinidad aumenta (Hammer, 1986; Herbst, 2001; Golovatyuk y Shitikov, 2016).
En el país existe poca información sobre lagunas y humedales salinos costeros, también falta desarrollar protocolos de monitoreo biológico y estandarización de métodos de muestreo en ambientes lénticos, estas carencias son resaltadas por la Estrategia Nacional de Humedales del Ministerio del Ambiente [MINAM] (2015). En el presente estudio se eligieron las Salinas de Chilca debido a que carecen de estudios respecto a la composición, estructura y variación espacial de macroinvertebrados acuáticos, por lo que se desea aportar información ecológica importante que sería utilizada para planes de gestión, conservación y evaluación de impacto ambiental de lagunas costeras salinas. En los últimos años se observa una preocupación por conservar y evitar la reducción de los humedales costeros a través de la creación de áreas de conservación, como el ACR Humedales de Ventanilla y el ACR Albuferas de Medio Mundo, dejando de lado lagunas salinas y humedales de tamaño pequeño como los evaluados en el presente estudio, de los cuales se desconoce su diversidad biológica y su potencial importancia como puntos de conectividad del gran corredor costero peruano. Por lo anterior, el objetivo del presente estudio fue realizar un inventario de los macroinvertebrados acuáticos en las lagunas de las Salinas de Chilca y determinar la influencia de las variables ambientales en los cambios de su estructura comunitaria.
MATERIALES Y MÉTODOS
Área de estudio
Las lagunas que comprenden las Salinas de Chilca se encuentran dentro de la Zona de Vida Desierto Subtropical (d-ST) (Oficina Nacional de Evaluación de Recursos Naturales [ONERN], 1976; Tarazona et al., 2017), localizadas al sur de la ciudad de Lima, en el distrito de Chilca (11° 35" 27''- 11° 35' 46'' S y 77° 15' 59'' - 77° 16' 17'' W). Estas lagunas han sido catalogadas como medicinales por algunos autores (Pronaturaleza, 2010; Chacón, 1980a), y sus aguas sódico-cloruradas fuertes han demostrado una acción bactericida sobre ciertos patógenos, ejerciendo una acción estimulante en el organismo y activando las defensas en la lucha contra enfermedades infecciosas en las personas que se bañan en este tipo de aguas (Chacón, 1980b; Zapata, 1971). Debido a lo anterior, en los últimos años existe un interés creciente de la población y autoridades para valorizar estas lagunas como un eje turístico, ya que los lugareños y sus visitantes, que suelen llegar cada año y principalmente en los meses de verano, aseguran que tomar baños en sus lodos es un buen tratamiento para males óseos y dermatológicos; esta terapia natural es conocida como fangoterapia (Instituto Geológico, Minero y Metalúrgico [INGEMMEET], 2021).
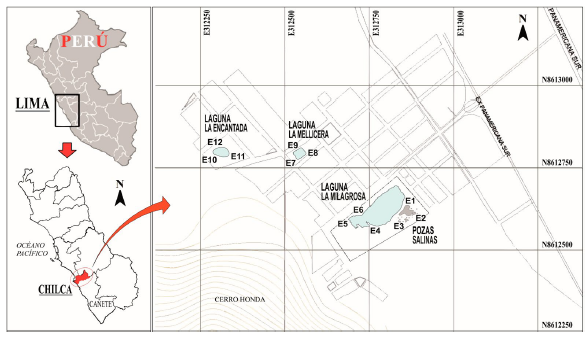
Figura 1 Mapa de ubicación mostrando las doce estaciones de muestreo en las Salinas de Chilca (Lima, Perú).
En el presente trabajo se estudiaron cuatro ambientes acuáticos: La Milagrosa (sus pozas salinas y el cuerpo principal de la laguna), La Mellicera y La Encantada. Las pozas salinas se encuentran en el sector sur de la Laguna La Milagrosa y constan de charcos poco profundos con depósitos de sal en casi toda su extensión debido probablemente a la infiltración y posterior evaporación de agua salobre, sus aguas presentan una tonalidad rosácea por la presencia dominante de Dunaliella salina y Dunaliella viridis (Montoya y Olivera, 1993; Montoya, 2009). La laguna "La Milagrosa" o también llamada Santa Cruz de las Salinas, es el ambiente más extenso, se compone de un cuerpo de agua principal de aproximadamente 200 m de largo por 50 m de ancho, con una profundidad máxima de 0,90 m (Chacón, 1980a), presenta un color verdoso muy característico debido a la presencia dominante de Picocystis salinarum y de Chlorella peruviana (Tarazona et al., 2017). La laguna Mellicera tiene una forma subcuadrangular, producto de modificaciones antrópicas, ocupa un área aproximada de 784 m2 y una profundidad máxima de un metro (Maldonado, 1943, Tarazona et al., 2017), su coloración también es similar al de la laguna Milagrosa debido a la presencia dominante de las algas antes mencionadas. La laguna Encantada presenta una forma irregular, y al igual que en las demás lagunas presenta escalinatas para el ingreso de los bañistas, tiene una profundidad máxima de 0,50 metros (Chacón, 1980a); también se ha reportado, para las lagunas mencionadas, la presencia de cianobacterias del género Oscillatoria, Aphanocapsa, Phormidium, entre otros (Maldonado, 1943). Según la clasificación de humedales propuesta por la convención RAMSAR, las Salinas de Chilca pertenecen al tipo Humedal Marino/Costero, código J que corresponde a lagunas costeras salobres/salinas (Grobicki et al., 2016).
Respecto a la flora de las Salinas de Chilca, se observó en el sitio de estudio a Distichlis spicata, Sesuvium portulacastrum, Sarcocornia neii, Paspalidium geminatum, Schoenoplectus americanus, Typha sp. entre otras. Muchas especies de la vegetación característica de las Salinas de Chilca también se pueden encontrar en el humedal vecino de Puerto Viejo y en otros humedales costeros de Perú (La Torre y Aponte, 2009; Pronaturaleza, 2010). En la ciudad de Chilca, se pueden encontrar zonas con cultivos de camote, tomate, higo, granada, eucalipto y gramíneas (Pronaturaleza, 2010).
Se realizaron cuatro campañas de colecta en las Salinas de Chilca que incluyeron los meses de mayor y menor caudal de los ríos costeros: enero, abril, julio y setiembre de 2018. Se establecieron 12 estaciones de muestreo, tres estaciones por cada ambiente léntico: pozas salinas (E1, E2 y E3) y lagunas La Milagrosa (E4, E5 y E6), La Mellicera (E7, E8 y E9) y La Encantada (E10, E11 y E12) (Fig. 1).
Colecta, procesamiento e identificación de macroinvertebrados
Para la colecta de los organismos se utilizó una red tipo D con abertura de malla de 500 µm. Se sumergió la red en la orilla y se realizaron diez desplazamientos rápidos a manera de barridos en dos secciones de un metro, en un área de 0,3 m2 cada una (Domínguez y Fernández, 2009), obteniéndose una muestra compuesta en cada una de las estaciones de colecta. La intención de los desplazamientos rápidos fue crear una corriente circular en la cual los organismos queden atrapados; luego se levantó rápidamente la red para evitar su huida. Se colectaron 12 muestras compuestas por cada campaña de muestreo, totalizando 48 muestras, las cuales fueron depositadas en frascos plásticos y fijadas con alcohol al 96 %. En cada estación se registró los siguientes parámetros fisicoquímicos del agua: pH, conductividad eléctrica, sólidos totales disueltos, oxígeno disuelto y salinidad; además, con la ayuda de una varilla marcada en centímetros se evaluó la profundidad del punto de muestreo a un metro de la orilla.
En el laboratorio, las muestras de macroinvertebrados fueron lavadas en un tamiz de 500 µm para eliminar detrito, sedimento fino y restos vegetales. Luego los organismos fueron separados por categorías taxonómicas y conservados en alcohol al 96 % en viales y frascos de plástico. La identificación taxonómica se realizó hasta el nivel taxonómico de género en lo posible. Para la identificación se usaron las claves de Hamada et al. (2018); Domínguez y Fernández (2009), Merritt et al. (2008), Prat et al. (2011), entre otras. Para identificar algunas larvas de Diptera se optó por criarlas en el laboratorio hasta que emerja el adulto y así obtener una identificación más precisa a partir de éste. El material identificado fue depositado en la colección de macroinvertebrados del Laboratorio de Invertebrados Acuáticos de la Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos.
Análisis de los datos
Para calcular la riqueza se contabilizó el número total de taxones identificados y para la abundancia se consideró el número de organismos por cada taxón identificado (Moreno, 2001). Se realizó un análisis de componentes principales (ACP) que relacionó a las estaciones de las lagunas estudiadas con los parámetros abióticos evaluados. Luego, para los siguientes análisis estadísticos se consideraron las abundancias por cada estación y para cada campaña de colecta. Como los datos no se ajustaron a los supuestos de normalidad se aplicaron pruebas no paramétricas (Wantzen y Rueda, 2009). Para la determinación de diferencias significativas (p< 0,05) a nivel espacial (estaciones de muestreo) se realizó el Análisis de Similitud (ANOSIM), se creó una matriz de similitud que consideró las abundancias por estación de muestreo, luego se aplicó el índice de Bray-Curtis (Herrera, 2000). Se realizó un Análisis de Porcentajes de Similitud (SIMPER) para conocer el grado de disimilitud entre estaciones de muestreo y los géneros más influyentes en los patrones comunitarios (Clarke, 1993). Para graficar los patrones espaciales de las estaciones de muestreo se utilizó la rutina de Escalamiento Multidimensional No Métrico (nMDS) del software Primer 6 (Clarke y Gorley, 2006). La asociación de los macroinvertebrados acuáticos con las variables ambientales se realizó a través de un Análisis de Correspondencia Canónica (ACC); se utilizó el software PAST 3.26 para estos análisis (Hammer et al., 2001).
RESULTADOS
Parámetros ambientales
Se observaron diferencias notorias entre las lagunas de las Salinas de Chilca, en especial en la salinidad, conductividad eléctrica y sólidos totales disueltos donde se apreciaron valores escalonados descendentes entre las lagunas, formando una gradiente de salinidad, desde los más salinos hacia los menos salinos. Los valores de pH y profundidad se diferenciaron de modo ascendente, con un pH dentro del rango alcalino y la profundidad promedio menor a un metro en todas las estaciones (Tabla 1). En el caso del oxígeno disuelto, La Milagrosa y La Mellicera destacaron por sus valores elevados en comparación con las demás lagunas. De acuerdo con la clasificación propuesta por la FGDC (2013), La Encantada se clasificaría como mesosalina, mientras que las lagunas La Mellicera, La Milagrosa y las pozas salinas serían del tipo hipersalina (Tabla 1).
Composición y riqueza
Se identificaron 42 géneros y 31 familias de macroinvertebrados, clasificados en los grupos: Ephemeroptera, Odonata, Hemiptera, Diptera, Coleoptera; Lepidoptera, ácaros, moluscos, anélidos y crustáceos (Anexo 1). El orden Diptera fue el de mayor riqueza con 20 géneros y 11 familias, siendo Chironomidae y Ephydridae las familias con mayor riqueza con cinco y cuatro géneros cada una. El orden Hemiptera presentó siete géneros en siete familias, mientras que en tercer lugar el orden Coleoptera presentó cinco géneros en tres familias, donde Hydrophilidae presentó la mayor riqueza con tres especies. Entre los macroinvertebrados no insectos, destacaron los moluscos con dos géneros, seguido de los anélidos, crustáceos e hidracáridos, todos con un solo género. De la tabla de composición y riqueza obtenida se observó que muchos géneros de macroinvertebrados presentaron mayor abundancia en zonas donde la conductividad y salinidad eran bastante elevadas (p.e. Trichocorixa, Ephydra, Neoephydra, Artemia) mientras que géneros como Heleobia, Larsia, Goeldichironomus y Buenoa se encontraron en zonas con conductividad y salinidad baja y su presencia en ambientes hipersalinos era inclusive nula (Anexo 1).
Análisis multivariado
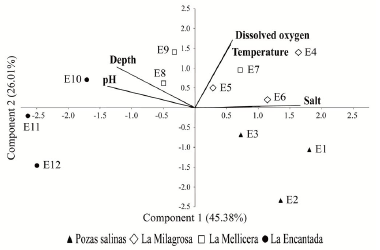
El análisis de componentes principales (ACP) indicó que la variabilidad entre los parámetros ambientales se explica en sus dos primeros componentes al 71,38 %. El primer eje (45,37 %) relacionó de manera negativa los parámetros de pH y profundidad y de manera positiva con la salinidad, mientras que el segundo eje (26,01 %) asoció a las estaciones de muestreo de manera positiva con el oxígeno disuelto y la temperatura. Las estaciones de las pozas salinas y la laguna La Encantada se ubicaron en direcciones opuestas al eje X, influenciados por sus valores diferenciados de pH, profundidad y principalmente, de salinidad (Fig. 2).
La prueba estadística ANOSIM señaló diferencias significativas a nivel espacial entre las estaciones de muestreo en las Salinas de Chilca (R = 0,675, p< 0,05) evidenciando así heterogeneidad a nivel espacial. Esta rutina fue complementada con el análisis SIMPER, que mostró mayores disimilitudes entre la laguna La Encantada versus los otros ambientes lénticos (Pozas salinas: 98,80 %, La Milagrosa: 92,01 % y La Mellicera: 89,53 %). Los géneros que más contribuyeron a estas diferencias fueron Heleobia, Larsia, Trichocorixa, Ephydra y Artemia. El Análisis de Escalamiento Multidimensional no Métrico (nMDS) con un valor de stress aceptable (2D Stress = 0,14) evidenció una gradiente de separación de las estaciones que inició desde el lado izquierdo del gráfico donde se encuentran las pozas salinas, hasta las estaciones de La Encantada al lado derecho, las cuales forman un grupo muy diferenciado de las demás estaciones (Fig. 3).
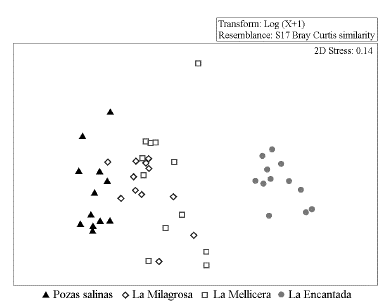
Figura 3 Análisis de escalamiento multidimensional no métrico (nMDS) en las lagunas de las Salinas de Chilca (Lima, Perú), considerando las tres estaciones por laguna y los cuatro periodos de estudio.
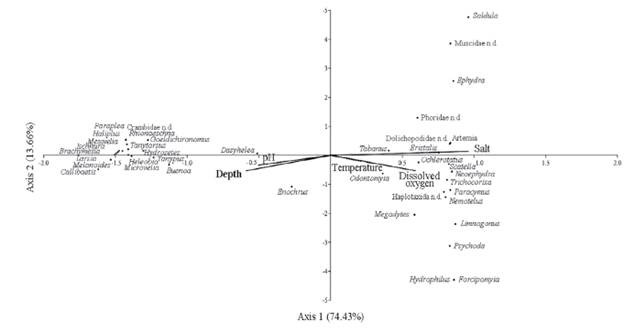
El análisis de correspondencia canónica (ACC) explicó en sus dos primeros componentes el 88,09 % de la variabilidad en las relaciones entre variables ambientales y macroinvertebrados, de los cuales fue el primer eje el que obtuvo un porcentaje muy elevado (74,43 %), y asoció a macroinvertebrados como Goeldichironomus, Buenoa, HeleobiayDasyhelea con valores bajos de salinidad y oxígeno disuelto, mientras que macroinvertebrados como Trichocorixa, Neoephydra, Ephydra y Artemia se relacionaron con ambientes rasos y valores elevados de salinidad y oxígeno disuelto (Fig. 4).
DISCUSIÓN
Los parámetros fisicoquímicos se caracterizaron por sus valores elevados y escalonados de conductividad, solidos totales disueltos y salinidad, estas aguas presentan una influencia marcada de sales de origen marino (INGEMMET, 2021), sin embargo estos valores podrían ser consecuencia de la salinización en los humedales, la cual se produce entre otras causas, por el aumento del nivel del mar, extracción del agua no controlada, modificación y retiro de plantas del terreno, actividades agrícolas y otras alteraciones de índole antropogénica (Waterkeyn et al., 2008; Herbert, 2015). Respecto a la extracción de agua subterránea en Chilca, Herrera (2003) mencionó que las aguas provenientes de la cuenca del Río Chilca en épocas de avenida son casi ausentes, por lo que la napa freática no se recargaría en su totalidad y estaría perdiendo volumen por la extracción no controlada, produciéndose una infiltración marina cada vez mayor; de hecho, muchos de los pozos explotados para uso de la población y de la agricultura en el valle de Chilca están abandonados debido al aumento de salinidad en sus aguas (INGEMMET, 2021). Gracias a la iniciativa de empresas privadas como Fenix Power, y a través de su planta desalinizadora, se abastece de agua potable a la población de Chilca (INGEMMET, 2021).
En el caso particular de las pozas salinas, las costras gruesas de sal de hasta 15 cm de grosor generadas por diagénesis y la evaporación parcial de sus aguas debido a la baja profundidad y pequeño tamaño también aportaría en el aumento de los valores antes mencionados (INGEMMET, 2021; Maldonado, 1943; Chacón, 1980a). En la lagunas hipersalinas La Milagrosa y La Mellicera, el terreno calcáreo arenoso (Aguilar y Montoya, 2001), el flujo freático mínimo producto de las aguas de la cuenca hidrológica de Chilca (Aguilar y Montoya, 2001; Chacón, 1980a), la evaporación parcial de sus aguas debido a su baja profundidad y el aerosol marino (INGEMMET, 2021) contribuirían al aumento de los niveles de conductividad, salinidad y solidos disueltos observados; cabe mencionar que la última característica también la compartiría con las pozas salinas.
En la laguna mesosalina La Encantada, los niveles de salinidad menores, podrían deberse a una mayor influencia de las aguas freáticas del valle de Chilca y las garúas de la costa, beneficiándose con un flujo de recarga mayor (Maldonado, 1943); además, en esta laguna no se observaron costras salinas en la superficie de su perímetro, como en el caso de la laguna La Milagrosa y sus pozas salinas. En el caso del oxígeno disuelto, los valores en las pozas salinas y la laguna La Encantada fueron claramente bajos. Al respecto de las pozas salinas, los valores extremos de salinidad del agua obtenidos disminuirían el nivel de saturación de oxígeno en sus aguas, y si consideramos las tres primeras lagunas estudiadas, el oxígeno disuelto tiende a disminuir a medida que la salinidad aumenta, lo cual es una relación frecuente en aguas hipersalinas (Sherwood et al., 1991). Con respecto a La Encantada y sus valores de oxígeno disuelto, en el estudio se observó una gran cantidad de algas y en especial una gran cantidad de plantas sumergidas como Chara sp., las cuales al descomponerse podrían afectar a esta laguna, reduciendo los valores de oxígeno disuelto. La medición de valores como la cobertura de la flora acuática, la cantidad de fosforo y nitrógeno en el agua, entre otros valores, serían necesarios para esclarecer si existe eutrofización o no en las lagunas de Chilca (McCormick and Laing, 2003).
En cuanto a la composición y riqueza de macroinvertebrados acuáticos, el presente trabajo es el primer inventario de macroinvertebrados acuáticos en las Salinas de Chilca, ya que hasta el momento solo presenta un pequeño listado de dípteros acuáticos de la laguna La Milagrosa y sus pozas salinas (Castillo et al., 2021). En la diversidad de la comunidad de macroinvertebrados se observa un aumento de la riqueza y la abundancia conforme la conductividad y salinidad disminuyen (Tabla 1); previos estudios de macroinvertebrados en lagunas salinas coinciden con esta relación (Hammer, 1990; Pérez et al., 2015). La salinidad se ha manifestado como un factor limitante de la riqueza de macroinvertebrados acuáticos en numerosos estudios (Williams et al., 1990; Hart y Lovvorn, 2005; Golovatyuk y Shitikov, 2016). Al comparar la riqueza de macroinvertebrados acuáticos del presente estudio con otros trabajos realizados con una metodología similar en lagunas costeras oligo a mesosalinas del Perú, encontramos que la riqueza en estos últimos ambientes es mayor, aunque también el esfuerzo de muestreo y la presencia de una mayor cobertura vegetal acuática influiría en esta relación (Peralta y Huamantinco, 2014; Castillo y Huamantinco, 2020; ).
Los órdenes Diptera, Hemiptera y Coleoptera obtuvieron los valores más altos de riqueza en el presente estudio, los cuales presentaron a las familias Chironomidae, Ephydridae, Corixidae e Hydrophilidae como dominantes en términos de riqueza y abundancia, esto coincide con previos reportes en estudios de ambientes lénticos salinos a nivel mundial, estos órdenes presentan adaptaciones a la vida acuática (respiración cutánea, sifones, branquias, entre otros), tolerancia al stress hídrico producido por las variaciones del nivel del agua ( Scheibler y Ciocco, 2011; Batzer, 2013; Peralta y Huamantinco, 2014) y capacidad osmorreguladora eficiente, lo que les permite colonizar ambientes lénticos con gradientes de conductividad y salinidad amplios (Por, 1980).
La familia Ephydridae tiene una marcada ocurrencia en ambientes hipersalinos, muchos estudios reafirman esta condición (Por, 1980; Herbst, 2001, 2006; Castillo et al., 2021) e inclusive mencionan al género Ephydra, junto con Artemia y Eristalis como los que suelen presentarse a salinidades iguales o superiores a los 140 g/L, lo que se comprobó en el presente estudio; además, el género Neoephydra también estuvo presente, en especial en las pozas salinas poco profundas donde la evaporación aumenta los valores de salinidad, en otros estudios se ha reportado la presencia de este género en hábitats inhóspitos (Mathis, 2008). Algunos representantes del género Ephydra, son capaces de soportar valores de salinidad extremos, debido, entre otros motivos, al nivel alto de osmolalidad que presenta su hemolinfa (Herbst, 1999). La familia Chironomidae tiene una alta ocurrencia y abundancia en muchos ambientes lóticos y lénticos debido a su amplia tolerancia de sus géneros, los cuales pueden presentarse en lagunas dulceacuícolas hasta ambientes hipersalinos (Shadrin et al., 2017). Sin embargo, en el presente estudio fueron la familia Corixidae (Trichocorixa sp.) y Artemiidae (Artemia sp.) las que se presentaron con una mayor abundancia en la laguna La Mellicera y La Milagrosa, estos géneros han sido reportados como tolerantes a salinidad elevada, pero su población puede decaer cuando esta se eleva más allá de su rango óptimo (Por, 1980; Tripp y Collazo, 2003); así parece ocurrir con la familia Corixidae que fue menos abundante en las lagunas que presentaron mayor salinidad (pozas salinas), mientras que la familia Artemiidae no presentó ningún individuo en la laguna menos salina (La Encantada).
En el caso de la laguna mesosalina La Encantada, fue el caracol Heleobia sp. el más abundante, mientras que en los demás cuerpos de agua por arriba de los 65 g/L disminuye drásticamente su población, muchas de las especies pertenecientes a este género no toleran las aguas hipersalinas (Ciocco, 2011); adicionalmente esta laguna presentó una cantidad de algas y plantas sumergidas, lo cual junto con el exceso de materia orgánica favorecería una mayor dominancia de organismos raspadores de perifiton como este caracol (Albertoni et al., 2001).
El ACP confirma el gradiente que relacionó a las estaciones de muestreo de manera inversa con la salinidad y de manera directa con el pH, lo cual ha sido reportado en estudios con rangos de salinidad amplios (Por, 1980; Shadrin et al., 2017). Como se mostró en el ANOSIM y el nMDS, las estaciones pertenecientes a la laguna La Encantada se agrupan y diferencian de las demás estaciones de manera marcada, esta laguna mesosalina presentó valores fisicoquímicos muy diferenciados en comparación con las otras lagunas con características hipersalinas. El exceso de salinidad supone una barrera abiótica para los macroinvertebrados. Si bien es cierto que los macroinvertebrados presentan un patrón comunitario persistente en muchas lagunas costeras debido a su tolerancia a las condiciones ambientales adversas, capacidad para colonizar distintos tipos de hábitats y adaptaciones a la vida acuática, esta composición y estructura puede variar cuando se presentan condiciones ambientales extremas (Batzer y Ruhí, 2013). El ACC confirma esta gradiente ambiental en la comunidad que se plasma gráficamente en dos grupos muy separados, principalmente por la influencia de factores abióticos como la profundidad, oxígeno disuelto y en especial por la salinidad del agua, lo que estaría excluyendo a un grupo de especies que no toleran grandes cambios en estos parámetros, los cuales conforman un nicho propio y apartado de las especies que soportan un stress abiótico extremo, estos últimos se agruparían de manera dispersa. A pesar de estas variables abióticas influyentes, no se puede dejar de mencionar que la estructura de la comunidad puede estar siendo modificada por el impacto antrópico, que en el caso de estas salinas puede ser importante ya que son consideradas lagunas medicinales y reciben afluencia de visitantes. Otros factores que pueden estar influyendo son depredación, disponibilidad de alimento, estructura del hábitat, entre otros factores (Vandermeer, 1972; Alberti et al., 2018).
Anexo 1 Composición y abundancia de macroinvertebrados acuáticos de las cuatro lagunas estudiadas en las Salinas de Chilca (Lima, Perú).
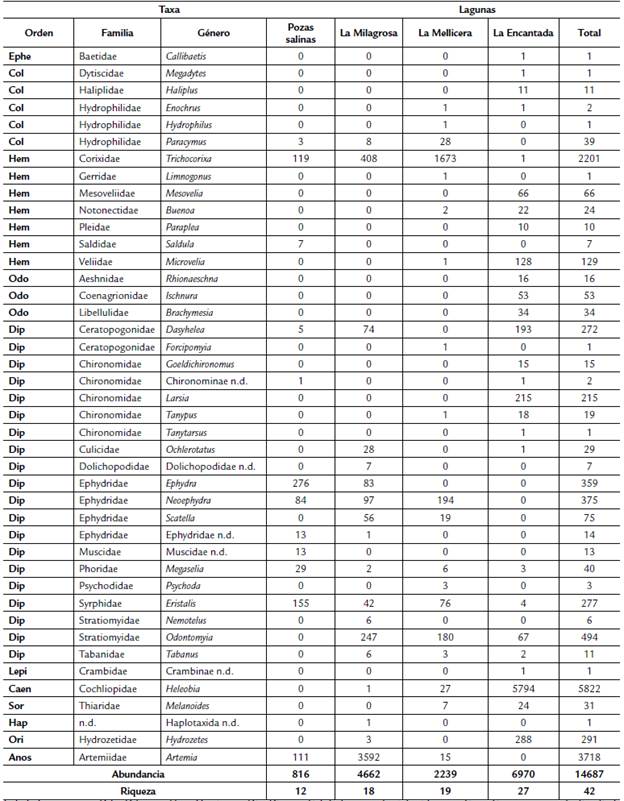
Eph: Ephemeroptera, Odo: Odonata, Hem: Hemiptera, Dip: Diptera, Col: Coleoptera, Lepi: Lepidoptera, Caen: Caenograstropoda, Sor: Sorbeo-concha, Hap: Haplotaxida, Ori: Oribatida, Anos: Anostraca, N.D.: No determinado.
CONCLUSIONES
El presente trabajo es el primer inventario de macroinvertebrados acuáticos para las Salinas de Chilca, registrándose 42 géneros en estos ambientes acuáticos meso e hipersalinos. A nivel ecológico, se corroboró que la comunidad de macroinvertebrados acuáticos respondió a cambios abióticos extremos, donde el oxígeno disuelto, la profundidad y, en especial, la salinidad, fueron los parámetros más influyentes en la variabilidad de la estructura comunitaria.