INTRODUCCIÓN
Dentro de los Phlebotominae, el género Lutzomyia es importante en salud pública ya que algunas especies son vectores de patologías como leishmaniasis, bartonelosis y arbovirus. La leishmaniasis es una enfermedad metaxénica causada por parásitos trypanosomatideos del género Leishmania Ross, 1903, la cual se presenta en tres formas: cutánea (CL), causa llagas en distintas zonas del cuerpo, mucocutánea (MCL) ataca las fosas nasales, los labios y la garganta y la forma visceral (VL), que provoca, hepatoesplenomegalia y anemia (Desjeux, 2004). La frecuencia de estas patologías es proporcional a la abundancia de algunas especies de Lutzomyia y se asocia a ambientes poco intervenidos por el ser humano. No obstante, la actividad humana favorece la adaptación y dominancia de ciertas especies de flebotomíneos y la aparición de Leishmania (Cárdenas et al., 2005; OMS, 2010; Valderrama, Tavares, y Filho, 2011). En las últimas dos décadas los registros periurbanos y urbanos de Lutzomyia aumentaron en Suramérica; sin embargo, la mayoría de estos registros pertenecen a la investigación en focos urbanos de leishmaniasis (Bejarano et al., 2002; Lambraño et al., 2012; Pasquali et al., 2019).
Colombia registra más de 150 especies de Lutzomyia, 19 halladas en ambientes periurbanos y urbanos de ciudades como Villeta, Bucaramanga, Medellín, Sincelejo, Cartagena y Neiva (Pardo et al., 1996; Sandoval et al., 1998; Gómez Agudelo et al., 2002; et al., 2013; Salomón et al., 2015; Zambrano Hernández et al., 2015; Toro-Cantillo et al., 2017). Sin embargo, estos registros siguen la tendencia regional de hallazgos en focos urbanos y peri-urbanos de leishmaniasis, excluyendo así áreas donde la enfermedad está ausente, pero que dadas sus condiciones eco-climáticas pueden albergar flebotomíneos en ambientes densamente poblados, lo cual puede representar un riesgo epidemiológico potencial (Bejarano et al., 2002). Asimismo, el conocimiento sobre la diversidad, la composición y la estructura de las comunidades de este género es escaso en estos sitios. Por otra parte, estas zonas pueden contribuir a comprender la biología y ecología urbana de Lutzomyia.
En el departamento de Córdoba los estudios están centrados en sectores rurales y en focos de leishmaniasis (Toro-Cantillo et al., 2017; Vivero et al., 2017; Carrero-Sarmiento y Hoyos-López, 2018). 15 de las 16 especies de flebotomíneos registradas son sospechosas o son vectores comprobados de enfermedades (González et al., 2018). Aunque hay estudios en áreas urbanizadas en los municipios del departamento, los esfuerzos de muestreo son insuficientes para conocer a profundidad el estado de las poblaciones de Lutzomyia en áreas urbanas selectas (González et al., 2018). Montería, capital del departamento de Córdoba, debido a su dinámica socioeconómica, su posición geográfica, sus ecosistemas y su crecimiento urbanístico, presenta gran interés eco-epidemiológico. Por lo tanto, el objetivo de este trabajo fue determinarla diversidad de Phlebotominae y especialmente del género Lutzomyia França, 1924 (Psychodidae: Phlebotominae) en la zona peri-urbana de esta ciudad.
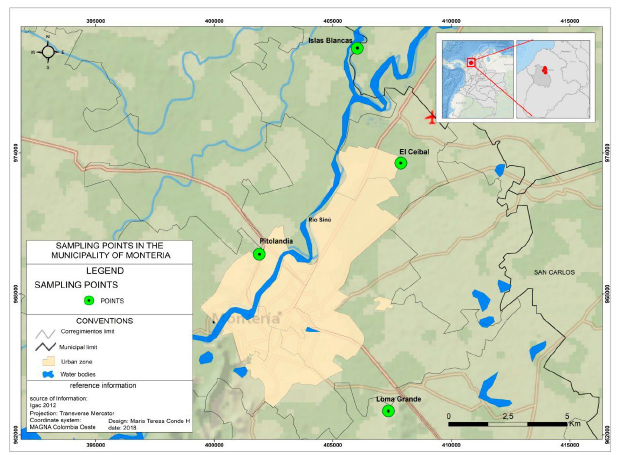
Figura 1 Mapa del área urbana y de los sitios de muestreo de flebotomíneos en la ciudad de Montería, Córdoba.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se ubicó en Montería (Córdoba, Colombia) (8° 45' 35" N, 75° 53' 8" W). Su zona de vida corresponde a bs-T (Holdridge, 1987), con temperatura promedio de 27 °C, humedad relativa del 78 %, precipitación media anual de 1262 mm3 con régimen bimodal, población aproximada de 450 mil habitantes y gran crecimiento demográfico y urbanístico. La ganadería y la agroindustria juegan un papel importante en su economía (Alcaldía de Montería, 2009; IDEAM, 2018).
Recolección de muestras
Se escogieron cuatro áreas periurbanas, teniendo en cuenta su cercanía a zonas urbanas, la presencia de casas aledañas, de vegetación relativamente densa y posibles sitios de cría y reposo (Hoyos López et al., 2013). Estas áreas fueron: la vereda Islas Blancas (08° 50' 54.4" N, 075° 51' 15.5" W) al noroeste de la ciudad, ubicada en la ribera del río Sinú; el barrio El Ceibal (08° 48' 24.2" N, 075° 50' 17.2" W) al noreste de Montería, corresponde al sitio de muestreo más urbanizado; el Vivero Pitolandia (08° 46' 17.7" N, 075° 53' 30.8" W) situado en la margen izquierda del río Sinú, al oeste de la ciudad; y el relleno sanitario Loma Grande (08° 42' 37.2" N, 75° 50' 35.8" W) al este de la ciudad (Fig. 1). Se utilizaron ocho trampas CDC (Center of Desease Control) en cada sitio por dos períodos de cuatro noches cada uno entre febrero y junio de 2018, los cuales se llevaron a cabo entre las 18:00 y las 6:00. Adicionalmente, se hizo búsqueda activa en sitios de cría y reposo (raíces de árboles, agujeros etc.) entre las 6:30 y las 9:00 en los sitios de muestreo, para abarcar especies fototróficas y no fototróficas.
Preparación e identificación taxonómica
Los individuos se llevaron al Laboratorio de Investigaciones Biomédicas de la Universidad del Sinú. Se fragmentaron el abdomen, el tórax, la cabeza y las alas para la identificación taxonómica. El material se aclaró en una solución de lactofenol (ácido láctico 1: fenol 1) por 24 horas y los individuos se identificaron usando las claves taxonómicas de Young y Duncan (1994) y Galati (2018).
Análisis de datos
Se contabilizaron los especímenes por especie, sexo, sitio y tipo de muestreo. La diversidad y estructura se estimó mediante el índice de Shannon-Wiener (H') que integra el número de especies y la representatividad de cada una de ellas. La dominancia se evaluó con el índice de Simpson y su inverso que muestra la probabilidad de que dos individuos sacados al azar de una muestra sea de una misma especie. Para el análisis estadístico se utilizó EstimateS 9.1.0 (http://viceroy.eeb.uconn.edu/estimates). Para comparar los sitios se utilizó la distancia de Bray-Curtis que expresa la disimilitud entre cada uno de los sitios estudiados en cuanto a su composición y abundancia, donde cero representa el menor grado de disimilaridad (totalmente similar) y uno es totalmente disimilar; este índice se calculó con el software InfoStat (http://www.infostat.com.ar). Se determinó la representatividad del muestreo de las comunidades mediante curvas de acumulación de especies usando por una parte el estimador no paramétrico Chao 2, que estima el número de especies esperadas considerando la relación entre el número de especies que solo aparecen en una muestra y el número de especies que aparecen en dos muestras, y por la otra el índice de completitud de Jacknife 2, que se basa en el número de especies que solo aparecen en una muestra o dos y reduce el sesgo de los valores estimados, siendo los estimadores más rigurosos para estudios de este tipo. Para estos cálculos se usó el programa EstimateS 9.1.0 (Villareal et al., 2004; Jost 2007; Colwell et al., 2012; Lou y González- Oreja, 2012).
RESULTADOS
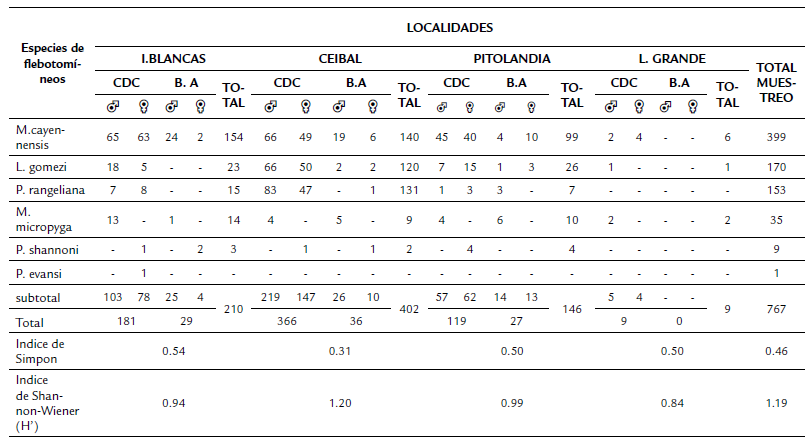
Se colectaron 890 individuos de seis especies: 452 machos y 438 hembras; 124 de estas últimas fueron grávidas o tuvieron ingestas, por lo que no se identificaron. La especie más abundante fue Micropygomyia cayennensis (Floch y Abonnenc 1941) (52,0 %), seguida por Lutzomyia gomezi (Nitzulescu 1931) (22,2 %), Pintomyia rangeliana (Ortiz 1953) (19,9%), Micropygomyia micropyga (Mangabeira 1942) (4,6 %) y Psathyromyia shannoni (Dyar 1929) (1,2 %). De Pintomyia evansi (Núñez- Tovar 1924) (0,1 %) sólo se capturó un individuo. El número de individuos por sexo, método de captura y localidad se detallan en la tabla 1.
Las especies de flebotomíneos se distribuyeron de forma homogénea. El índice de diversidad de toda la zona periurbana de Montería fue de 1,19. El sitio con el mayor índice de diversidad fue El Ceibal (H'=1,20). Pitolandia e Islas Blancas mostraron diversidades parecidas (H'=0,99 y H'= 0,94, respectivamente). Loma Grande fue el punto con menor índice de diversidad (H'=0,84). La dominancia promedio de los sitios de estudio en la zona peri-urbana de Montería fue del 46 %. Islas Blancas, Pitolandia y Loma Grande expresaron dominancias similares (54 %, 50 % y 50 %, respectivamente), mientras que El Ceibal registró una baja dominancia (32 %). La especie dominante en todas las zonas fue M. cayennensis y el sitio con mayor dominancia de esta especie (72 %) fue Islas Blancas (Tabla 1).
Los sitios más similares en su composición de flebotomíneos fueron Islas Blancas y Pitolandia; estos a su vez estuvieron más cercanos a El Ceibal. Por su parte, Loma Grande presentó la mayor disimilaridad y mostró poca relación con los demás sitios (Fig. 2).
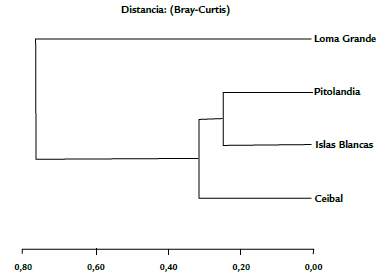
Figura 2 Disimilaridad entre los sitios de muestreo de la ciudad de Montería de acuerdo a la composición y abundancia de flebotomíneos.
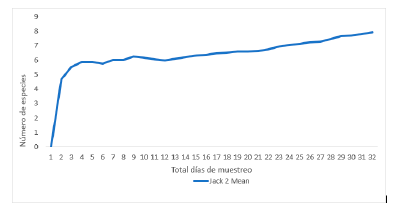
El estimador Chao 2 denotó la existencia de no más de seis especies en el área de muestreo (Fig. 3), mientras que Jacknife 2, el estimador más riguroso en cuanto a especies raras, expresó la probabilidad de encontrar 8 especies en la zona de estudio (Fig. 4).
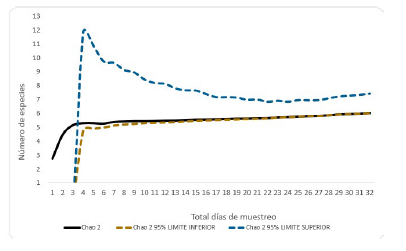
Figura 3 Curva de acumulación de especies de flebotomíneos para Montería, Córdoba, de acuerdo al estimador Chao 2
DISCUSIÓN
P. shannoni, M. micropyga y P. evansi constituyen nuevos registros para el municipio de Montería. Las especies colectadas ya se registraron en distintas áreas de todo el departamento. A pesar de ser un estudio realizado en zonas bastante antropizadas, la composición y abundancia de flebotomíneos fueron similares a las registradas en pesquisas anteriores en áreas rurales cercanas a Montería, las cuales comparten casi todas las especies. En esos estudios las especies más abundantes fueron M. cayennensis y L. gomezi, con la primera como el taxón con distribución más amplia, seguida por L. gomezi y P. rangeliana (González et al., 2018), lo cual sugiere cierta homogeneidad entre las comunidades netamente rurales y las peri-urbanas. Dicha homogeneidad podría estar aunada a la poca variabilidad de las condiciones eco-climáticas entre las áreas de estudio y a las peculiaridades propias de las especies en cuestión (Valderrama et al., 2011). Esto podría deberse a que las comunidades reaccionan de maneras similares, aun encontrándose parcial o totalmente aisladas, con lo cual exponen abundancias y dominancias parecidas en distintos sitios.
Las seis especies registradas en este estudio pueden catalogarse como resistentes a la fragmentación, ya que poseen ciclos de vida cortos, alta fecundidad, resistencia a condiciones ambientales estresantes y amplia distribución. Además, tienen la capacidad de explotar distintas fuentes alimenticias, son antropofílicas y en algunas especies existe una alta variabilidad genética, características que podrían facilitar su supervivencia en áreas peri-urbanas y urbanas (Hernández Ramírez, 2014).
El registro alimenticio de M. cayennensis es amplio. Se ha demostrado que consume sangre humana, de aves y de reptiles, entre otras fuentes; además, es altamente antropofílica, característica que facilita su dominancia en áreas muy antropizadas, como en el presente estudio (Montesino y Vergara, 2015; González et al., 2018). Se encuentra esparcida en Centro y Suramérica ocupando distintas áreas bioclimáticas (Young y Duncan, 1994). En Colombia se encuentra en zonas urbanas de la costa Caribe y el centro del país. Se adapta muy bien a condiciones urbanas y a áreas alteradas donde se presenten las condiciones mínimas para su supervivencia (Lambraño et al., 2012; Vivero et al., 2015; Zambrano Hernández et al., 2015). En el ámbito epidemiológico, se ha encontrado que esta especie porta promastigotes de trypanosomatideos no identificados y, más recientemente, de Leishmania panamensis en Montelibano-Córdoba (Cochero et al., 2007; González et al., 2018).
L. gomezi es posiblemente la especie con mayor colonización del medio urbano en Colombia, puesto que se ha detectado en los últimos 20 años en ciudades tanto del centro del país como de la costa Caribe, en distintos gradientes altitudinales (Sandoval et al., 2012). Es muy resistente a cambios ecológicos (Rujano et al., 2015); su plasticidad adaptativa no está dada solo por su habilidad de alimentarse de distintos mamíferos (perros, cerdos, humanos, etc.), sino que también puede deberse a su alta variabilidad genética (Cortés et al., 2009; Valderrama et al., 2014, Alemán, 2018). En Córdoba se ha evidenciado recientemente la presencia de distintos linajes de L. gomezi (Carrero-Sarmiento y Hoyos-López, 2018), lo que podría significar que en el futuro esta especie podría adaptarse a áreas urbanizadas dentro de Montería y Córdoba. Esto implica un riesgo epidemiológico potencial importante, dado su rol como vector de Leishmania panamensis y L. braziliensis. Además, fue detectada en los municipios de Lorica y Moñitos, Córdoba, asociada a L. panamensis (Feliciangeli et al., 1994; Paternina et al., 2016; González et al., 2018).
Por su parte, aunque P. rangeliana podría ocupar una amplia variedad de zonas bioclimáticas, por el momento solo se ha registrado en zonas urbanas de la costa Atlántica. Su ingesta sanguínea varía entre distintos animales, siendo medianamente antropofílica (Paternina et al., 2011; Lambraño et al., 2012). Se sugiere estudiar su genética, dado su amplio rango adaptativo, pues se supone que podría llegar a tener características similares en sus poblaciones a las expuestas anteriormente para L. gomezi (Cazorla-Perfetti, 2015). En Venezuela, P. rangeliana se encontró infectada con promastigotes parecidos a Leishmania venezuelensis (Bonfante-Garrido et al., 1999).
M. micropyga también se alimenta de diversas fuentes; además, está ampliamente distribuida en Suramérica (Young y Duncan, 1994; Paternina et al., 2016). Ha demostrado no ser afectada en gran medida por los cambios en las condiciones climáticas (Cazorla-Perfetti, 2015). En Colombia sólo se ha encontrado en zonas urbanas de Sincelejo y en el presente estudio. Esta especie también ha mostrado una importante variabilidad genética en poblaciones distantes del país (Posada López, 2016) y se ha reportado infectada con trypanosomatídeos (Paternina et al., 2011).
P. shannoni es una de las especies con mayor distribución en el continente y se encuentra en Norte, Centro y Suramérica. En Colombia podría estar ampliamente distribuida, aunque solo se ha hallado en ambientes peri-urbanos de Sincelejo y en este trabajo (Young y Duncan, 1994; Lambraño et al., 2012), donde a pesar de su baja abundancia mostró estar bien distribuida. Es antropofílica y resistente a los cambios ambientales. El ciclo de vida medio de esta especie es de 54 días aproximadamente y una hembra puede ovipositar 23 huevos en promedio (Ferro et al., 1998). P. shannoni ha reportado alta variabilidad genética (Florin, 2006); sin embargo, es necesario dilucidar si sus poblaciones dentro de Colombia son genéticamente distantes. Su preferencia alimentaria también es amplia (Contreras, 2013; Cazorla-Perfetti, 2015; Posada López, 2016). Epidemiológicamente es muy importante, debido a que porta tres especies de Leishmania: L. panamensis y L, mexicana (agentes transmisores de leishmaniasis cutánea) y L. infantum (causante de leishmaniasis visceral). También está incriminada en la transmisión de estomatitis vesicular en Estados Unidos (Comer et al., 1994).
Aunque solo se encontró un espécimen de P. evansi en todo el estudio, su presencia reviste importancia debido a su capacidad como vector de L. infantum (Bejarano et al., 2002). Esta especie ya se ha documentado en ambientes urbanos de la costa Caribe colombiana con grandes abundancias (Fuya et al., 2011; Lambraño et al., 2012), lo que ratifica su amplia capacidad adaptativa. Su ciclo de vida es corto, de aproximadamente 40 días y pone cerca de 30 huevos (Paternina 2012; Montesino y Vergara 2015; Paternina et al., 2016). Sus fuentes alimenticias son muy variadas y es muy adaptable a distintas condiciones (Bejarano et al., 2009). Aunque hay estudios sobre su variabilidad genética comparando poblaciones urbanas y rurales del Caribe colombiano, los resultados revelan que las poblaciones son genéticamente similares; sin embargo, entre Centro y Suramérica son genéticamente distantes. La especie es altamente antropofílica y su distribución también es amplia en toda Colombia, al parecer, sus poblaciones son resistentes a cambios climatológicos de precipitación y temperatura (Lambraño et al., 2012). En el departamento de Córdoba habita principalmente en la zona costanera y en las sabanas al norte y nororiente.
En general, la composición yla similaridad de flebotomíneos fueron parecidas entre los sitios de muestreo. Los índices de diversidad fueron homogéneos (tuvieron valores cercanos entre localidades). Esto implicaría que las comunidades de estos dípteros en Montería no se ven afectadas de manera significativa por la actividad antropogénica y que presentan una buena adaptación a ecosistemas rurales y peri-urbanos por igual. Lo anterior se explica a partir de la resistencia y adaptabilidad de las especies en cuestión. Empero, ni la distancia entre las localidades ni la cercanía a áreas muy urbanizadas parecieron tener un efecto significativo sobre la composición, dominancia y estructura de las comunidades de flebotomíneos, puesto que sitios distantes entre sí (Pitolandia e Islas Blancas) y con distinto grado de cercanía al área urbana (Fig. 1) fueron muy semejantes en sus índices de diversidad.
La similitud entre El Ceibal, Islas Blancas y Pitolandia (Fig. 2) podría deberse a las características edáficas y de vegetación parecidas entre estos tres puntos. Sus suelos tienen un drenaje aceptable y una buena disponibilidad de nutrientes y de materia orgánica. Por el contrario, Loma Grande exhibe un tipo de suelo distinto, más rocoso y escarpado, con menor cantidad de materia orgánica (Gobernacion de Córdoba, 2014). Vivero et al. (2015) y Gómez et al. (2013) demostraron la importancia de las características edáficas y de vegetación sobre el desarrollo larval de Lutzomyia, y cómo estas condiciones definen la composición y estructura de las comunidades de flebotomíneos. Lo anterior se refleja en los índices de diversidad y dominancia en Pitolandia y en Islas Blancas. Es posible que el mayor índice de diversidad en El Ceibal esté ligado a una especie vegetal en particular Pithecellobium dulce ((Roxb.) Benth. 1844), y a la presencia de distintos animales domésticos. Tanto las trampas de luz como la búsqueda activa en estas plantas fueron muy efectivas y aportaron más del 50 % del total de todo el muestreo en todas las localidades. Vivero et al. (2015) proporcionaron evidencia sobre cómo las características de P. dulce y otras plantas favorecen al género Lutzomyia. No obstante, y aunque en Loma Grande existe esta planta, así como refugios y posibles sitios de cría similares a los demás sitios, la composición y la abundancia fueron menores, lo que evidencia la posible importancia del suelo para estos dípteros. Los altos índices de dominancia debidos a M. cayennensis parecen indicar que esta especie se ve favorecida por las condiciones del terreno.
La curva de especies estimadas y el índice de Chao 2 (Fig. 3) revelaron que se alcanzó una buena representatividad de especies en el área de estudio, producto de un muestreo riguroso y exhaustivo. No obstante, el estimador de Jacknife 2 sugiere que con un muestreo aún más riguroso se podrían hallar quizás tres especies más (Fig. 4). Tentativamente, esas especies podrían ser Micropygomyia trinidadensis (Newstead 1922), Psychodopygus panamensis (Shannon 1926) y Evandromyia dubitans (Sherlock 1962). M. trinidadensis ya se ha encontrado en ambientes urbanos de Montería en muestreos no publicados; las otras dos especies se han reportado también en ambientes urbanos con características ecológicas similares a las de Montería y de sus áreas cercanas. La captura de más especies pudo estar limitada por los métodos de colecta; el uso de técnicas como las trampas Shannon y Disney y la búsqueda de inmaduros pudieron haber brindado un inventario mucho más completo (Lambraño et al., 2012; García, 2018).
CONCLUSIONES
La diversidad de flebotomíneos de la zona peri-urbana de Montería estuvo representada por especies generalistas, de amplio rango adaptativo. La riqueza de especies no parece estar afectada por la fragmentación del hábitat ni por las barreras geográficas, sino más bien por las características propias de los taxones encontrados. La presencia de estas especies implica un riesgo epidemiológico potencial, por lo que se requiere hacer seguimiento a futuro sobre el desarrollo y la dinámica de estos dípteros en áreas intervenidas de la región estudiada.