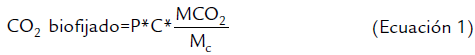INTRODUCCIÓN
En la actualidad los gases de efecto invernadero (GEI) más liberados a la atmosfera son el dióxido de carbono (CO2), el gas metano (CH4) y los óxidos de nitrógeno (NOx), de los cuales el CO2 es el de mayor impacto sobre la atmosfera alcanzando una concentración global promedio de 405±0,1 ppm en 2017 (Hartfield et al., 2018). Por ello, existen diferentes tecnologías para la fijación, secuestro y almacenamiento de CO2, siendo el método biológico uno de los más atractivos gracias a la cualidad que poseen las plantas de transformar el CO2 en materia orgánica a través del proceso de fotosíntesis (Razzak et al., 2017). Los organismos más relevantes para la biofijación de CO2 mediante la fotosíntesis son las plantas terrestres, las macroalgas y microalgas, estas últimas representan solo el 1 % de la biomasa viva y se clasifican en procariotas (cianobacterias) y eucariotas (microalgas), y se caracterizan por tolerar niveles altos de CO2 (Seth y Wangikar, 2015).
Las microalgas son organismos unicelulares fotosintéticos con el potencial de transformar la energía solar en biomasa, fijar hasta 20 veces más CO2 que las plantas terrestres y producir elementos de alto valor como lípidos, proteínas y ácidos grasos poliinsaturados (Suparmaniam et al., 2019). Estos microorganismos son capaces de crecer en distintos ambientes y climas, ya que una de sus grandes ventajas es el no requerir tierras fértiles ni agua potable para su desarrollo, además de poder crecer en aguas residuales o contaminadas (Acién-Fernandez et al., 2017). Las microalgas poseen altas tasas de crecimiento que contribuyen a una elevada productividad de biomasa y su actividad fotosintética es apreciablemente más eficiente para la fijación del CO2 en comparación con cultivos como la caña de azúcar y la palma de aceite (Benedetti et al., 2018).
El cultivo de las microalgas posee variables que deben ser consideradas ya que podrían afectar su desarrollo, por tanto, cada especie tiene sus propias condiciones ideales de cultivo que dependen de su sitio de origen, como la intensidad de luz y la temperatura los cuales son factores determinantes para el crecimiento (Tessarolli et al., 2017). Los nutrientes más importantes para el adecuado desarrollo de las microalgas son en primer lugar el carbono, obtenido principalmente del CO2 atmosférico (Walter et al., 2011), el nitrógeno, que afecta en la síntesis de proteína, ácidos nucleicos y clorofila, así como la productividad de lípidos (Menegol et al., 2017). Aunque el contenido de fosforo en las microalgas no es mayor al 1 %, un medio de cultivo sin la presencia adecuada de este nutriente provocaría serias repercusiones en el desarrollo ya que es esencial en la transferencia de energía, en la constitución de fosfolípidos, nucleótidos y la constitución del ácido nucleico (Guerra- Vieira et al., 2012).
La biotecnología de las microalgas sugiere que el alto potencial de biofijación de CO2 de las mismas podría ser de utilidad para controlar las emisiones de CO2 por actividades antropogénicas, debido a su alta capacidad fotosintética (Moraes et al., 2018). La concentración de CO2 en el aire influye directamente en el crecimiento de las microalgas, cuanto más alta sea la concentración mayor será el crecimiento, sin embargo, cada especie tiene un límite máximo que puede tolerar en el cual se produce una disminución en el crecimiento (Gatamaneni et al., 2018). La presente investigación analizó las siguientes hipótesis: I) Existen diferencias entre la capacidad biofijadora de CO2 en las especies de microalgas y II) El potencial genético de las microalgas les permite biofijar contenidos de CO2 mayores a los presentes a nivel ambiental, como por ejemplo las emisiones que se presentan en las industrias. El objetivo de esta investigación fue evaluar la capacidad de biofijación de CO2 de las especies de microalgas Chlorella vulgaris y Scenedesmus obliquus mediante un sistema de cultivo en fotobiorreactores de bajo costo en condiciones controladas, como piloto para el control de las emisiones de fuentes fijas de GEI.
MATERIALES Y MÉTODOS
Localización del estudio
La investigación se realizó en las instalaciones de la Universidad Nacional Abierta y a Distancia CEAD - Palmira en el departamento del Valle del Cauca, Colombia. Los análisis de peso seco se realizaron en las instalaciones del laboratorio ambiental de la Corporación Autónoma Regional del Valle del Cauca - CVC.
Microalgas empleadas y preparación de medios para cultivo
Como especies experimentales se emplearon las dos microalgas C. vulgaris CV-2714A y S. obliquus SOB-001 proporcionadas por la empresa NUTRE S.A.S ubicada en Cumaral, Meta - Colombia.
Con base en la metodología planteada por Ammar (2016), los medios para cultivo empleados en los ensayos de crecimiento y biofijación de CO2 se elaboraron a partir de los fertilizantes solubles: TODO EN UNO, 42-0-0 (SUPERABONO S.A.S., Colombia), 1,08 g.L-1; FOSFACEL 800, 20-53-0 (Cosmoagro S.A., Colombia), 0,94 g.L-1; Nitrato de potasio, 13-0-44 (Microfertisa S.A., Colombia), 1,16 g.L-1, para el medio de cultivo de S. obliquus se reemplazó el fertilizante TODO EN UNO por Nitrax-S, 28-4-0-6 (YARA, Colombia), 1,64 g.L-1.
Los medios para cultivo se elaboraron con agua potabilizada de acueducto y fertilizantes solubles de uso comercial con el propósito de reproducir situaciones que se pueden presentar a una escala mayor. Para la desinfección del agua del medio para cultivo se adicionó 1 ml.L-1 de hipoclorito de sodio al 5 % y se dejó actuar por 24 horas, transcurrido este tiempo se adicionó 0,25 g.L-1 de Tiosulfato de sodio marca Merck para neutralizar el cloro. Los nutrientes se adicionaron uno a uno y se disolvieron con agitación, posteriormente se filtró por vacío para la remoción de las partículas no disueltas, por último, se expuso el medio para cultivo a una fuente de luz ultravioleta procedente de una lámpara germicida de 15 W marca LUMEK por un periodo de cuatro horas.
Sistema y condiciones de cultivo
Los ensayos de crecimiento para C. vulgaris y S. obliquus se realizaron dentro de una cámara de cultivo acondicionada con un ventilador extractor, una lámpara fluorescente, un temporizador programable para el control del fotoperiodo y un temporizador cíclico para el control de la dosificación de aire y CO2 (Figura 1). La luz del fotoperiodo se suministró mediante una lámpara de luz fluorescente blanca de la marca SYLVANIA de 54 W y una intensidad lumínica de 4400 lm. Las dimensiones internas de la cámara fueron las siguientes: largo (130 cm), fondo (30 cm) y alto (50 cm). Para los fotobiorreactores se usaron botellas PET sin filtro UV con capacidad de 4 L, de cada especie se sembraron tres replicas con un volumen de 3,8 L de medio de cultivo. Los fotobiorreactores se acoplaron a un equipo de dosificación automático, con el que se alternó la dosis de aire a un caudal de 0,7 L.min-1 y el CO2 al 87,65 % a un caudal de 0,15 L.min-1 con base en el método planteado por Razzak et al. (2017), la dosis de CO2 se suspendió durante la fase oscura del fotoperiodo.

Figura 1 Montaje experimental a escala laboratorio. a) Línea de distribución de aire y CO2. b) Cilindro de CO2 a una concentración del 87,65 %. c) Temporizador para la dosificación de CO2. d) Conjunto de fotobiorreactores antes del inoculo inicial. e) Conjunto de fotobiorreactores con 5 días de cultivo.
Para los ensayos de crecimiento se emplearon tres dosis de CO2, el tiempo de cultivo en cada ensayo fue de cinco días con fotoperiodos 12:12 h con base en la metodología utilizada por Zhao et al. (2011). En la dosis D1 se suministraron 0,36 g.dia-1 de CO2 provenientes de la inyección de aire atmosférico únicamente, en la D2 se suministraron 11,44 g.día-1 de CO2 dosificados por intervalos cada 30 minutos durante las 12 horas de luz, finalmente en la D3 se suministraron 22,62 g.día-1 dosificados por intervalos cada 15 minutos durante las 12 horas de luz. La temperatura al interior de la cámara de cultivo presentó variaciones entre los 26 °C min y los 31 °C máx.
Cálculo de la productividad de biomasa y biofijación del CO2
El cálculo de la productividad de biomasa se realizó mediante la metodología del peso seco, cada 24 horas se filtraron 10 mL de muestra por medio de un filtro con un diámetro de poro de 1,2 µm (Axiva G3/3F, Sonipat Haryana, India), previamente secado en un horno Binder WTB (New York, Estado Unidos). La filtración de la muestra se hizo por vacío y seguidamente se introdujo en el horno de secado a 105 °C durante seis horas. El resultado del peso seco se obtuvo de la diferencia entre el peso final e inicial divido entre el volumen de muestra filtrada (Suzuki et al. 2019), el pesaje de los filtros se realizó con balanza analítica (Mettler Toledo AL204, Ohio, Estado Unidos).
El cálculo de la biofijación de CO2 a partir de la biomasa producida se realizó por medio de la ecuación uno, basado en la metodología utilizada por Fan et al. (2015).
Donde P corresponde al peso de la biomasa producida (base seca), C al porcentaje total de carbono de la especie de microalga, MCO2 es el peso molecular del CO2 y Mc el peso molecular del carbono.
El cálculo del porcentaje de remoción del CO2 por el sistema de fotobiorreactores se realizó con base en la metodología propuesta por Pirkarami y Olaya (2017) sobre la base del CO2 biofijado en g.L-1 pormedio de la ecuación dos.
Donde Ci es el CO2 de entrada al fotobiorreactor y Cf es el CO2 a la salida (CO2 no fijado).
La tasa de crecimiento especifica (µ max (d-1)) definida como el incremento de la concentración de biomasa en el tiempo, se calculó con base en la metodología usada por Nayak et al. (2016). mediante la ecuación tres
Donde, W 1 y W0 se refiere a la concentración final e inicial de la biomasa en g.L-1. Δt es el tiempo de cultivo en días.
El tiempo de duplicación (TD) es el tiempo necesario para lograr la duplicación de la concentración celular viable calculado en función de la tasa de crecimiento especifica mediante la ecuación cuatro, de acuerdo con lo planteado por Nayak et al. (2016).
Una vez se confirmó que los datos cumplieran con los supuestos de normalidad mediante la prueba de Shapiro Wilks y de homocedasticidad mediante pruebas de Levene para cada análisis realizado, los datos experimentales obtenidos se sometieron a un análisis de varianza y pruebas de medias de Tukey (p<0,05) mediante el software estadístico S.A.S versión 9.3, para la productividad de biomasa microalgal, y del CO2 biofijado en función de la dosis aplicada de CO2 en ambas especies.
RESULTADOS
Influencia de la dosificación de CO2 sobre la productividad de biomasa en el cultivo de microalgas.
En la Figura 2 se observó que la dosificación más adecuada de CO2 fue la establecida en la D2 (11,44 g.día-1), la cual incidió en una mayor productividad de biomasa para las especies C. vulgaris y S. obliquus, alcanzando en un periodo de cinco días de cultivo 0,485 ± 0,014 g.L-1 y 0,158 ± 0,002 g.L-1 de biomasa respectivamente. Los menores resultados fueron obtenidos en la D1 donde se dosificó únicamente aire atmosférico (0,36 g.día-1 de CO2) registrando una productividad de 0,141 ± 0,009 g.L-1 y 0,106 ± 0,002 g.L-1 de biomasa respectivamente. Igualmente, se observó que en las tres dosificaciones de CO2 realizadas en el estudio la tendencia de crecimiento es similar en ambas especies, alcanzándose una mayor productividad con una dosis de CO2 moderada. La prueba de medias de Tukey mostró diferencias significativas (p<0,05) entre cepas para las tres dosis utilizadas; los valores p correspondientes a la diferencia mínima significativa en las tres dosis fueron p = 0,0146 para D1, p = 0,0229 para D2 y p = 0,0096 para D3.
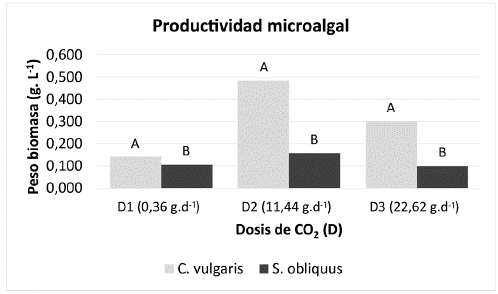
Las letras A y B en las barras indican las diferencias entre C. vulgaris y S. obliquus para cada dosis de CO2 mediante prueba de medias de Tukey (p<0,05).
Figura 2 Productividad microalgal expresada en biomasa de C. vulgaris y S. obliquus. Dosificaciones de CO2 D1, D2 y D3 en un periodo de cinco días de cultivo. Iluminación artificial (4400 lm), fotoperiodo 12:12 h, rango de temperatura 26 °C - 31 °C.
Estos resultados indican que para las especies C. vulgaris y S. obliquus, el exceso de CO2 produce una inhibición en el crecimiento, mientras que una dosificación muy baja deriva en una limitación, ambas situaciones inciden en una disminución de la productividad de biomasa. Igualmente se observa que la especie S. obliquus obtuvo menores resultados en las tres dosis aplicadas en comparación con C. vulgaris, ya que los resultados obtuvieron una diferencia altamente significativa en las tres dosis según los resultados arrojados por la prueba de medias de Tukey (p<0,05), lo cual indica que C. vulgaris tiene una mejor respuesta a dosis altas de CO2 dentro del medio de cultivo utilizado. La adecuada dosificación de CO2 en un cultivo de microalgas es un parámetro que debe ajustarse a las necesidades de cada especie, ya que todas no poseen la misma capacidad de tolerancia al CO2. En general, las microalgas pueden agruparse en dos rangos de tolerancia al CO2, las sensibles, que pueden soportar concentraciones entre el 2 -5 % y las tolerantes que soportan un rango del 5 - 20 % de concentración de CO2 (Kassim y Meng, 2017).
Tasa de biofijación de CO2
Las características productivas en cuanto a biomasa microalgal manifestadas por ambas especies en un periodo de cultivo de cinco días, muestran que la especie C. vulgaris se adaptó con mayor éxito a las diferentes dosificaciones de CO2 principalmente en las D2 y D3, alcanzando un rendimiento de productividad 1,33 veces más alto en la D1, adicionalmente fue 3,07 veces más alto en D2 y 2,57 veces en la D3 en comparación con S. obliquus. Los valores de la tasa de crecimiento específica y tiempo de duplicación obtenidos para ambas especies corroboran una mayor eficiencia en C. vulgaris a dosificaciones altas de CO2 obteniendo valores de 0,56 d1 y 1,25 d en D2 y 0,47 d1 y 1,48 d en D3 (Tabla 1).
Tabla 1 Tasa de crecimiento especifica (pmax (d-1)), tiempo de duplicación (TD(d)). Productividad de biomasa microalgal y CO2 biofijado. Periodo de cultivo de cinco días. Dosis D1 - D3. Iluminación artificial (4400 lm), fotoperiodo 12:12 h, temperatura 26 °C - 31 °C.
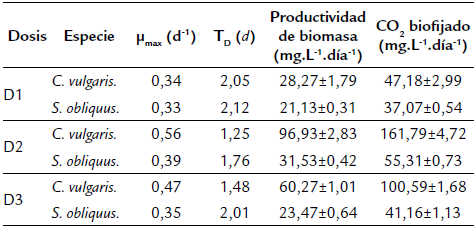
Los valores son expresados como media ± desviación estándar
La productividad de biomasa como se describe en la Tabla 1, mostró una relación directa con la cantidad de CO2 biofijado por las microalgas, indicando que a mayor cantidad de biomasa producida habrá una mayor cantidad de CO2 biofijado. Para estimar el CO2 biofijado por las microalgas se requiere del valor del porcentaje de carbono contenido en la biomasa, que en las especies de estudio se ha estimado en 45,52 % en C. vulgaris y en 47,84 % en S. obliquus (Radmann et al., 2011).
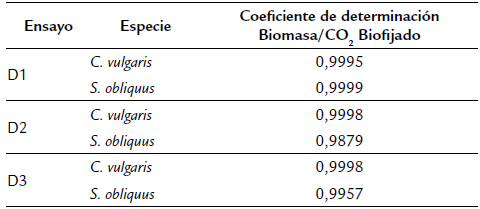
Los valores de CO2 biofijado más altos se registraron en C. vulgaris para las dosificaciones D2 y D3 donde se usó CO2 al 87,65 % inyectado directamente en el medio de cultivo, en las cuales se logró biofijar hasta 161,79 ± 4,72 mg.L-1. día-1 y 100,59 ± 1,68 mg.L-1.día-1 de CO2 respectivamente. El valor más bajo de biofijación se registró en la D1 con 47,18 ± 2,99 mg.L-1.día-1 de CO2. Debido a la baja productividad de biomasa generada por S. obliquus, la cantidad de CO2 biofijado fue inferior a la de C. vulgaris en las tres dosificaciones realizadas en las cuales se registraron valores de 37,07 ± 0,54 mg.L-1.día-1, 55,31 ± 0,73 mg.L-1.día-1 y 41,16 ± 1,13 mg.L-1.día-1 de CO2 en D1, D2 y D3 respectivamente. La prueba de medias de Tukey mostró diferencias significativas (p<0,05) entre cepas para las tres dosis utilizadas; los valores p correspondientes a la diferencia mínima significativa en las tres dosis fueron p = 0,0241 para D1, p = 0,0385 para D2 y p = 0,0163 para D3. Los coeficientes de determinación para la relación productividad de biomasa/CO2 biofijado descritos en la Tabla 2 muestran que en las tres dosificaciones existe una relación alta, lo que corrobora que el total de CO2 que es biofijado por las especies C. vulgaris y S. obliquus está vinculado directamente al total de biomasa generada.
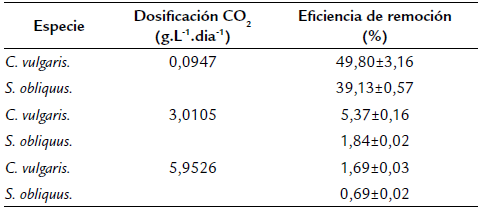
La eficiencia máxima de remoción de CO2 en el sistema de fotobiorreactores se obtuvo por ambas especies en la dosis D1, registrando valore de 49,80 ± 3,16 % en C. vulgaris y 39,13 ± 0,57 % en S. obliquus como se describe en la tabla 3. Esto contrastó con los resultados obtenidos de productividad de biomasa y biofijación de CO2, indicando que a mayores dosis de CO2 no hubo mayor eficiencia de remoción.
DISCUSIÓN
Las microalgas en general pueden tolerar concentraciones de CO2 más altas que la concentración atmosférica, motivo por el cual los cultivos de microalgas pueden ser alimentados con gases de combustión provenientes de las emisiones industriales (Arias et al., 2013). Los resultados obtenidos en el presente estudio evidenciaron que el uso de una fuente de CO2 adicional en un cultivo de microalgas favorece la productividad de la biomasa microalgal en comparación con los cultivos alimentados con aire atmosférico. Es importante tener en cuenta que la capacidad de asimilación del CO2 varía en cada especie de microalga, una concentración muy elevada de CO2 podría inhibir el crecimiento del cultivo (Arias et al., 2013). Siendo esto concordante con los resultados del presente estudio, donde la dosis de 11,44 g.día-1 de CO2 generó las mayores productividades en ambas especies. Resultados similares fueron registrados por Nayak et al. (2016) en un estudio en el cual la microalga Scenedesmus sp. cultivada a diferentes concentraciones de CO2, 0,03%, 1%, 2,5%, 5% y 10%, obtuvo producciones de 127 ± 4,1, 148 ± 4,5, 196 ± 5,1, 180 ± 4,9 y 163 ± 4,8 mg L-1D-1 respectivamente, observándose que el límite máximo de concentración de CO2 en el cual la producción de biomasa disminuye es a partir del 5%. Para el caso de C. vulgarisLiu et al. (2017) reportaron producciones de biomasa de 0,18, 0,62, 1,00, 1,12 y 0,63 g L-1 usando mezclas de aire y CO2 a concentraciones del 0,04%, 1%, 5%, 10% y 20% respectivamente, registrando una disminución significativa en la producción de biomasa en la concentración más alta de CO2. Por su parte, Chaudhary et al. (2019) evaluaron el crecimiento de C. vulgaris y S. obliquus en concentraciones de CO2 al 0,03% y 5%, los resultados de producción de biomasa en C. vulgaris fueron 17,9 mg L-1 D-1 y 94,1 mg L-1 D-1 y en S. obliquus fueron 16,7 mg L-1 D-1 y 86,5 mg L-1 D-1 respectivamente, registrando un efecto positivo de la aplicación de CO2 sobre el crecimiento de las microalgas. En general, el aumento de la concentración de CO2 en el aire de alimentación de los cultivos de microalgas incrementa notoriamente su producción de biomasa, sin embargo, cada especie tiene un potencial diferencial máximo de tolerancia de CO2, donde un incremento en la concentración reduce drásticamente la producción de biomasa y con ello la biofijación. En este estudio se observó que a pesar de que las dos especies de microalgas redujeron notablemente la producción de biomasa con la dosis más alta de CO2 empleada, estas si lograron alta biofijación en concentraciones cercanas a treinta veces la del aire atmosférico (11,44 g.día-1), pudiendo emplearse en controles de contaminación atmosférica en fuentes fijas industriales. De igual forma, la biomasa producida podría ser aprovechada en la industria cosmética, alimenticia y de biocombustibles (Ararát et al., 2020) con lo que se favorece la producción de materias primas y la mitigación de gases de efecto invernadero.
CONCLUSIONES
Se logró evidenciar una relación directa entre el total de CO2 biofijado por las especies de microalgas C. vulgaris y S. obliquus y la productividad de la biomasa microalgal. Igualmente, la especie C. vulgaris mostró una mejor adaptación a las tres dosis de CO2 ya que alcanzó la mayor producción de biomasa, y fue la dosis de 11,44 g.día-1 la que favoreció el máximo crecimiento. Así mismo, en términos generales se evidenció que tanto la falta de CO2 como el exceso del mismo, influye de forma negativa en la productividad y crecimiento de las microalgas, debido a que causa limitaciones en el crecimiento e inhibición. Por otra parte, la eficiencia de remoción de CO2 del fotobiorreactor dependió directamente de la relación entre el volumen de cultivo y la dosis de CO2, donde se pudo apreciar que a cargas altas de CO2 la eficiencia de remoción fue mínima, mientras una carga baja de CO2 como la suministrada en D1 logró remover más del 30 % de CO2 en ambas especies, en este caso se requieren de más estudios para lograr hallar una relación adecuada entre el volumen de cultivo, cantidad de CO2 suministrado y especie de microalga que permita incrementar la eficiencia en la remoción del CO2. Los resultados de esta investigación permiten identificar posibles biotecnologías enfocadas en la mitigación de los GEI, asociadas a la productividad de biomasa microalgal y metabolitos de interés industrial.