INTRODUCCIÓN
Las plantas pueden responder a cambios abióticos tales como la perturbación climática y bióticos como la defoliación, estos pueden expresarse en atributos químicos, fisiológicos y morfológicos acorde a su plasticidad fenotípica (Stotz et al., 2021), la cual ha sido reconocida como una estrategia importante en plantas, que maximizan o mantienen su adecuación ante estos cambios (Ramos y Schiestl, 2020). Algunas de las características que influyen en la adecuación son las condiciones de crecimiento, la defoliación, la composición química, la morfología foliar (Caruso et al., 2020), además que pueden variar con la edad, haciendo que los individuos en ciertas circunstancias se vuelvan más resistentes a la herbivoría a lo largo de su vida (Boege y Marquis, 2005; Rusman et al., 2020).
En diferentes estudios se ha observado que los herbívoros tienen la capacidad de buscar y seleccionar su alimento, mostrando diferentes grados de preferencia que dependen de características presentes tanto en la planta hospedera como en el ambiente en que se encuentra (Herrera y Pellmyr, 2002). De este modo, hojas más jóvenes son más consumidas por los herbívoros, ya que representan un recurso más nutritivo y presumiblemente no están tan defendidas por sustancias químicas, especialmente por los compuestos que reducen su digestibilidad y, por tanto, son preferidas por los herbívoros ante hojas viejas con mayor resistencia por la acumulación de compuestos estructurales (Turner, 2001; Rusman et al., 2020). Por lo tanto, variaciones en la morfología y en el tamaño de las hojas acorde a la disponibilidad de humedad y temperatura, representan un ajuste morfo-fisiológico en las plantas que puede involucrar plasticidad fenotípica, diferenciación genética o ambos fenómenos, en respuesta a resistencia a los cambios ambientales (Uribe et al., 2008).
Aunado a esto, la defoliación causada por los insectos herbívoros ejerce también una especie de presión de selección natural, que permite que las plantas desarrollen constantemente estrategias de defensa contra herbívoros en un proceso interactivo y coevolutivo a largo plazo (Gong y Zhang 2014). Algunas características foliares como el grosor, dureza, área, peso seco, y área foliar específica (SLA, specific leaf area) son rasgos funcionales ampliamente usados como características de resistencia y tolerancia a insectos herbívoros (Gong y Zhang, 2014). Incluso el grosor y la dureza muestran una correlación negativa con la defoliación (Boege et al., 2011). La asimetría fluctuante es una característica foliar que se destaca, ya que puede usarse para medir patrones de inestabilidad en el desarrollo de individuos (Díaz et al., 2004), en términos prácticos representa la variación aleatoria en caracteres bilateralmente simétricos. Motivo por el cual ha sido usada para correlacionarla con la defoliación causada por insectos (Cuevas-Reyes et al., 2018), sugiriendo que plantas con hojas más asimétricas tendrán mayor daño que aquellas con hojas simétricas, consecuencia de una combinación en la calidad nutricional y metabolismo secundario (Koslov et al., 2018).
Las plantas forrajeras en especial son un grupo que se ha caracterizado por recibir repetida defoliación por insectos herbívoros en sus hojas y a que generalmente presentan altas tasas de crecimiento (Lee, 2018; Onoda et al., 2017). Un mejor conocimiento sobre la influencia de las características morfológicas en la defoliación en plantas forrajeras puede ayudar en la elección de especies con rasgos defensivos intrínsecos que conlleven a reducciones claras en los daños causados por insectos defoliadores (Silva et al., 2017). En virtud de lo anterior, hipotetizamos que las especies forrajeras evaluadas en el presente estudio, tendrán mayor probabilidad de compensar el daño causado por la herbivoría de insectos, debido a su adaptación a la defoliación natural y artificial (Lee, 2018) que les confiere una alta plasticidad fenotípica y tentativamente altas tasas de crecimiento (Noda et al., 2007; Noguera-Talavera et al., 2014; Mejía-Díaz et al., 2017).
En forma novedosa, creemos que las características foliares tendrán un papel importante en estas respuestas de tolerancia hacia la herbivoría por insectos, todo ello basado a la luz de la literatura de la ecología vegetal de las selvas tropicales, ya que, a nuestro conocimiento, no hay información para estas especies forrajeras. El objetivo del estudio fue evaluar la influencia de la edad de las plantas y de las hojas, sobre las características foliares, y a su vez, la relación con la defoliación causada por insectos herbívoros en tres especies forrajeras en zonas tropicales. El estudio se realizó durante el periodo de establecimiento de un banco de biomasa de tres especies forrajeras, Tithonia diversifolia (Helms) A. Gray, Morus alba L. y Moringa oleifera Lam.
MATERIALES Y MÉTODOS
Sistemas de estudio
El trabajo se realizó en la Unidad de Producción e Investigación Agrícola y Pecuaria del Tecnológico Nacional de México/Campus Conkal, Yucatán, México, (21° 05' N y 89° 32' W) durante los meses de octubre, noviembre y diciembre. Se eligió esta temporada debido a que es la época de mayor humedad en la región, factor relacionado a la presencia de insectos. La península de Yucatán tiene un clima tropical subhúmedo con tres estaciones durante el año: la temporada de lluvias (julio-octubre) se caracteriza por una precipitación abundante (> 60 mm por mes), con la precipitación más alta (> 200 mm) en septiembre; la temporada de vientos del norte (noviembre-febrero) tiene una precipitación moderada (<60 mm por mes) con lluvias o lloviznas breves; y en la estación seca (marzo-junio) la precipitación es <16 mm por mes (González et al., 2015). Se usaron tres especies como modelos de estudio: Tithonia diversifolia, Moringa oleifera y Morus alba. En el caso de T. diversifolia se caracteriza por ser una especie de rápido crecimiento, con una eficiente depuración de nutrimentos del suelo, abundante producción de hojas y rápida descomposición que permite la rehabilitación del suelo en un período corto de barbecho (Murgueitio et al., 2015). En cuanto a M. oleífera, se caracteriza principalmente por sus características nutricionales y un alto rendimiento en producción de biomasa fresca (Puentes, 2014). Asimismo, M. alba es una especie que se ha usado para el consumo humano y como forraje, posee gran adaptación agroecológica y elevada capacidad para producir biomasa, además de presentar una composición química en su follaje de gran valor nutricional para la alimentación de animales (Medugu et al., 2012).
Registro de datos
Se seleccionaron diez plantas ubicadas a una distancia de 0,50 m entre cada planta y 2,50 m entre cada surco, en cada una de las plantas seleccionadas se eligieron tres hojas de edades diferentes: joven (primera hoja apical totalmente expandida del ápice), intermedia (hoja a la mitad de la altura total) y vieja (hoja ubicada en la ramificación más baja). De cada hoja se registraron los siguientes datos: área foliar (mm), dureza (g cm-2), grosor (mm), peso seco (g), área foliar especifica (SLA, cm2g-1). Los datos se registraron cada 30 días por tres meses.
Para la medición del área foliar (cm2), se fotografiaron las hojas completamente extendidas, en cada foto se incluyó una regla a lado de las hojas a modo de referencia; posteriormente las fotos se analizaron a través del software (ImageJ 1.8.0). Para la dureza (g cm-2), se tomó un fragmento de cada hoja, y se colocaron en un penetrómetro portátil (AMS, modelo 59032 OSHA, EUA) para medir la fuerza necesaria para romper el limbo de la hoja. Se excluyeron al momento de medir las hojas la nervadura central, ya que, debido a la alta concentración de fibras de sustentación y vasos conductores, estas áreas son más resistente que el limbo foliar. En el caso de grosor de la hoja se registraron los datos de las hojas con ayuda de un micrómetro digital (Mitutoyo, modelo H-2780, Japón).
Una vez obtenido el material fresco se sometieron las hojas a un proceso de secado a 60 °C de 72 a 96 horas hasta alcanzar un peso constante, para determinar el peso seco foliar. También, se determinó el área foliar específica (specific leaf area, SLA cm2 g-1) dividiendo la masa (g) entre el área (cm2) de cada una de las muestras. Para estimar la asimetría foliar (AF), se usó la asimetría absoluta en vez de la asimetría fluctuante debido al bajo número de hojas por muestreo. Para ello, se restó el ancho izquierdo (LW) menos el derecho (RW) y se utilizó el valor absoluto del resultado de la resta. A pesar de ello, el valor absoluto es un buen estimador de la varianza de la asimetría fluctuante entre hojas, asumiendo que no hay asimetría direccional (consistentemente mayor izquierda o derecha) o anti-simetría (falta constante de simetría, pero en ninguna dirección particular). Para minimizar el error de medición en la asimetría fluctuante (Palmer, 1996), se realizó una reevaluación del 10 %de todas las hojas recogidas 10 días después de las primeras mediciones y las dos mediciones se correlacionaron utilizando un índice de repetibilidad (Falconer, 1981). Finalmente, para cuantificar la defoliación por los herbívoros se siguió la clasificación de Dirzo y Domínguez (1995), se determinaron seis clases de proporción de defoliación: (0) ausencia de defoliación; (1) 1 a 6 % de defoliación; (2) 7 a 12 %; (3) 13 a 25 %; (4) 26 a 50 %; (5) 51 a 100 %.
Análisis estadístico
Se analizaron las características foliares de manera interespecífica a través de modelos lineales generalizados GLM con una distribución normal y función de enlace identidad, considerando como factor de variación las tres especies, con corrección para comparación de pruebas por pares de Bonferroni (Moran, 2003).
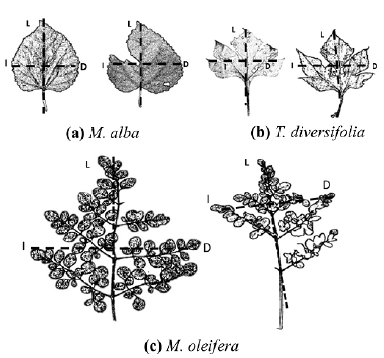
Figura 1 (a) Morus alba, (b) Thitonia diversifolia y (c) Moringa oleifera representación esquemática de las hojas usadas para medir asimetría fluctuante, y SLA, mostrando hojas dañadas y hojas completas I (Izquierda) D (Derecha) L (Longitud).
Para las diferencias intraespecíficas, se analizaron todas las variables de cada especie y su cambio en las edades, bajo una estructura factorial en donde la edad de la planta (30, 60 y 90 días) y edad de la hoja (hoja joven, intermedia y vieja) fungieron como factores. Para todas las características foliares (variables dependientes) se usaron modelos probabilísticos Normal con una función de enlace Identidad. Posteriormente, se realizaron comparaciones pareadas de las medias con una prueba de Bonferroni. Todos los análisis estadísticos se realizaron con el paquete estadístico SPSS 16 para Windows.
Para evaluar las relaciones entre las características foliares con las edades de las plantas, de las hojas, las especies forrajeras estudiadas y la defoliación, se realizó un análisis de redundancia (RDA, redundancy analysis) (Legendre y Legendre, 1998). Previo al RDA, se calculó la longitud de gradiente de la matriz de las características foliares, para ello se usó un Análisis de Correspondencia Distendido (DCA, Detrended Correspondence Analysis) (Hill, 1979). La significancia estadística de cada característica foliar y de los cuatro ejes, se examinó a través de un procedimiento de selección hacia adelante usando las pruebas de permutaciones aleatorias de Monte Carlo (499 permutaciones, p< 0.05). Estos análisis se realizaron con el software Canoco 4.5.
RESULTADOS
En general, se encontraron diferencias estadísticamente significativas en las características foliares tanto inter como intraespecíficas en las tres especies forrajeras (Cuadro 1). Entre especies, se encontró que M. oleifera presentó hojas con mayor área (gl=2, Chi2 Wald=17.390, p=0,000), peso seco (gl=2, Chi2 Wald=41,664, p=0,000), FA (gl=2, Chi2 Wald=31,385, p=0,000) y grosor (gl=2, Chi2 Wald= 16,209, p=0,002), mientras que M. alba y T. diversifolia tuvieron menores valores y similares entre ellas (Fig. 2a, b, d, e). En forma opuesta, la dureza mostró diferencias estadísticamente significativas entre las tres especies (gl=2, Chi2 Wald=21,52, p=0,000), siendo mayor en M. alba seguida de M. oleifera y T. diversifolia (Fig. 2f). Asimismo, el SLA fue estadísticamente mayor en forma similar en M. alba y T. diversifolia, pero menor en M. oleifera (gl=2, Chi2 Wald=9,912, p=0,007) (Fig. 2c).
Tabla 1 Efecto de la edad de hoja, edad de la planta y especie sobre área foliar, peso seco, dureza, grosor SLA y AF (media ± e.e).
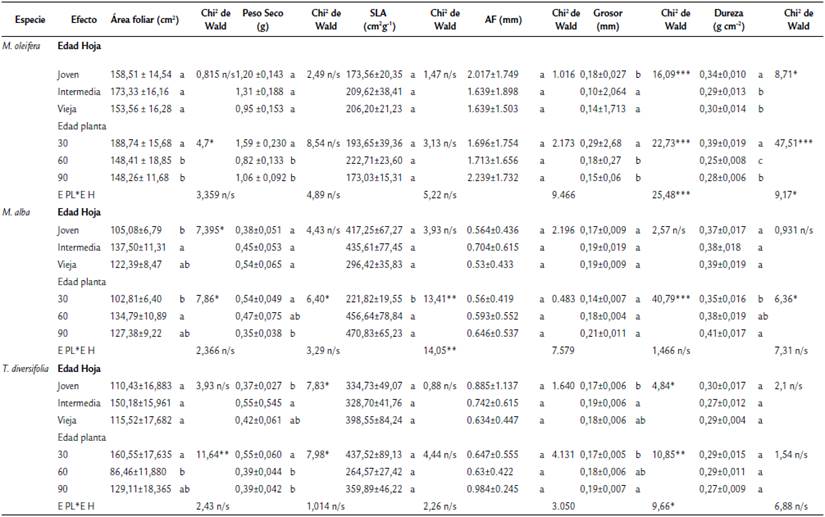
***= < 0,001; ** = <0,005; *= <0,05. Ps = parcialmente significativo a 0.006 - 0,07; n/s = estadísticamente no significativo
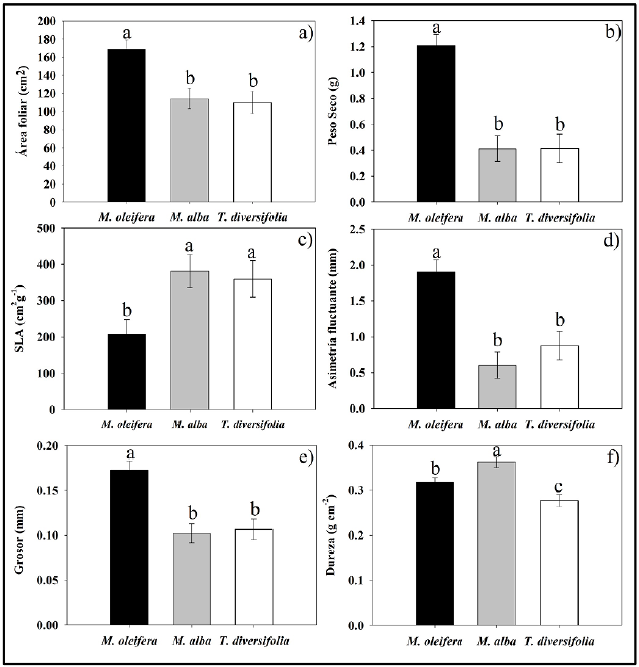
Figura 2 Características morfológicas foliares en M. oleifera, M. alba y T. diversifolia. a) Área foliar, b) Peso seco, c) Área foliar especifica (SLA), d) Asimetría fluctuante e) Grosor, f) Dureza. Diferentes literales indican diferencia estadística significativa (Bonferroni< 0,005).
Cuando se analizaron las diferencias intraespecíficas, se encontró que en el caso de M. oleifera, se presentaron dos interacciones significativas edad planta x edad hoja y fueron para las características de dureza y grosor foliar (Cuadro 1). En esta especie, no hubo variaciones en el área foliar por la edad de la hoja, pero si por la edad de la planta, ya que los individuos de 30 días tuvieron mayor área foliar. Para la dureza, se encontró que las hojas con valores más altos fueron las jóvenes y en plantas con 30 días de edad. En contraste, el grosor fue mucho mayor en hojas intermedias y viejas. El peso seco, SLA y asimetría foliar no presentaron diferencias significativas en ningún caso (Cuadro 1). Para M. alba, se registró sólo en el SLA una interacción significativa para edad planta x edad hoja. El área foliar fue mayor en las hojas intermedias y viejas, así como en las plantas con 60 y 90 días de edad. En tanto, la dureza, grosor, peso seco y SLA sólo mostraron cambios significativos por la edad de la planta. La dureza, grosor y SLA fueron mayores en las plantas de 60 y 90 días de edad; a diferencia del peso seco que fue mayor en las plantas de 30 días de edad. En T. diversifolia también se registró sólo una interacción significativa en edad planta x edad hoja, en este caso fue en la característica de grosor foliar. Para la edad de la hoja solo se encontraron incrementos significativos en el grosor y peso seco, en ambos casos fue mayor en las hojas intermedias y viejas. Mientras que, para la edad de la planta, el área foliar y el peso seco fueron mayores en las plantas con 30 días de edad. A diferencia del grosor que fue mayor en las plantas con 90 días de edad (Cuadro 1).
Cuando se analizó la defoliación, se encontró que la interacción entre los factores edad planta x edad hoja fue marginalmente significativa en M. oleifera (gl=26, Chi2 Wald= 6,08, p= 0,083). De manera independiente el factor edad de hoja mostró diferencias significativas en las tres especies, M. oleifera, M. alba y T. diversifolia (gl= 2, Chi2 Wald= 22,65, p= 0,0), presentando mayor defoliación las hojas viejas e intermedias. También, el factor edad de la planta presentó diferencias significativas, pero solo en dos especies, T. diversifolia y M. alba (gl= 2, Chi2 Wald = 23,351 p= 0,013); en ambas especies la defoliación fue mayor en plantas con 60 días de edad. Por su parte, M. oleifera no mostró cambios en la defoliación en ningún caso.
Relaciones de las características foliares
Se analizaron las relaciones entre las características foliares con las edades de las plantas, de las hojas, las especies forrajeras estudiadas y la defoliación. El RDA mostró una estrecha separación, pero estadísticamente significativa sobre los ejes (Tabla 2), y, además, que los análisis de las permutaciones de Monte Carlo fueron significativos para la mayoría de las variables (Tabla 2). Las tres especies forrajeras M. oleifera (F=36,01, p=0,002), M. alba (F= 17,13, p=0,002) y T. diversifolia (F= 10,8, p=0,002) mostraron influencias significativas en el análisis RDA (Fig. 3). M. oleifera se asoció positivamente con el grosor, peso seco, asimetría foliar y el área foliar, pero negativamente con la dureza y el SLA. Por su parte, M. alba se relacionó en forma positiva con la dureza y negativamente con la asimetría fluctuante. Las otras características foliares no presentaron una tendencia marcada. T. diversifolia solo estuvo asociada a hojas con menor grosor y dureza (Fig. 3). Las edades de las plantas también influenciaron significativamente a las características foliares, 30 días (F= 11,37, p=0,002), 60 días (F= 3,69, p=0,002) y 90 días (F= 2,95, p=0,02) y de manera significativa entre especies. Por ejemplo, a los 30 días se encontraron asociaciones positivas con el grosor, la dureza y el peso seco, pero negativas a los 60 y 90 días. En forma interesante, el SLA, área foliar y asimetría foliar fueron constantes a lo largo del ciclo de crecimiento vegetal (Fig. 3). Para la edad foliar, se observó que solo las hojas jóvenes mostraron efectos significativos (F=2,56, p=0,03). Las hojas viejas no tuvieron ninguna influencia significativa en la ordenación de las características foliares. Las hojas jóvenes presentaron relaciones negativas con el grosor, la dureza y el peso seco. Las hojas de mediana edad, aunque con resultados marginalmente significativos (F=2,02, p=0,08), tuvieron asociaciones positivas con el grosor, el peso seco, asimetría foliar y el área foliar, pero negativas con la dureza y el SLA. La defoliación también con resultados marginalmente significativos (F=1,92, p=0,09), presentó asociaciones positivas con el SLA y la dureza; y negativas con el grosor, el peso seco, asimetría foliar y el área foliar (Fig. 3).
DISCUSIÓN
El presente estudio se enfocó en el efecto de la edad de las plantas y de las hojas sobre las características foliares de tres especies forrajeras y su asociación con el grado de defoliación por insectos herbívoros. Se hipotetizó que las especies forrajeras tendrían mayor probabilidad de compensar el daño causado por la herbivoría de insectos, debido a su adaptación a la defoliación natural y artificial que les confiere una alta plasticidad fenotípica, y a que poseen altas tasas de crecimiento. Se encontró evidencia de que el ajuste de las características foliares beneficia a los mecanismos de resistencia (dureza foliar) y tolerancia (crecimiento compensatorio relacionado al SLA), resultados que son sustentados por la hipótesis de la compensación continua de Maschinski y Whitham (1989). Se observó que las hojas jóvenes presentaron rasgos de resistencia como mayor grosor y dureza foliar. Lo cual coincide con lo reportado para especies de selvas tropicales, que tienen un metabolismo, con alta capacidad fotosintética y metabolismo de nitrógeno elevado, de modo que la planta puede asignar más nutrimentos y recursos de defensa hacia las hojas jóvenes, de mayor susceptibilidad a la defoliación (Larcher, 2006). Los resultados anteriores también fueron consistentes con el menor porcentaje de defoliación encontrado en las hojas jóvenes, esto puede ser explicado por la acumulación de hormonas, metabolitos de defensa y calidad nutricional que tienden a decaer con la edad de la hoja y de la planta; lo cual interviene directamente en el proceso de selección del tejido vegetal del cual se van a alimentar los herbívoros (Gaquerel y Stitz, 2017).
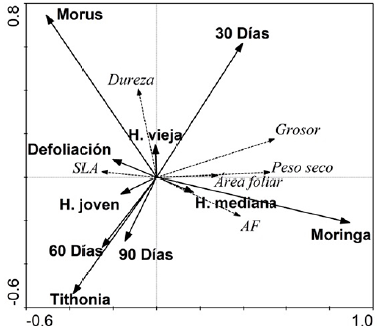
Figura 3 Análisis de redundancia (RDA) de las relaciones entre las características foliares asociadas a edad de la planta, edad de las hojas, las especies forrajeras estudiadas y la defoliación (%).
Existe una vasta literatura que expone la influencia de la edad vegetal y foliar en las características foliares y defoliación en especies que habitan naturalmente las selvas tropicales (Muiruri et al., 2019). Aunque para el caso de especies forrajeras, los reportes son principalmente respecto al efecto de los rayos UV, sexo, (Chen et al., 2016), altitud geográfica (Bajpai et al., 2015), contaminación industrial (Dineva, 2017), ubicación geográfica, temperatura y su estatus nativo o introducido (Tecco et al., 2012); y muy pocos sobre los factores de edad evaluados aquí (Abdulkadir et al., 2015). Aunque habría que considerar que tanto M. alba como M. oleifera se consideran especies introducidas con una importante adaptabilidad y de mejores habilidades competitivas que las especies nativas (Divísek et al., 2018), lo cual podría impactar positivamente su aptitud individual (Cuevas-Reyes et al., 2018).
Las respuestas en los mecanismos de resistencia y tolerancia son complejas debido a que varían entre especies, tejidos vegetales y estado de desarrollo de la planta (Meihls et al., 2012). Se ha reportado que las características morfológicas foliares de cada especie pueden variar debido a que no necesariamente comparten una equivalencia funcional y estructural exacta entre ellas (Vernescu y Ryser, 2009). Nuestros resultados presentan evidencia de ello, ya que se observaron características foliares marcadas principalmente en M. oleífera, tanto al inicio del estudio (lluvias) como al final (nortes). Por ejemplo, esta especie tuvo mayor área foliar, grosor y peso seco; lo que es consistente con lo reportado por Baatar (2008), que encontró que M. oleífera puede maximizar su producción de peso seco en época de lluvias, lo cual sugiere una respuesta eficiente a esas condiciones ambientales y una correlación positiva con las lluvias, independientemente del tipo de vegetación en que se asocia (Fuglie, 2000). Aunque también, se ha reportado que M. oleífera tiene una alta capacidad de adaptarse a condiciones limitadas de agua, debido a su sistema radicular pivotante engrosado (Casanova et al., 2018).
En la asimetría foliar se encontró una marcada diferenciación entre especies, siendo M. oleifera la especie con hojas más asimétricas. Es posible que estas respuestas sean el resultado que M. oleifera al ser una especie caracterizada por una alta variabilidad interanual e intertemporal (Singh y Mal, 2014), ha desarrollado una plasticidad en sus rasgos adaptativos, lo cual contribuye a la aptitud y supervivencia de sus poblaciones (Gianoli y González et al., 2005). Incluso, Ndubuaku et al. (2014) establecen a esta especie como un cultivo adecuado para el cambio climático, dada su alto nivel de adaptabilidad y valores nutricionales, medicinales, agrícolas, domésticos e industriales, a pesar de estar sometida a altos niveles de estrés. En forma opuesta, M. alba presentó hojas más duras, a pesar que estudios como el de Vijayan et al., (2006) han encontrado que dentro del género Morus esta especie presenta los rangos más bajos de dureza foliar. Es posible que esta dureza foliar en M. alba sea atribuible a deposiciones de cristales de calcio que llenan las vacuolas de idioblastos y estos en sí, seleccionar para atributos que beneficie a los mecanismos de defensa (Dineva, 2017). Asimismo, entre las tres especies forrajeras estudiadas, M. alba junto con T. diversifolia mostraron los valores más altos de SLA, característica foliar que ha sido relacionada a especies de rápido crecimiento (Lamers et al., 2006), lo que les permiten un pronto uso de los nutrimentos en ciclos más cortos (Westoby et al., 2002).
Cuando se analizó la relación entre las características foliares con la defoliación, se encontraron resultados divergentes. Por un lado, se encontraron relaciones negativas de la defoliación con el grosor de la hoja (medida relacionada indirectamente con la biomasa foliar por área, LMA leaf mass area) (Ballina-Gómez et al., 2010), biomasa (producto de un crecimiento subcompensatorio) (Ballina-Gómez et al., 2008), asimetría fluctuante (aquí medida como la asimetría foliar) y el área foliar (Hosseini et al., 2018). En el caso del grosor, se ha explicado que su incremento puede ser causado por el mayor volumen de las células del mesófilo y los espacios aéreos que hay entre ellos (Sperlich et al., 2015). Respecto a la disminución del peso seco y área foliar causada por la defoliación se ha sugerido que puede ser debido a la existencia de un crecimiento subcompensatorio del follaje en especies forrajeras (Ballina-Gómez et al., 2008), lo cual es posible sea producido por una reducción del cociente C:N resultado de una disminución de la ganancia de carbono en la fotosíntesis (Palacio et al., 2012). Por otro lado, es posible que la relación negativa de la asimetría foliar y la defoliación haya sido dirigida por una disminución de la resistencia como resultado del estrés de la planta causado por la herbivoría (Moller, 1995).
En forma sorpresiva, la dureza foliar se relacionó positivamente con la defoliación, que generalmente tiene un impacto negativo en la defoliación, ya que a menudo se utiliza como indicador funcional de defensa física foliar (Lusk et al., 2008). Creemos que, aunque las hojas presentan un fuerte incremento en la dureza en la fase de maduración, este constante desarrollo de la dureza, podría causar restricciones anatómicas que evitarían la esclerificación celular durante la fase de expansión, haciendo que las hojas jóvenes sean vulnerables al daño por defoliación (Barton et al., 2019). También, se encontró que el SLA tuvo una relación positiva con la defoliación, esto estaría sugiriendo una respuesta compensatoria (Maschinski y Whitham, 1989; McNickle y Evans, 2018). El cual establece que las plantas tendrán mayor probabilidad de compensar el daño por la herbivoría conforme hayan más recursos, como es el caso de las especies de rápido crecimiento que habitan generalmente sitios sin limitación de recursos (Ballina-Gómez et al., 2010; Carrillo-Herrera et al., 2021) como el sitio del presente estudio (Ruiz-Santiago et al., 2021) pero sometidas a mayores niveles de herbivoría (Schulze et al., 2005), siendo que la alta disponibilidad de luz y un contenido de nitrógeno foliar óptimo, les daría a las plantas la capacidad de incrementar su capacidad fotosintética (Marron et al., 2007).
Aunque en forma opuesta, el modelo de la tasa de crecimiento (Hilbert et al., 1981) menciona que las especies de rápido crecimiento son las que tendrán menores posibilidades de compensar el daño por la herbivoría, debido a que su crecimiento intrínseco se encuentra muy cerca de su umbral y, por tanto, su incremento sería mínimo; no así, las especies de lento crecimiento, creciendo lejos de su umbral. El presente estudio muestra que las plantas forrajeras, similar a las plantas de selvas tropicales, despliegan diferentes estrategias para lidiar con la defoliación causada por insectos, entre ellas la plasticidad fenotípica mediante la cual logran ajustar algunas características como la dureza y el SLA, que le confieren resistencia (aumento de la dureza foliar) y tolerancia al daño (crecimiento compensatorio) (Barton, 2008).
CONCLUSIONES
El presente estudio contribuye en forma novedosa al entendimiento de las interrelaciones entre la estructura de la hoja, su función y sus relaciones con la expresión de los rasgos morfológicos de resistencia (defensa) y tolerancia en especies forrajeras tropicales de alta importancia económica y ecológica.