INTRODUCCIÓN
Los humedales son cuerpos de agua determinantes en la productividad ecosistémica, favoreciendo el desarrollo de una amplia diversidad de flora, fauna y microorganismos (Castellanos, 2006). Actualmente los humedales tropicales someros han sido poco estudiados, a pesar de proveer servicios ecosistémicos como almacenar agua, regular inundaciones, estabilizar suelos y almacenar carbono (Bejumea, Villada y Castaño, 2020). Existen diferentes factores como las variaciones en la pluviometría y fluctuaciones en el nivel del agua que afectan estos ecosistemas aumentando los niveles de eutroficación, nutrientes y anoxia (Menezes et al. 2019). De igual forma este tipo de humedales son vulnerables al cambio climático, así como a la contaminación por actividades agropecuarias, principalmente en áreas tropicales y subtropicales (Menezes et al. 2019). Los cambios provocados por la contaminación y las actividades agrícolas afectan la biodiversidad de estos humedales, incluyendo la composición de especies, la estructura trófica y el funcionamiento del ecosistema en general (Havens et al., 2016).
El fitoplancton constituye uno de los componentes más importantes de los ecosistemas dulceacuícolas lenticos (Ramírez, 2000). Es una comunidad que integra organismos microscópicos fotosintetizadores (algas) que viven en suspensión en la columna de agua (Reynolds, 2006). Las algas planctónicas participan de importantes funciones en la dinámica de nutrientes, al ser los responsables de la mayor parte de la producción primaria en los lagos, lagunas y humedales (Roldán y Ramírez, 2008). En zonas tropicales, la influencia de la precipitación y la variabilidad en la temperatura diaria condiciona la riqueza, biomasa y dinámica del fitoplancton, lo cual es más evidente en sistemas lenticos someros, que reflejan una mayor susceptibilidad a la (hiper)eutrofización por efectos antropogénicos y del cambio climático (Díaz et al., 2021; Ortega et al., 2013).
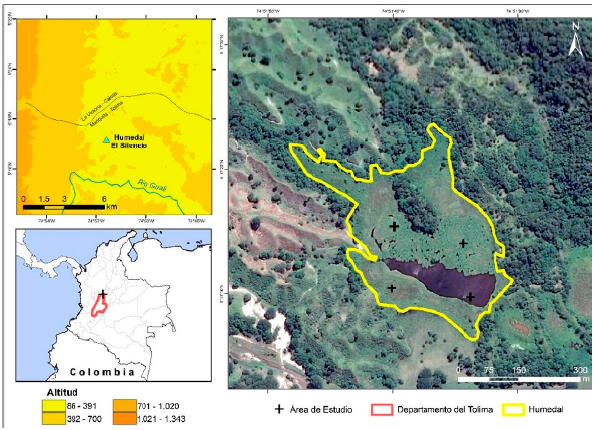
A pesar de la importancia del fitoplancton en los ecosistemas lenticos, son pocos los estudios enfocados a conocer la composición y estructura de estas comunidades y su relación con las variables fisicoquímicas en humedales someros de zonas tropicales (Vásquez et al., 2006), particularmente los de zonas bajas (Beklioglu et al., 2016). Dada la importancia ecológica de los humedales en Colombia (Ricaurte et al., 2019), en el presente estudio se seleccionó el humedal El Silencio (San Sebastián de Mariquita, Colombia), el cual fue uno de los priorizados por la Corporación Autónoma Regional del Tolima-CORTOLIMA, con el propósito de establecer una línea base de su biota fitoplanctónica y de sus posibles relaciones con las variables fisicoquímicas. La información generada constituye un elemento fundamental para el diseño de planes y programas de manejo y conservación de este cuerpo de agua en el departamento del Tolima.
MATERIALES Y MÉTODOS
Área de estudio
El humedal El Silencio se encuentra ubicado en el departamento del Tolima, Colombia; georreferenciado al extremo norte (5° 17' 23,68" N, 74° 51' 27,399" W), sur (5°17' 5,253" N, 74° 51' 32,504" W), oriente (5° 17' 10,863" N, 74° 51' 30,08" W) y occidente (5°17' 2,24" N, 74° 51'49,693" W). Pertenece a la subzona hidrográfica río Gualí y comprende 16 ha incluida el área inundable (Fig. 1). Se localiza a una elevación de 343 m. s. n. m y presenta una profundidad fótica promedio de 1,57 m. Es un humedal con un espejo de agua variable, el cual se ve influenciado por la colonización, cobertura y dinámica de macrófitas durante el año (Gordillo et al., 2020).
COLECTA DEL MATERIAL BIOLÓGICO
Las muestras analizadas se tomaron como parte de las colectas realizadas en el macroproyecto "Humedales Fase III. Caracterización y planes de manejo de los humedales del Tolima" (Cortolima, 2016). Para la colecta se siguió la metodología recomendada por Samanez (2014), por medio de una red de fitoplancton de ojo de malla de 23 µm y filtración de 50 litros de agua a través de la red. Se realizaron ocho muestreos durante un ciclo hidrológico, con colectas de cuatro muestras en la zona limnética por evento de muestreo, desde septiembre de 2016 hasta abril de 2017. Los muestreos se definieron como sigue: M1-septiembre, M2-octubre y M3-noviembre (altas precipitaciones); M4-diciembre, M5-enero y M6-febrero (transición y bajas precipitaciones); y M7-marzo y M8-abril (transición y altas precipitaciones).
Análisis de laboratorio
El conteo y la determinación del material biológico se realizó en el Laboratorio de Investigación en Zoología (Universidad del Tolima, Ibagué, Colombia), con un microscopio invertido Carl-Zeiss (aumento del objetivo 60X) y con un aumento del ocular de 10X, usando una cámara de conteo Sedgwick-Rafter (SR). Para la cuantificación de organismos se siguió el método de conteo en campos aleatorios hasta completar 30 en 4 ml de muestra (American Public Health Association [APHA], 1999; Ramírez, 2000).
La determinación taxonómica se realizó siguiendo las claves y descripciones de Alves da Silva y Schüler (2007), Bellinger y Sigee (2015), Komárek et al. (2014), Novelo (2012), Oliveira et al. (2013) y Wehr y Sheath (2003). Además, se soportó la identificación de las algas con la base de datos electrónica Algaebase (Guiry y Guiry, 2019) y Diatombase (Kociolek et al., 2019). Los datos de densidad total se presentan como individuos/ml.
Análisis de datos
La descripción del comportamiento de las variables biológicas y fisicoquímicas se realizó a través de estadística descriptiva teniendo en cuenta el tipo y clasificación de cada variable. Con el software estadístico R program versión 1.2.5 (R core Team, 2013) se verificó la normalidad de los datos mediante la prueba de Shapiro-Wilk. Dado que los datos no presentaron una distribución normal, se realizaron pruebas no paramétricas (Kruskal-Wallis) para establecer diferencias significativas en la variación temporal de la composición de la comunidad fitoplanctónica.
Se realizó una curva de acumulación de especies con el programa EstimateS (Collwell, 2013), para calcular el esfuerzo de muestreo y el porcentaje de organismos observados versus los esperados, utilizando los estimadores no paramétricos de riqueza Ace mean, ICE mean, Chao 1 mean, Jack 1 mean y Boostrap mean (Magurran, 2004). Se calcularon los números de diversidad de Hill, por medio del número efectivo de especies o "diversidad verdadera" presentes en una muestra, los cuales se basan en una medida del grado de distribución de las abundancias relativas entre las especies (Moreno et al., 2011).
Análisis de variables fisicoquímicas
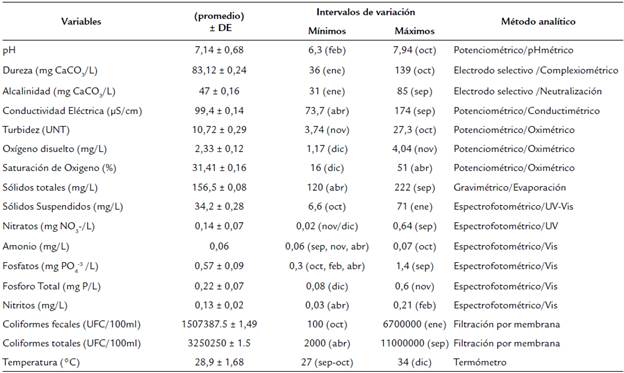
Se determinaron los valores de pH, conductividad eléctrica (µS/cm), oxígeno disuelto (mg O2/L), porcentaje de saturación de oxígeno (% SAT. O2), turbidez (UNT), alcalinidad total y dureza (mg CaCO3/L), nitratos (mgNO3/L), fosfatos (mg PO4/L), sólidos totales (mg/L), fósforo (P), sulfatos (mgSO4/L), coliformes totales y fecales (Tabla 1). Para establecer posibles relaciones entre las variables fisicoquímicas y la composición de la comunidad fitoplanctónica se realizó un Análisis de Correspondencia Canónica (CCA) utilizando el programa Canoco 4.5 (Smilauer y Leps, 2014).
RESULTADOS
Composición del fitoplancton
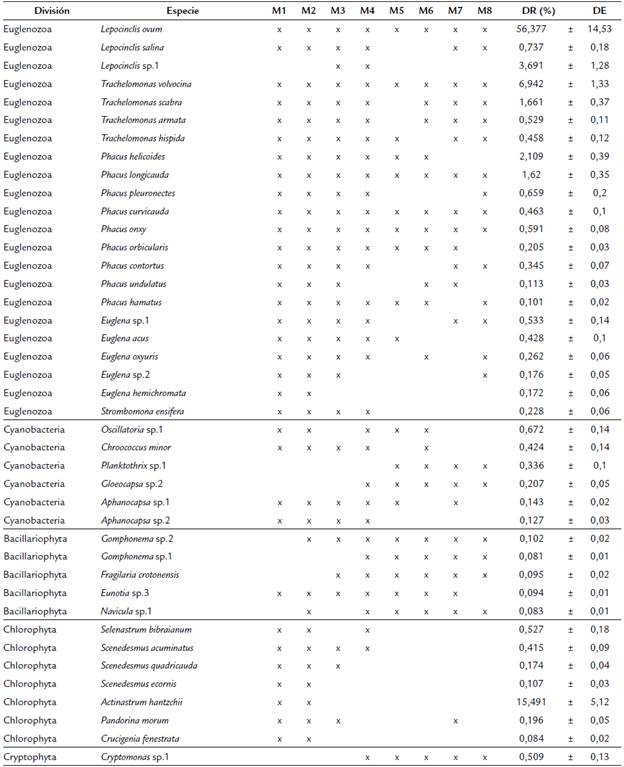
La comunidad fitoplanctónica del humedal presentó una composición de seis phyla (Euglenozoa, Chlorophyta, Cyanobacteria, Cryptophyta, Bacillariophyta y Charophyta), ocho clases, 18 órdenes, 34 familias, 57 géneros y 142 especies/morfoespecies. Los géneros más representativos fueron Lepocinclis, Actinastrum, Trachelomonas, Phacus y Euglena, la mayoría pertenecientes al phylum Euglenozoa. La Tabla 2 presenta las especies registradas en el humedal El Silencio a lo largo del período de estudio.
Dinámica del fitoplancton
Se destaca la presencia del phylum Euglenozoa que presentó una densidad total de 515 641 individuos/ml (78,89 %), seguido del phylum Chlorophyta con 114 416 individuos/ml (17,50 %) y, los phyla Cyanobacteria (13 466 individuos/ml), Bacillariophyta (6 041 individuos/ ml), Cryptophyta (3 333 individuos/ml) y Charophyta (708,3 individuos/ml), los cuales presentaron las menores densidades relativas (<5 %) (Fig. 2). En la tabla 2 se presentan las especies más abundantes (> 90%) registradas en el humedal El Silencio a lo largo del período de estudio.
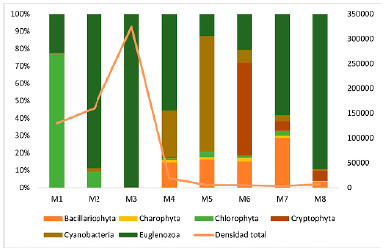
Fig. 2 Densidad total de los phyla correspondientes a la comunidad fitoplanctónica del humedal El Silencio en los diferentes muestreos realizados. Se indican también las densidades totales por muestreo evaluado (M1 - M8).
A nivel de género Lepocinclis presentó una densidad de 401 375 individuos/ml (61,40 %), seguido de Actinastrum con 101 425 (15,51 %), Trachelomonas (63 208 individuos/ml), Phacus (41 166 individuos/ml) y Euglena (8 291 individuos/ml); todos con una representatividad general de la comunidad del 94,12 %. Los demás géneros en conjunto no alcanzaron a una densidad relativa mayor al 6 %.
Lepocinclis ovum fue la especie con mayor densidad de la comunidad fitoplanctónica con 369 125 individuos/ ml (56,47 %), seguida de Actinastrum hantzschii con 101 425 individuos/ml (15,51 %), Trachelomonas volvocinopsis con 45 450 individuos/ml (6,95 %), Lepocinclis sp.1 (24 166 individuos/ml), Phacus helicoides (13 808 individuos/ ml), Trachelomonas scabra (10 875 individuos/ml) y Phacus longicauda (10 608 individuos/ml). Las demás especies en conjunto se denominan raras y representaron menos del 20 % de la comunidad fitoplanctónica presente en el humedal. Las especies que presentaron una densidad relativa menor a 0,01 % fueron en su mayoría clorofíceas (Closterium acerosum, Cl. aciculare, Cl. turgidum, Cl. venus, Cosmarium baileyi, Co. maculatum, Co. margaritatum, Co. phaseolus y Micrasterias laticeps, entre otras) (Tabla 2).
La curva de acumulación de especies de la comunidad fitoplanctónica del humedal El Silencio reflejó un 80 % de representatividad para los resultados observados (142 especies) con respecto a los esperados (171 especies). Los estimadores evaluados evidenciaron un esfuerzo de muestreo importante, ya que se obtuvo más del 60 % de la comunidad esperada. Los estimadores no paramétricos basados en riqueza presentaron los siguientes resultados: ICE mean obtuvo un 73 %, Chao 1 mean (82 %), Jack 1 mean (76 %) y Boostrap mean (87 %).
El análisis de Kruskal-Wallis mostró diferencias significativas (p <0,05) a nivel temporal en la composición y estructura de la comunidad fitoplanctónica. Los muestreos realizados en septiembre (M1), octubre (M2) y noviembre (M3) presentaron las mayores densidades poblacionales, siendo noviembre el que presentó una mayor densidad de algas (324 400 individuos/ml). En septiembre, Actinastrum hantzchii fue la especie dominante, mientras que para octubre y noviembre fueron Lepocinclis ovum y Trachelomonas volvocinopsis. A partir del cuarto muestreo las densidades disminuyeron, siendo diciembre (M4) el que presentó la mayor densidad (18 908 individuos/ml) con respecto a enero (M5), febrero (M6) y abril (M8); marzo (M7) presentó la menor densidad de algas (3 683 individuos/ml) durante todo el estudio. Las densidades en estos muestreos fueron bajas que no se observaron especies con una densidad relativa mayor al 1 %.
Diversidad de especies
La diversidad de especies correspondiente al orden q0 (riqueza de especies) de la comunidad fitoplanctónica evidencia que los muestreos M1, M2 y M3 presentaron una gran diversidad de fitoplancton (62, 63 y 66 especies observadas). Los demás muestreos presentaron menor diversidad con: M5 (44), M6 (45), M7 (49) y M8 (37) especies observadas.
El orden q1, correspondiente a las especies con un peso exactamente proporcional a su abundancia en la comunidad evidenció que M1, M2 y M3 presentaron una diversidad observada igual a la esperada (3,6 6,9 y 2,11) Los muestreos M5, M6, M7 y M8 presentaron 9,3, 8,3, 20,2 y 7,41 especies observadas de 10, 8,92, 21,85 y 7,7 especies esperadas con errores estándar > 0,8 y coberturas de muestreo menores a 1.
El orden de diversidad que tiene en cuenta las especies abundantes (q2) evidenció un patrón de comportamiento similar a q0 y q1, ya que M1, M2 y M3 alcanzaron los valores estimados de diversidad (1,822, 3,025 y 1,435), con un error estándar <0,05 y una cobertura de muestreo de (0,999 ± 0,016, 1 ± 0,036 y 1 ± 0,006, respectivamente).
Variables fisicoquímicas
Las variables relacionadas con procesos de mineralización (pH, dureza, alcalinidad y conductividad eléctrica) se observaron oscilantes durante los muestreos, el pH presentó valores entre 6,3 a 7,8, con el menor registro en febrero y el mayor en diciembre. La dureza osciló entre los 36 mg/L (enero) y 139 mg/L de CaCO3 (octubre). En septiembre, octubre y noviembre se presentaron altos datos de alcalinidad (85, 73 y 47 de CaCO3 mg/L, respectivamente), mientras que enero tuvo un valor de 31 mg/L. Así mismo la conductividad fue mayor en septiembre, octubre y noviembre (174, 143 y 94,5 |S/cm, respectivamente). A partir de diciembre se disminuyó la conductividad del humedal (Tabla 1).
Las variables relacionadas con procesos de oxido-reducción (nitratos, nitritos, fosfatos, fósforo total y amonio), presentaron concentraciones más altas en los meses de septiembre, octubre y noviembre en general. Las mayores concentraciones de nitratos se presentaron en septiembre y octubre (0,64 y 0,24 mg/L, respectivamente). El amonio fue estable durante los muestreos (0,06 mg/L) con excepción de octubre (0,07 mg/L). Los fosfatos presentaron el mayor valor en septiembre (1,4 mg/L) y los menores registros en febrero, marzo y abril (0,3 mg/L). En octubre y noviembre se registraron los valores más altos de fósforo total (0,5 y 0,6 mg/L) mientras que diciembre presentó el menor valor con 0,08 mg/L. Los nitritos presentaron los mayores valores en enero y febrero (0,16 y 0,21 mg/L, respectivamente); sin embargo, su concentración fue similar a lo largo de los muestreos.
En octubre se registró la mayor turbidez en el humedal El Silencio (27,3 UNT), mientras que febrero presentó el menor valor. Las concentraciones de oxígeno disuelto fueron mayores en noviembre (4,04 mg/L) en comparación con diciembre (1,17 mg/L). Así mismo noviembre de 2016 y abril de 2017 presentaron los valores más altos de % Sat. O2 (48,5% y 51% mg/L), mientras que el menor dato ocurrió en diciembre (16%). Los sólidos totales registrados en los diferentes muestreos evidenciaron que septiembre presentó el mayor valor (222 mg/L), mientras que abril presentó 120 mg/L. Enero tuvo el mayor registro de sólidos suspendidos (71 mg/L) y, el menor se midió en octubre con 6.6 mg/L. Los coliformes fecales presentaron las mayores cantidades en enero y marzo (6700000 y 4900000 UFC/100 ml, respectivamente) y la menor en octubre (100 UFC/100 ml). Con respecto a los coliformes totales se presentó en el mes de octubre la mayor concentración con 11000000 UFC/100 ml y la menor en abril de 2017 (2000 UFC/100 ml).
Tabla 2 Listado de taxones más abundantes (>90 % de la densidad total) encontrados en el humedal El Silencio en los diferentes muestreos evaluados (DR= Densidad relativa y DE= Desviación estandar).
La transparencia del agua medida por el disco Secchi evidenció que los meses correspondientes a diciembre y enero presentaron los mayores niveles de transparencia (2,1 y 2,3 m respectivamente) y bajas precipitaciones (± 241 mm), mientras que los meses de marzo y abril registraron los menores valores (0,98 y 1,21 m) y altos niveles de precipitación (± 382 mm). Los valores de precipitación se obtuvieron con el registro histórico pluviométrico de los últimos 20 años del Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM) de la zona.
Relaciones entre las variables fisicoquímicas y el fitoplancton
El Análisis de Correspondencia Canónica evidenció a través de la prueba de Monte Carlo, que las variables con efectos condicionantes (p <0,05) en la comunidad fitoplanctónica fueron la alcalinidad y el fósforo total. Sin embargo, en el diagrama de ordenamiento directo del ACC se presume algún tipo de relación entre las variables nitritos (NO2), coliformes fecales y sólidos suspendidos con los muestreos M4 - M8, y las morfoespecies asociadas con los géneros Frustulia, Navicula, Nitzschia, Ankistrodesmus, Pinnularia, entre otros (Fig. 3). El muestreo M1 se relacionó con la alcalinidad, el NO3, los sólidos totales, y el PO4, principalmente con las especies Desmodesmus opoliensis, Scenedesmus acuminatus, Crucigenia fenestrata, Euglena hemicromata, Actinastrum hanztschii. Los muestreos M2 y M3 se relacionaron con fósforo total, pH, oxígeno disuelto y precipitación, y a su vez con Lepocinclis ovum, L. salina, Phacus pleuronectes, P. contortus y Monormorphina pyrum. Previo a este análisis, se realizó el análisis de correlación de Spearman, el cual evidenció correlación significativa (p <0,05) en algunas variables que se tuvieron en cuenta u omitieron en el ACC para evitar ruidos estadísticos en los resultados obtenidos.
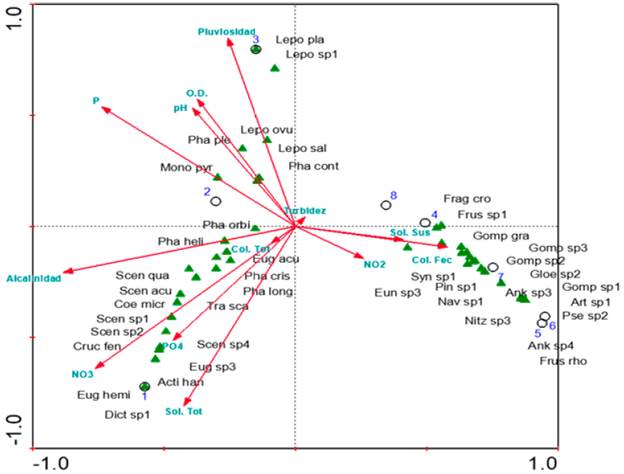
Acti han=Actinastrum hantzchii, Ank sp.3=Ankistrodesmus sp.3, Ank sp.4=Ankistrodesmus sp.4, Cos gale= Cosmarium galeratum, Coe sp.=Coelastrum sp., Cruc fen=Crucigenia fenestrata, Dict sp.1=Dictyosphaerium sp.1, Eug acu=Euglena acus, Eug hemi=Euglena hemichromata, Eug sp.3=Euglena sp.3, Eun sp, Frus sp=Frustulia sp., Gloe sp.2=Gloeocapsa sp2,, Gomp sp.1=Gomphonema sp.1, Gomp sp.2=Gomphonema sp.2, Gomp sp.3=Gomphonema sp3, Lepo ovu=Lepocinclis ovum, Lepo play=Lepocinclis playfairiana, Lepo sal=Lepocinclis salina, Lepo sp.1=Lepocinclis sp.1, Mono pyr=Monomorphina pyrum, Nav sp.1=Navicula sp.1, Nitz sp.3=Nitzschia sp.3, Pha cont=Phacus contortus, Pha cris=Phacus cristatus, Pha heli=Phacus helicoides, Pha long=Phacus longicauda, Pha orbi=Phacus orbicularis, Pha ple=Phacus pleuronectes, Pin sp.=Pinnularia sp., Pse sp.2=Pseudoanabaena sp.2, Scen acu=Scenedesmus acuminatus, Desmo opo=Desmodesmus opoliensis, Scen sp.1=Scenedesmus sp.1, Scen sp.2=Scenedesmus sp.2, Scen sp.4=Scenedesmus sp.4,, Tra sca=Trachelomonas scabra.
Fig. 3 Analisis de correspondencia canonica en los diferentes muestreos evaluados entre la comunidad fitoplanctonica con las variables fisicoquimicas del humedal El Silencio (San Sebastian de Mariquita, Tolima, Colombia).
DISCUSIÓN
El humedal objeto de estudio presenta características eutróficas, de acuerdo con las variables fisicoquímicas registradas, las concentraciones de nutrientes provenientes de material alóctono, la precipitación y la presencia masiva de macrófitas flotantes que al morir y descomponerse aportan constantemente materia orgánica al humedal (Huertas y Reinoso, 2019). Diversos factores, como las dinámicas naturales del humedal y la intervención antrópica por medio del aporte de compuestos inorgánicos y fósforo proveniente de las actividades agrícolas aumentan la concentración de nutrientes y por ende la dinámica natural del cuerpo de agua (Torres y Rodríguez, 2019), modificando la estructura natural de su comunidad fitoplanctónica.
El humedal El Silencio presentó altas densidades del phylum Euglenozoa, esto puede relacionarse en parte con el pH registrado (<7), debido a que estas algas generalmente se encuentran en aguas ácidas, ricas en nutrientes y con una alta concentración de materia orgánica (Wehr y Sheath, 2003). Gordillo (2018) reportó para este mismo humedal que este phylum fue el más abundante al evaluar los procesos de sucesión de la comunidad fitoperifítica. De igual forma el phylum Chlorophyta presentó una alta representatividad en la comunidad, mostrando que este phylum se desarrolla bajo diversas condiciones ambientales; sin embargo, algunos miembros de la familia Desmidiaceae evidencian una preferencia hacia las aguas ácidas muy productivas (Coesel, 1983). Los demás phyla registrados en el estudio (Cyanobacteria, Bacillariophyta, Cryptophyta y Charophyta) presentaron bajas densidades, quizás debido a que esta biota tiene altos requerimientos en las condiciones ambientales, tal es el caso de las cianobacterias que abundan en los meses más cálidos del año y en aguas de pH neutro a ligeramente básico (Roldán y Ramírez, 2008). El phylum Bacillariophyta es común en un amplio rango de ambientes, por lo que no presentan muchos requerimientos específicos de hábitat. Los phyla Cryptophyta y Charophyta prefieren ambientes con características oligotróficas, lo que puede explicar sus bajas densidades poblacionales (Roldán y Ramírez, 2008), ya que este humedal ha sido tipificado como eutrófico (Gordillo et al., 2020), y nuestros resultados así lo corroboran.
Los géneros Lepocinclis, Trachelomonas, Phacus y Euglena (todos pertenecientes al orden Euglenales) y Actinastrum (orden Chlorellales) alcanzaron una representatividad del 93 y 98 % de la comunidad fitoplanctónica del humedal. Las altas densidades de estos géneros coinciden con lo reportado por Gordillo (2018) y Esqueda et al. (2016) en humedales tropicales. La densidad de estas algas puede relacionarse con la alta concentración de amonio en el humedal, que en promedio registró 60 µg/L. Round (1983) mencionó que las Euglenophyceae son algas características de ambientes ricos en amonio, además de presentar preferencias por aguas cálidas y ricas en nutrientes orgánicos, lo cual facilita su desarrollo y establecimiento en el ecosistema (Pereira y Azeteiro, 2003). Actinastrum se caracteriza por ser un género muy común y ampliamente reportado en pantanos, estanques y lagos (Wehr y Sheath, 2015).
El ensamble fitoplanctónico registrado, sugiere que el humedal reflejó un comportamiento más o menos "estable" de manera consecutiva hasta el tercer muestreo (noviembre 2016), debido a que pocas especies estaban contribuyendo con más del 80 % de la densidad fitoplanctónica total (Sommer et al., 1993), sin embargo, a partir del cuarto muestreo se evidenció un cambio en la estructura del ensamblaje, en donde se observó un aumento repentino de diatomeas, situación que puede deberse en parte a la presencia de plantas acuáticas, ya que De Tezanos-Pinto (2008) señala que el establecimiento de macrófitas acuáticas como Pistia stratiotes y Cyperus sp. pueden generar un efecto de desprendimiento de su comunidad fitoperifítica, con el consecuente cambio en la estructura y composición de la comunidad fitoplanctónica del humedal. Estas especies de macrófitas, ya han sido reportadas para el humedal El Silencio (Gordillo et al., 2020).
Algunas especies de los géneros Euglena, Trachelomonas, Phacus, y Lepocinclis han sido descritas por Palmer (1969; 1980) como indicadores de polución orgánica del agua, aspecto que se denotó con la especie Lepocinclis ovum ya que registró la mayor abundancia en el humedal. En diversas investigaciones se ha reportado esta especie como la más abundante en embalses con alto contenido de materia orgánica (Dillard, 2000). González et al. (2003) reportaron en embalses venezolanos hipereutróficos la presencia de la especie Actinastrum hantzschii. La especie Trachelomas volvocinopsis es cosmopolita, frecuente en charcas y humedales con preferencia por aguas con contenido elevado en materia orgánica y es en general indicadora de un nivel de eutrofia y contaminación de nivel medio a alto (Díaz et al., 2019). Phacus longicauda ha sido registrada como una especie cosmopolita que puede soportar una amplia variedad de condiciones ambientales; Alves da Silva y Bicudo (2009) reportaron esta especie en el 77 % de los humedales evaluados, presentando coexistencia con Phacus tortus, hecho que coincide con los resultados obtenidos en esta investigación.
A nivel temporal se encontró que de los ocho muestreos realizados, aquellos de septiembre (M1), octubre (M2) y noviembre 2016 (M3) se presentaron las mayores densidades de fitoplancton, coincidiendo con la temporada de altas precipitaciones, según el reporte histórico del IDEAM para la zona evaluada (Fig. 2), condiciones que son favorables para el desarrollo de las comunidades planctónicas, ya que la lluvia trae consigo cambios en la carga de nutrientes y temperatura, aumentando la eficiencia fotosintética (Roldán y Ramírez, 2008), además de ejercer un efecto de lavado por la entrada y salida del agua y exportando gran cantidad de elementos necesarios en el metabolismo de estos organismos (Barbosa, 2009).
Los análisis de diversidad (números efectivos de especies) mostraron que M1, M2 y M3 obtuvieron los mayores valores de q1 (entropía de Shannon), y q2 (inverso de Simpson) con un porcentaje de cobertura satisfactorio, lo que indica que el número de individuos del "universo" del cual se obtiene la muestra, es similar al observado en la muestra (Chao y Shen, 2003), lo que indica que la representatividad del muestreo de la comunidad fitoplantónica del humedal El Silencio, durante los primeros tres muestreos, fue bastante buena (Moreno et al., 2011). Después del M4 se detectó una baja diversidad en términos de riqueza específica (q0), debido a la influencia de diversos factores físicos, químicos, temporalidad y, en especial, la incidencia directa de macrófitas flotantes (Gordillo et al., 2020), las cuales afectaron la dinámica de esta comunidad (Caraco et al., 2006; Dorador et al., 2003; Umaña, 2010).
El diagrama de ordenación directa (ACC) evidenció que las variables alcalinidad y fósforo total presentan un efecto significativo (p <0,05) en la comunidad fitoplanctónica del humedal. El fósforo es un elemento limitante en el desarrollo de las comunidades algales, ya que es un principal contribuyente en los ciclos energéticos celulares (Zouiten, 2012). De igual forma, la alcalinidad es una variable relacionada con la productividad del agua, en donde las aguas con mayor concentración presentan mayor productividad (Araya, 2018). La posible relación del fitoplancton en M1 con alcalinidad, NO3, sólidos totales, y PO4, puede indicar la preferencia de algunas especies de euglenofíceas y clorofíceas por estos nutrientes. Los muestreos M2 y M3 presentaron alguna relación entre el fósforo total, pH, oxígeno disuelto y precipitación con especies de euglenofíceas, lo que se muestra el efecto directo que tiene el fósforo sobre el crecimiento de las comunidades algales, ya que las especies relacionadas, en especial Lepocinclis ovum, fueron muy abundantes. Los demás muestreos presentaron algún tipo de relación con las variables nitritos (NO2), coliformes fecales y sólidos suspendidos y las morfoespecies asociadas con los géneros Frustulia, Navicula, Nitzschia, Ankistrodesmus y Pinnularia, evidenciándose cambios importantes en la composición del humedal, nuevamente a partir del establecimiento de macrófitas acuáticas.
CONCLUSIONES
Las especies fitoplanctónicas más representativas del humedal El Silencio fueron relativamente constantes en los primeros muestreos; sin embargo, se asociaron con la dinámica del cuerpo de agua, ya que a partir del cuarto muestreo Lepocinclis ovum, Actinastrum hantzschii, Trachelomonas volvocinopsis, Lepocinclis sp.1 y Phacus longicauda, disminuyeron sus densidades y no se evidenció una dominancia exclusiva de alguna especie, confirmando lo observado en otras investigaciones con especies de algas en humedales tropicales de zonas bajas.
La temporada climática influyó en la dinámica de la comunidad fitoplanctónica, ya que en el periodo de mayores precipitaciones se reflejaron altas concentraciones de nutrientes como fósforo y nitratos, factores que son indispensables para el crecimiento y desarrollo de esta comunidad en el humedal.
El fósforo presentó un efecto significativo en el desarrollo de las comunidades fitoplanctónicas del humedal según el análisis de ordenación directa (ACC), ya que es un elemento limitante para el metabolismo del fitoplancton. A partir del cuarto muestro su concentración disminuyó, lo que se generó una disminución proporcional en las densidades algales, posiblemente por el establecimiento repentino de macrófitas flotantes.
Debido a su gran sensibilidad a los cambios fisicoquímicos y ambientales, la comunidad fitoplanctónica representa una excelente alternativa para la evaluación y monitoreo de los ecosistemas acuáticos lenticos someros de zonas bajas, generando un conocimiento base para la creación de planes de manejo y programas de conservación de estos cuerpos de agua claves y altamente susceptibles a la presión antropogénica y al cambio climático global.